3. ТЕМПЕРАТУРА ГОРЕНИЯ
В теплотехнике различаются следующие температуры горения газов: жаропроизводительность, калориметрическую, теоретическую и действительную (расчетную). Жаропроизводительность tж — максимальная температура продуктов полного сгорания газа в адиабатических условиях с коэффициентом избытка воздуха α = 1,0 и при температуре газа и воздуха, равной 0°C:
tж = Qн /(∑Vcp)(8.11)
где Qн — низшая теплота сгорания газа, кДж/м3; ∑Vcp — сумма произведений объемов диоксида углерода, водяного пара и азота, образовавшихся при сгорании 1 м3 газа (м3/м3), и их средних объемных теплоемкостей при постоянном давлении в пределах температур от 0°С до tж (кДж/(м3o°С).
В силу непостоянства теплоемкости газов жаропроизводительность определяется методом последовательных приближений. В качестве начального параметра берется ее значение для природного газа (≈2000°С), при α = 1,0 определяются объемы компонентов продуктов сгорания, по табл. 8.
Таблица 8.3. Средняя объемная теплоемкость газов, кДж/(м3•°С)
Температура, °С | CO2 | N2 | O2 | CO | CH4 | H2 | H2O (водяные пары) | воздух | |
|---|---|---|---|---|---|---|---|---|---|
| сухой | влажный на 1 м3 сухого газа | ||||||||
| 0 | 1,5981 | 1,2970 | 1,3087 | 1,3062 | 1,5708 | 1,2852 | 1,4990 | 1,2991 | 1,3230 |
| 100 | 1,7186 | 1,2991 | 1,3209 | 1,3062 | 1,6590 | 1,2978 | 1,5103 | 1,3045 | 1,3285 |
| 200 | 1,8018 | 1,3045 | 1,3398 | 1,3146 | 1,7724 | 1,3020 | 1,5267 | 1,3142 | 1,3360 |
| 300 | 1,8770 | 1,3112 | 1,3608 | 1,3230 | 1,8984 | 1,3062 | 1,5473 | 1,3217 | 1,3465 |
| 400 | 1,9858 | 1,3213 | 1,3822 | 1,3356 | 2,0286 | 1,3104 | 1,5704 | 1,3335 | 1,3587 |
| 500 | 2,0030 | 1,3327 | 1,4024 | 1,3482 | 2,1504 | 1,3104 | 1,5943 | 1,3469 | 1,3787 |
| 600 | 2,0559 | 1,3453 | 1,4217 | 1,3650 | 2,2764 | 1,3146 | 1,6195 | 1,3612 | 1,3873 |
| 700 | 2,1034 | 1,3587 | 1,3549 | 1,3776 | 2,3898 | 1,3188 | 1,6464 | 1,3755 | 1,4020 |
| 800 | 2,1462 | 1,3717 | 1,4549 | 1,3944 | 2,5032 | 1,3230 | 1,6737 | 1,3889 | 1,4158 |
| 900 | 2,1857 | 1,3857 | 1,4692 | 1,4070 | 2,6040 | 1,3314 | 1,7010 | 1,4020 | 1,4293 |
| 1000 | 2,2210 | 1,3965 | 1,4822 | 1,4196 | 2,7048 | 1,3356 | 1,7283 | 1,4141 | 1,4419 |
| 1100 | 2,2525 | 1,4087 | 1,4902 | 1,4322 | 2,7930 | 1,3398 | 1,7556 | 1,4263 | 1,4545 |
| 1200 | 2,2819 | 1,4196 | 1,5063 | 1,4448 | 2,8812 | 1,3482 | 1,7825 | 1,4372 | 1,4658 |
| 1300 | 2,3079 | 1,4305 | 1,5154 | 1,4532 | – | 1,3566 | 1,8085 | 1,4482 | 1,4771 |
| 1400 | 2,3323 | 1,4406 | 1,5250 | 1,4658 | – | 1,3650 | 1,8341 | 1,4582 | 1,4876 |
| 1500 | 2,3545 | 1,4503 | 1,5343 | 1,4742 | – | 1,3818 | 1,8585 | 1,4675 | 1,4973 |
| 1600 | 2,3751 | 1,4587 | 1,5427 | – | – | – | 1,8824 | 1,4763 | 1,5065 |
| 1700 | 2,3944 | 1,4671 | 1,5511 | – | – | – | 1,9055 | 1,4843 | 1,5149 |
| 1800 | 2,4125 | 1,4746 | 1,5590 | – | – | – | 1,9278 | 1,4918 | 1,5225 |
| 1900 | 2,4289 | 1,4822 | 1,5666 | – | – | – | 1,9698 | 1,4994 | 1,5305 |
| 2000 | 2,4494 | 1,4889 | 1,5737 | 1,5078 | – | – | 1,9694 | 1,5376 | 1,5376 |
| 2100 | 2,4591 | 1,4952 | 1,5809 | – | – | – | 1,9891 | – | – |
| 2200 | 2,4725 | 1,5011 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2300 | 2,4860 | 1,5070 | 1,5943 | – | – | – | 2,0252 | – | – |
| 2400 | 2,4977 | 1,5166 | 1,6002 | – | – | – | 2,0389 | – | – |
| 2500 | 2,5091 | 1,5175 | 1,6045 | – | – | – | 2,0593 | – | – |
Жаропроизводительность распространенных простых и сложных газов при их горении в сухом воздухе приведена в табл. 8.4. При сжигании газа в атмосферном воздухе, содержащем около 1 вес. % влаги, жаропроизводительность снижается на 25–30°С.
Таблица 8.4. Жаропроизводительность газов в сухом воздухе
Калориметрическая температура горения tк — температура, определяемая без учета диссоциации водяных паров и диоксида углерода, но с учетом фактической начальной температуры газа и воздуха. Она отличается от жаропроизводительности tж тем, что температура газа и воздуха, а также коэффициент избытка воздуха α принимаются по их действительным значениям. Определить tк можно по формуле:
tк = (Qн qфиз)/(ΣVcp)(8.12)
где qфиз — теплосодержание (физическая теплота) газа и воздуха, отсчитываемое от 0°С, кДж/м3.
Природные и сжиженные углеводородные газы перед сжиганием обычно не нагревают, и их объем по сравнению с объемом воздуха, идущего на горение, невелик. Поэтому при определении калориметрической температуры теплосодержание газов можно не учитывать. При сжигании газов с низкой теплотой сгорания (генераторные, доменные и др.) их теплосодержание (в особенности нагретых до сжигания) оказывает весьма существенное влияние на калориметрическую температуру.
Зависимость калориметрической температуры природного газа среднего состава в воздухе с температурой 0°С и влажностью 1% от коэффициента избытка воздуха α приведена в табл. 8.5, для сжиженного углеводородного газа при его сжигании в сухом воздухе — в табл. 8.7. Данными табл. 8.5–8.
7 можно с достаточной точностью руководствоваться при установлении калориметрической температуры горения других природных газов, сравнительно близких по составу, и углеводородных газов практически любого состава. При необходимости получить высокую температуру при сжигании газов с малыми коэффициентами избытка воздуха, а также для повышения КПД печей, на практике подогревают воздух, что приводит к росту калориметрической температуры (см. табл. 8.6).
Таблица 8.5. Калориметрическая и теоретическая температуры горения природного газа в воздухе с t = 0°С и влажностью 1% в зависимости от коэффициента избытка воздуха α
| Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С | Теоретическая температура горения tт, °С | Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С |
|---|---|---|---|---|
| 1,0 | 2022 | 1920 | 1,33 | 1620 |
| 1,02 | 1990 | 1900 | 1,36 | 1600 |
| 1,03 | 1970 | 1880 | 1,40 | 1570 |
| 1,05 | 1940 | 1870 | 1,43 | 1540 |
| 1,06 | 1920 | 1860 | 1,46 | 1510 |
| 1,08 | 1900 | 1850 | 1,50 | 1470 |
| 1,10 | 1880 | 1840 | 1,53 | 1440 |
| 1,12 | 1850 | 1820 | 1,57 | 1410 |
| 1,14 | 1820 | 1790 | 1,61 | 1380 |
| 1,16 | 1800 | 1770 | 1,66 | 1350 |
| 1,18 | 1780 | 1760 | 1,71 | 1320 |
| 1,20 | 1760 | 1750 | 1,76 | 1290 |
| 1,22 | 1730 | – | 1,82 | 1260 |
| 1,25 | 1700 | – | 1,87 | 1230 |
| 1,28 | 1670 | – | 1,94 | 1200 |
| 1,30 | 1650 | – | 2,00 | 1170 |
Таблица 8.6. Калориметрическая температура горения природного газа tк, °С, в зависимости от коэффициента избытка сухого воздуха и его температуры (округленные значения)
| Коэффициент избытка воздуха α | Температура сухого воздуха, °С | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | |
| 0,5 | 1380 | 1430 | 1500 | 1545 | 1680 | 1680 | 1740 | 1810 | 1860 |
| 0,6 | 1610 | 1650 | 1715 | 1780 | 1840 | 1900 | 1960 | 2022 | 2150 |
| 0,7 | 1730 | 1780 | 1840 | 1915 | 1970 | 2040 | 2100 | 2200 | 2250 |
| 0,8 | 1880 | 1940 | 2022 | 2060 | 2130 | 2200 | 2260 | 2330 | 2390 |
| 0,9 | 1980 | 2030 | 2090 | 2150 | 2220 | 2290 | 2360 | 2420 | 2500 |
| 1,0 | 2050 | 2120 | 2200 | 2250 | 2320 | 2385 | 2450 | 2510 | 2560 |
| 1,2 | 1810 | 1860 | 1930 | 2000 | 2070 | 2140 | 2200 | 2280 | 2350 |
| 1,4 | 1610 | 1660 | 1740 | 1800 | 2870 | 1950 | 2030 | 2100 | 2160 |
| 1,6 | 1450 | 1510 | 1560 | 1640 | 1730 | 1800 | 1860 | 1950 | 2030 |
| 1,8 | 1320 | 1370 | 1460 | 1520 | 1590 | 1670 | 1740 | 1830 | 1920 |
| 2,0 | 1220 | 1270 | 1360 | 1420 | 1490 | 1570 | 1640 | 1720 | 1820 |
Таблица 8.7. Калориметрическая температура горения tк технического пропана в сухом воздухе с t = 0°С в зависимости от коэффициента избытка воздуха α
| Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С | Коэффициент избытка воздуха α | Калориметрическая температура горения tк, °С |
|---|---|---|---|
| 1,0 | 2110 | 1,45 | 1580 |
| 1,02 | 2080 | 1,48 | 1560 |
| 1,04 | 2050 | 1,50 | 1540 |
| 1,05 | 2030 | 1,55 | 1500 |
| 1,07 | 2022 | 1,60 | 1470 |
| 1,10 | 1970 | 1,65 | 1430 |
| 1,12 | 1950 | 1,70 | 1390 |
| 1,15 | 1910 | 1,75 | 1360 |
| 1,20 | 1840 | 1,80 | 1340 |
| 1,25 | 1780 | 1,85 | 1300 |
| 1,27 | 1750 | 1,90 | 1270 |
| 1,30 | 1730 | 1,95 | 1240 |
| 1,35 | 1670 | 2,00 | 1210 |
| 1,40 | 1630 | 2,10 | 1170 |
Теоретическая температура горения tT — максимальная температура, определяемая аналогично калориметрической tк, но с поправкой на эндотермические (требующие теплоты) реакции диссоциации диоксида углерода и водяного пара, идущие с увеличением объема:
СО2 ‹–› СО 0,5О2 — 283 мДж/моль(8.13)
Н2О ‹–› Н2 0,5О2 — 242 мДж/моль(8.14)
При высоких температурах диссоциация может привести к образованию атомарного водорода, кислорода и гидроксильных групп ОН. Кроме того, при сжигании газа всегда образуется некоторое количество оксида азота. Все эти реакции эндотермичны и приводят к снижению температуры горения.
Теоретическая температура горения может быть определена по следующей формуле:
tT = (Qн qфиз – qдис)/(ΣVcp)(8.15)
где qдис — суммарные затраты теплоты на диссоциацию СО2 и Н2О в продуктах сгорания, кДж/м3; ΣVcp — сумма произведения объема и средней теплоемкости продуктов сгорания с учетом диссоциации на 1 м3 газа.
Таблица 8.8. Степень диссоциации водяного пара H2O и диоксида углерода CO2 в зависимости от парциального давления
| Температура, °С | Парциальное давление, МПа | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,004 | 0,006 | 0,008 | 0,010 | 0,012 | 0,014 | 0,016 | 0,018 | 0,020 | 0,025 | 0,030 | 0,040 | |
| Водяной пар H2O | ||||||||||||
| 1600 | 0,85 | 0,75 | 0,65 | 0,60 | 0,58 | 0,56 | 0,54 | 0,52 | 0,50 | 0,48 | 0,46 | 0,42 |
| 1700 | 1,45 | 1,27 | 1,16 | 1,08 | 1,02 | 0,95 | 0,90 | 0,85 | 0,8 | 0,76 | 0,73 | 0,67 |
| 1800 | 2,40 | 2,10 | 1,90 | 1,80 | 1,70 | 1,60 | 1,53 | 1,46 | 1,40 | 1,30 | 1,25 | 1,15 |
| 1900 | 4,05 | 3,60 | 3,25 | 3,0 | 2,85 | 2,70 | 2,65 | 2,50 | 2,40 | 2,20 | 2,10 | 1,9 |
| 2000 | 5,75 | 5,05 | 4,60 | 4,30 | 4,0 | 3,80 | 3,55 | 3,50 | 3,40 | 3,15 | 2,95 | 2,65 |
| 2100 | 8,55 | 7,50 | 6,80 | 6,35 | 6,0 | 5,70 | 5,45 | 5,25 | 5,10 | 4,80 | 4,55 | 4,10 |
| 2200 | 12,3 | 10,8 | 9,90 | 9,90 | 8,80 | 8,35 | 7,95 | 7,65 | 7,40 | 6,90 | 6,50 | 5,90 |
| 2300 | 16,0 | 15,0 | 13,7 | 12,9 | 12,2 | 11,6 | 11,1 | 10,7 | 10,4 | 9,6 | 9,1 | 8,4 |
| 2400 | 22,5 | 20,0 | 18,4 | 17,2 | 16,3 | 15,6 | 15,0 | 14,4 | 13,9 | 13,0 | 12,2 | 11,2 |
| 2500 | 28,5 | 25,6 | 23,5 | 22,1 | 20,9 | 20,0 | 19,3 | 18,6 | 18,0 | 16,8 | 15,9 | 14,6 |
| 3000 | 70,6 | 66,7 | 63,8 | 61,6 | 59,6 | 58,0 | 56,5 | 55,4 | 54,3 | 51,9 | 50,0 | 47,0 |
| Диоксид углерода CO2 | ||||||||||||
| 1500 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,4 | 0,4 | 0,4 | 0,4 | 0,4 | – |
| 1600 | 2,0 | 1,8 | 1,6 | 1,5 | 1,45 | 1,4 | 1,35 | 1,3 | 1,25 | 1,2 | 1,1 | |
| 1700 | 3,8 | 3,3 | 3,0 | 2,8 | 2,6 | 2,5 | 2,4 | 2,3 | 2,2 | 2,0 | 1,9 | |
| 1800 | 6,3 | 5,5 | 5,0 | 4,6 | 4,4 | 4,2 | 4,0 | 3,8 | 3,7 | 3,5 | 3,3 | |
| 1900 | 10,1 | 8,9 | 8,1 | 7,6 | 7,2 | 6,8 | 6,5 | 6,3 | 6,1 | 5,6 | 5,3 | |
| 2000 | 16,5 | 14,6 | 13,4 | 12,5 | 11,8 | 11,2 | 10,8 | 10,4 | 10,0 | 9,4 | 8,8 | |
| 2100 | 23,9 | 21,3 | 19,6 | 18,3 | 17,3 | 16,5 | 15,9 | 15,3 | 14,9 | 13,9 | 13,1 | |
| 2200 | 35,1 | 31,5 | 29,2 | 27,5 | 26,1 | 25,0 | 24,1 | 23,3 | 22,6 | 21,2 | 20,1 | |
| 2300 | 44,7 | 40,7 | 37,9 | 35,9 | 34,3 | 32,9 | 31,8 | 30,9 | 30,0 | 28,2 | 26,9 | |
| 2400 | 56,0 | 51,8 | 48,8 | 46,5 | 44,6 | 43,1 | 41,8 | 40,6 | 39,6 | 37,5 | 35,8 | |
| 2500 | 66,3 | 62,2 | 59,3 | 56,9 | 55,0 | 53,4 | 52,0 | 50,7 | 49,7 | 47,3 | 45,4 | |
| 3000 | 94,9 | 93,9 | 93,1 | 92,3 | 91,7 | 90,6 | 90,1 | 89,6 | 88,5 | 87,6 | 86,8 | |
Как видно из табл. 8.8, при температуре до 1600°С степень диссоциации может не учитываться, и теоретическую температуру горения может принять равной калориметрической. При более высокой температуре степень диссоциации может существенно снижать температуру в рабочем пространстве.
На практике особой необходимости в этом нет, теоретическую температуру горения необходимо определять только для высокотемпературных печей, работающих на предварительно нагретом воздухе (например, мартеновских). Для котельных установок в этом нужды нет.
Действительная (расчетная) температура продуктов сгорания tд — температура, которая достигается в реальных условиях в самой горячей точке факела. Она ниже теоретической и зависит от потерь теплоты в окружающую среду, степени отдачи теплоты из зоны горения излучением, растянутости процесса горения во времени и др.
Действительные усредненные температуры в топках печей и котлов определяются по тепловому балансу или приближенно по теоретической или калориметрической температуре горения в зависимости от температуры в топках с введением в них экспериментально установленных поправочных коэффициентов:
tд = tтη(8.16)
где η— т.н. пирометрический коэффициент, укладывающийся в пределах:
- для качественно выполненных термических и нагревательных печей с теплоизоляцией — 0,75–0,85;
- для герметичных печей без теплоизоляции — 0,70–0,75;
- для экранированных топок котлов — 0,60–0,75.
В практике надо знать не только приведенные выше адиабатные температуры горения, но и максимальные температуры, возникающие в пламени. Их приближенные значения обычно устанавливают экспериментально методами спектрографии. Максимальные температуры, возникающие в свободном пламени на расстоянии 5–10 мм от вершины конусного фронта горения, приведены в табл. 8.9.
Алканы ряда метана, их общая формула. метан, электронное и пространственное строение, химические свойства (горение, реакция замещения)
Алканы (предельные, насыщенные) – это нециклические углеводороды, в молекулах, которых атомы углерода связаны друг с другом только простыми (σ-связями). Алканы имеют общую формулу CnH2n 2 , не присоединяют водород и другие элементы.
Строение молекулы метана
Простейшим представителем предельных углеводородов является метан.
СН4 – молекулярная формула (качественный, количественный состав).
Молекула метана не имеет плоского строения. Молекула метана в действительности имеет формутетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. Вцентре тетраэдра находится атом углерода, а атомы водорода – в вершинах тетраэдра.
Вывод: молекула метана в пространстве имеет тетраэдрическое строение.
1) Для метана характерны главным образом реакции замещения атомов водорода на атомы галогенов:
2)
СН4 Cl2→CH3Cl HCl — хлорметан
СН3Cl Cl2→CH2Cl2 HCl — дихлорметан
СН2Cl2 Cl2→CHCl3 HCl – трихлорметан (хлороформ)
СНCl3 Cl2→CCl4 HCl – тетрахлорметан (четыреххлористый углерод)
Метан с кислородом: реакция горения
Процесс горения метана — это взаимодействие метана с кислородом. В результате реакции образуется вода, двуокись углерода и много энергии. Уравнение реакции горения метана:
CH₄[газ] 2O₂[газ] → CO₂[газ] 2H₂O[пар] 891кДж
ВОПРОС №7
Алкены ряда этена (этилена), их общая формула. Этилен, его химические свойства (горение, реакции присоединения и полимеризации)
Алкены– нециклические углеводороды с одной двойной связью и общей формулой С n Н2n
Двойная связь – сочетание прочной σ–связи и непрочной π –связи.
Электронное строение молекулы этилена
Атомы углерода в составе молекулы алкена связаны между собой двойной связью. Эти атомы находятся в состоянии sp2-гибридизации. Двойная связь между ними образована из двух пар обобществленных электронов, т.е. это четырехэлектронная связь. Она сочетанием ковалентных σ-связи и π-связи. σ-Связь образована за счет осевого перекрывания sp2-гибридных орбиталей, а π-связь – за счет бокового перекрывания негибридизованных p-орбителей двух атомов углерода (рис. 1).
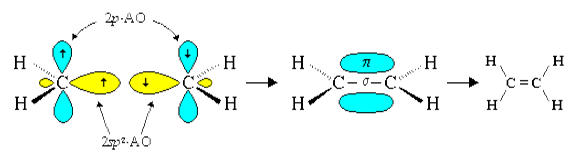
Рис. 1. Строение молекулы этилена.
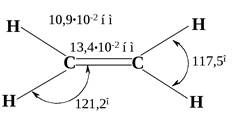
Пять σ-связей двух sp2-гибридизованных атомов углерода лежат в одной плоскости под углом 120o и составляют σ-скелет молекулы. Над и под этой плоскостью симметрично расположена электронная плотность π-связи, которую можно изобразить также в виде плоскости, перпендикулярной σ-скелету.
При образовании π-связи происходит сближение атомов углерода, потому что межъядерное пространство в двойной связи более насыщено электронами, чем в σ-связи. Это стягивает атомные ядра и поэтому длина двойной связи (0,133 нм) меньше одинарной (0,154 нм).
Рис. 4.3. Молекула этена:
а — боковое перекрывание 2р-орбиталей (p-перекрывание);
б — p-связь состоит из двух электронных облаков, одно из которых лежит над, а другое – под плоскостью молекулы
Таким образом, двойная углерод-углеродная связь построена из более прочной s-связи (347 кДж/моль) и менее прочной p-связи (260 кДж/моль). p-Связь делает невозможным вращение одного атома углерода относительно другого вдоль связи углерод-углерод. С этим связано явление геометрической изомерии.
Двойная углерод-углеродная связь в этене короче, чем простая связь в этане.
Реакции присоединения.
а) Взаимодействие с водородом (гидрирование)
СН2=СН2 Н2→СН3-СН3
этен этан
б) Взаимодействие с галогенами (галогенирование)
СН2=СН2 Br2 → СН2Br-СН2Br (1,2-дибромэтан)
обесцвечивание бурой окраски раствора брома в воде служит качественной реакцией на наличие двойной связи.
в) Взаимодействие с галогеноводородами
СН2=СН2 НСl→СН3-СН2Cl (хлорэтан)
г) Взаимодействие с водой (гидратация)
СН2=СН2 Н2O→СН3-СН2OH (этанол)
Реакции полимеризации.
Полимеризация – соединение небольших молекул мономера в гигантские молекулы полимера:
n СН2=СН2 → (-СН2-СН2-)n
этилен полиэтилен
§
В отличии от остальных предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами). Так, например, при действии на 1,5-дихлорпентан активным металлом цепь углеродных атомов замыкается и образуется циклический углеводород циклопентан:
Известны циклопарафины, молекулы которых состоят из трех, четырех и шести атомов углерода:
У циклопарафинов возможна изомерия. Например, молекулярной формуле C6H12соответствует насколько веществ-изомеров; изомерия этих соединений связана с наличием боковых углеводородных цепей.
Общая формула циклопарафинов CnH2n.
Химические свойства
У циклопарафинов, как и у предельных углеводородов, все связи насыщены, однако, в отличие от последних, они способны к реакциям присоединения. Это объясняется тем, что связи между атомами углерода в цикле могут разорваться. В результате образуются свободные связи, способные присоединять атомы водорода и других элементов. Соединения с малыми циклами легче вступают в реакции присоединения, что их аналоги с большими циклами. Так, например, реакция гидрирования (присоединение водорода) происходит при различной температуре у разных циклопарафинов.
Для соединений с большими циклами характерны реакции замещения. В этом отношении они сходны с парафинами.
Циклопарафины подвергаются и реакциям дегидрирования(отщепления водорода).
Нахождение в природе
Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В. В. Морковниковым
Применение
Из циклопарафинов практическое значение имеют циклогексан, митилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используют для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза.
ВОПРОС №9
Диеновые углеводороды их химическое строение свойства получение и практическое значение
Диеновые углеводороды, их строение, свойства, получение и практическое значение
Диеновые углеводороды, или алкадиены, – это углеводороды, содержащие в углеродной цепи две двойные связи. Их состав может быть выражен общей формулой CnH2n–2. Они изомерны ацетиленовым углеводородам.
Большое применение имеют алкадиены, в молекулах которых двойные связи разделены простой связью (сопряженные двойные связи) – это:
которые являются исходными веществами для получения каучуков.
Для образования двух двойных связей в одной молекуле необходимо по крайней мере три атома С. Простейшим представителем алкадиенов является пропадиен CH2 = C = CH2.
Химические свойства. Диеновые углеводороды с сопряженными двойными связями обладают высокой химической активностью.
Они легко вступают в реакции присоединения, реагируя с водородом, галогенами, галогеноводородами и т.д.

При избытке брома может быть присоединена еще одна его молекула по месту оставшейся двойной связи.
У алкадиенов реакции присоединения могут протекать по двум направлениям:
1) по месту разрыва одной двойной связи (1,2 — присоединение):

2) с присоединением к концам молекулы и разрывом двух двойных связей (1,4 — присоединение):

Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
Вследствие наличия двойных связей диеновые углеводороды довольно легко полимеризуются. Продуктом полимеризации 2 — метилбутадиена — 1,3 (изопрена) является полиизопрен – аналог натурального каучука
Получение. Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем Васильевичем Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола в присутствии катализаторов на основе ZnO и Al2O3:

Но более перспективным методом получения бутадиена является дегидрирование бутана, содержащегося в нефтяных газах. При t = 600 °С происходит ступенчатое дегидрирование бутана при наличии катализатор
ВОПРОС №10
§
Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Химические свойства ацетилена. Для алкинов характерны реакции окисления, присоединения и полимеризации.
Реакции окисления
а) Горение
б) Обесцвечивание KMnO4
Реакции присоединения
а) Гидрирование
СН≡СН H2 → CH2 = CH2
этин этен
б) Присоединение галогенов
СН≡СН Cl2 → CHCl = CHCl
этин 1,2- дихлорэтен
в) Присоединение галогеноводородов
СН≡СН HCl → CH2 = CHCl
Хлорэтен
Полимеризация
3C2H2 → C6H6 (бензол)
Получение ацетилена
а) Из метана: 2CH4 → C2H2
3H2
Применение ацетилена:
сварка и резка металлов, получение уксусного альдегида, пластмасс, растворителей, лекарств, красителей и многих других веществ.
Арены (ароматические углеводороды), их общая формула. Бензол, его структурная формула, свойства, применение.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат ароматическую связь – единую π-электронную систему из шести электронов. Ароматическая связь прочнее π –связи и менее прочная, чем σ–связь. Для бензола и его гомологов характерны реакции замещения, реакции присоединения идут с трудом.
ВОПРОС №11
Арены (ароматические углеводы) их общая формула Бензол его электронное строение структурная формула свойства применение
Аренами называют богатые углеродом циклические углеводороды, которые содержат в молекуле бензольное ядро и обладают особыми физическими и химическими свойствами. Арены по числу бензольных колец в молекуле и способа соединения циклов подразделяют на моноциклические (бензол и его гомологи) и полициклические (с конденсированными и изолированными циклами) соединения.
Арены бензольного ряда можно рассматривать как продукты замещения атомов водорода в молекуле бензола на алкильные радикалы. Общая формула таких аренов СnH2n-6. В названии монозамещенных аренов указывают название радикала и цикла (бензол):
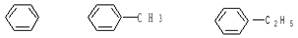
 бензол метилбензол (толуол) этилбензол.
бензол метилбензол (толуол) этилбензол.
В более замещенных аренах положение радикалов указывают наименьшими цифрами, в дизамещенных аренах положение радикалов называют: 1,2 — орто (o-)-, 1,3 — мета (м-)- и 1,4 — пара (п-)-:
 1,3-диметилбензол 1,2-метилэтилбензол
1,3-диметилбензол 1,2-метилэтилбензол
м-диметилбензол (м-ксилол) о-метилэтилбензол (о-ксилол)
Для аренов широко распространены тривиальные названия (некоторые названия указаны в скобках).
Ароматические углеводороды, или арены, – это соединения углерода с водородом, в молекулах которых содержится бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Простейшим представителем аренов является бензол C6H6. Гомологический ряд бензола имеет общую формулу CnH2n-6.
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А. Кекуле:
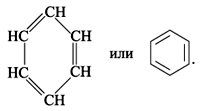
Атомы С в молекуле бензола образуют правильный плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает равноценность шести атомов С, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя  -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все
-связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все  -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o). Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца. В результате шесть p-электронов (всех шести атомов С) образуют общее
-связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o). Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца. В результате шесть p-электронов (всех шести атомов С) образуют общее  -электронное облако и единую химическую связь для всех атомов С.
-электронное облако и единую химическую связь для всех атомов С.
 -Электронное облако обусловливает сокращение расстояния между атомами С. В молекуле бензола они одинаковы и равны. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическаясвязь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С) .
-Электронное облако обусловливает сокращение расстояния между атомами С. В молекуле бензола они одинаковы и равны. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическаясвязь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С) .
Применение бензола.
1. Бензол служит исходным веществом для синтеза очень многих органических соединений.
2. Реакцией нитрования получают нитробензол C6H5NO2, хлорированием бензола – хлорбензол С6Н5Сi (растворитель) и другие хлорпроизводные.
3. Бензол используется как исходный продукт при синтезе лекарственных и душистых веществ, разнообразных красителей, мономеров для синтеза высокомолекулярных соединений и т. д.
4. Он применяется также в качестве растворителя и как добавка к моторному топливу в целях улучшения его свойств.
5. Хлорпроизводные бензола и других углеводородов используются в сельском хозяйстве в качестве химических средств защиты растений.
6. Так, продукт замещения в бензоле атомов водорода хлором – гексахлорбензол C6Cl6применяется для сухого протравливания семян пшеницы и ржи против твердой головни.
7. Из галогенопроизводных других углеводородов можно назвать гексахлорбутадиен С4Сl6, аналогичный по строению бутадиену-1,3, необходимый для борьбы с филлоксерой на виноградниках.
8. В сельском хозяйстве используется много других ядохимикатов для борьбы с насекомыми.
9. Также бензол используется для уничтожения сорняков, защиты растений от болезней и т. д.
10. Применение ядохимикатов требует хорошего знания их свойств и строгого следования установленным правилам их использования, так как при неправильном обращении они небезопасны для человека и могут нанести большой ущерб окружающей природе.
ВОПРОС №12
§
Предельные одноатомные спирты – это органические вещества, состоящие из радикала предельного углеводорода и функциональной гидроксильной группы (–OH).
Общая формула предельных одноатомных спиртов: CnH 2n 1– OH или R-OH.
Физические свойства. Низшие спирты до C12H25 -OH – жидкости, а высшие – твердые вещества. Низшие спирты хорошо растворимы в воде. По мере увеличения молекулярной массы спирта растворимость уменьшается. Метиловый спирт — сильный яд! Этиловый спирт — медленно действующее наркотическое вещество, вызывающее постепенное отравление организма (действует на печень и мозг, рождение умственно отсталых детей). Метанол, этанол и пропанол-1 имеют алкогольный запах!
Химические свойства.
Свойства спиртов определяются функциональной гидроксильной (–ОН) группой.
· Водные растворы спиртов не действуют на индикаторы, они нейтральны.
· спирты подобно воде реагируют с активными металлами:
 C2H5-OH 2Na 2C2H5-ONa H2↑
C2H5-OH 2Na 2C2H5-ONa H2↑
этанол натрий этилат натрия водород
· в присутствии конц. серной кислоты спирты реагируют с галогеноводородными кислотами, при этом образуются галогенопроизводные углеводородов:
 CH3-OH H-Cl CH3Cl H2O
CH3-OH H-Cl CH3Cl H2O
этанол соляная к-та хлорметан вода
· дегидратация спиртовв присутствии водоотнимающих средств (конц. H2SO4):
H H
│ │ конц.H2SO4
 H–C – C–H CH2=CH2 H2O
H–C – C–H CH2=CH2 H2O
│ │
H OH этилен
· взаимодействуют с кислотами с образованием сложных эфиров.
· cпирты горят с образованием углекислого газа и воды:
 C2H5OH 3O2 2CO2 3H2O.
C2H5OH 3O2 2CO2 3H2O.
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
См. также: Биоэтанол § Брожение
Известный с давних времён способ получения этанола — спиртовое брожениеорганических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
{displaystyle {mathsf {C_{6}H_{12}O_{6}rightarrow 2C_{2}H_{5}OH 2CO_{2}}}}
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
§
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
· Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы, яблок и т. п.
· Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
· Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в брагеспирта.
· Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
· Альфа
· Люкс
· Экстра
· базис
· высшей очистки
· 1 сорт
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
Основная статья: Гидролизный спирт
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
· прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
{displaystyle {mathsf {CH_{2}{text{=}}CH_{2} H_{2}Orightarrow C_{2}H_{5}OH}}}
· гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):
{displaystyle {mathsf {CH_{2}{text{=}}CH_{2} H_{2}SO_{4}rightarrow CH_{3}CH_{2}OSO_{2}OH}}}
{displaystyle {mathsf {CH_{3}CH_{2}OSO_{2}OH H_{2}Orightarrow CH_{3}CH_{2}OH H_{2}SO_{4}}}}
Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами[5], например, спирт обрабатывают веществами, реагирующими с водой или поглощающими воду, такими, как негашёная известь CaO или прокалённый медный купорос CuSO4[6].
Применение этилового спирта нашло широкое распространение в медицинской практике. В основном его используют наружно, как мощный антисептик, в качестве раздражающего средства, для компрессов и обтираний. Помимо того, он является компонентом многих настоек и экстрактов.
В промышленности этиловый спирт производят путем сбраживания продуктов растительного происхождения (углеводов), отходов деревообработки, в присутствии дрожжей. Также этанол можно получить синтезированием через метиловый спирт.
По своему фармакологическому действию этиловый спирт – наркотическое вещество, воздействующее на клетки ЦНС. Его употребление вызывает алкогольное возбуждение, а также нарушение функций организма.
ВОПРОС №13
§
Фенол С6Н5ОН– бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70◦С растворяется в любых отношениях. Фенол ядовит. В феноле гидроксильная группа соединена с бензольным кольцом.
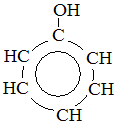
фенол
Химические свойства
1. Взаимодействие с щелочными металллами.
2C6H5OH 2Na → 2C6H5ONa H2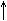
фенолят натрия
2. Взаимодействие со щелочью (фенол – слабая кислота)
C6H5OH NaOH → C6H5ONa H2O
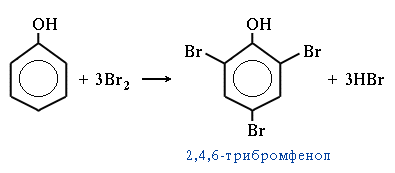
3. Галогенирование.
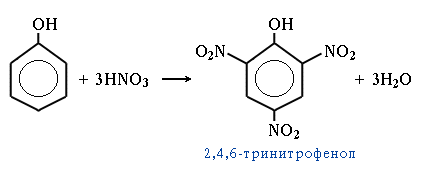
4. Нитрование
5.Качественная реакция на фенол
3C6H5OH FeCl3 → (C6H5O)3Fe 3HCl (фиолетовое окрашивание)
Применение
Для дезинфекции, получение лекарств, красителей, взрывчатых веществ, пластмасс.
Получение спиртов из предельных и непредельных углеводородов. Промышленный способ получения метанола.
Наибольшее промышленное значение имеют метанол и этанол.
ВОПРОС №14
Альдегиды их химическое строение и свойства Получение применение муравьного и уксусного альдегидов
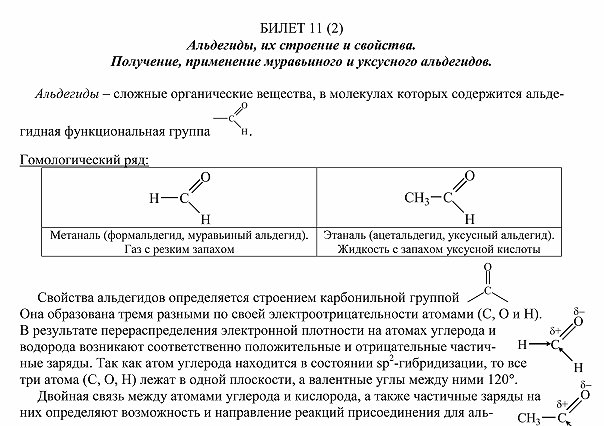
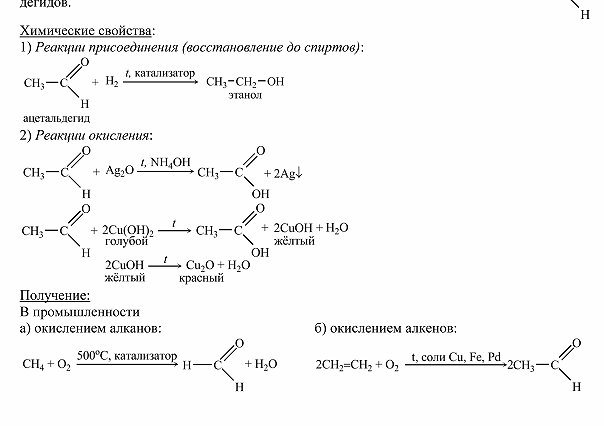
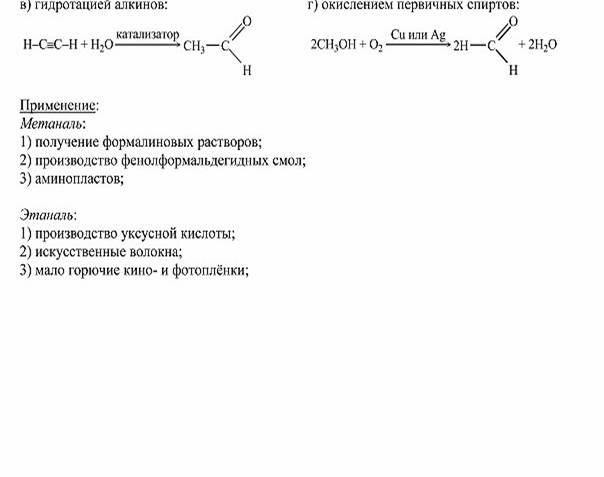
ВОПРОС №15
Предельные одноосновные карбоновые кислоты их строение и свойства на примере уксусной кислоты
Предельные одноосновные карбоновые кислоты– это органические соединения, состоящие из функциональной карбоксильной группы атомов (– CООН), соединенной с радикалом предельного углеводорода.
Общая формула: R-CООН , или Cn H 2n 2 – CООН , где n= 1,2,3 …
Физические свойства: Уксусная кислота – жидкость с острым неприятным запахом, хорошо растворима в воде (как и другие низшие кислоты). Высшие кислоты – твердые вещества, нерастворимы в воде. 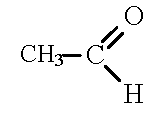
Строение молекулы уксусной кислоты:
В результате сдвига электронной плотности в карбоксильной группе атом водорода в гидроксильной группе становится более подвижным, чем в спиртах, но менее подвижен, чем в муравьиной кислоте. Поэтому уксусная кислота слабее муравьиной.
Химические свойства.
1.Общие с минеральными кислотами:
Диссоциирует в воде (индикатор лакмус дает красный цвет):
CH3 COOH CH3 COO — H
Взаимодействует с металлами, стоящими в ряду напряжений до водорода:
2 CH3 COOH Mg (CH3 COO)2 Mg H2
ацетат магния
Взаимодействует с основными оксидами с образованием соли и воды:
2 CH3 COOH MgO (CH3 COO) 2 Mg H2O
Взаимодействует со щелочами с образованием соли и воды:
CH3 COOH NaOH CH3 COONa H2O
ацетат натрия
Взаимодействует со спиртами с образованием сложных эфиров:
CH3 COOH CH3 OH CH3 CO–O–CH3 H2O
метиловый спирт метиловый эфир уксусной кислоты
ВОПРОС №16
Жиры их состав и свойства Жиры в природе превращение жиров в организме Продукты технической переработки жиров понятие о синтетических моющих средствах
Жиры – это сложные эфиры глицерина и карбоновых кислот.
Общая формула жиров:
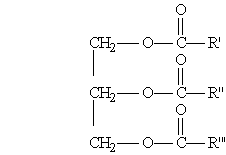
Твёрдые жиры образованы преимущественно высщими предельными карбоновыми кислотами – стеариновой C17H35COOH, пальмитиновой C15H31COOH и некоторыми другими. Жидкие жиры образованы главным образом высшими непредельными карбоновыми кислотами – олеиновойC17H33COOH, ленолевойC17H31COOH
Жиры наряду с углеводородами и белками входят в состав организмов животных и растений. Они являются важной составной частью пищи человека и животных. При окислении жиров в организме выделяется энергия. Когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются на глицерин и соответствующие кислоты.
Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный организм. Потоком крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до оксида углерода (IV) и воды.
Жиры чаще всего образуются не одной, а разными кислотами.
Вследствие этого различают:
1) жидкие жиры (масла), в составе которых остатки непредельных кислот;
2) твёрдые жиры, в составе которых остатки предельных кислот.
Реакция получения жиров называется этерификация, т.к. жиры это сложные эфиры
Химические свойства жиров определяются принадлежностью их к классу эфиров, следовательно наиболее характерна для них реакция – гидролиз, процесс, обратный этерификации.
Химические свойства жиров.
вода (гидролиз) – образуются глицерин и карбоновые кислоты, происходит в организме под действием ферментов.
Щелочь (щелочной гидролиз) – образуются глицерин и соли карбоновых кислот (мыла)
Н2 (гидрирование, для жидких жиров, содержащих остатки непредельных кислот) – образуются твердые жиры.
Физические свойства:
Жиры- легкоплавкие вещества, легче воды, нерастворимы в воде, растворимы в органических растворителях, имеют низкую теплопроводность.
Жиры — одна из основных групп веществ, входящих, наряду с белками и углеводами, в состав всех растительных и животных клеток. Жиры обладают высокой энергетической ценностью, при полном окислении в живом организме 1 г жира выделяется 37,7 кДж, что в два раза больше, чем при окислении 1 г белка или углевода.
Гидролиз жиров в технике – источник получения карбоновых кислот, глицерина, мыла. Мыло также получают и при гидрировании жиров.
В настоящее время для стирки в быту и для промывки шерсти и ткани в промышленности используют синтетические моющие средства (СМС). Они обладают более сильными моющим действием по сравнению с мылом. Сырьё для получения СМС – продукты переработки нефти, но не пищевые жиры. Моющая способность СМС примерно в 10 раз выше моющей способности обычного мыла, они моют в жёсткой воде, про этом не создают щелочную среду, так как не гидролизуются.
Жиры в природе превращение жиров в организме
Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.
Строение жиров выяснили благодаря трудам французских химиков Шевреля и Бертло. Нагрев жиры с водой в присутствии щелочи, еще в начале XIX века выяснил, что они разлагаются на глицерин и высшие карбоновые кислоты. М. Бертло в 1854, совершил обратную реакцию. Он нагрел смесь глицерина с высшими кислотами и получил жироподобные вещества.


(см с конца на начало 2 . 1)
ВОПРОС №17
§
Углеводы – это органические вещества в состав молекул которых входит углерод, водород и кислород, причём соотношение водорода и кислорода как и в молекуле воды 2:1
Углеводы делятся на три основных группы:
Моносахариды – углеводы которые не гидролизуются
Пример: C6H12O6– глюкоза
Дисахариды – это углеводы, которые гидролизуются с образованием двух молекул моносахаридов C12H22O11 H2O = 2C6H12O6
К дисахаридам относятся сахароза, мальтоза (солодовый сахар), лактоза (молочный сахар).
Полисахариды – подвергаются гидролизу с образованием множества молекул моносахаридов
(C12H10O5)n nH2O = nC6H12O6
Глюкоза C6H12O6
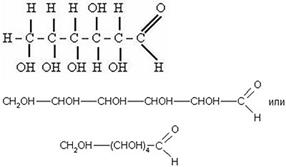
Глюкоза – это этоальдегидоспирт
Физические свойства:
Глюкоза – бесцветное, кристалическое, растворимое в воде вещество, сладкое на вкус, без запаха.
Химические свойства:
Глюкоза реагирует с Cu(OH)2
2NaOH CuSO4 = Cu(OH)2 Na2SO4
Реакция серебрянного зеркала
Реакция гидрирования
 CH2OH (CHOH)4 – C =O H2 = CH2OH (CHOH)4 – CH2OH
CH2OH (CHOH)4 – C =O H2 = CH2OH (CHOH)4 – CH2OH
Спиртовое брожение
C6H12O6 = 2C2H5OH CO2
Молочнокислое брожение
C6H12O6 = CH3 – CHOH – COOH — молочная кислота
Масленно-кислое брожение:
C6H12O6 = C3H7COOH 2CO2 2H2 бутановая кислота
Применение:
Глюкоза применяется в медицине, в кондитерской промышленности, глюкоза в составе патоки используется для изготовления мармелада, карамели, пряников и т.д
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 6O2→ 6H2O 6CO2 2800 кДж
Реакция серебряного зеркала применяется при изготовлении зеркал и елочных украшений. Используется в текстильной промышленности.
ВОПРОС №18
Крахмал Нахождение в природе практическое значение гидролиз крахмала
Физические свойства
Это белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 6H2O свет, хлорофилл → C6H12O6 6O2
nC6H12O6 → (C6H10O5)n nH2O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
Строение
Состоит из остатков α — глюкозы.
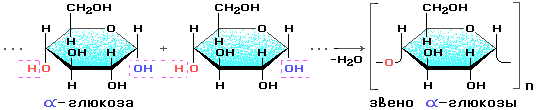
В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.

Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 — 6 млн.
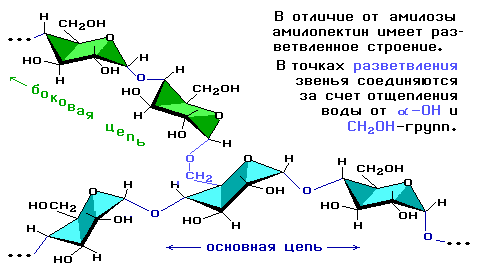
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Видео-опыт «Кислотный гидролиз крахмала» .
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:

Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
§
Гидролиз:
(C6H10O5)n nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6(Примечание, m < n )
крахмал декстрины мальтоза глюкоза
ВОПРОС №19
Целлюлоза состав молекул физические и химические свойства применение. Понятие об искуственных волокнах на примере ацетатного волокна
Целлюлоза (C6H10O5)n –природный полимер, полисахарид, состоящий из остатков β-глюкозы, молекулы имеют линейное строение. В каждом остатке молекулы глюкозы содержатся три гидроксильные группы, поэтому она проявляет свойства многоатомного спирта.
Физические свойства
Целлюлоза – волокнистое вещество, нерастворимое ни в воде, ни в обычных органических растворителях, гигроскопична. Обладает большой механической и химической прочностью.
Химические свойства
1. Целлюлоза – полисахирид, подвергается гидролизу с образованием глюкозы:
(C6H10O5)n nН2О → nС6Н12О6
2. Целлюлоза – многоатомный спирт, вступает в реакции этерификации с образованием сложных эфиров
[С6Н7О2(ОН)3]n 3nCH3COOH → 3nH2O [С6Н7О2(ОCOCH3)3]n
триацетат целлюлозы
Ацетаты целлюлозы – искусственные полимеры, применяются в производстве ацетатного шёлка, плёнки (киноплёнки), лаков.
Применение
Применение целлюлозы весьма разнообразно. Из неё получают бумагу, ткани, лаки, плёнки, взрывчатые вещества, искусственный шёлк (ацетатный, вискозный), пластмассы (целлулоид), глюкозу и многое другое.
Ацетатные волокна — один из основных видов искусственных волокон; получают из ацетилцеллюлозы. В зависимости от типа исходного сырья различают триацетатное волокно (из триацетилцеллюлозы) и собственно ацетатные волокна (из частично омыленной, т. е. вторичной, ацетилцеллюлозы).
Получение[править | править код]
Ацетатные волокна формируют из растворов ацетилцеллюлозы в органических растворителях (триацетилцеллюлозу — в смеси метиленхлорида и спирта, вторичную ацетилцеллюлозу — в ацетоне), обычно по т. н. сухому методу. По этому методу получают филаментные нити, т. н. ацетатный шёлк. При получении ацетатного штапельного волокна формование ведут по сухому или мокрому методу.
Свойства[править | править код]
Ацетатные волокна вдвое превосходят вискозные и медноаммиачные волокна по эластичности; поэтому ткани из них отличаются пониженной сминаемостью. Кроме того, ацетатные волокна приятны на ощупь, мягки, обладают способностью пропускать ультрафиолетовые лучи. Окрашиваются ацетатные волокна только специальными типами красителей, которые непригодны для большинства других волокон. Это даёт возможность получать разнообразные колористические эффекты на изделиях из смеси ацетатных волокон и волокон других типов. Триацетатное волокно характеризуется более низкой гигроскопичностью, но большей эластичностью и меньшей сминаемостью, чем изделия из ацетатного волокна. При 65%-ной относительной влажности триацетатное волокно адсорбирует 2,5—3 % влаги, а ацетатное 6—7 %.
Ацетатные волокна растворимы в ацетоне, поэтому чистить их этим растворителем нельзя.
Недостатки ацетатных волокон[править | править код]
Прочность при разрыве ацетатных волокон невысока (разрывная длина 11—13 мм). Потеря прочности при испытании в мокром состоянии для ацетатного волокна составляет 40—45 %, а для триацетатного 15—20 %. Ацетатные волокна характеризуются недостаточно высокой термостабильностью: выше 160—170 °C изменяется форма изделий из этого волокна, при 210 °C начинается его термический распад. Поэтому изделия из ацетатных волокон можно гладить только через влажную ткань. Ацетатные волокна малоустойчивы к действию даже разбавленных растворов щелочей, например, стиральной соды. К недостаткам изделий из ацетатных волокон относятся также низкая устойчивость к истиранию и высокая электризуемость. Для устранения этих недостатков используют методы химической модификации ацетилцеллюлозы.
Применение[править | править код]
Основные области применения ацетатных волокон — изготовление изделий широкого потребления (верхней одежды, женского нижнего белья, подкладочных и платяных тканей). Ацетатное штапельное волокно применяют для частичной замены шерстипри изготовлении тонких сукон и некоторых трикотажных изделий. Использование ацетатных волокон позволяет снижать сминаемость изделий. Триацетатные гидрофобные нити применяют как электроизоляционный материал.
Производство[править | править код]
Производство ацетатных волокон до 1957 бурно развивалось благодаря безвредности и простоте производства, ценным свойствам этих волокон, а также дешевизне исходного сырья. В дальнейшем развитие производства ацетатных волокон замедлилось в связи с появлением новых ценных типов синтетических волокон.
ВОПРОС №20)
§
Аминами называются производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами.
CH3 – NH2 C6H5 – NH2
метиламин фениламин, анилин
Группа NH3 называется аминогруппой.
Наибольшее практическое значение имеет ароматический амин анилин.
Анилин более слабое основание, чем амины предельного ряда.
Строение молекулы анилина
Строение молекулы можно изобразить несколькими способами:
C6H5 – NH2

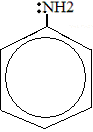
В молекуле анилина у атома азота, как и в молекуле других аминов, имеется неподелённая электронная пара, обуславливающая характерные свойства.
Получение анилина в промышленности основано на реакции восстановления нитробензола, которую в 1842 г. открыл русский учёный Н. Н. Зинин. Нитробензол восстанавливают в присутствии чугунных стружек и солёной кислоты. Вначале выделяется атомный водород, который и взаимодействует с нитробензолом.
Fe 2HCl à FeCl2 H2
C6H5 – NO2 6H à C6H5 – NH2 2H2O


ВОПРОС №21
Аминокислоты – амфотерные органические соединения их строение химические свойства (взаимодействие с соляной кислотой щелочами друг с другом) Применение биологическая роль
Аминокислоты – это гетерофункциональные органические соединения, в состав молекул которых входит аминогруппа NH2 и карбоксильная группа COOH
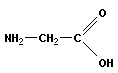 аминоуксусная кислота
аминоуксусная кислота
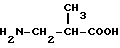 аминопропановая кислота
аминопропановая кислота
Физические свойства.
Аминокислоты – это бесцветные кристаллические растворимые в воде вещества. В зависимости от радикала они могут быть кислыми, горькими и безвкусными.
Химические свойства
Аминокислоты – это амфотерные органические соединения (за счёт аминогруппы, они проявляют основные свойства и за счёт карбоксильной группы COOH проявляют кислотные свойства)
Химические свойства
кислоты (проявляются основные свойства)
основания (проявляются кислотные свойства)
Аминокислоты не изменяют окраску индикатора, если количество аминогрупп и карбоксильных групп одинаково.
1) NH2-CH2-COOH НCl → NH3Cl-CH2-COOH
2) NH2-CH2-COOH NaOH → NH2-CH2-COONa H2O
3) NH2-CH2-COOH NH2-CH2-COOH → NH2-CH2-CO NH-CH2-COOH H2O
Биологическая роль аминокислот заключается в том, что из их остатков образуется первичная структура белка. Существует 20 аминокислот, которые являются исходными веществами для производства белков в нашем организме. Некоторые аминокислоты применяются в качестве лечебных средств, например глутаминовую кислоту — при нервных заболеваниях, гистидин – при язве желудка. Некоторые аминокислоты находят применение в пищевой промышленности, их добавляют в консервы и пищевые концентраты для улучшения пищи.
ВОПРОС №22
§
Белки – это биополимеры, состоящие из остатков α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). Белки входят в состав клеток и тканей всех живых организмов. В молекулы белков входит 20 остатков различных аминокислот.
Структура белка
Белки обладают неисчерпаемым разнообразием структур.
Первичная структура белка – это последовательность аминокислотных звеньев в линейной полипептидной цепи.
Вторичная структура – это пространственная конфигурация белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт водородных связей между группами: CO и NH.
Третичная структура – это пространственная конфигурация, которую принимает закрученная в спираль полипептидная цепь.
Четвертичная структура – это полимерные образования из нескольких макромолекул белка.
Физические свойства
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
Химические свойства
1. Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т.д.
2. Качественные реакции на белки:
а) При горении белка – запах палёных перьев.
б) Белок HNO3 → жёлтая окраска
в) Раствор белка NaOH CuSO4 → фиолетовая окраска
3. Гидролиз
Белок Н2О → смесь аминокислот
Функции белков в природе:
· каталитические (ферменты);
· регуляторные (гормоны);
· структурные (кератин шерсти, фиброин шелка, коллаген);
· двигательные (актин, миозин);
· транспортные (гемоглобин);
· запасные (казеин, яичный альбумин);
· защитные (иммуноглобулины) и т.д.
Функции белков
Функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α — аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α — аминокислоты. Многие α — аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белковα — аминокислоты не синтезируются в организме и должны поступать извне. Такие аминокислоты называются незаменимыми. К ним относятся валин, лейцин, треонин, метионин, триптофан и др. (см. таблицу). При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
· Каталитическая функция — осуществляется с помощью специфических белков — катализаторов (ферментов). При их участии увеличивается скорость различных реакций обмена веществ и энергии в организме.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК. Известно несколько тысяч ферментов. Среди них такие, как, например пепсин, расщепляют белки в процессе пищеварения.
· Транспортная функция — связывание и доставка (транспорт) различных веществ от одного органа к другому.
Так, белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин. Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
· Защитная функция — связывание и обезвреживание веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), образующиеся в организме (физическая, химическая и иммунная защита). Так, например, защитную функцию выполняет белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
· Сократительная функция (актин, миозин) – в результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
· Структурная функция — белки составляют основу строения клетки. Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей и кожи, эластин сосудистой стенки, кератин шерсти, фиброин шелка и др.) выполняют почти исключительно структурную функцию.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
· Гормональная (регуляторная) функция — способность передавать сигналы между тканями, клетками или организмами.
Выполняют белки-регуляторы обмена веществ. Они относятся к гормонам, которые образуются в железах внутренней секреции, некоторых органах и тканях организма.
· Питательная функция — осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Разнообразные функции белков определяются α-аминокислотным составом и строением их высокоорганизованных макромолекул.
ВОПРОС №23 ОТВЕТ) Взаимосвязь между классами органических соединений
Генетическая связь классов органических веществ состоит в том, что, используя вещества одного класса соединений, можно получить вещества, принадлежащие к другому классу органических соединений. Взаимосвязь классов органических веществ можно выразить различными схемами. Ниже приведены некоторые общие схемы взаимосвязи органических веществ, а также наиболее важные частные схемы (схемы 12.3 и 12.4).
Схема 12.3
. Взаимосвязи различных классов углеводородов
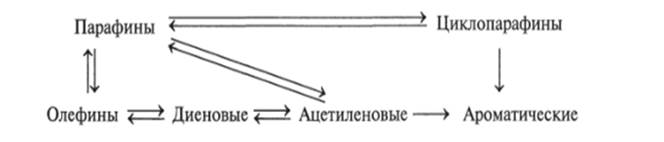
Схема 12.4. Общая взаимосвязь классов органических веществ
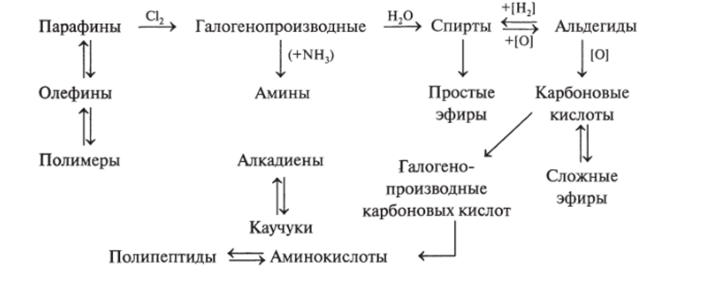
Схема 12.5. Частные превращения органических веществ
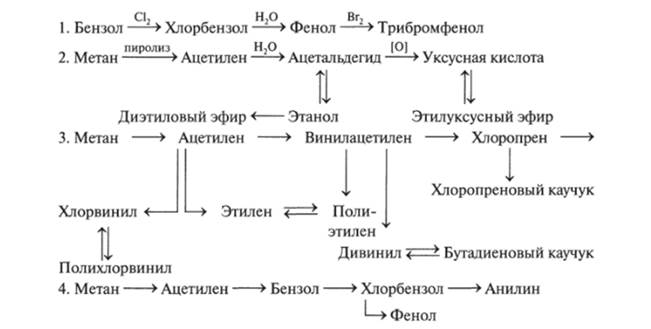
В схеме 12.5 (1—4) каждое превращение можно осуществить только в одну стадию. В заданиях часто предлагается осуществление превращений в несколько стадий (желательно наименьшее их число). Приведем примеры таких превращений (нумерация частных превращений едина).
Схем частных превращений существует бесконечное множество. Для составления таких схем необходимо знание свойств конкретных соединений и общих закономерностей взаимосвязи классов органических веществ.
Между различными классами органических веществ существует генетическая взаимосвязь, позволяющая осуществлять синтезы нужных соединений, основываясь на выбранной схеме превращений. В свою очередь, простейшие органические вещества могут быть получены из неорганических веществ. В качестве примера рассмотрим практическое осуществление реакций согласно следующей схеме:
1) Из углерода (графита) представляется возможность получить метан, с помощью прямого синтеза: так же возможно получить метан в 2 стадии – через карбид алюминия
→ 2) Из метана так же можно получить этилен. Его получение возможно различными способами в несколько стадий. К примеру, можно провести синтез Вюрца. После чего провести дегидрирование этана: так же можно проделать термический крекинг метана и частичное гидрирование полученного ацетилена
→ 3) Этиловый спирт образуется путем гидратации этилена. Гидратация осуществляется в присутствии неорганической кислоты
→ 4) Уксусный альдегид (этаналь) возможно получить с помощью дегидрирования этанола на медном катализаторе. Так же можно получить и при окислении спирта оксидом меди(II)
→ 5) Уксусный альдегид достаточно легко окисляется до уксусной кислоты. В качестве примера можно взять реакцию «серебряного зеркала», или взаимодействии с подкисленным раствором KMnO4 или K2Cr2O7 в процессе нагревания. Так же данную реакцию можно изобразить схематично, с помощью следующего уравнения
→ 6) Синтез аминоуксусной кислоты проводится через промежуточную стадию получения хлоруксусной кислоты.
ВОПРОС №24
Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
Полимеры – органические или неорганические соединения, молекулы которых состоят из десятков и сотен тысяч связанных между собой повторяющихся звеньев. Исходное вещество – мономер (низкомолекулярные вещества, способные к взаимодействию друг с другом) за счёт наличия кратных связей (этилен, стирол и т.д.) или существования функциональных групп (COOH и NH2).
Высокомолекулярные соединения (полимеры) существуют как в природе (белки, нуклеиновые кислоты, крахмал, целлюлоза, природный каучук), так и производится в больших масштабах синтетическим путём. Объёмы этих производств всё возрастают. Самыми известными полимерами являются полиэтилен, поливинилхлорид, полистирол, синтетический каучук.
Свойства:
1) химическая стойкость;
2) пластичность;
3) механическая прочность;
4) диэлектрические характеристики;
Свойства полимеров определяются как химической природой мономеров, так и строением макромолекулярной цепи.
1) Цепи могут быть линейными (полиэтилен, каучук), разветвлёнными (крахмал) или пространственно структурированными (резина).
2) В зависимости от порядка соединения мономеров в макромолекуле полимеры могут иметь регулярное (2,3) и нерегулярное строение (1).
Вид структуры определяет физические свойства молекулы.
3) Химическая природа мономера определяет гибкость и термомеханические свойства материала.
Для получения ВМС существуют 2 реакции получения:
1) Полимеризация (образование более сложной молекулы за счёт раскрытия двойной связи)
nCH2=CH2 [−CH2−CH2−]n полиэтилен n≤10000, n≤300000
nCH2=CH−CH=CH2 [−CH2−C=CH−CH2−]n
CH3изопрен CH3 полиизопрен
2) Реакция поликонденсации заключается в химическом взаимодействии мономеров по их функциональным группам с отщеплением низкомолекулярного продукта (например, H2O)
H O
nH2N−(CH2)5−COOH −N−(CH2)5−C− n nH2O
аминокапроновая кислота полимер «капрон»
Синтетические полимеры – уникальные материалы современности и будущего.
ВОПРОС №25
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В 1869 г. Д. И. Менделеев на основе анализа свойств простых веществ и соединений сформулировал Периодический закон:
Свойства простых тел и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы — группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось «поменять местами» теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
Заряд ядра равен номеру элемента в периодической системе и числу электронов в электронной оболочке атома.
Эта формулировка объяснила «нарушения» Периодического закона.
В Периодической системе номер периода равен числу электронных уровней в атоме, номер группы для элементов главных подгрупп равен числу электронов на внешнем уровне.
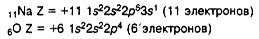
Причиной периодического изменения свойств химических элементов является периодическое заполнение электронных оболочек. После заполнения очередной оболочки начинается новый период. Периодическое изменение элементов ярко видно на изменении состава и свойств и свойств оксидов.

Научное значение периодического закона. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При составлении периодической системы Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и предсказал многие свойства неоткрытых элементов, что облегчило их открытие.


ВОПРОС №26
Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы
Атом – наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочкиуравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен -1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда.
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 – 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне,
n – номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии.
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
максимальным количеством электронов: на 1-м уровне не больше 2 e–, на 2-м – 8 e–,
на внешнем уровне – 8 e–;
числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко
выраженные металлические свойства. Элементы, расположенные в средней части
коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную
ковалентнуто структуру, а элементы из правой части этих периодов существуют в
виде простых ковалентных молекул.
Атомные радиусы изменяются следующим образом: уменьшаются при перемещении
слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль
группы. При перемещении слева направо по периоду возрастает
электроотрицательность, энергия ионизации и сродство к электрону, которые
достигают максимума у галогенов. У благородных же газов
электроотрицательность равна 0. Изменение сродства к электрону элементов при
перемещении сверху вниз вдоль группы не столь характерны, но при этом
уменьшается электроотрицательность элементов.
В элементах второго периода заполняются 2s, а затем 2р-орбитали.
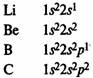
Главная подгруппа IV группы периодической системы химических элементов Д. М.
Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb.
Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s
2p2). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна 4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии
ионизации и радиуса их атомов. С увеличением атомного номера свойства
элементов закономерно изменяются. Так, углерод и кремний — типичные
неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что
углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной
оболочки атома p-элементы IV группы имеют четные степени окисления: 4, 2, –
Формула простейших водородных соединений — ЭН4, причем связи Э—Н
ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с
образованием направленных под тетраэдрическими углами sp3 -орбиталей.
Ослабление признаков неметаллического элемента означает, что в подгруппе
(С—Si—Ge—Sn—Pb) высшая положительная степень окисления 4 становится все
менее характерной, а более типичной становится степень окисления 2. Так,
если для углерода наиболее устойчивы соединения, в которых он имеет степень
окисления 4, то для свинца устойчивы соединения, в которых он проявляет
степень окисления 2. А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.
ВОПРОС №27
§
Химическая связь – электрические силы притяжения, которые удерживают частицы друг около друга. В образовании химической связи могут участвовать атомы, ионы или молекулы. Атомы химических элементов, имеющих незавершённый внешний уровень, неустойчивы и стремятся его завершить. В процессе химических реакций осуществляется завершение внешних уровней, что достигается либо отдачей электронов (у металлов), либо присоединением (у неметаллов), а также образованием общих электронных пар. Различают несколько типов химических связей:
1.Ковалентная связьосуществляется за счёт образования общих электронных пар, связывающих ядра атомов. Ковалентная связь образуется между атомами неметаллов.
Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью (в простых веществах – неметаллах):
Н◦ ◦Н → Н◦◦Н (или Н—Н)
Общие электронные пары в равной степени принадлежат обоим атомам.
2.Ковалентная полярная связь образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.
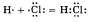
Атом хлора имеет большую электроотрицательность, чем атом водорода, поэтому общая электронная пара смещена в его сторону. Соответственно возникнут заряды: на атоме хлора — отрицательный, на атоме водорода – положительный. Такая связь называется полярной. (Примеры: Н2О, H2S, CH3Cl)
3. Ионная связь. Ионы — это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
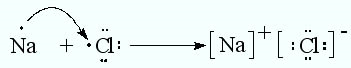
Атом натрия полностью отдаёт один электрон, а атом хлора его принимает, образуются ионы, которые притягиваются друг к другу и образуют ионную кристаллическую решётку:
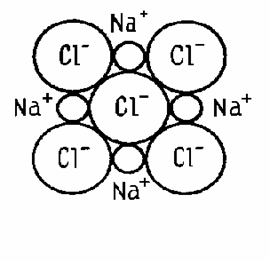
Ионная связь характерна для щелочей, солей, оксидов типичных металлов.
Простые и кратные связи
Если атомы связаны между собой одной общей электронной парой, то возникает одна ковалентная связь, которая называется простой, одинарной или σ-связью. Это основной вид связи, он существует во всех молекулах: Н-Н; Br-Br; CH3-CH3
σ-связи – это ковалентные связи, при образовании которых перекрывание электронных облаков осуществляется вдоль линии связи, соединяющей центры атомов.
Двойные и тройные связи имеют общее название: кратные связи.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей центры атомов.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи: СН2=СН2; О=О.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух
π-связей: СН≡СН; N≡N.
Различают четыре основных вида химической связи:
1. Ковалентная связь осуществляется общими электронными парами. Она образуется в результате перекрывания электронных облаков (орбиталей) атомов неметаллов. Чем больше перекрывание электронных облаков, тем прочнее химическая связь. Ковалентная связь бывает полярная и неполярная.Ковалентная неполярная связь возникает между атомами одного вида, у которых электроотрицательность одинакова. (Электроотрицательность – это свойство атомов притягивать к себе электроны). Например, образование молекулы водорода можно показать схемой:
 H . .H = H (:) H H2
H . .H = H (:) H H2
или H . .H = H – H
Аналогично образуются молекулы O2, Cl2, N2, F2 и др.
Неполярная ковалентная связь симметрична. Электронное облако, образованное общей (поделенной) электронной парой, одинаково принадлежит двум атомам.
Полярная ковалентная связь возникает между атомами, электроотрицательности которых отличаются, но незначительно. В этом случае общая электронная пара сдвигается в сторону более электроотрицательного элемента, например, при образовании молекулы хлороводорода электронное облако связи смещено к атому хлора. За счет этого смещения атом хлора приобретает частичный отрицательный заряд, а атом водорода – частичный положительный заряд, а образующаяся молекула является полярной.
H Cl = H Cl H → Cl HCl
Аналогично образуются молекулы HBr, HI, HF, H2O, CH4 и т.д.
Ковалентные связи бывают одинарные (осуществляются одной общей электронной парой), двойные (осущ. двумя общими электронными парами), тройные (осущ. тремя общими электронными парами). Например, в этане все связи одинарные, в этилене присутствует двойная связь, а в ацетилене – тройная связь.
Этан: CH3 –CH3 Этилен: CH2 = CH2 Ацетилен: CH ≡ CH
2. Ионная связь возникает в соединениях, образуемых атомами элементов, которые сильно отличаются по электроотрицательности, т. е. с резко противоположными свойствами (атомы металлов и неметаллов). Ионы – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Ионная связь образуется за счет электростатического притяжения разноименно заряженных ионов. Например, атом натрия, отдавая свой электрон, превращается в положительно заряженный ион, а атом хлора, принимая этот электрон, превращается в отрицательно заряженный ион. За счет электростатического притяжения между ионами натрия и хлора возникает ионная связь:

 Na Cl Na Cl– Na Cl–
Na Cl Na Cl– Na Cl–
Молекулы хлорида натрия существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют.
Ионную связь можно рассматривать как крайний случай ковалентной связи.
3. Металлическая связь существует в металлах и сплавах. Она осуществляется за счет притяжения между ионами металла и обобществленными электронами (это валентные электроны, которые покинули свои орбитали и перемещаются по всему куску металла между ионами – « электронный газ »).
4. Водородная связь – это своеобразная связь, которая возникает между атомом водорода одной молекулы, имеющим частичный положитедьный заряд, и электроотрицательным атомом другой или той же самой молекулы. Водородная связь может быть межмолекулярной и внутримолекулярной. HF…HF…HF. Обозначается точками. Слабее ковалентной.
ВОПРОС №28
Классификация химических реакций в неорганической и органической химии
§
А) Классификация по количеству начальных веществ:
Разложение – вследствие данной реакции, из одного имеющегося сложного вещества, образуются два или несколько простых, а так же сложных веществ.
Пример: 2Н2O2 → 2Н2O O2
Соединение – это такая реакция, при которой из двух и более простых, а также сложных веществ, образуется одно, но более сложное.
Пример: 4Al 3O2 → 2Al2O3
Замещение – это определенная химическая реакция, которая проходит между некоторыми простыми, а так же сложными веществами. Атомы простого вещества, в данной реакции, замещаются на атомы одного из элементов, находящегося в сложном веществе.
Пример: 2КI Cl2 → 2КCl I2
Обмен – это такая реакция, при которой два сложных по строению вещества обмениваются своими частями.
Пример: HCl KNO2 → KCl HNO2
Б) Классификация по тепловому эффекту:
Экзотермические реакции – это определенные химические реакции, при которых происходит выделение тепла.
Примеры:
S O2 → SO2 Q
2C2H6 7O2 → 4CO2 6H2O Q
Эндотермические реакции – это определенные химические реакции, при которых происходит поглощение тепла. Как правило, это реакции разложения.
Примеры:
CaCO3 → CaO CO2 – Q
2KClO3 → 2KCl 3O2 – Q
Теплота, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом.
Химические уравнения, в которых указан тепловой эффект реакции, называют термохимическими.
В) Классификация по обратимости:
Обратимые реакции – это реакции, которые протекают при одинаковых условиях во взаимопротивоположных направлениях.
Пример: 3H2 N2 ⇌ 2NH3
Необратимые реакции – это реакции, которые протекают только в одном направлении, а так же завершающиеся полным расходом всех исходных веществ. При этих реакциях выделяется газ, осадок, вода.
Пример: 2KClO3 → 2KCl 3O2 ↑
Г) Классификация по изменению степени окисления:
Окислительно — восстановительные реакции – в процессе данных реакций происходит изменение степени окисления.
Пример: Сu 4HNO3 → Cu(NO3)2 2NO2 2H2O.
Не окислительно — восстановительные – реакции без изменения степени окисления.
Пример: HNO3 KOH → KNO3 H2O.
Д) Классификация по фазе:
Гомогенные реакции – реакции, протекающие в одной фазе, когда исходные вещества и продукты реакции имеют одно агрегатное состояние.
Пример: Н2(газ) Cl2(газ) → 2HCL
Гетерогенные реакции – реакции, протекающие на поверхности раздела фаз, при которых продукты реакции и исходные вещества имеют разное агрегатное состояние.
Пример: CuO H2 → Cu H2O
Классификация по использованию катализатора:
Катализатор – вещество, которое ускоряет реакцию. Каталитическая реакция протекает в присутствии катализатора, некаталитическая – без катализатора.
Пример: 2H202MnO2→ 2H2O O2 катализатор MnO2
Взаимодействие щелочи с кислотой протекает без катализатора.
Пример: КOH HCl → КCl H2O
Ингибиторы – вещества, замедляющие реакцию.
Катализаторы и ингибиторы сами в ходе реакции не расходуются.
 Виды химических реакций в органической химии
Виды химических реакций в органической химии
Замещение – это реакция, в процессе которой происходит замена одного атома/группы атомов, в исходной молекуле, на иные атомы/группы атомов.
Пример: СН4 Сl2 → СН3Сl НСl
Присоединение – это реакции, при которых несколько молекул вещества соединяются в одну. К реакциям присоединения относятся:
- Гидрирование – реакция, в процессе которой происходит присоединение водорода по кратной связи.
Пример: СН3—СН = СН2 (пропен) Н2 → СН3—СН2—СН3 (пропан)
- Гидрогалогенирование – реакция, присоединяющая галогенводород.
Пример: СН2 = СН2 (этен) НСl → СН3—СН2—Сl (хлорэтан)
Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом) так же, как и алкены. Присоединение в химической реакции проходит в 2 стадии, и определяется правилом Марковникова:
При присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода.
Механизм данной химической реакции. Образующийся в 1 — ой, быстрой стадии, p- комплекс во 2 — ой медленной стадии постепенно превращается в s-комплекс — карбокатион. В 3 — ей стадии происходит стабилизация карбокатиона – то есть взаимодействие с анионом брома:

И1, И2 — карбокатионы. П1, П2 — бромиды.
Галогенирование – реакция, при которой присоединяется галоген. Галогенированием так же, называют все процессы, в результате которых в органические соединения вводятся атомы галогена. Данное понятие употребляется в «широком смысле». В соответствии с данным понятием, различают следующие химические реакции на основе галогенирования: фторирование, хлорирование, бромирование, йодирование.
Галогенсодержащие органические производные считаются важнейшими соединениями, которые применяются как в органическом синтезе, так и в качестве целевых продуктов. Галогенпроизводные углеводородов, считаются исходными продуктами в большом количестве реакций нуклеофильного замещения. Что касается практического использования соединений, содержащих галоген, то они применяются в виде растворителей, например хлорсодержащие соединения, холодильных агентов — хлорфторпроизводные, фреоны, пестицидов, фармацевтических препаратов, пластификаторов, мономеров для получения пластмасс.
Гидратация – реакции присоединения молекулы воды по кратной связи.
Полимеризация – это особый вид реакции, при которой молекулы вещества, имеющие относительную невеликую молекулярную массу, присоединяются друг к другу, впоследствии образовывая молекулы вещества с высокой молекулярной массой.
ВОПРОС №29
Химическое равновесие и условия его смещения (изменение концентрации реагентов, температуры, давления).
Необратимые реакции протекают до полного расходования одного из исходных веществ, т. е. если одно из получающихся веществ выпадает в осадок или выделяется в виде газа:
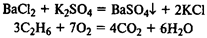
Обратимые реакции протекают до достижения состояния химического равновесия.

Химическое равновесие — состояние, при котором скорости прямой и обратной реакций равны.
Обратимые реакции протекают до достижения состояния равновесия.
Обратимость многих реакций кажущаяся. Так, реакция водорода с кислородом с образованием воды кажется обратимой. Однако при температуре 2000°С с заметной скоростью протекает обратный процесс — разложение воды на водород и кислород и устанавливается равновесие.
Смещение химического равновесия при изменении условий описывается принципом Ле-Шателье.
§
Смещение равновесия при изменении температуры. В случае экзотермической реакции (протекающей с выделением тепла) равновесие смещается влево (в сторону исходных веществ) при повышении температуры, и вправо (в сторону продуктов реакции) при понижений температуры: |
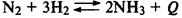
В случае эндотермической реакции (протекающей с поглощением тепла) равновесие смещается вправо при повышении температуры и влево при понижении температуры:

Смещение равновесия при изменении давления.
Если реакция протекает с увеличением числа молекул газообразных веществ, при повышении давления равновесие смещается влево, а при понижении давления вправо:
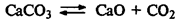
Если реакция протекает с уменьшением числа молекул газообразных веществ, то при повышении давления равновесие смещается вправо, а при понижений давления влево:
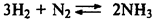
Если реакция протекает без изменения числа молекул газообразных веществ, то при изменении давления равновесие не смещается:
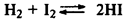
Химические реакции бывают обратимые и необратимые.
| Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении: |
т.е. если некоторая реакция A B = C D необратима, это значит, что обратная реакция C D = A B не протекает.
| Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄): |
т.е., например, если некая реакция A B = C D обратима, это значит, что одновременно протекает как реакция A B → C D (прямая), так и реакция С D → A B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
T | ↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
p | ↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
c | ↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
ВОПРОС №30
§
Скорость реакции – это число частиц образованных за единицу времени в единице объема.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенная реакция протекает в одной фазе. Гетерогенные реакции протекают на границе раздела фаз. [моль*м-3/с] не учитывая газы.
Vср = -Dc/Dt
Vмг = ±dc/dt
Vпр=Kпр*[A]a[B]b
Vобр=Kобр*[С]с[В]d
Молекулярность и порядок реакции.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называется одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно-параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные) и три молекулы (тримолекулярные). Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется её молекулярностью.
Порядок реакции — это сумма порядков реакции по реагентам.
Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении:
а) V1 = K1[H2O2] ; б) V2 = K2[O2].
Поэтому обе реакции первого порядка.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция а) одномолекулярная, б) двухмолекулярная.
Выражение для определения скорости реакции первого порядка
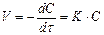 .
.
Скорость реакции второго порядка для двух реагентов В и D подчиняется кинетическому уравнению
V = K·CB·CD,
где СВ – концентрация реагента В, а СD – концентрация реагента D.
Наиболее часто встречаются реакции первого и второго порядка. Реакции третьего порядка крайне редки. Реакции более высокого порядка, чем третий, неизвестны, так как в большинстве случаев реакции многостадийны.
Правило Вант-Гоффа. V2 = V1×gDT/ 10
Повышение температуры ускоряет большинство реакций. Согласно правилу Вант-Гоффа при увеличении температуры на 10 К скорость многих реакций увеличивается в 2-4 раза V2 = V1×gDT/ 10
Где V2 и V1 – скорость реакции при температурах Т2 и Т1 , γ – коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции. Для многих реакций γ лежит в пределах 2- 4.
Скорость химических реакций зависит:
1. Природа реагирующих веществ
а) 2Na 2H2O=2NaOH H2
б) 2K 2H2O=2KOH H2 Скорость реакции» б» больше чем «а» , так как калий
активнее натрия.
2.Концентрация. Чем выше концентрация, тем больше скорость реакции, Эта зависимость выражается законом действующих масс.
Например, сера горит в чистом кислороде и на воздухе. СКОРОСТЬ ГОРЕНИЯ СЕРЫ В КИСЛОРОДЕ В 5 раз больше, чем на воздухе.
2. Температура
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
3. Катализатор — вещество, изменяющее скорость реакции. Он может как увеличивать скорость реакции так и уменьшать ( такой катализатор называется ингибитором) .
ВОПРОС №31
§
В растворах электролитов реакции протекают между ионами.
Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления.
Условия течения реакций в растворах электролитов до конца:
1) в результате реакции выпадает осадок:
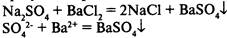
2) в результате реакции выделяется газ:
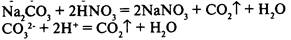
3) в результате реакции образуется малодиссоциирующее вещество:
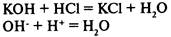
Ионный обмен – это процесс, в результате которого ионы, находящиеся в твердой фазе. обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок.
На поверхности этих твердых веществ имеются электрически заряженные центры, расположенные на более или менее регулярном расстоянии друг от друга. Эти центры удерживают на себе простые ионы с зарядами противоположного знака. Именно эти ионы обмениваются с другими ионами, содержащимися в растворе.
Катионообменники. Катионообменные материалы состоят из трех частей:
1) основная масса, или скелет, обычно обозначаемый символом R–;
2) активные центры (такие группы, как — 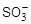 либо —
либо — 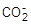 );
);
3) катионы, подлежащие обмену (обычно это ионы Н или Н3О ).
Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие. Например,
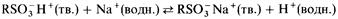
Если первоначально раствор содержит, например, хлорид натрия, то ионы натрия обмениваются с ионами водорода и из нижней части колонки вытекает разбавленный раствор соляной кислоты.
Ионообменный материал можно регенерировать (восстанавливать), промывая колонку разбавленной соляной кислотой. Это приводит к смещению влево рассматриваемого равновесия, в результате чего ионы натрия замещаются ионами водорода.
Анионообменники. Анионообменник удаляет из раствора анионы. Типичным примером анионного обмена является следующее равновесие:
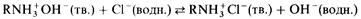
Для регенерации анионообменника может использоваться какое-либо основание, например раствор гидроксида натрия. Это сдвигает указанное равновесие влево.
1. Если образуется осадок (¯) (смотри таблицу растворимости)
Pb(NO3)2 2KI ® PbI2¯ 2KNO3
Pb2 2I— ® PbI2¯
2. Если выделяется газ ()
Na2CO3 H2SO4 ® Na2SO4 H2O CO2
CO32- 2H ® H2O CO2
3. Если образуется малодиссоциированное вещество (H2O)
Ca(OH)2 2HNO3 ® Ca(NO3)2 2H2O
H OH— ® H2O
4. Если образуются комплексные соединения (малодиссоциированные комплексные ионы)
CuSO4 • 5H2O 4NH3 ® [Cu(NH3)4]SO4 5H2O
Cu2 4NH3 ® [Cu(NH3)4]2
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O) или комплексных ионов реакции обмена обратимы «.
ВОПРОС №32
Важнейшие классы неорганических соединений
К важнейшим классам неорганических соединений относятся оксиды, кислоты, основания и соли.
Оксиды — это сложные вещества, состоящие из двух видов химических элементов, одним из которых является кислород. Оксиды делятся на кислотные (в основном оксиды неметаллов) и основные (оксиды многих металлов). Кислотные оксиды реагируют с щелочами, в результате чего образуется соль. Соли также образуются в результате взаимодействия основного оксида с кислотой.
Основания — это сложные вещества, состоящие из атомов металла и гидроксогрупп (OH). Гидроксогруппа имеет валентность I, поэтому их количество в основании определяется валентностью металла. Например, NaOH — здесь одна гидроксогруппа, так как валентность натрия I. Ca(OH)2 — здесь валентность металла равна II, следовательно, к нему присоединяются две гидроксогруппы.
Основания, которые растворяются в воде, называются щелочами. Их можно получить при взаимодействии металла или его оксида с водой. Щелочи образуют наиболее активные металлы.
Все основания реагируют с кислотами с образованием соли и воды. Эта реакция называется реакцией нейтрализации.
Кислоты — это сложные вещества, состоящие из атомов водорода, которые могут замещаться на металл, и кислотных остатков. Кислотные остатки большинства кислот содержат атомы кислорода и другого какого-либо неметалла. Например, H2SO4, HNO3, H3PO4, H2CO3. Однако есть бескислородные кислоты — HCl, H2S, HBr.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Например, NaCl, CaCl2, K2SO4, CuSO4 и т. д. Соли можно рассматривать как результат замещения атомов водорода в кислоте на металл. Соли вступают в реакции обмена с другими солями, растворами кислот и щелочей. Более активный металл вытесняет из соли менее активный.
Из одних классов веществ в результате химических взаимодействий можно получать другие классы. Таким образом, говорят, что классы химических соединений генетически взаимосвязаны между собой.
В химии все многообразие неорганических веществ: принято разделять на две группы – простые и сложные. Простые вещества подразделяются на металлы и неметаллы. А сложные – на производные от простых, образованные путем их взаимодействия с кислородом, водой и между собой. Эту классификацию неорганических веществ в виде схемы изображают следующим образом:
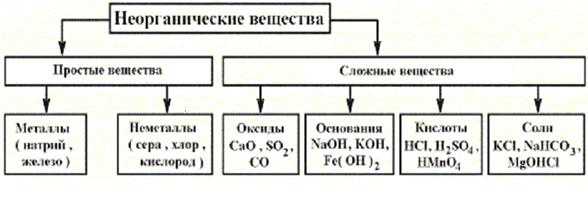
Рис. 2.1. Классификация неорганических соединений.
Классификация реакций в неорганической химии. В неорганической химии различают реакции: 1)соединения, 2)разложения (и те и другие могут быть окислительно-восстановительными реакциями, а могут и не быть таковыми), 3)обмена, 4)замещения, которые всегда являются окислительно-восстановительными. Схемы реакций и примеры даны в таблице 2.1.
Таблица 2.1
Классификация реакций
| Тип реакции | Схема реакции | Примеры реакций |
| Соединение | А В = АВ | 1) Ca0 Cl20= Ca2 Cl2— (ОВР) 2) CaO CO2 = CaCO3 |
| Разложение | АВ = А В | 1) 2Ag2O = 4Ag O2 (ОВР) 2) Cu(OH)2 = CuO H2O |
| Обмен | AB CD=AD CB | BaCl2 Na2SO4 = BaSO4↓ 2NaCl |
| Замещение | AB C = CB A | Zn Pb(NO3)2 = Pb Zn(NO3)2 (ОВР) |
Рассмотрим получение и свойства наиболее важных классов неорганических соединений.
ОКСИДЫ (окислы) — сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления, равной -2. Общая формула любого оксида — ЭхОу-2. Различают солеобразующие (основные: Li2O, CaO, MgO ,FeO; амфотерные: ZnO, Al2O3, SnO2, Cr2O3, Fe2O3; кислотные: B2O3 , SO3 , CO2, P2O5 Mn2O7) и несолеобразующие: N2O, NO, CO оксиды. Элементы с переменной степенью окисления образуют несколько оксидов (MnO, MnO2, Mn2O7, NO, N2O3, NO2, N2O5). В высшем оксиде, как правило, элемент находится в степени окисления, равной номеру группы.
По современной международной номенклатуре названия оксидов составляют следующим образом: слово «оксид», далее русское название элемента в родительном падеже, степень окисления элемента (если она переменна). Например: FeO – оксид железа (II), P2O5 – оксид фосфора (V).
Основные оксиды это те, которым соответствуют гидроксиды – основания. Основными называют оксиды, взаимодействующие с кислотами с образованием соли и воды. Основные оксиды образуются только металлами в степени окисления 1, 2 (иногда 3), например: BaO, SrO, FeO, MnO, CrO, Li2O, Bi2O3, Ag2O.
Получение основных оксидов:
1) Окисление металлов при нагревании в атмосфере кислорода:
2Mg O2=2MgO;
2Cu O2=2CuO.
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера; в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с ионами O2-, поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава, и могут существовать смешанные оксиды переменного состава.
Кислотные оксиды — оксиды, которые при взаимодействии с основаниями образуют соль и воду. Кислотным оксидам соответствуют гидроксиды – кислоты. Кислотные оксиды – это оксиды неметаллов в различных степенях окисления, либо оксиды металлов в высокой степени окисления ( 4 и выше). Примеры: SO2, SO3, Cl2O7, Mn2O7, CrO3.
Химическая связь в кислотных оксидах – ковалентная полярная. При обычных условиях кислотные оксиды неметаллов могут быть газообразными (CO2, SO2), жидкими (N2O3, Cl2O7), твердыми (P2O5, SiO2).
Получение кислотных оксидов.
1) Окисление неметаллов:
S O2=SO2
2) Окисление сульфидов:
2ZnS 3O2=2ZnO 2SO2
Амфотерные оксиды взаимодействуют и с кислотами и со щелочами, проявляя свойства кислотных и основных оксидов. Им соответствуют амфотерные гидроксиды. Все они твердые вещества, нерастворимые в воде. Примеры амфотерных оксидов: ZnO, BeO, SnO, PbO, Al2O3, Cr2O3, Sb2O3, MnO2.
Свойства амфотерных оксидов.
Амфотерные оксиды реагируют с кислотами как основные:
Al2O3 6HCl=2AlCl3 3H2O,
а со щелочами – как кислотные. Состав продуктов реакции зависит от условий. При сплавлении:
ZnO 2NaOH=Na2ZnO2 H2O;
Цинкат натрия
В растворе щелочи образуется растворимая комплексная соль, содержащая гидроксокомплексный ион:
ZnO 2NaOH H2O=Na2[Zn(OH)4]
Тетрагидроксоцинкат натрия
Несолеобразующие оксиды – это оксиды неметаллов, которым не соответствуют гидроксиды и соли. Примеры: CO, N2O, NO, SiO.
Оксиды широко распространены в природе. Так вода – самый распространенный оксид покрывает 71% поверхности планеты. Оксид кремния (IV) в виде 400 разновидностей кварца составляет 12% от массы земной коры. Оксид углерода (IV) (углекислый газ) содержится в атмосфере — 0,03% по объему, а также в природных водах. Важнейшие руды: гематит, магнетит, бурый железняк состоят из различных оксидов железа. Бокситы содержат оксид алюминия, и т.д.
ОСНОВАНИЯ – сложные вещества, в которых на атом металла приходится одна или несколько гидроксогрупп ОН—. Степень окисления атомов металла обычно 1, 2 (реже 3). Общая формула оснований Ме(ОН)х, где х – число гидроксогрупп – кислотность основания. (МеОН – однокислотное, Ме(ОН)2 – двухкислотное , Ме(ОН)3 – трехкислотное основание).
Названия основаниям дают следующим образом: «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами – степень окисления, если она переменная. Например: KOH –гидроксид калия, Ni(OH)2 – гидроксид никеля(II).
При обычных условиях основания – твердые вещества, кроме гидроксида аммония – водного раствора аммиака NH4OH (NH4 — ион аммония, входящий в состав солей аммония).
Классификация оснований. В зависимости от отношения к воде основания делятся на растворимые (щелочи) и нерастворимые. К растворимым основаниям — щелочам относятся только гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, CsOH, RbOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2) а также водный раствор аммиака. Все остальные основания практически нерастворимы в воде.
С точки зрения теории электролитической диссоциации основания – электролиты, диссоциирующие в водном растворе с образованием в качестве анионов только гидроксид-ионов:
Ме(ОН)х Û Мех хОН—.
Наличие в растворе ионов гидроксида определяют с помощью индикаторов: лакмуса (синий), фенолфталеина (малиновый), метилоранжа (желтый). Нерастворимые основания не меняют окраски индикаторов.
ВОПРОС №33
Классификации:
Все неорганические соединения делятся на две большие группы:
- Простые вещества — состоят из атомов одного элемента;
- Сложные вещества — состоят из атомов двух или более элементов.
Простые вещества по химическим свойствам делятся на:
- металлы
- неметаллы
- амфотерные простые вещества
- благородные газы
Сложные вещества по химическим свойствам делятся на:
- осно́вные оксиды
- кислотные оксиды
- амфотерные оксиды
- двойные оксиды
- несолеобразующие оксиды
- основания
- кислоты
- амфотерные гидроксиды
- средние соли
- кислые соли
- осно́вные соли
- двойные и/или комплексные соли
бинарные соединения:
- бескислородные кислоты
- бескислородные соли
- прочие бинарные соединения
Неорганические вещества, содержащие углерод:
Данные вещества традиционно относятся к области неорганической химии:
- Карбонаты
- Карбиды
- Цианиды
- Оксиды углерода
- Цианаты
- Неорганические тиоцианаты (роданиды)
- Селеноцианаты
- Карбонилы металлов
Металлы — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Характерные свойства металлов
- Металлический блеск
- Хорошая электропроводность
- Возможность лёгкой механической
- Высокая плотность
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
В реакциях чаще всего являются восстановителями окислительно-восстановительных реакциях в водных растворах.
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
В периодической системе элементов Д.И.Менделеева металлы расположены в левом нижнем углу от диагонали B–At.
В металлах связь металлическая и металлическая кристаллическая решётка чем объясняются физические свойства металлов.
Для главных подгрупп: чем левее и ниже металл, тем большую химическую активность он проявляет. В периодах металлические свойства убывают, а в группах усиливаются (с увеличением порядкового номера), так как изменяется радиус атома.
Для металлов характерны общие физические свойства:
1) твёрдость; 2) электро и теплопровдность; 3) непрозрачность; 4) металлический блеск;
5) ковкость или пластичность (объяснение – металлическая кристаллическая решётка).
ВОПРОС №34
§
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Из 118 известных на данный момент химических элементов 22 элемента образуют простые вещества, обладающие неметаллическими свойствами.
Неметаллы располагаются в III-VII группах. По физическим свойствам к неметаллам следует отнести также VIIIА группу, или группу благородных газов. Неметаллы образуют p-элементы, а также водород и гелий, являющиеся s-элементами. В длиннопериодной таблице p-элементы, образующие неметаллы, располагаются правее и выше условной границы B—At.
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Особенности строения атомов неметаллов.
У большинства атомов неметаллов от четырех до восьми валентных электронов во внешнем слое, но у атома водорода — один, у атома гелия — два, а у атома бора — три валентных электрона, небольшой радиус атома (орбитальный радиус меньше 0,1 нм). Поэтому атомы неметаллов стремятся довести недостающие до 8е. Это свойство атомов характеризуется электроотрицательностью. Для атомов неметаллов характерны высокие значения электроотрицательности. Она изменяется в пределах от 2 до 4.
В соответствии с ним неметаллы образуют особый ряд:
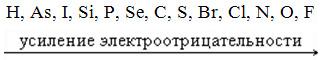
Вида связи, характерные для неметаллов:
· ионная (КСI);
· ковалентная (неполярная − в простых веществах(С12)
· полярная − в соединениях неметаллов (SCl2).
4. Неметаллы − простые вещества. Строение.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью; в благородных газах химических связей нет. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Cl2, Вг2), двойные (например, в молекулах кислорода) тройные (например, в молекулах азота) ковалентные связи.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это галогены − F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также H2, N2, O2. Атомы озона, фосфора, серы — из большего числа атомов (O3, Р4, S8), инертных газов – из одного атома (Не,Ne,Ar,Kr).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов — C, Si, S и т.д.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
1. Молекулярное строение. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому при обычных условиях большинство таких веществ представляют собой газы или твердые вещества с низкими температурами плавления и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы «одноатомными молекулами».
2. Атомное строение. У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления.Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
§
- Взаимодействие с металлами:
2Na Cl2 = 2NaCl,
Fe S = FeS,
6Li N2 = 2Li3N,
2Ca O2 = 2CaO
в этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- Взаимодействие с другими неметаллами:
- взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения – ковалентные гидриды:
3H2 N2 = 2NH3,
H2 Br2 = 2HBr;
- взаимодействуя с кислородом , все неметаллы, кроме фтора, проявляют восстановительные свойства:
S O2 = SO2,
4P 5O2 = 2P2O5;
- при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем:
2F2 O2 = 2OF2;
- неметаллы взаимодействуют между собой, более электроотрицательный металл играет роль окислителя, менее электроотрицательный – роль восстановителя:
S 3F2 = SF6,
C 2Cl2 = CCl4.
ВОПРОС №35
Аллотропия неорганических веществ на примере углерода и кислорода
Многие элементы-неметаллы образуют несколько простых веществ − аллотропных модификаций.
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ. а эти простые вещества – аллотропными видоизменениями или модификациями.
Аллотропия может быть связана и с разным составом молекул − различным числом атомов в молекуле (O2 и O3), и с разным строением кристаллов. Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Если какой-либо элемент может существовать в двух или нескольких твердых формах (кристаллических либо аморфных), то считается, что он проявляет аллотропию. Различные формы одного элемента называются аллотропами. Аллотропы существуют приблизительно у половины всех элементов.
Например, углерод существует в виде алмаза либо графита. Сера существует в двух кристаллических формах — ромбической и моноклинной — в зависимости от температуры. Обе еекристаллические формы являются примерами молекулярных кристаллов. Молекулы в них представляют собой гофрированные циклы, в каждом из которых содержится по восемь ковалентно связанных атомов серы. Твердая сера может существовать ещев третьей аллотропной форме как пластическая сера. Эта форма серы неустойчива. Она состоит из длинных цепочек атомов серы, которые при комнатной температуре разрушаются и снова образуют молекулы S8, кристаллизующиеся в ромбическую решетку.
Так же аллотропным элементом является углерод.
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ. В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (3700°С).
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Химические свойства
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
· Взаимодействие с металлами.
Углерод реагирует с металлами при высокой температуре с образованием карбидов:
4Al0 3C0=tAl 34C−43.
В этой реакции углерод выступает как окислитель.
· Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0 2H02=tC−4H 14.
· Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0 O02=tC 4O−22.
· Взаимодействие с оксидами металлов.
Углерод способен восстанавливать металлы из их оксидов:
2Cu 2O C0=t2Cu0 C 4O2.
Применение простых веществ
Алмаз применяется:
· для обработки твёрдых поверхностей;
· для резки стекла;
· для изготовления буров и свёрл;
· для изготовления ювелирных украшений.
Графит используется:
· при изготовлении карандашей;
· как твёрдая смазка в подшипниках;
· для изготовления электродов;
· в качестве замедлителя нейтронов в ядерных реакторах;
· для получения искусственных алмазов.
Сажа:
· входит в состав типографской краски, крема для обуви;
· используется как наполнитель для производства резины.
Уголь используется:
· в противогазах, промышленных и бытовых фильтрах;
· для очистки сахарного сиропа, спирта и т. д.;
· в медицине.
Кокс применяется в металлургической промышленности.
ВОПРОС №36
Металлы в химических реакциях всегда восстановители. Восстановительную активность металла отображает его положение в электрохимическом ряду напряжений.
На основании ряда можно сделать следующие выводы:
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из солей в растворе те металлы, которые стоят правее
2Fe 3CuSO4 → 3Cu Fe2 (SO4)3
3. Металлы, находящиеся в ряду напряжений левее водорода способны вытеснять его из кислот.
Zn 2HCl → ZnCl2 H2
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные) в любых водных растворах прежде сего реагируют с водой.
Восстановительная способность металла, определённая по электрохимическому ряду не всегда соответствует его положению в периодической системе т.к в ряду напряжений учитывается не только радиус атома, но и энергия отрыва электронов.
§
Альдегиды – это органические соединения, в состав молекулы которых входит карбонильная группа, соединённая с водородом и углеводородным радикалом.
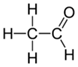 Этаналь
Этаналь
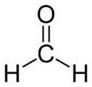 Метаналь (муравьиный альдегид)
Метаналь (муравьиный альдегид)
Физические свойства
Метаналь – газообразное вещество, водный раствор – формалинь
Химические свойства
H2 = CH3OH
Реактивом на альдегиды является Cu(OH)2
Применение
Наибольшее применение имеют метаналь и этаналь. Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы изготовлены для из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирту получают различные лаки. При взаимодействии метаналя с карбамидом CO(NH2)2 получают карбидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники.Метаналь идёт так же на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 40% метаналя. Он называетсяформалином. Его использование основано на свойстве свёртывать белок.
Получение
Альдегиды получают окислением алканов и спиртов. Этаналь получают гидротациейэтина и окислением этена.
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно-земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
§
- С кислородом большинство металлов образует оксиды – амфотерные и основные:
4Li O2 = 2Li2O,
4Al 3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na O2= Na2O2.
- С галогенами металлы образуют соли галогеноводородных кислот, например,
Cu Cl2= CuCl2.
- С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
2Na H2= 2NaH.
- С серой металлы образуют сульфиды – соли сероводородной кислоты:
Zn S = ZnS.
- С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
3Mg N2= Mg3N2.
- С углеродом образуются карбиды:
4Al 3C = Al3C4.
- С фосфором – фосфиды:
3Ca 2P = Ca3P2.
- Металлы могут взаимодействовать между собой, образуя интерметаллические соединения:
2Na Sb = Na2Sb,
3Cu Au = Cu3Au.
- Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.
Сплавы
Сплаваминазываются системы, состоящие из двух или более металлов, а также металлов и неметаллов, обладающих характерными свойства, присущими только металлическому состоянию.
Свойства сплавов – самые разнообразные и отличаются от свойств их компонентов, так, например, для того чтобы золото стало более твердым и пригодным для изготовления украшений, в него добавляют серебро, а сплав, содержащий 40 % кадмия и 60 % висмута, имеет температуру плавления 144 °С, т.е намного ниже температуры плавления его компонентов (Cd 321 °С, Bi 271 °С).
Возможны следующие типы сплавов:
— расплавленные металлы смешиваются между собой в любых соотношениях, неограниченно растворяясь друг в друге, например, Ag-Au, Ag-Cu, Cu-Ni и другие. Эти сплавы однородны по составу, обладают высокой химической стойкостью, проводят электрический ток;
— расправленные металлы смешиваются между собой в любых соотношениях, однако при охлаждении расслаиваются, и получается масса, состоящая из отдельных кристалликов компонентов, например, Pb-Sn, Bi-Cd, Ag-Pb и другие.
ВОПРОС №37
Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева.
Гидриды. В соединениях с неметаллами водород проявляет степень окисления 1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН4, представляющий собой нейтральное соединение, а также аммиак NH3, обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.
Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
RH4 → RH3 → H2R → HR
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
2) Соединения, разлагаемые водой:
BH3 3H2O = H3BO3 3H2↑
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы (исключение – вода H2O). Например, CH4 – метан, NH3 –аммиак, HF – фтороводород и др.
Группа IV V VI VII
общая формула водородного RH4 RH3 RH2 RH
соединения.
Представители (CH4 ,SiH4) (NH3 ,PH3) (H2O, H2S, H2Se) (HF, HCl, HBr, HI)
Растворимость в воде нераствор. раствор. раствор. раствор.
Агрегатное состояние газы (искл.- H2O)
Характер безразличный основной кислотный
(нейтраль- (искл. H2O-
ный) амфотерный)
Отношение к кислороду горят негорючие
При растворении в воде водородные соединения неметаллов дают гидраты – основания или кислоты. Соединения с общей формулой RH3 проявляют основные свойства. При взаимодействии с водой они образуют основания, а при взаимодействии с кислотами – соли. Например, при растворении аммиака образуется гидроксид аммония – основание, а при взаимодействии с соляной кислотой – хлорид аммония – соль.
NH3 H2O = NH4OH
гидроксид аммония
NH3 HCl = NH4Cl
аммиак хлорид аммония
Соединения с общими формулами RH2 и RH проявляют кислотные свойства. Так, при растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF – фтороводородная (плавиковая), HCl – хлороводородная (соляная), HBr – бромоводородная, HI – иодоводородная, H2S – сероводородная, H2Se – селеноводородная, H2Te – теллуроводородная.
Как все кислоты, они диссоциируют в растворах с отщеплением катионов водорода, например,
HCl = H Cl–
соляная кислота
При взаимодействии со щелочами эти водородные соединения образуют соли. Например, сероводород взаимодействует со щелочью с образованием соли и воды:
H2S NaOH = Na2S H2O
Сероводород гидроксид натрия сульфид натрия
В периоде слева направо кислотные свойства водородных соединений увеличиваются.
В подгруппе сверху вниз кислотные свойства
и окислительная способность водородных
соединений увеличиваются, а
основные свойства – уменьшаются.
ВОПРОС №38
Высшие оксиды химических элементов третьего периода. Закономерности в измерении их свойств в связи с положением химических элементов в периодической системе. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых является кислород со степенью окисления «-2»
К оксидам третьего периода относятся:
Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
С увеличением степени окисления элементов, увеличиваются кислотные свойства оксидов.
Na2O, MgO – основные оксиды
Al2O3 – амфотерный оксид
SiO2, P2O5, SO3, Cl2O7 – кислотные оксиды.
Основные оксиды реагируют с кислотами с образованием соли и воды.
MgO 2CH3COOH → (CH3COO)2Hg H2O
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием щёлочи.
Na2O HOH → 2NaOH
Основные оксиды реагируют с кислотными оксидами с образованием соли.
Na2O SO2 → Na2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды
2NaOH SO3 → Na2SO4 H2O
Реагирует с водой, с образованием кислоты
SO3 H2O → H2SO4
Амфотерные оксиды реагируют с кислотами и щелочами
Al2O3 6HCl → 2AlCl3 3H2O
Со щёлочью
Al2O3 2NaOH → 2NaAlO2 H2O
Физические свойства.
Животные жиры в большинстве случаев твёрдые вещества, но встречаются и жидкие (рыбий жир). Растительные жиры чаше всего жидкие вещества – масла; известны и твёрдые растительные жиры – кокосовое масло.
Химические свойства.
Жиры в животных организмах в присутствии ферментов гидролизуются. Кроме реакций с водой, жиры взаимодействуют со щелочами.
В состав растительных масел входят сложные эфиры непредельных карбоновых кислот, то их можно подвергнуть гидрированию. Они превращаются в предельные соединения
Пример: Из растительного масла в промышленности получают маргарин.
Применение.
Жиры в основном применяют в качестве пищевого продукта. Раньше жиры использовали для получения мыла
Синтетические моющие средства.
Синтетические моющие средства оказывают вредное действие на окружающую среду, т.к. они устойчивы и с трудом подвергаются разрушению.
ВОПРОС №39
§
Кислоты – это электролиты, при диссоциации водных растворов которых в качестве катионов отщепляются только ионы водорода.
HCl → H Cl—
H2SO4 → 2H SO42-
Отрицательные ионы, которые отщепляются от молекулы кислоты называются кислотными остатками.
Кислоты классифицируют по нескольким признакам.
По составу:
Бескислородные HCl, HNO3
Кислородосодержащие H2SO4, H2CO3
По основности:
Одноосновные HCl, HNO3
Двухосновные H2SO4, H2CO3
Трехосновные H3PO4
По силе:
Сильные HCl, HNO3, H2SO4
Слабые H2S, H2CO3
Общие химические свойства кислот обусловлены наличием иона водорода. Для кислот характерны следующие химические свойства:
1. Взаимодействие с активными металлами.
Zn HCl = ZnCl2 H2↑
2. Взаимодействие с основными оксидами.
CuO H2SO4 = CuSO4 H2O
3. Взаимодействие с основаниями.
HCl NaOH = NaCl H2O
H Cl— Na OH— = Na Cl— H2O
H OH— = H2O
4. Взаимодействие с солями – такая реакция протекает только в том случае, е6сли образуется осадок, летучее вещество или слабый электролит.
HCl AgNO3 = AgCl↓ HNO3
H Cl— Ag NO3— = AgCl↓ H NO3—
Cl— Ag = AgCl↓
Глицерин – многоатомный спирт; состав молекулы, физические и химические свойства, применение.
Глицери́н — химическое соединение с формулой HOCH2CH(OH)-CH2OH или C3H5(OH)3. Простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость.
Глицерин — бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Взаимодействие глицерином с натрием:
2СН2ОН – СНОН-СН2ОН 6Nа = 2СН2ОNа –СНОNa- СН2ОNа 3 Н2 глицерат натрия.
ВОПРОС №40
Основания, их классификация и свойства на основе представлений об электролитической диссоциации.
Основания — вещества, диссоциирующие в водном растворе с образованием катионов металла и гидроксид-анионов ОН−.
Основание — NaOH:
NaOH ↔ Na OH—
Существует также основание, в котором гидрокси-группа присоединена не к металлу, а к иону NH4 (катиону аммония). Это основание называется гидроксидом аммония и имеет формулу NH4OH. Гидроксид аммония образуется в рекции присоединения воды к аммиаку, когда аммиак растворяют в воде:
NH3 H2O = NH4OH (гидроксид аммония).
Основания бывают растворимыми и нерастворимыми. Растворимые основания называются щелочами. Растворы щелочей скользкие на ощупь («мыльные») и довольно едкие. Они разъедают кожу, ткани, бумагу, очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH)2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH)2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
Щелочами называются растворимые в воде сильные основания.
Свойства, характерные для всех оснований, проявляются благодаря присутствию в их растворах гидроксид- ионов OH-..
1. Наиболее важное химическое свойство всех оснований – взаимодействие с кислотами – реакция нейтрализации.
NaOH HCl = NaCl H2O
Na OH— H Cl— = Na Cl— H2O
H OH— = H2O
2. Взаимодействие щелочей с кислотными оксидами.
NaOH CO2 = Na2CO3
3. Взаимодействие щелочей с солями, если в результате реакции одно из веществ выпадает в осадок.
3NaOH FeCl3 = Fe(OH)3↓ 3NaCl
3Na 3OH— Fe3 3Cl— = Fe(OH)3↓ 3Na 3Cl—
3OH— Fe3 = Fe(OH)3↓
Основания — электролиты, при диссоциации которых образуется только один вид анионов — гидроксид-ионы.
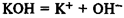
Классификация оснований
1. Растворимые в воде (щелочи) — гидроксиды металлов главных подгрупп I и II групп.
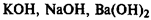
2. Нерастворимые в воде — гидроксиды остальных металлов.
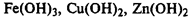
Химические свойства. Щелочи изменяют окраску индикаторов (лакмус становится синим, фенолфталеин – малиновым).
Взаимодействие с кислотами:
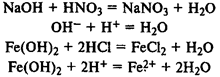
Взаимодействие с кислотными оксидами:
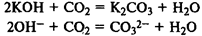
Растворы щелочей вступают в реакции ионного обмена с растворами солей, если образующийся при этом гидроксид нерастворим в воде:
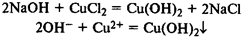
При нагревании слабые основания разлагаются на оксиды металлов и воду:

Получение оснований. Щелочи получают электролизом растворов солей.
Электролиз раствора хлорида натрия. Процессы на катоде и аноде:
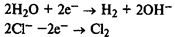
Уравнение реакции:
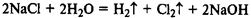
Нерастворимые в воде основания получают реакцией обмена со щелочами:
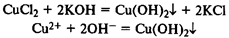
ВОПРОС №41
§
Соли – это сложные кристалические вещества, в состав которых входят катионы металлов и анионы кислотных остатков. Исключением являются соли амонияNH4Cl. Состав солей определяет их название. Сначало называют кислотный остаток, а затем металл который входит в состав соли NaCl – хлорид натрия MgSO4 – сульфат магния и т.д.
Расплавы и растворы солей диссоциируют на ионы Na2SO4
Na2SO4 = 2Na SO4
В водных растворах соли реагируют с кислотами с образованием соли и кислоты.
BaCl2 H2SO4 = BaSO4 2HCl
Ba2 2Cl— 2H SO42- = BaSO4 2H 2Cl—
Ba2 SO42- = BaSO4
В водных растворах соли реагируют со щелочами с образованием соли и основания, если хотя бы один из продукции нерастворим.
Na2CO3 Ca(OH)2 = Ca(OH)2 = CaCO3 2NaOH
2Na CO32- Ca2 2OH— = CaCO3 2Na 2OH—
CO32- Ca2 = CaCO3
В водных растворах соли реагируют между собой с образованием двух солей.
Pb(NO3)2 K2SO4 = PbSO4 2KNO3
Pb2 3NO3— 2K SO42- = PbSO4 2K 2NO3—
Pb2 SO42- = PbSO4
В водных растворах солей метал, входящий в их состав может замещаться другими, более активными металлами.
Fe CuCl2 = Cu FeCl2
Fe0 Cu2 2Cl— = Cu0 Fe2 2Cl—
Fe0 Cu2 = Cu0 Fe2
Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
1.B водных растворах соли могут реагировать со щелочами. Так, хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль и новое основание:
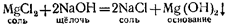
2. Соли могут реагировать с кислотами. Так, раствор азотнокислого бария Ва(гЮз)а взаимодействует с раствором серной кислоты, образуя новую кислоту и новую соль:
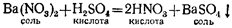
З.В водных растворах соли могут реагировать между собой.
Если слить вместе водные растворы хлористого кальция CaCl2 я углекислого натрия Na2CO3TO тотчас же образуется белый осадок нерастворимого в воде углекислого кальция СаСО3, а в растворе — хлористый натрий:
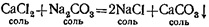
4. В водных растворах солей металл, входящий в их состав, может замещаться другим металлом, стоящим до него в ряду активности.
Если в раствор сернокислой меди опустить чистую железную проволоку или кусочек цинка, то на их поверхности выделяется медь, а в растворе образуется сернокислое железо (если было опущено железо) или сернокислый цинк (если был опущен цинк):
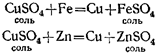
Но из сернокислого цинка нельзя вытеснить цинк медью: медь в ряду активности стоит после цинка.
ВОПРОС №42
Химическая и электрохимическая коррозия металлов. Меры защиты металлов и сплавов от коррозии
Коррозия – это разрушение металлов и сплавов под действием окружающей среды. Различают два вида коррозии – химическую и электрохимическую..
1. Химическая коррозия – это разрушение металла окислителями, находящимися в окружающей среде, в отсутствии электролита. Такая коррозия протекает без возникновения электрического тока в системе.
Химическая коррозия может быть газовой и жидкостной. Газовая коррозия возникает при воздействии на металл агрессивных газов – кислорода, галогенов, оксида серы (IV) и т.д. в условиях высоких температур.
Например: 4Fe 3O2 = 2Fe2O3 (t0C)
2Cu O2 = 2CuO (t0C)
2 Fe 3Cl2 = 2FeCl3
Жидкостная коррозия протекает в среде жидких неэлектролитов: нефти, бензина, керосина и т.д.
Если образующийся на поверхности металла оксид ложится рыхлым слоем
(как у железа или меди), то коррозия продолжается до полного разрушения металла, так как кислород может диффундировать сквозь постепенно утолщающуюся оксидную пленку.
Однако некоторые металлы образуют на своей поверхности оксид в виде очень плотной пленки, предохраняющей металл от дальнейшей коррозии, т.е.
оксидная пленка пассивирует металл. Такие пленки всегда существует на поверхности алюминия, хрома, цинка, никеля и некоторых других металлов. В
этом случае коррозия быстро прекращается и не приносит большого вреда. Например, оксидная пленка алюминия образуется в результате реакции:
4Al 3O2 = 2Al2O3
2. Электрохимическая коррозия приносит гораздо больший вред. Это разрушение металла при контакте его с электролитами и возникновением в системе электрического тока.
В этом случае наряду с химическим процессом (отдача электролитов) протекает и электрический (процесс переноса электронов от одного участка к другому).
Если коррозия происходит в кислой среде, то металл окисляется катионами водорода.
Например: Fe 2HCl = FeCl2 H2↑
Fe0 – 2e → Fe2
2H 2e → H2↑
Таким образом, продукт коррозии железа – бурая ржавчина содержит гидроксид железа (III).
Электрохимическая коррозия может быть усилена, если металл содержит примеси других веществ (металлов и даже неметаллов). Например, железо загрязнено примесями меди. При этом возникает гальванический микроэлемент, который действует следующим образом: железо как более активный металл отдает электроны атому меди (Fe0 – 2e → Fe2 ). Эти электроны принимаются катионами водорода и выделяются в виде пузырьков (2H 2e → H2↑). Образовавшиеся катионы железа Fe2 переходят в раствор электролита (в нашем случае – кислота) и соединяются с анионами кислотного остатка. Таким образом, направленный поток электронов все время движется от более активного металла к менее активному, а катионы более активного металла переходят в среду электролита, т.е. возникает электрический ток (направленное движение заряженных частиц), в результате чего более активный металл разрушается, а менее активный не изменяется, он служит лишь проводником электронов.
Для предохранения металлов от коррозии существуют различные способы:
1. Чтобы изолировать металл от окружающей среды, его покрывают защитными покрытиями. Это могут быть как металлические, так и неметаллические покрытия. К неметаллическим покрытиям относятся лаки, краски, смазки, эмали. К металлическим – покрытия более активным металлом (например, оцинкованное железо) или менее активным металлом (хромированные и никелированные стальные изделия). Во всех этих случаях покрытие имеет пассивирующую оксидную пленку. В случае нарушения менее активного покрытия, начинает постепенно корродировать защищаемый металл (например, железо) и тогда надо сразу же возобновлять покрытие.
2. Чтобы сделать металл более устойчивым к коррозии, промышленность выпускает сталь, содержащую до 12% хрома, который создает пассивирующую пленку на поверхности стали. Такая сталь называется нержавеющей. Существуют и другие сплавы с антикоррозионными свойствами.
3. Протекторная защита металла состоит в том, что к поверхности защищаемого металла (например, подводная часть судна) прикрепляют кусок более активного металла (например, цинка) и тогда разрушается протектор (Zn), а не защищаемый металл. По мере разрушения протектора, его заменяют новым.
4. Для замедления коррозии металлических изделий можно также изменить состав среды (электролита) путем введения специальных веществ (чаще всего органических), которые замедляют коррозию. Такие вещества называются ингибиторами. Их обычно используют, когда металл следует защитить от разъедания кислотами, например, при перевозке соляной кислоты в стальной таре.
ВОПРОС №43
Дисперсные системы. Коллоидные растворы
1. Дисперсные системы. Все дисперсные системы состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц), называемой дисперсной фазой.
От линейных размеров частиц дисперсной фазы зависит гомогенность или гетерогенность дисперсной системы. Гомогенные дисперсные системы называются истинными растворами, или просто растворами. Истинные растворы содержат молекулы или атомы, размеры которых не превышают 5 нм (5˙10-9 м).
Гетерогенные дисперсные системы подразделяют на грубодисперсные системы, у которых частицы имеют размер 1000 нм и более, и коллоидные системы, размер частиц которых лежит в пределах от 1 до 500 нм.
К грубодисперсным системам относятся суспензии, эмульсии, пены. Суспензии представляют собой системы, состоящие из раздробленного твердого вещества и жидкости, в которой распределена дисперсная фаза. Например, крахмал в холодной воде, шоколад (какао в масле), мутная вода. Примеры концентрированных суспензий – пасты, взвесь глины в воде.
Эмульсии – образуются двумя несмешивающимися жидкостями; обычно одной из фаз является вода. Примеры эмульсий: молоко, майонез, маргарин, бензол в воде.
Пены – грубодисперсные системы, состоящие из ячеек, заполненных газом, и отделенных друг от друга пленками очень малой толщины. К пенам относятся: мыльная пена, мусс, пенопласты.
Характерным признаком грубодисперсных систем является то, что частицы дисперсной фазы видны в обычный микроскоп или даже невооруженным глазом.
Частицы в коллоидных системах уже невозможно различить в обычный микроскоп, так как их размеры меньше длины волны видимого света.
Дисперсные системы с частицами коллоидных размеров называют золями. По характеру дисперсионной среды различают: гидрозоли (растворитель – вода), аэрозоли (мельчайшие капельки жидкости, тонкораспыленные в газе, например, туман), мелкие твердые частицы в газе (дым).
Помимо классификации дисперсных систем по размерам частиц, существует и другая классификация – по агрегатному состоянию дисперсной фазы и дисперсионной среды.
2. Коллоидные растворы. Коллоидные растворы отличаются от истинных рядом свойств: 1) малой скоростью перемещения ввиду малой скорости диффузии; 2) повышенной вязкостью; 3) гетерогенностью.
От грубодисперсных систем они отличаются относительной устойчивостью. Для коллоидов характерна очень развитая поверхность, в связи с чем в коллоидных растворах исключительно важную роль играет адсорбция.
Адсорбция – это изменение (обычно – повышение) концентрации вещества вблизи поверхности раздела фаз.
Существует два основных пути получения коллоидных растворов.
1. Дисперсионный – измельчение частиц грубодисперсных систем до размеров, соответствующих коллоидам. При этом используются обычно физические методы с применением различных диспергаторов и коллоидных мельниц.
2. Конденсационный – укрупнение частиц истинных растворов (ионов, молекул) путем их ассоциации до размеров, соответствующих коллоидам. Применяются обычно химические методы: осаждение, гидролиз, окисления-восстановления, нейтрализации.
Например, в результате гидролиза солей железа (III) получают его гидроксид: Fe3 3H2O = Fe(OH)3 3H .
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы – поверхностно-активные вещества (ПАВ).
2.1. Строение и заряд коллоидной частицы. Мицелла.Коллоидная частица состоит из ядра, адсорбирующего из окружающей среды ионы одного вида. Эти ионы называют зарядообразующими, их химическая природа близка химической природе ядра коллоидной частицы.
Ядро коллоидной частицы с адсорбированными зарядообразующими ионами притягивает к себе из среды ионы противоположного знака (заряда). Зарядообразующие ионы и противоионы гидратированы. Весь этот комплекс и называют коллоидной частицей.
3. Свойства коллоидных растворов.Оптические свойства коллоидных растворов. При прохождении через дисперсную систему свет может поглощаться, отражаться или рассеиваться частицами. Поглощение света – явление избирательное. Одни вещества полностью поглощают свет, другие поглощают только лучи определенной части спектра. Отражение света поверхностью частиц возможно только в грубодисперсных системах. Отражение света проявляется в мутности таких дисперсных систем как в проходящем свете, так и при боковом их освещении.
Для типичных коллоидных систем наиболее характерным оптическим свойством является рассеивание света по всем направлениям. Размеры коллоидных частиц меньше длины световой волны, и поэтому рассеивание света обусловлено не отражением его от поверхности частиц, а дифракцией. Рассеивание света при освещении коллоидного раствора было исследовано Тиндалем. Это свечение было названо опалесценцией.
Электрические свойства коллоидных растворов. В 1909 г профессор Московского университета Р. Рейсе наблюдал воздействие постоянного электрического тока на диспергированную в воде глину, и на этом основании описал электрические свойства коллоидных растворов.
Движение частиц дисперсной фазы к одному из электродов при пропускании через него постоянного электрического тока получило название электрофореза, а движение частиц дисперсионной среды – электроосмоса.
Электрические свойства коллоидных растворов объясняют их агрегатную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются и не слипаются.
Коагуляция коллоидных растворов. Коагуляцией называют процесс соединения коллоидных частиц в крупные агрегаты с последующей потерей коллоидной системой кинетической устойчивости.
Коагуляцию коллоидных растворов можно вызвать нагреванием, охлаждением, интенсивным перемешиванием, а также добавлением различных электролитов.
4. Коллоидные растворы в природе и технике. В природной воде содержится часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных нужд, электростанций, строительства, подвергают обработке, вызывающей коагуляцию коллоидных частиц.
Коагуляцию широко используют при очистке воды для удаления взвешенных веществ. В качестве коагулянтов используют сульфаты алюминия или железа.
Дымовые газы электростанций, металлургических заводов представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость.
Наибольшее практическое применение имеют твердые системы с газовой дисперсной фазой, называемые твердыми пенами.
ВОПРОС №44
§
Диссоциация кислот
При диссоциации кислот роль катионов играют ионы водорода (H ), других катионов при диссоциации кислот не образуется:
HF ↔ H F—
HNO3 ↔ H NO3—
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Одной из характеристик диссоциации кислот является их оснОвность — число ионов водорода, содержащихся в молекуле кислоты, которые могут образоываваться при диссоциации:
· одноосновные кислоты: HCl, HF, HNO3;
· двухосновные кислоты: H2SO4, H2CO3;
· трехосновные кислоты: H3PO4.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий).
Ступенчатая диссоциация двухосновной кислоты:
H2SO4 ↔ H HSO4—
HSO4— ↔ H HSO42-
Ступенчатая диссоциация трехосновной кислоты:
H3PO4 ↔ H H2PO4—
H2PO4— ↔ H HPO42-
HPO42- ↔ H PO43-
При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй — 0,15%; третьей — 0,005%.
· Таблица названий кислот и их анионов
Диссоциация оснований
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH—), других анионов при диссоциации оснований не образуется:
NaOH ↔ Na OH—
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
· однокислотные основания — KOH, NaOH;
· двухкислотные основания — Ca(OH)2;
· трехкислотные основания — Al(OH)3.
Многокислотные основания диссоциируют, по аналогии с кислотами, также ступенчато — на каждом этапе отщепляется по одному гидроксид-иону:
Zn(OH)2 ↔ ZnOH OH—
ZnOH ↔ Zn2 OH—
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными (см. Кислотно-основные реакции).
Диссоциация Zn(OH)2, как основания:
Zn(OH)2 ↔ ZnOH OH—
ZnOH ↔ Zn2 OH—
Диссоциация Zn(OH)2, как кислоты:
Zn(OH)2 2H2O ↔ 2H [Zn(OH)4]2-
Диссоциация солей
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Классификация диссоциации солей:
· Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла — это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
· Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода — диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
· Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп — диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
· Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
· Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
Диссоциация нормальной соли:
K3PO4 ↔ 3K PO43-
Диссоциация кислой соли:
NaHCO3 ↔ Na HCO3—
HCO3— ↔ H CO32-
Диссоциация основной соли:
Mg(OH)Cl ↔ Mg(OH) Cl—
Mg(OH) ↔ Mg2 OH—
Диссоциация двойной соли:
KAl(SO4)2 ↔ K Al3 2SO42-
Диссоциация смешанной соли:
CaClBr ↔ Ca2 Cl— Br—
ВОПРОС №45
Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Роль железа в современной технике. Сплавы железа .
В периодической таблице химических элементов Д. И. Менделеева железо Fe расположено в 4-м периоде VIII группы побочной подгруппы.
Распределение электронов по электронным слоям в атоме железа выглядит так:
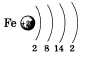
В атоме железа четыре электронных слоя. Электронами заполняется d–подуровень третьего слоя, на нём находится 6 электронов, а на четвёртом слое s–подуровне находится 2 электрона. В соединениях железо проявляет степени окисления 2 и 3.
Известны также соединения с атомами железа в степенях окисления 4, 6 и некоторых других.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:

Типичные степени окисления железа 2 и 3. Степень окисления 2 проявляется за счет потери двух 4s-электронов. Степень окисления 3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства. Железо реагирует со многими неметаллами:
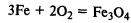
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2О3.

Реагирует с кислотами с выделением водорода:
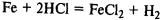
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
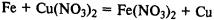
Соединения железа. FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует также с рас творами щелочей.
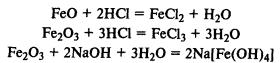
Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
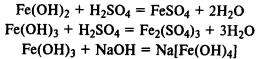
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
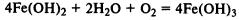
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
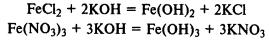
Сплавы железа. Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный’для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. —
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так,хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях ‘
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значигельно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
2. Белкикак биополимеры. Первичная, вторичная и третичная структуры белков. Свойства и биологические функции белков.
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот.
Белки, подобно полисахаридам, являются биологическими полимерами. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу:
Молекулярная формула одного из белков группы пенициллинов – C43H58N4O12; казеина – белка коровьего молока, – C47H48N3NaO7S2; гемоглобина – C3032H48I6O872N780S8Fe4;
Каталитическое окисление метана
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

