Биологическая роль
Аммиак является важным источником азота для живых организмов. Несмотря на высокое содержание свободного азота в атмосфере (более 75 %), очень мало живых существ способны использовать свободный, нейтральный двухатомный азот атмосферы, газ N2.
Поэтому для включения азота атмосферы в биологический оборот, в частности в синтез аминокислот и нуклеотидов, необходим процесс, который называется «азотфиксацией». Некоторые растения зависят от доступности аммиака и других нитрогенных соединений, образующихся в почве в результате разложения органических (растительных и животных) остатков.
Другие, такие как бобовые, используют преимущества симбиоза с азотфиксирующими бактериями (ризобиями), которые способны синтезировать аммиак из атмосферного азота с помощью ферментов, называемых нитрогеназами. И хотя маловероятно, что когда-либо будут изобретены биомиметические методы, способные конкурировать по производительности с химическими методами производства аммиака из азота, тем не менее, учёные прилагают большие усилия к тому, чтобы как можно лучше понять механизмы биологической фиксации азота.
Научный интерес к этой проблеме отчасти мотивируется необычной структурой активного каталитического центра азотфиксирующего фермента (нитрогеназы), которая содержит необычный биметаллический молекулярный ансамбль Fe7MoS9.
Аммиак является также конечным побочным продуктом метаболизма аминокислот, а именно продуктом их дезаминирования, катализируемого такими ферментами, как глутамат-дегидрогеназа. Экскреция аммиака в неизменённом виде является обычным путём детоксикации аммиака у водных существ (рыбы, водные беспозвоночные, отчасти амфибии).
У млекопитающих, включая человека, аммиак обычно быстро превращается в мочевину, которая гораздо менее токсична и, в частности, имеет менее щелочную реакцию и меньшую реакционную способность в качестве восстановителя. Мочевина является основным компонентом сухого остатка мочи.
Аммиак также играет важную роль как в нормальной, так и в патологической физиологии животных. Аммиак производится в процессе нормального метаболизма аминокислот, однако весьма токсичен в высоких концентрациях. Печень животных преобразует аммиак в мочевину с помощью серии последовательных реакций, известных как цикл мочевины.
Нарушение функции печени, такое, например, какое наблюдается при циррозе печени, может приводить к нарушению способности печени обезвреживать аммиак и образовывать из него мочевину, и, как следствие, к повышению уровня аммиака в крови, состоянию, называемому гипераммониемия.
К аналогичному результату — повышению уровня свободного аммиака в крови и развитию гипераммониемии — приводит наличие врождённых генетических дефектов в ферментах цикла мочевины, таких, например, как орнитин-карбамилтрансфераза. К тому же результату может приводить нарушение выделительной функции почек при тяжёлой почечной недостаточности и уремии: вследствие задержки выделения мочевины её уровень в крови возрастает настолько, что «цикл мочевины» начинает работать «в обратную сторону» — избыток мочевины гидролизуется обратно почками в аммиак и углекислый газ, и, как следствие, уровень аммиака в крови возрастает.
Гипераммониемия привносит свой вклад в нарушения сознания и развитие сопорозных и коматозных состояний при печёночной энцефалопатии и уремии, а также в развитие неврологических нарушений, часто наблюдаемых у больных с врождёнными дефектами ферментов цикла мочевины или с органическими ацидуриями.
Менее выраженная, однако клинически существенная, гипераммониемия может наблюдаться при любых процессах, при которых наблюдается повышенный катаболизм белков, например, при обширных ожогах, синдроме сдавления или размозжения тканей, обширных гнойно-некротических процессах, гангрене конечностей, сепсисе и т. д., а также при некоторых эндокринных нарушениях, таких, как сахарный диабет, тяжёлый тиреотоксикоз.
Особенно высока вероятность возникновения гипераммониемии при этих патологических состояниях в тех случаях, когда патологическое состояние, помимо повышенного катаболизма белков, вызывает также выраженное нарушение детоксицирующей функции печени или выделительной функции почек.
Аммиак важен для поддержания нормального кислотно-щелочного баланса крови. После образования аммиака из глютамина, альфа-кетоглутарат может быть далее расщеплён с образованием двух молекул гидрокарбоната, которые затем могут использоваться как буфер для нейтрализации кислот, поступающих с пищей.
Полученный из глютамина аммиак затем выделяется с мочой (как непосредственно, так и в виде мочевины), что, с учётом образования двух молекул бикарбоната из кетоглутарата, приводит в сумме к потере кислот и сдвигу pH крови в щелочную сторону. Кроме того, аммиак может диффундировать через почечные канальцы, соединяться с ионом водорода и экскретироваться совместно с ним ( NH3 H ⟶ NH4 ), и тем самым ещё больше способствовать выведению кислот из организма.
Аммиак и ионы аммония являются токсическим побочным продуктом метаболизма у животных. У рыб и водных беспозвоночных аммиак выделяется непосредственно в воду. У млекопитающих (включая водных млекопитающих), земноводных и у акул аммиак в цикле мочевины преобразуется в мочевину, поскольку мочевина гораздо менее токсична, менее химически реакционноспособна и может более эффективно «храниться» в организме до момента возможности её выделения.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
- 2NH3 ⟶ NH4 NH2−.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb.
В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов.
В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)
6], обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворённый в NH3 металл постепенно реагирует с образованием амида:
- 2Na 2NH3 ⟶ 2NaNH2 H2 .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака.
Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
- CuSO4 4NH3 ⟶ [Cu(NH3)4]SO4.
- Ni(NO3)2 6NH3 ⟶ [Ni(NH3)6](NO3)2.
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO4) переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной ( Ni(NO3)
2 ) в сине-фиолетовую. Наиболее прочные комплексы с NH3 образуют хром и кобальт в степени окисления 3.
Немного истории
Еще в 20 веке известным ученым-химиком Габером был разработан физико-химический синтез аммиака. Последователи Габера также внесли свою лепту в данное производство. Так, Митташ смог разработать эффективный катализатор, Бошем создано специальное оборудование.
Митташем испытано огромное количество смесей в качестве катализаторов (порядка 20 тысяч), пока он не остановился на шведском магнетите, имеющем такой же состав, как и катализаторы, активно применяемые и сегодня. Современные катализаторы представляют собой сталь, промотированную незначительным количеством окиси алюминия и калия.
Еще в советское время в исследовательских институтах и лабораториях при заводах была проведена громадная работа в сфере исследований кинетики и термодинамики синтеза аммиака. Существенный вклад в совершенствование самой технологии производства аммиака внесен инженерами азотно-туковых заводов и рабочими-новаторами производства.
Советская система производства аммиака характеризовалась достаточной экономичностью и высокой производительностью.
Первым практическим применением, подтверждающим успех предложенной теории, была разработка такого важнейшего процесса химической технологии, как синтез аммиака.
Одним из видов достаточно эффективных путей усовершенствования технологии производства аммиака является утилизация газов продувочного вида. Современные установки выделяют аммиак из таких газов вымораживанием.
Продувочные газы после получения аммиака могут быть использованы как низкокалорийное топливо. Иногда их просто выбрасывают в атмосферу. Газы на сжигание должны направляться в трубчатую печь (отделение конверсии метана). Это позволяет сэкономить расход сырья (природный газ).
Существует и другой способ утилизации указанных газов. Это разделение их методиками глубокого охлаждения. Данный способ позволит снизить общую себестоимость готовой продукции (аммиака). Также аргон, получаемый в данном технологическом процессе, гораздо дешевле, чем его аналог, но извлекаемый в установке разделения воздуха.
В продувочных газах имеется повышенное содержание инертов, которые способствуют менее интенсивному протеканию реакции.
Нитрозный способ
При нитрозном способе получения серной кислоты окисление сернистого газа осуществляется оксидами азота. Обжиговый газ подается в продукционную башню, орошаемую нитрозилсерной кислотой (NОНSО3). Для запуска процесса сернистую кислоту окисляют азотной кислотой согласно уравнениям:
SО2 Н2О = Н2SО3;
3Н2SO3 2НNО3 = 3Н2SО4 2NО Н2О
Оксиды азота вместе с выхлопными газами (азот и кислород) подаются в следующую башню для окисления монооксида азота в диоксид. Поток газа регулируют таким образом, чтобы 50 % газа проходило через окислительную башню, а 50 % — миновало ее. Таким образом в поглотительную башню попадает газовая смесь, содержащая монооксид и диоксид азота в эквимолярном соотношении, вследствие чего образуется азотистый ангидрид:
NО NО2 = N2О3
При низкой температуре равновесие сдвигается в сторону образования азотистого ангидрида (N2О3), а при повышении температуры — в сторону образования монооксида и диоксида азота. В поглотительной башне азотистый ангидрид реагирует с концентрированной серной кислотой, образуя нитрозилсерную кислоту:
N2О3 2Н2SO4 = 2NОНSО4 Н2О
Эта реакция может протекать только с концентрированной серной кислотой. При разбавлении водой нитрозилсерная кислота вновь разлагается на серную кислоту и оксиды азота.
Нитрозилсерная кислота подается на орошение в продукционную башню, где и разлагается водой, а выделившийся азотистый ангидрид окисляет образующуюся в башне сернистую кислоту:
2NОНSO4 Н2О = 2Н2SO4 N2О3;
SO2 Н2О = Н2SO3;
Н2SО3 N2О3 = Н2SO4 2NО.
Монооксид азота вновь направляется в окислительную башню и процесс повторяется.
Оксиды азота, которые не поглотились серной кислотой, улавливаются в санитарной башне, в которую подают либо раствор соды (Nа2СО3), либо раствор извести (Са(ОН)2):
N2О3 Nа2СО3 = 2NаNО2 СО2;
2NО2 Nа2СО3 = NаNО3 NаNО2 СО2;
N2О3 Са(ОН)2 = Са(NО3)2 Н2О;
4NО2 2 Са(ОН)2 = Са(NО3)2 Са(NО2)2 2Н2О.
Потеря оксидов азота компенсируется введением новых порций азотной кислоты.
Концентрация серной кислоты, получаемой нитрозным способом, достигает 70-80 %.
Общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д.
В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Ag, Hg, Pt, Au, Cu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы. В соответствии с этим существуют следующие способы получения металлов:
• пирометаллургический;
• гидрометаллургический;
• электрометаллургический.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnO2, а медь — из куприта Cu2O прокаливанием с углем (коксом):
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
Восстановлением углем можно получить Fe, Cu, Zn, Cd, Ge, Sn, Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
Водородотермия:
К достоинствам этого метода относится получение очень чистого металла.
Магний и алюмотермия:
Чаще всего в металлотермии используют алюминий, теплота образования оксида которого очень велика (2Al 1,5O2 = Al2O3 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов.
где Q1 — теплота образования продукта, Q2 — теплота образования исходного вещества.
Гидрометаллургия— это восстановление металлов из их солей в растворе. Процесс проходит в два этапа:
1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла;
2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди CuO, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом получают серебро, цинк, молибден, золото, уран.
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Применение
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода NH3 ⋅ H2O — продукт, представляющий собой газообразный аммиак NH3, растворённый в воде.
Природные источники углеводородов. нефть.
Это природная сложная смесь углеводородов, в основном алканов линейного и разветвленного строения, содержащих в молекулах от 5 до 50 атомов углерода, с другими органическими веществами. Состав ее существенно зависит от места ее добычи (месторождения), она может помимо алканов содержать циклоалканы и ароматические углеводороды.
Газообразные и твердые компоненты нефти растворены в ее жидких составляющих, что и определяет агрегатное состояние.
Нефть — маслянистая жидкость темного (от бурого до черного) цвета с характерным запахом, нерастворимая в воде. Ее плотность меньше, чем у воды, поэтому, попадая в нее, нефть растекается по поверхности, препятствуя растворению кислорода и других газов воздуха в воде.
Существуют бактерии, способные использовать компоненты нефти в качестве пищи, преобразуя ее в безвредные продукты своей жизнедеятельности. Понятно, что именно использование культур этих бактерий — наиболее экологически безопасный и перспективный путь борьбы с загрязнением окружающей среды нефтью в процессе ее добычи, транспортировки и переработки.
В природе нефть и попутный нефтяной газ заполняют полости земных недр. Представляя собой смесь различных веществ, нефть не имеет постоянной температуры кипения. Понятно, что каждый ее компонент сохраняет в смеси свои индивидуальные физические свойства, что и позволяет разделить нефть на составляющие.
Фракционная перегонка — физический способ разделения смеси компонентов
Перегoнка осуществёяется в специальных установках – ректефикационных колонках в которых повторяют циклы в которых повторяют циклы конденсации и испарения жидких веществ, содержащихся в нефти.
Пары, образующиеся при кипении смеси веществ, обогащены более легкокипящим (т. е. имеющим более низкую температуру) компонентом. Это пары собирают, конденсируют (охлаждают до температуры ниже температуры кипения) и снова доводят до кипения. В этом случае образуются пары, еще более обогащенные легкокипящим веществом. Многократным повторением этих циклов можно добиться практически полного разделения веществ, содержащихся в смеси.
В ректификационную колонну поступает нефть, нагретая до температуры 320-350 °С. Ректификационная колонна имеет горизонтальные перегородки с отверстиями — так называемые тарелки, на которых происходит конденсация фракций нефти. На более высоких скапливаются легкокипящие фракции, на нижних — высококипящие.
В процессе ректификации нефть разделяют на следующие фракции:
• ректификационные газы — смесь низкомолекулярных углеводородов, преимущественно бутана и пропана с температурой кипения до 40 °С;
• газолиновую фракцию (бензин) — углеводороды состава от С5Н12 до С21Н24 (температура кипения 40-200 °С); при более тонком разделении этой фракции получают газолин (петролейный эфир, 40-70 °С) и бензин (70-120 °С);
• лигроиновую фракцию — углеводороды состава от С8Н18 до С14Н30 (температура кипения 150250 °С);
• керосиновую фракцию — углеводороды состава от С12Н26 до С18Н38 (температура кипения 180300 °С);
• дизельное топливо — углеводороды состава от С13Н28 до С19Н36 (температура кипения 200-350 °С).
Остаток перегонки нефти — мазут — содержит углеводороды с числом атомов углерода от 18 до 50. Перегонкой при пониженном давлении из мазута получают соляровое масло, смазочные масла, вазелин и парафин — легкоплавкие смеси твердых углеводородов. Твердый остаток перегонки мазута — гудрон — и продукты его переработки — битум и асфальт — используют для изготовления дорожных покрытий.
Производство аммиака
Промышленный синтез аммиака основан на прямом взаимодействии простых веществ — азота N2 и водорода H2. Азот, используемый при производстве аммиака, получают фракционной перегонкой жидкого воздуха, а водород – паровой конверсией угля или природного газа:
Рассмотрим уравнение взаимодействия азота с водородом:
Данная реакция является каталитической, т.е. ее скорость многократно возрастает в присутствии катализатора. В качестве катализатора синтеза аммиака из азот-водородной смеси используют катализатор на основе пористого железа.
Поскольку реакция взаимодействия азота с водородом является экзотермической, то для смещения равновесия в сторону образования аммиака процесс целесообразно проводить при низких температурах. Однако без нагревания скорость реакции взаимодействия азота с водородом ничтожно мала, поэтому для синтеза аммиака при выборе температурных условий приходится ориентироваться на «золотую середину». Такой «золотой серединой» является температура около 400-500 оС.
Негативным следствием использования высокой температуры является то, что равновесие реакции сильно смещается в сторону обратной реакции – разложения аммиака, вследствие чего падает его выход.
Согласно уравнению взаимодействия азота и водорода, при протекании реакции суммарное количество газообразных веществ уменьшается, ведь при взаимодействии 3 моль водорода и 1 моль азота (всего 4 моль) взамен образуется только 2 моль аммиака. Поэтому, исходя из принципа Ле Шателье, негативные эффекты, связанные с разложением аммиака, можно снизить, осуществляя процесс под высоким давлением.
Давление азот-водородной смеси в колонне синтезасоздается с помощью турбокомпрессора и составляет около 300 атм. Тем не менее, даже несмотря на использование колоссального давления, степень превращения азот-водородной смеси «за один заход» не превышает 20 %.
Дальнейшее повышение давления по ряду причин невозможно, поэтому проблема низкого выхода решается довольно простым способом. Образовавшийся аммиак отделяется в сепараторе от непрореагировавшей азот-водородной смеси, а оставшаяся смесь направляется с помощью циркуляционного компрессора обратно в колонну синтеза вместе с новой порцией сырья.
Производство аммиака и метанола
Любое химическое производство состоит из отдельных взаимосвязанных процессов (стадий).
Основные стадии химического производства:
1) подготовка сырья и подвод реагирующих веществ в зону реакции;
2) химические процессы;
3) отвод продуктов и непрореагировавших веществ из зоны реакции.
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках, которые часто монтируют на одном предприятии.
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии.
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органическое стекло) соответственно. Помимо этого, метанол применяют для синтеза некоторых красителей, фотореактивов и фармакологических препаратов, а также как растворитель, экстрагент.
Сырьевая база для производства аммиака
Свойства аммиака
Аммиак является важнейшим и практически единственным соединением азота, производимым в промышленных масштабах из азота атмосферы. Таким образом, его следует рассматривать как полупродукт для получения всех остальных соединений азота.
Аммиак NH3 – бесцветный газ с резким запахом. При нормальных условиях плотность газообразного аммиака составляет 0,771 кг/м3. При охлаждении до -33,40С (760мм рт.ст.) аммиак сжижается и при -780С затвердевает в виде кристаллов кубической формы. Жидкий аммиак — бесцветная жидкость плотностью 0,6814 т/м3 при температуре кипения. Критическая температура аммиака равна 132,40С. Аммиак хорошо растворим в воде (700л в 1л), ограниченно растворим в органических растворителях. Жидкий аммиак растворяет щелочные и щелочноземельные металлы, фосфор, серу, йод и многие неорганические и органические соединения. При температуре выше 13000С аммиак диссоциирует на азот и водород:
2 NH3 = N2 3H2 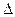 Н
Н
Сухой аммиак образует с воздухом взрывоопасные смеси, пределы взрываемости которых зависят от температуры и при 180С ограничены интервалам содержания аммиака в газовой смеси от 0,155 до 0,27 объемных долей. Эта особенность системы аммиак – воздух учитывается при производстве азотной кислоты окислением аммиака, в котором сырьем является аммиачно-воздушная смесь.
Применяется аммиак для получения азотной кислоты, минеральных удобрений (карбамид, аммофос, нитрат аммония, карбонат аммония), гербицидов, уротропина, соды по аммиачному методу, высокомолекулярных соединений (полиуретаны, полиамиды, полиакрилонитрил). На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильном деле. Жидкий аммиак и его водные растворы применяют как жидкие удобрения.
Сырьевая база для производства аммиака
Сырьем для производства аммиака является азотно-водородная смесь (АВС) стехиометрического состава N2 : Н2 = 1 : 3. Так как ресурсы атмосферного азота практически неисчерпаемы, сырьевая база аммиачного производства определяется вторым компонентом смеси – водородом, который может быть получен разделением обратного коксового газа, газификацией твердого и жидкого топлива, конверсией природного газа и газов переработки нефти.
Структура сырьевой базы производства аммиака менялась, и сейчас свыше 90% аммиака вырабатывается на основе природного газа.
АВС независимо от метода ее получения содержит примеси веществ, некоторые из которых являются каталитическими ядами, вызывающими как обратимое (кислород, оксиды углерода, пары воды), так и необратимое (различные соединения серы и фосфора) «отравление» катализатора. Для удаления этих веществ АВС подвергают предварительной очистке, методы и глубина которой зависят от их природы и содержания, т.е. от способа производства АВС. Обычно АВС, получаемая конверсией природного метана, содержит диоксид углерода, метан, аргон, следы кислорода, оксид углерода.
Для очистки АВС в промышленности используют абсорбцию жидкими поглотителями (мокрый метод) и твердыми поглотителями (сухой метод). При этом очистка может производиться на различных стадиях производства:
· исходного газа перед подачей его на конверсию;
· конвертированного газа для удаления из него оксида углерода;
· АВС непосредственно перед синтезом аммиака (тонкая очистка АВС).
Тонкая очистка АВС достигается хемосорбцией примесей жидкими реагентами и окончательно каталитическим гидрированием или промыванием АВС жидким азотом.
Для удаления диоксида углерода и сероводорода АВС промывают в башнях с насадкой щелочными реагентами, образующими с ними термически нестойкие соли; водным раствором этаноламина или горячим, активированным добавкой диэтаноламина, раствором карбоната калия.
Более эффективным методом очистки АВС от диоксида углерода является применяемая в современных установках промывка АВС жидким азотом при температуре –1900С, в процессе которой из нее удаляются помимо диоксида углерода метан и аргон.
Окончательная очистка АВС достигается каталитическим гидрированием примесей, получившим название метанирования, или предкатализа. Этот процесс проводится в специальных установках метанирования при температуре 250-3000С и давлении около 30МПа на никель-алюминиевом катализаторе (Ni Al2O3). При этом протекают экзотермические реакции восстановления кислородсодержащих примесей до метана, который не является ядом для железного катализатора, а вода конденсируется при охлаждении очищенного газа и удаляется из него:
СО 3Н2 « СН4 Н2О
СО2 4Н2« СН4 2Н2О
О2 2Н2« 2Н2О
Процесс метанирования прост, легко управляем, а выделяющаяся в результате протекающих экзотермических реакций гидрирования теплота используется в общей энерготехнологической схеме производства аммиака.
Очищенная АВС, поступающая на синтез, содержит до 0,0025 об. долей аргона, 0,0075 об. долей метана и не более 0,00004 об. долей диоксида углерода, являющегося наиболее сильным каталитическим ядом.
Рассмотрим технологическую схему получения азотно-водородной смеси.
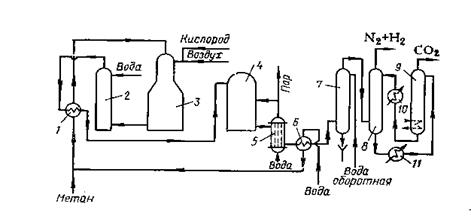
Рисунок 1 Технологическая схема получения азотно-водородной смеси
1 – теплообменник; 2- увлажнитель; 3- конвертор метана; 4 – конвертор оксида углерода; 5- котел-утилизатор; 6 – подогреватель воды; 7 – конденсационная башня; 8- абсорбер диоксида углерода; 9 – десорбер; 11 – подогреватель этаноламина.
Метан подогревают в теплообменнике 1 за счет тепла конвертированного газа. Перед входом в теплообменник к газу добавляют горячую воду. Паро-газовая смесь нагревается до 6000С и проходит с кислородо-воздушной смесью в конвертор 3. Конверсия протекает на никелевом катализаторе при 850-9000С. Из конвертора газовая смесь поступает в увлажнитель 2, в котором она охлаждается водой до 7000С, а затем поступает в теплообменник, где охлаждается до 4000С. После этого газовая смесь направляется в конвертор оксида углерода 4. Температура в конверторе регулируется путем впрыска различного количества конденсата в увлажнитель и изменением подачи пара в конвертор. Катализатор (железо-хромовый) помещается в двух секциях конвертора. Газ из конвертора поступает в котел-утилизатор 5, в котором получается пар давлением 0,5 МПа. Затем он направляется в подогреватель воды 6, нагревая воду до 850С. Окончательное охлаждение газа до 300С происходит в конденсационной башне 7 путем орошения ее оборотной водой. Охлажденный конвертированный газ подается в абсорбер 8 для очистки от диоксида серы раствором моноэтаноламина. Азотно-водородная смесь направляется на синтез аммиака. Раствор моноэтаноламина, выходящий из абсорбера, регенерируется в десорбере 9, пройдя предварительно подогреватель 11, в котором он нагревается до 100-1100С. Диоксид углерода сбрасывается в линию инертного газа или в дымовую трубу, а раствор этаноламина охлаждается в холодильнике 10 и вновь подается в абсорбер.
Химические свойства
- NH3 H ⟶ NH4 .
- NH3 H2O ⟶ NH4 OH− , Ko=1,8⋅10−5.
- NH3 HNO3 ⟶ NH4NO3.
- 2NH3 2K ⟶ 2KNH2 H2.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH− и NH2−, а также молекулы H2O и NH3 изоэлектронны.
- NaNH2 H2O ⟶ NaOH NH3.
и в спиртах:
- KNH2 C2H5OH ⟶ C2H5OK NH3.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- KNH2 ⇄ K NH2− .
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
- 2NH3 →1200—1300∘C N2 3H2 (реакция обратима),
- 4NH3 3O2 ⟶ 2N2 6H2O (без катализатора, при повышенной температуре),
- 4NH3 5O2 ⟶ 4NO 6H2O (в присутствии катализатора, при повышенной температуре).
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
- 3CuO 2NH4Cl ⟶ 3Cu 3H2O 2HCl N2.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- 2NH3 NaOCl ⟶ N2H4 NaCl H2O.
- NH3 CH3Cl ⟶ [CH3NH3]Cl (гидрохлорид метиламмония).
- 2CH4 2NH3 3O2 ⟶ 2HCN 6H2O,
- Cu(NO3)2 4NH3 ⟶ [Cu(NH3)4](NO3)2,
- Cu3(PO4)2 12NH3 ⟶ [Cu(NH3)4]3(PO4)2,
- Cu(CH3COO)2 4NH3 ⟶ [Cu(NH3)4](CH3COO)2,
- AgNO3 2NH3 ⟶ [Ag(NH3)2]NO3.

