- Диагностика
- Классификация и стадии развития сердечной недостаточности
- Недостаточность левого желудочка сердца
- Недостаточность правого желудочка сердца
- Систолическая и дистолическая сердечная недостаточность
- Острая и хроническая сердечная недостаточность
- Стадии развития сердечной недостаточности
- Классификация хсн российского общества специалистов по сердечной недостаточности
- Классификация сердечной недостаточности нью-йоркской кардиологической ассоциации
- Лечение сердечной недостаточности
- Этапы оказания помощи пациенту с острой сердечной недостаточностью
- Цели терапии
- Нужна ли госпитализация при сердечной недостаточности
- Медикаментозное лечение
- Хирургические и механические методы лечения
- Питание и режим дня при сердечной недостаточности
- Нейродегенеративные патологии и дисфункция митохондрий
- Проблема утомления, стресса и хронической усталости
Диагностика
Цель обследования – выяснить, есть ли у обследуемого кислотно-щелочной дисбаланс, определить, насколько сложно это расстройство, чтобы помочь диагностировать основное заболевание или состояние (например, диабетический кетоацидоз, отравление и т. д.).
Вызвавшее расстройство. Обследование также проводится при наблюдении за тяжелобольными пациентами, а также в условиях, которые, как мы знаем, влияют на кислотно-щелочной баланс, например, при хронических заболеваниях легких или почек.
Основные тесты, используемые для выявления, оценки и мониторинга кислотно-щелочного дисбаланса:
- газы крови;
- анализ на электролиты.
Газы крови – это группа тестов, выполняемых вместе, обычно на основе образца артериальной крови (кровь, полученная из артерии, а не вены). Они отображают pH, pO2 (количество кислорода) и pCO2 (количество углекислого газа) в крови. По этим результатам можно рассчитать концентрацию бикарбонатов (HCO 3 -).

Для большинства случаев кислотно-щелочного дисбаланса значения HCO3 – и I pCO2 выходят за пределы допустимого диапазона. Это связано с тем, что организм пытается поддерживать уровень pH крови близким к норме. Следовательно, если одно из этих веществ является аномально высоким или низким, концентрация другого изменится в том же направлении, чтобы вернуть pH крови к норме.
Значения наблюдаются при четырех основных нарушениях кислотно-щелочного баланса:
| Ошибка ABR | pH | HCO 3 – | pCO 2 | Компенсация деятельности организма |
| Метаболический ацидоз | <7,36 | Низкий | Низкий | Увеличение частоты дыхания (гипервентиляция) для снижения CO 2 |
| Метаболический алкалоз | > 7,44 | Высокая | Высокая | Медленное дыхание (гиповентиляция) для увеличения выведения CO 2. |
| Респираторный ацидоз | <7,36 | Высокая | Высокая | Почки задерживают HCO 3 – и увеличивают выведение кислоты. |
| Респираторный алкалоз | > 7,44 | Низкий | Низкий | Почки уменьшают всасывание HCO 3 – и выведение кислот |
Электролиты представляют собой четыре теста: Na (натрий, натрий), K (калий, калий), Cl – (хлориды) и бикарбонаты (HCO 3 -), которые обычно рассчитываются по pH и CO2. Содержание жидкости в организме, концентрация электролитов и кислотно-щелочной баланс взаимосвязаны; при кислотно-щелочном дисбалансе концентрация одного или нескольких электролитов обычно повышается или понижается.
У пациентов с метаболическим ацидозом так называемая анионная щель рассчитывается с использованием концентраций электролитов; помогает узнать, какие нарушения могут быть причиной нарушения кислотно-щелочного баланса. Например, увеличение анионной щели указывает на ацидоз, например, диабетический.
Пациенты с метаболическим алкалозом обычно имеют низкие уровни хлорида (Cl -) и калия (K ), что снова является ориентиром для выявления причины кислотно-щелочного дисбаланса. На основании этих результатов могут потребоваться дополнительные тесты для выявления заболевания или состояния, вызывающего ацидоз или алкалоз (например, глюкоза, лактат, кетоновые тела, осмоляльность, метанол, этиленгликоль, токсикологические тесты на передозировку некоторыми лекарствами, индикаторы сепсиса и т. д.).
Бывает, что у пациента одновременно наблюдается более одного кислотно-щелочного дисбаланса. Примерами являются прием аспирина (который может вызвать как респираторный алкалоз, так и метаболический ацидоз) или люди с заболеваниями легких, принимающие диуретики (респираторный ацидоз плюс метаболический алкалоз).
Классификация и стадии развития сердечной недостаточности
Выделяют следующие формы сердечной недостаточности:
- лево- и правостороняя;
- систолическая и диастолическая (сердечная недостаточность со сниженной и сохранной фракцией выброса);
- острая и хроническая.
Недостаточность левого желудочка сердца
Левосторонняя сердечная недостаточность бывает левожелудочковой и левопредсердной. Для неё свойственно снижение выброса левого желудочка и/или застой крови на пути к левым отделам сердца, то есть в венах малого круга кровообращения.
Левожелудочковая недостаточность обычно развивается при ишемической болезни сердца (ИБС), гипертензии, кардиомиопатии, врождённых пороках сердца, недостаточности сердечных клапанов, а левопредсердная — при сужении отверстия митрального клапана и в редких случаях при миксоме левого предсердия — доброкачественной опухи сердца [14].
Симптомы при левосторонней сердечной недостаточности (СН): слабость, головокружения, бледность кожи, одышка и быстрая утомляемость.
Недостаточность правого желудочка сердца
Для правожелудочковой недостаточности характерно снижение выброса правого желудочка и застой крови в венах большого круга кровообращения. Состояние обычно вызвано предшествующей недостаточностью левого желудочка или тяжёлыми заболеваниями лёгких [14].
Симптомы при правосторонней СН: периферические отёки, цианоз и скопление жидкости в брюшной полости.
Изолированная сердечная недостаточность встречается редко и кратковременно. В последующем нарушение затрагивает все камеры сердца и развиваются типичные симптомы болезни.
В некоторых источниках для описания сердечной недостаточности обоих желудочков применяют термин «глобальная сердечная недостаточность». Такая формулировка некорректна, и врачами не используется. В литературе для описания этого состояния встречается термин «тотальная сердечная недостаточность» [17].
Систолическая и дистолическая сердечная недостаточность
Нарушение насосной функции левого желудочка может быть вызвано систолической и диастолической дисфункцией. Систолическая дисфункция более распространена и связана со снижением сократимости миокарда — мышечной ткани сердца. В большинстве случаев причиной систолической хронической сердечной недостаточности становится ИБС, сочетаясь с артериальной гипертензией и сахарным диабетом.
Диастолическая дисфункция вызвана нарушением активного расслабления или повышением жёсткости миокарда. Пациенты с этой формой болезни реже страдают ИБС, чаще — от артериальной гипертонии и фибрилляции предсердий. Среди них больше пожилых людей, женщин и пациентов с ожирением [16].
Помимо привычных терминов “диастолическая сердечная недостаточность” и «систолическая сердечная недостаточность», используются названия “сердечная недостаточность с сохраненной фракцией выброса ЛЖ (СНСФВ)” и «сердечная недостаточность со сниженной фракцией выброса (СН СФВ)».
Речь идёт об одних и тех же состояниях, но применение терминов диастолической и систолической СН требует объективных доказательств, полученных с помощью эхокардиографии, магнитно-резонансной томографии и изотопного исследования сердца. В некоторых источниках эти термины используют как синонимы [14][18].
Симптомы при систолической и диастолической СН схожи [13]. Различить эти формы болезни можно только с помощью инструментальных методов диагностики. У многих пациентов наблюдаются одновременно оба вида дисфункции [17].
Острая и хроническая сердечная недостаточность
Симптомы при хронической и острой СН различаются лишь интенсивностью и сроками развития.
Стадии развития сердечной недостаточности
Современная классификация хронической сердечной недостаточности объединяет модифицированную классификацию Российской кардиологический школы по стадиям, которые могут только ухудшаться (В. Х. Василенко, М. Д. Стражеско, 1935 г.), и международную классификацию по функциональным классам, которые определяются способностью больного переносить физическую нагрузку (тест с 6-ти минутной ходьбой) и могут ухудшаться или улучшаться (Нью-Йоркская классификация кардиологов).[2]
Классификация хсн российского общества специалистов по сердечной недостаточности
| ФК | ФК ХСН (могут изменяться на фоне лечения) | НК | Стадии ХСН (не меняются на фоне лечения) |
|---|---|---|---|
| 1ФК | Ограничений физической активности нет; повышенная нагрузка сопровождается одышкой и/или медленным восстановлением | 1 ст | Скрытая сердечная недостаточность |
| 11ФК | Незначительное ограничение физической активности: утомляемость, одышка, сердцебиение | 11а ст | Умеренно выраженные нарушения гемодинамики в одном из кругов кровообращения |
| 111ФК | Заметное ограничение физической активности: по сравнению с привычными нагрузками сопровождается симптомами | 11б ст | Выраженные нарушения гемодинамики в обоих кругах кровообращения |
| 1У ФК | Симптомы СН присутствуют в покое и усиливаются при минимальной физической активности | 111 ст | Выраженные нарушения гемодинамики и необратимые структурные изменения в органах-мишенях. Финальная стадия поражения сердца и других органов |
Классификация сердечной недостаточности нью-йоркской кардиологической ассоциации
Класс I. Заболевание сердца не ограничивает физическую активность. Обычная нагрузка не вызывает усталость, сердцебиение и одышку.
Класс II. Болезнь незначительно ограничивает физическую активность. В покое симптомов нет. Обычная физическая нагрузка вызывает усталость, сердцебиение или одышку.
Класс III. Физическая активность значительно ограничена. В покое симптомов нет. Небольшая физическая активность вызывает усталость, сердцебиение или одышку.
Класс IV. Выраженное ограничение любой физической активности. Симптомы сердечной недостаточности появляются в покое и усиливаются при любой активности [15].
Лечение сердечной недостаточности
Этапы оказания помощи пациенту с острой сердечной недостаточностью
При сердечной недостаточности не стоит заниматься самолечением. Своевременное обращение к врачу поможет избежать негативных последствий.
Цели терапии
Правильно подобранная медикаментозная терапия способна улучшить качество жизни и значительно продлить её продолжительность у больных даже с тяжелыми формами хронической сердечной недостаточности (по данным литературы — до 10 лет).[4]
Стандарты диагностики и лечения сердечной недостаточности, которые утверждены Минздравом, предписывают определенные исследования и манипуляции для пациентов, обратившихся с симптомами, напоминающими сердечную недостаточность; там же есть список лекарственных средств, но без указания, кто и как должен это лечить. Терапевты в поликлиниках не имеют соответствующей подготовки и не могут грамотно оказывать помощь этим больным.
Нужна ли госпитализация при сердечной недостаточности
Причиной госпитализации является декомпенсация — выраженное нарастание отёков и одышки, тахикардия и нарушение сердечного ритма.
В России сегодня почти нет специализированных отделений, где принимали бы больных с этим заболеванием, проводили бы дифференциальную диагностику и подбирали лечение (в Западной Европе введена врачебная специальность «специалист по сердечной недостаточности»). Кто реально занимается индивидуальным подбором лекарственных препаратов для больного? Терапевт, который назначает преимущественно фуросемид (мочегонный препарат), выводящий калий, снижающий давление и ускоряющий наступление летального исхода?
Кардиологические отделения районных больниц, куда с огромным трудом можно госпитализировать тяжелого больного на очень короткий срок, где опять же назначат фуросемид и лишь выведут избыточно накопленную жидкость, а через 1-2 месяца опять наступит ухудшение (правило 4-х госпитализаций: время между каждой последующей госпитализацией сокращается, состояние ухудшается, после 4-й госпитализации больных не остается!) В то время как современные препараты в постепенно повышающихся дозах могут обеспечить гемодинамическую разгрузку сердца, улучшить состояние пациента, уменьшить потребность в госпитализациях, продлить жизнь больного.
При хронической сердечной недостаточности показано сохранять режим питания и нагрузок и непрерывно принимать лекарственные препараты. Одно-двухдневный пропуск может ухудшить состояние, симптомы могут вернуться, и станет неизбежной госпитализация. Хроническая сердечная недостаточность часто встречается у людей пожилого возраста и сочетается с энцефалопатией, и помощь близких может значительно повысить их приверженность к лечению. Нужно обучение правильному питанию, режиму дня, контролю за задержкой жидкости (за рубежом эти функции выполняет специально обученная медсестра, которая осуществляет патронаж больного).
Острая или тяжелая форма хронической сердечной недостаточности подразумевает постельный режим, полный психический и физический покой. В остальных случаях показаны умеренные нагрузки, которые не сказываются на самочувствии. Следует потреблять не более 500-600 мл жидкости в сутки, соли – 1-2 г. Назначается витаминизированное, легкоусвояемое диетическое питание, олигомерные питательные смеси.
Медикаментозное лечение
- Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецептора ангиотензина II (БРА): снижают нагрузку на сердце. В наше время неназначение ингибиторов АПФ/БРА больному с ХСН приравнивается к неоказанию медицинской помощи пациенту. Назначаются в минимально переносимых дозах, которые постоянно титруются на повышение под контролем АД и уровня креатинина. [12]
- Бета-блокаторы: уменьшают повреждающее воздействие адреналина на сердце, снижают число сердечных сокращений, удлиняя диастолу, улучшают коронарный кровоток. Дозы этих препаратов тоже постепенно увеличивают.
- Диуретики (мочегонные средства): позволяют вывести из организма задержанную жидкость, принимаются ежедневно (а не дважды в неделю, как было принято 10-15 лет назад). Современные диуретики не так значительно выводят калий, а в комбинации с калийсберегающими диуретиками это побочное действие значительно уменьшено. Они предотвращают развитие фиброза миокарда, остановливают прогрессирование ХСН.[8]
- Ингибиторы неприлизина: позволяют увеличить продолжительность жизни больных с ХСН.
- Блокаторы IF каналов: уменьшают частоту сердечных сокращений. ЧСС около 70 в 1 мин. при хронической сердечной недостаточности делают работу сердца наиболее эффективной.
- Сердечные гликозиды: усиливают работу сердца, урежают сердечный ритм.
- Антикоагулянты и антиагреганты: снижают риск тромбообразования, а это, с учетом заболеваний, которые вызывают хроническую сердечную недостаточность, является одной из главных задач в профилактике осложнений.
- Препараты омега-3 полиненасыщенных жирных кислот: улучшают свойства эндотелия сосудов, увеличивают сократимость миокарда, снижают риск жизнеопасных аритмий. В комплексе с основными препаратами дополнительно уменьшают риск смерти.
Если развивается приступ острой сердечной недостаточности левого желудочка (отёк легких), больной подлежит госпитализации, где ему оказывают неотложную помощь. Лечение заключается в введении диуретиков, нитроглицерина, препаратов, которые повышают сердечный выброс (добутамин, дофамин), проводятся ингаляции O2.
Если развивается асцит, показано проведение пункционного удаления жидкости из брюшной полости, при возникновении гидроторакса — плевральная пункция.
Поскольку сердечная недостаточность сопровождается выраженной гипоксией тканей, пациентам показана кислородная терапия. [10]
Хирургические и механические методы лечения
- Восстановление кровотока по коронарным артериям: стентирование коронарных артерий, аорто-коронарное шунтирование, маммаро-коронарное шунтирование (если сосуды сердца значительно поражены атеросклерозом).
- Хирургическая коррекция клапанных пороков сердца (если значительно выражен стеноз или недостаточность клапанов).
- Трансплантация (пересадка) сердца (при ХСН, не поддающейся медикаментозной терапии).
- Ресинхронизирующая терапия при ХСН с широкими комплексами QRS>130 мс., имплантация кардиостимулятора, регулирующего работу сердца.
- Имплантация кардиовертера-дефибрилятора, способного остановить приступ жизнеопасной аритмии.
- Лечение мерцательной аритмии — восстановление синусового ритма.
- Использование аппаратов вспомогательного кровообращения — искусственных желудочков сердца. Они полностью внедряются в организм, через поверхность кожи соединяются с аккумуляторными батареями на поясе у пациента. Искусственные желудочки перекачивают из полости левого желудочка в аорту до 6 л крови в минуту, в результате левый желудочек разгружается, и восстанавливается его сократительная способность.
Питание и режим дня при сердечной недостаточности
Пациенту с сердечной недостаточностью следует уменьшить употребление жидкости до одного литра в сутки. Также следует исключить солёности, пряности и копчёности.
При заболевании нужно больше двигаться и выполнять посильные нагрузки: чаще ходить пешком и заниматься лёгкой гимнастикой.
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17].
В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида.
Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4).
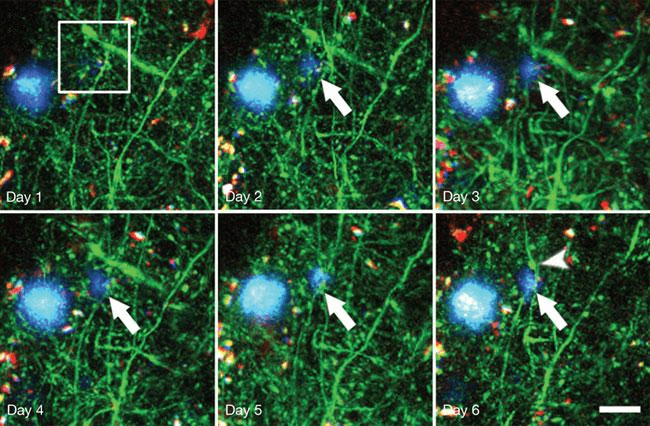
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
[33]
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE).
Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА.
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви.
Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания.
Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути.
Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани.
Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина.
Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти.
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных).
Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов.
Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией.
Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ.
Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран.
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП.
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Проблема утомления, стресса и хронической усталости
ММА имени И.М. Сеченова
Повышенная утомляемость и постоянное чувство усталости – распространенные жалобы, предъявляемые пациентами на приемах врачей различных специальностей. Представленность этих жалоб в общей популяции, по данным различных авторов, колеблется от 10 до 20% в зависимости от методов оценки. Хроническую усталость можно охарактеризовать, как состояние потери активности и способности продолжать какую–либо деятельность. Она влияет на физические и интеллектуальные способности, снижая качество жизни. Пациенты, ощущающие хроническую усталость, часто жалуются на нарушения сна, раздражительность, снижение памяти, внимания, трудность усвоения информации, сексуальные нарушения. Определяющими феноменами состояния хронической усталости являются физиологическое и патологическое утомление.
Физиологическое утомление – это состояние, субъективно ощущаемое как чувство «слабости, вялости», вызываемое тяжелой нагрузкой и характеризующееся пониженной работоспособностью. Оно может быть физическим (мышечным) и нейропсихическим (центральным). Обе формы утомления проявляются при физической и интеллектуальной деятельности, и нельзя отделить одну от другой. Тяжелая физическая работа приводит в первую очередь к мышечному утомлению, а усиленная или монотонная умственная нагрузка вызывает преимущественно утомление центрального типа.
Физическое утомление развивается вследствие таких изменений в скелетной мышце, как опустошение энергетических запасов и накопление молочной кислоты и ионов аммония, что обусловливает снижение работоспособности. Во время фазы восстановления, следующей за физической работой, запасы энергии возобновляются, а молочная кислота и ионы аммония удаляются. Если восстановление запасов энергии и удаление молочной кислоты происходит не полностью, возникает накопление «остаточного утомления».
В процессе дальнейшей активности в условиях остаточного утомления мышца продолжает использовать свои макроэргические субстраты и накапливать конечные продукты метаболизма, что приводит к еще большему нарастанию утомления. Мышечная утомляемость – неспособность мышц поддерживать мышечное сокращение заданной интенсивности – связано с присутствием избытка аммиака, усиливающего анаэробный гликолиз, блокируя выход молочной кислоты. Повышение уровня аммиака и ацидоз лежат в основе метаболических нарушений при мышечной утомляемости. Эти процессы играют определяющую роль в формировании усталости, связанной с физиологическим утомлением.
Нейропсихическое утомление ведет к снижению трудоспособности вследствие нарушений центральной нервной регуляции, связанных, в первую очередь, с функциональным состоянием ретикулярной формации – «энергетическим центром» головного мозга, отвечающим за активное бодрствование. Однако энергетические аспекты, связанные с метаболизмом и «веществами утомления», также очень важны и в случае нейропсихического утомления, так как мозг человека потребляет до 25% всех энергетических ресурсов организма, и его активность постоянно высока как в дневное, так и ночное время (деятельность мозга во сне). При нейропсихическом утомлении происходит замедление процессов передачи информации, ухудшение когнитивных функций, ослабление сенсорного восприятия и моторной функции. Нейропсихическое утомление может сопровождаться депрессивными и тревожными реакциями, раздражительностью, эмоциональной лабильностью и сниженной психомоторной активностью.
Если остаточное утомление в течение длительного времени не компенсируется полным восстановлением, возникает синдром перегрузки. Следом за перегрузкой развивается состояние истощения. Истощение возникает в тех случаях, когда физическая и/или умственная работа, превышающая предел утомления, не прерывается на срок, достаточный для восстановления.
Субъективно ощущаемое чувство утомления – это прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Этот сигнал тревоги информирует регуляторные системы мозга о необходимости временного прекращения умственной или физической деятельности.
Длительное утомление, приводящее к истощению, по сути своей является результатом стрессогенного воздействия на организм, вызывающим нарушение функций регуляторных систем – вегетативной, эндокринной и иммунной. Стресс – особое состояние, характеризующееся мобилизацией всех неспецифических, защитных и приспособительных сил, приводящих к повышению устойчивости организма, сохранению его гомеостаза. Возникновение и развитие стресса не зависит от типа повреждающих стрессорных факторов (психических, социальных, болевых), угрожающих гомеостатическому балансу организма. Стресс–реакция, если действие стрессора продолжается или повторяется, проходит 3 основные стадии.
Первая стадия тревоги – немедленная мобилизация всех адаптационных и защитных функций организма и подавление других, не играющих значимой роли в условиях действия стрессорного фактора. В этой стадии происходит мобилизация энергетических ресурсов, кардиоваскулярной, дыхательной и других систем. При этом гомеостатические константы могут значительно отклоняться от своего исходного уровня покоя. Стресс сопровождается выбросом кортикотропин–релизинг фактора, запускающего каскад реакций, направленных на высвобождение глюкокортикоидов.
Глюкокортикоиды обеспечивают мобилизацию и направленное перераспределение энергетических ресурсов организма, быстрое энергетическое обеспечение органов, отвечающих за адаптацию – активируется гликолиз, выброс липидов из депо, повышается окисление жирных кислот, активируется глюконеогенез. Активация задних отделов гипоталамуса приводит к стимуляции симпатико–адреналовой системы и выбросу катехоламинов.
При достаточной активности механизмов первой стадии происходит развитие второй стадии – резистентности, в течение которой происходят дальнейшие метаболические сдвиги, продолжается выброс катехоламинов, повышается продукция глюкагона, снижается выработка инсулина, возрастает продукция соматотропного гормона – пролактина. Если на этой стадии действие стессорного фактора ослабевает, то вызванные им изменения в организме постепенно нормализуются. Но если стрессорные факторы продолжают действовать, то наступает третья стадия – истощения. Падает резистентность организма, что связано с истощением функции коры надпочечников и развитием абсолютной глюкокортикоидной недостаточности.
Защитная реакция организма – стресс – при определенных условиях может переходить в болезнь адаптации – дистресс. В норме выброс глюкокортикоидов регулируется механизмом обратной связи – их повышенная концентрация в крови тормозит выработку кортикотропин–релизинг фактора. Состояние хронического стресса приводит к нарушению механизма обратной связи и длительному персистированию высоких концентраций глюкокортикоидов в крови. Это, в свою очередь, может привести к выраженной нейрональной недостаточности в структурах, содержащих рецепторы к глюкокортикоидам, например, гиппокампе – эти процессы получили название «изменение нейрональной пластичности». Повреждение гиппокампа ухудшает адаптивные возможности индивидуума при последующих стрессовых воздействиях.
Длительное действие высоких доз катехоламинов приводит к спазму сосудов слизистой оболочки желудка и 12–перстной кишки. Происходит нарушение перекисного окисления липидов, гиперлипидемия, повреждение различных органов и тканей. Атрофия лимфоидной ткани, наблюдаемая в третьей стадии, обусловливает снижение иммунных механизмов защиты организма. Когда стрессорные факторы действуют в течение достаточно длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в вегетативной и эндокринной системах – синдром вегетативной дистонии (вегетативная дисфункция). Синдром вегетативной дистонии протекает в виде психовегетативного синдрома, характеризующегося полисистемными функциональными нарушениями перманентного или перманентно–пароксизмального характера. Утомляемость, в данном случае уже патологическая, также может быть проявлением психовегетативного синдрома.
Патологическая утомляемость
Помимо физиологического утомления, выделяют патологическую усталость, утомляемость – астению. Астения (греч. – asthenia – бессилие, слабость) по определению – аномальная, спонтанная слабость (вялость), возникающая без нагрузки, длительно продолжающаяся и не проходящая после отдыха. Различают органическую астению при соматической патологии и так называемую функциональную астению, не связанную с какими бы то ни было органическими соматическими заболеваниями. От астении следует отличать мышечную слабость, возникающую при нервно–мышечных заболеваниях.
Наиболее частые причины, вызывающие развитие органической формы астении: инфекционные, эндокринные, неврологические, онкологические, гематологические заболевания, нарушения функции ЖКТ (в том числе и гепатиты), а также патология иммунной системы. Причиной органической астении являются метаболические нарушения, связанные чаще всего с митохондриальным метаболизмом и усилением распада белковых структур.
Функциональные астенические расстройства предполагают существование нарушений психической сферы: психические заболевания, проявляющиеся различными аффективными расстройствами (депрессии, невротические расстройства, дистимии, сезонно–аффективные расстройства и т.д.). Также астения входит в клиническую картину идиопатического диффузного полиалгического синдрома (фибромиалгии) и сложного заболевания, этиология которого до настоящего времени окончательно не выяснена – синдрома хронической усталости (chronic fatigue syndrome).
Синдром хронической усталости (chronic fatigue syndrome)
Если чувство утомления, недостатка энергии, не связанное с повышенной физической нагрузкой, продолжается более 6 месяцев, дестабилизирует человека и сочетается с другими характерными симптомами, следует обсуждать наличие синдрома хронической усталости (СХУ). Во взрослой популяции частота представленности СХУ составляет от 0,007% до 2,8%, он также встречается среди детей и подростков, но реже. По последним статистическим данным, СХУ наиболее часто подвержены женщины 30–40 лет, достигшие успехов в карьере («синдром менеджера»).
Как указывает само название, чувство постоянной усталости и повышенной утомляемости – главный симптом СХУ. Также пациенты часто жалуются на «предболезненное» состояние, внезапно возникшую «слабость, разбитость», напоминающую проявления «гриппа, простуды». Больные указывают, что физическая нагрузка усиливает чувство усталости. Многие пациенты с СХУ предъявляют жалобы на снижение аппетита, тошноту, усиленное (профузное) ночное потоотделение, головокружение, непереносимость алкоголя. Почти все пациенты с СХУ обращают внимание на уменьшение социальной активности, около трети из них не могут вообще выполнять работу, другая треть работает неполное рабочее время.
Проявления хронической усталости, равно как и сам СХУ, часто сосуществуют с фибромиалгией, синдромом раздраженной толстой кишки, болевой дисфункцией височно–нижнечелюстных суставов. Наиболее хорошо изучены взаимоотношения СХУ и фибромиалгии – заболевания, характеризующегося наличием чувствительных точек (tender points) и диффузным болевым синдромом. 20–70% пациентов с фибромиалгией соответствуют также критериям СХУ, и соответственно 35–70% больных с СХУ имеют признаки фибромиалгии.
В настоящее время предложено множество теорий патогенеза СХУ. Одни из них основываются на инфекционной вирусной этиологии СХУ, другие – на психических нарушениях, как основе данного патологического состояния. Вирус Эпштейна–Барра, цитомегаловирус, вирусы простого герпеса I, II, VI типов, вирус Коксаки, гепатит С, энтеровирус, ретровирус наряду с прочими обсуждались в качестве этиологических факторов СХУ. В настоящее время нет свидетельств о специфической вирусной инфекции при СХУ. Некоторые пациенты вообще не имеют признаков вирусной инфекции. Скорее всего, гетерогенная группа инфекций может являться триггером и поддерживающим фактором СХУ.
Некоторые авторы считают, что СХУ является следствием только психиатрической патологии: соматизированных расстройств, «больших» или атипичных депрессий. Эта точка зрения основывается на большей представленности эпизодов аффективных расстройств, «больших» депрессий в анамнезе (50–75%) у больных с СХУ по сравнению со здоровыми лицами или больными другими хроническими заболеваниями. Генерализованные тревожные и соматоформные расстройства также чаще встречаются у больных с СХУ, чем в общей популяции (до 30%). В большинстве случаев, но не во всех, аффективные расстройства предшествовали дебюту СХУ.
В некоторых работах обсуждаются, как факторы патогенеза, повышенное образование молочной кислоты в ответ на физическую нагрузку, нарушение транспорта кислорода к тканям, снижение числа митохондрий у больных СХУ.
Проведенные исследования зарегистрировали нарушения мозговых функций, нейроэнодкринной сферы, архитектоники сна, иммунные нарушения, эмоционально–личностные особенности у больных СХУ. В настоящее время большинство исследователей склоняется к мнению, что СХУ – состояние со сложной, мультифакториальной этиологией, является гетерогенным расстройством с психофизиологическими нарушениями, проявляющимися одинаковыми или схожими симптомами.
Основными клиническими симптомами проявления синдрома хронической усталости в настоящее время принято считать трудность концентрации внимания, общую слабость, утомляемость, головокружение, сонливость, склонность к липотимическим состояниям и синкопам. Данные симптомы, как предполагают, являются следствием функциональных нарушений центральной нервной системы, однако патофизиология этих расстройств остается неизвестной.
Проблемы, связанные с когнитивной сферой, в наибольшей степени дестабилизируют состояние больных с СХУ. Около 85% больных активно жалуются на нарушение внимания, снижение концентрации, расстройства памяти. Психологические исследования подтверждают умеренные, но достоверные снижения оперативной памяти и нарушение процессов восприятия информации. Однако предполагается, что состояние дистресса или психиатрическая патология могут быть причиной этого когнитивного дефицита.
Высказывают мнение, что астенические проявления и умеренные нарушения в психической сфере при СХУ могут быть связаны с хронической церебральной гипоперфузией, так как СХУ очень часто сочетается с хронической артериальной гипотензией. Гипоперфузия клеток мозга приводит к изменению нейротрансмиттерной функции и, как следствие, к депрессивным и тревожным расстройствам. Данная точка зрения подтверждается результатами исследований с применением фотон–эмиссионной томографии (single photon emission computed tomography – SPECT), при которых было получено снижение уровня регионального церебрального кровотока по сравнению со здоровыми испытуемыми. Гипоперфузия ЦНС при SPECT–сканировании выявлялась чаще у больных с СХУ по сравнению со здоровыми испытуемыми и больными депрессией.
У больных с СХУ выявлены нарушения гипоталамо–гипофизарно–адреналовой системы и серотониновых систем регуляции вследствие, как предполагается, изменения физиологической реакции на стресс. У трети пациентов с СХУ определяется снижение уровня кортизола. Причиной гипокортизолизма считают не первичное поражение коры надпочечников, а нарушения ЦНС. Прием агонистов серотонина приводит к достоверному повышению уровня пролактина в сыворотке крови у больных с СХУ в отличие от здоровых и больных депрессией, что свидетельствует о нарушении функции серотониновых систем. Больные депрессией имеют противоположный паттерн – гиперкортизолизм и сниженную серотонинобусловленную реакцию пролактина.
Диагностические критерии синдрома хронической усталости (Fukuda K, et al. 1994):
Усталость
Выявляемая клинически, не имеющая объяснений, постоянная или периодически возникающая в течение 6 месяцев или более:
- имеет определенное время начала
- не является результатом нагрузок
- не проходит после отдыха
- приводит к существенному снижению профессиональной, интеллектуальной и социальной личностной активности.
Другие симптомы
Четыре или более из перечисленных признаков, существующих наряду с усталостью или персистирующих в течение шести месяцев и более, но не предшествовавших усталости:
- снижение кратковременной памяти и концентрации внимания
- признаки воспаления верхних дыхательных путей (фарингит)
- болезненность при пальпации шейных или подмышечных лимфатических узлов
- боли в мышцах
- боли в суставах без признаков артрита
- головная боль нового для больного типа или силы выраженности
- не восстанавливающий сон
- плохое самочувствие после нагрузок, длящееся более 24 часов.
Диагноз основывается на наличии перечисленных признаков и исключении иных патологических форм. Поскольку подобные симптомы могут быть следствием ряда других заболеваний (таких как заболевания щитовидной железы, анемии, органические депрессии), в первую очередь следует провести необходимые исследования, исключающие данные заболевания. У отдельных пациентов проявления СХУ могут сочетаться с симптомами других патологических состояний, например, фибромиалгии или синдрома раздраженной толстой кишки. В таком случае ставится диагноз, соответствующий наиболее выраженным и дезадаптирующим пациента симптомам. Страдающие СХУ часто имеют сопутствующие депрессивные проявления, которые также следует отражать в диагнозе.
Таким образом, хроническая усталость, утомление (астения) вне зависимости от происхождения (дистресс, СХУ) характеризуются нарушениями функций регуляторных систем организма (нервной, эндокринной, иммунной) и сочетаются с изменениями метаболизма. Данные метаболические нарушения, в свою очередь, могут являться факторами, поддерживающими состояние хронической усталости. Комплексное лечение хронической усталости, помимо специфических методов (поведенческая терапия, препараты психотропного ряда), должно включать препараты, влияющие на метаболизм, улучшающие тканевой обмен и повышающие устойчивость основных физиологических систем к повреждающему действию стрессовых факторов. Этим требованиям наиболее соответствует препарат Геримакс (фармацевтическая кампания Никомед), созданный на основе женьшеня.
С 1960 года опубликовано более 70 научных работ, доказывающих высокий терапевтический эффект женьшеня. Многие из этих клинических испытаний проводились с использованием препарата Геримакс, который, как было установлено, обладает широким спектром фармакологического и терапевтического действия. Эти свойства препарата обусловлены содержанием в нем большого количества биологически активных веществ, полученных из женьшеня — в частности, витаминов группы B и E, таких микроэлементов, как марганец, медь и цинк, а также полисахаридов, стеролов, органических кислот, флавоноидов и эфирных масел.
Но высокий адаптогенный эффект женьшеня, в первую очередь, связан с содержащимися в нем гинзенозидами — биологически активными веществами рода гликозидов.
Уникальность препарата Геримакс заключается в особом экстракте женьшеня (Gerimax Ginseng Extract — GGE), из которого он изготовлен. Дело в том, что содержание различных биологически активных веществ в обычном экстракте зависит от используемого растительного сырья, качество которого непосредственно связано с условиями его культивации, регионом произрастания и т.п. Следовательно, невозможно гарантировать одинаковый состав всех препаратов, изготовленных на основе обычного экстракта. После 20 лет интенсивных исследований и клинических испытаний различных комбинаций активных ингредиентов в Дании был создан стандартизованный экстракт GGE, состав которого всегда одинаков как по качеству, так и по количеству активных компонентов. Это выгодно отличает Геримакс от множества других аналогичных средств, содержащих женьшень. Следует отметить и то, что комбинация GGE была разработана в соответствии с требованиями международных стандартов «Качественной производственной практики» (GMP), а эффективность препарата клинически доказана рядом испытаний, проведенных по стандартам «Качественной клинической практики» (GCP).
Стандартизация экстракта позволила провести систематизацию клинических исследований, подтверждающих эффективность и безопасность препарата Геримакс с учетом основных принципов и положений доказательной медицины. Доказано, что Геримакс способствует повышению физической и умственной работоспособности, улучшает память и повышает концентрацию внимания, укрепляет иммунную систему, стабилизирует уровень сахара в крови при диабете 2–го типа, повышает тонус и настроение.
Препарат Геримакс представлен в двух видах: Геримакс Женьшень (содержит 200 мг чистого экстракта GGE) и Геримакс (85 мг экстракта женьшеня GGE и сбалансированный комплекс 17 витаминов и микроэлементов, способных полностью восполнить их дефицит в организме взрослого человека). Рекомендуемый курс приема — 2 месяца. Первый положительный эффект применения Геримакса наблюдается к концу первой недели, а максимальный эффект отмечается через 21–28 дней.
.

