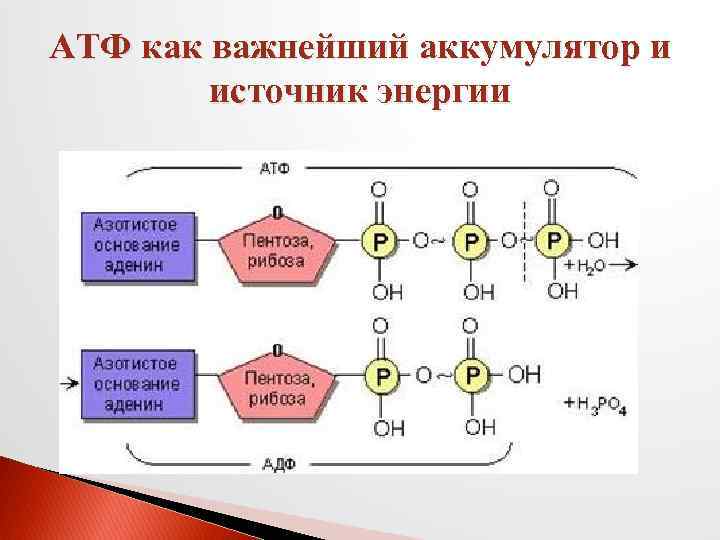
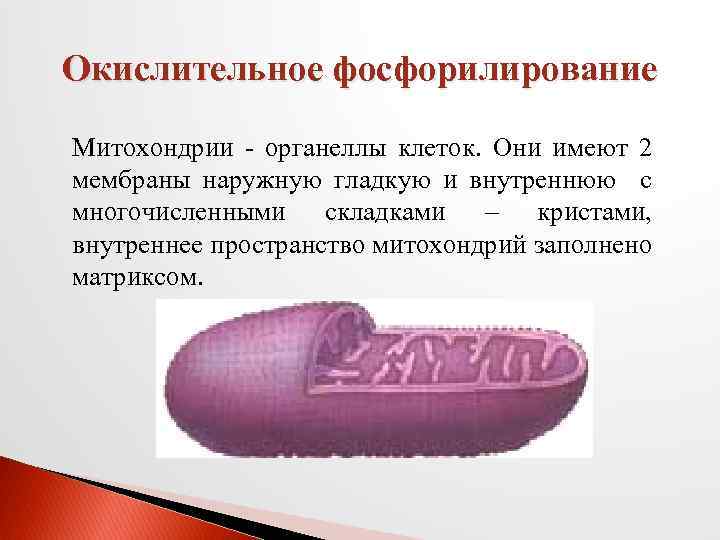
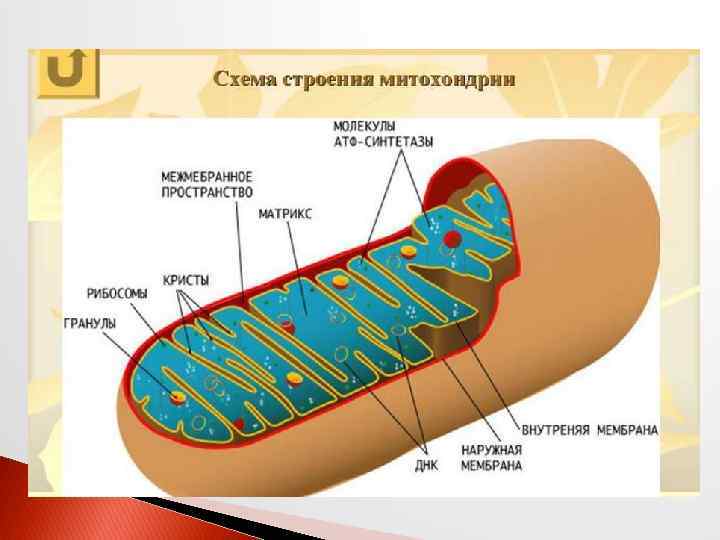
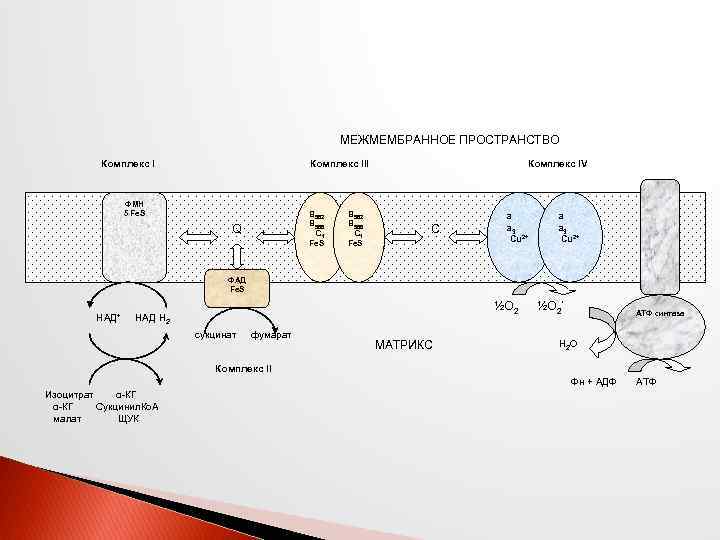
Биологическое окисление этапы пути использования кислорода в тканях
Особенности окисления углерода в кислородном конвертере при разных способах подачи дутья
МЕТАЛЛУРГИЯ СТАЛИ
УДК 669.18.001
Филатова Т.А., Иванин А.В., Брусникова А.В., Колесников Ю.А.
ОСОБЕННОСТИ ОКИСЛЕНИЯ УГЛЕРОДА В КИСЛОРОДНОМ КОНВЕРТЕРЕ ПРИ РАЗНЫХ СПОСОБАХ ПОДАЧИ ДУТЬЯ
Аннотация. Представлены результаты расчётов некоторых параметров конвертерной плавки в зависимости от содержания СО2 в газе из реакционной зоны, степени дожигания СО в газовой фазе и доли поступления тепла на нагрев металла от этого дожигания.
Ключевые слова: окисление углерода, кислородный конвертер, реакции окисления, расчёт параметров плавки, ККЦ ОАО «ММК».
Реакцию окисления углерода часто называют основной реакцией сталеплавильных процессов. При окислении (выгорании) углерода происходит так называемое кипение металла в результате выделения пузырей СО. В процессе кипения происходят перемешивание металла, выравнивание его химического состава и температуры, увеличивается площадь соприкосновения металла со шлаком, что, в свою очередь, ускоряет протекание всех процессов на границе шлак-металл, из металла удаляются газы и неметаллические включения [1].
Окисление углерода происходит в течение всего периода продувки. При взаимодействии струи кислорода с углеродом происходят реакции: [С] 1{о2} = {СО}, [С] {О2} = {СО2}.
80-95% углерода окисляется до СО преимущественно по первой реакции, а оставшиеся 5-20 % углерода — до СО2.
Кроме указанных выше основных реакций, в конвертере с верхней продувкой получает развитие реакция частичного дожигания СО до СО2 над ванной:
{СО} 1{О2} = {СО2}.
Скорость окисления углерода определяется интенсивностью подачи кислорода. Для образования пузырей СО и соответственно протекания реакции обезуглероживания нужен определенный уровень перегрева металла над линией ликвидуса. В особенности заметно воздействие температуры при перегреве более 100 °С. Так как реакция идет преимущественно в зоне воздействия струй кислорода, то условия ее протекания значительно зависят и от конструкции фурмы.
Таким образом, по мере увеличения температуры металла и понижения концентрации примесей, имеющих высокое сродство к кислороду, как кремний и марганец, скорость окисления углерода растет и через 5-7 мин после начала продувки достигает наибольшего значения. Степень полезного использования кислорода в этот момент приближается к 100%. Для
того чтобы в этот период плавки создать условия выделения СО и обеспечить наибольшее внедрение подаваемого кислорода для окисления углерода (а не железа), фурму несколько опускают, струи кислорода более активно внедряются в металл, площадь поверхности раздела окислительный газ — металл резко растет. Условия протекания реакции окисления углерода оказываются благоприятными: на окисление углерода в эти моменты расходуется больше кислорода, чем подается через фурму (отчасти расходуются оксиды железа шлака). Так длится 5-10 мин (в зависимости от интенсивности подачи кислорода) до момента, когда концентрация углерода снизится до ~0,10%, и скорость окисления углерода при всем этом резко понижается [2].
В настоящее время отсутствуют способы прямого измерения состава конвертерного газа, образующегося в реакционной зоне, степени дожигания СО до СО2 в газовой фазе, доли тепла от дожигания СО в тепловом балансе плавки. Эти параметры можно определить расчётом по математической модели периода продувки конвертерной плавки при различных режимах подачи дутья. С этой целью разработана математическая модель периода продувки, составленная на основе уравнений материального и теплового балансов плавки, включающих массу, состав и температуру металла, шлака и газа [3, 4].
В качестве базового варианта были использованы усреднённые параметры производственных данных выплавки стали марки 08Ю в условиях кислородно-конвертерного цеха ОАО «ММК» для регламентированной технологической инструкции параметров дутьевого режима.
Расчёты производились в электронных таблицах Microsoft Excel путём совместного решения балансовых уравнений методом итераций [5].
Результаты расчётов некоторых параметров конвертерной плавки в зависимости от содержания СО2 в газе из реакционной зоны, степени дожигания СО в реакционной зоне и доли поступления тепла на нагрев металла от этого дожигания представлены на рис. 1-4.
№1 (13). 2022
27
Раздел 3
—Доля leiiJid ui дижиганин
СО — Or 1
-СИЗ
—Даля тепла от дожигания
30% СО-ОД -03
75 SO 85 90 95 100
Окисляется углерода до СО в реакционной зоне, %
Рис. 1. Изменение расхода жидкого чугуна от развития реакции окисления углерода
23000
??500
22000
21500
ч
21000
CL
<5 20500
1 20000
it
о
■t 19500
¡C
CL
19000
-ж-ж—
— Долч тепла от до^иганм 5% СО-ОД
-0,3
-0,5 -0,7
— Доля тепло от
дожт ан ин 30% СО — 0,1
0,3
-0,5 0,7
Окисляется углерода до СО в реакционной зоне, %
Рис. 2. Изменение расхода дутья от развития реакции окисления углерода
326
324
н
я X 322
z
>■ т 320
о
о 318
-* 316
Í эй 314
я
о. 312
T7u
170 270 370 470 570
Расход дутья снизу, м3
Рис. 3. Влияние расхода инертного газа, подаваемого в конвертерную ванну снизу, на расход жидкого чугуна
170 2 70 370 470 570
Расход дутья снизу, м3
Рис. 4. Изменение содержания оксидов железа в шлаке при различных расходах дутья снизу
Литература
1. Бигеев А.М., Бигеев В.А. Металлургия стали. Теория и технология плавки стали: учебник для вузов. 3-е изд., перераб. и доп. Магнитогорск: МГТУ им. Г.И. Носова, 2000. 544 с.
2. Кудрин В.А. Теория и технология производства стали: учебник для вузов. М.: Мир; ООО «Издательство АСТ», 2003. 528 с., ил.
3. Филатова Т.А., Колесникоа Ю.А. Влияние условий окисления углерода на показатели выплавки стали в конвертере // Литейные процессы: межрегион. сб. науч. тр. / под ред. В.М. Колокольцева. Магнитогорск: Изд-во Магнитогорск. гос. техн. ун-та им. Г.И. Носова, 2022. Вып. 11. С. 63-71.
4. Колесников Ю.А., Буданов Б.А., Сергеев Д.С. Структура и размеры реакционной зоны при подаче кислородного дутья в металлический расплав сверху // Литейные процессы: межрегион. сб. науч. тр. / под ред. В.М. Колокольцева. Магнитогорск: Изд-во Магнитогорск. гос. техн. ун-та им. Г.И. Носова, 2022. Вып. 10. С. 68-73.
5. Колесников Ю.А. Расчет расхода лома на плавку стали в конвертере с использованием электронных таблиц // Теория и технология металлургического производства. межрегиональный сб. науч. трудов / под ред. В.М. Колокольцева. Магнитогорск: ГОУ ВПО «МГТУ им. Г.И. Носова», 2006. Вып. 6. С. 34 — 39.
Сведения об авторах
Филатова Татьяна Александровна — магистрант института металлургии, машиностроения и материалообработки ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова». E-mail: filatova.tanechka@mail.ru
Иванин Антон Дмитриевич — аспирант института металлургии, машиностроения и материалообработки ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова».
Брусникова Алена Викторовна — аспирант института металлургии, машиностроения и материалообработки ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова».
Колесников Юрий Алексеевич — канд. техн. наук, доц. института металлургии, машиностроения и материалообработки ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова».
♦ ♦ ♦
28
Теория и технология металлургического производства
Угарный газ, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Углеводы: моносахариды. важнейшие представители
Данный видеоурок посвящён моносахаридам (глюкозе и фруктозе), их составу и строению, функциональным группам, линейным и циклическим формулам, физическим и химическим свойствам глюкозы, качественным реакциям глюкозы, получению и применению моносахаридов.
Углеводы
– это органические вещества, содержащие карбонильную группу и несколько
гидроксильных групп.
Само
название происходит от слов «гидраты углерода» и было предложено в 1844 году К.
Шмидтом. Первые представители этого класса описывались формулой Cx(H2O)y, то есть соотношение
атомов водорода и кислорода 2 : 1, то есть такое же, как в воде.
Углеводы
делятся на моносахариды, дисахариды и полисахариды в
зависимости от числа молекул моносахаридов, которые образуются при гидролизе.
Моносахариды гидролизу не подвергаются, дисахариды состоят из двух остатков
моносахаридов, полисахариды состоят из большого числа моносахаридов.
Все
моносахариды по числу углеродных атомов делят на тетрозы, у которых
четыре атома углерода, пентозы, у которых пять атомов углерода и гексозы,
у которых шесть атомов углерода. К пентозам относят рибозу (С5Н10О5)
и дезоксирибозу (С5Н10О4). К гексозам
относят глюкозу и фруктозу (С6Н12О6).
Рассмотрим особенности строения
глюкозы. Из структурной формулы глюкозы видно, что это – бифункциональное
соединение, которое содержит в молекуле альдегидную группу и пять
гидроксильных групп. Линейная форма молекулы глюкозы существует только в
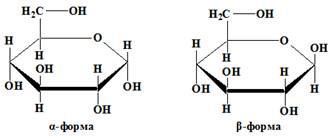
растворе, а в твёрдом виде глюкоза существует в циклической α- или
β-форме.
Переход линейной формы глюкозы в
циклическую происходит, когда альдегидная группа близко подойдет к пятому
углеродному атому. Тогда произойдет её взаимодействие с гидроксильной группой и
образуется новая гидроксильная группа. Это приводит к замыканию молекулы через
кислородный атом в шестичленное кольцо, и альдегидной группы в такой молекуле
уже не будет.
Процесс превращения альдегидной формы
в циклическую обратим. В растворе существует подвижное
равновесие между ними. Оно сильно смещено в сторону образования циклической
формы.
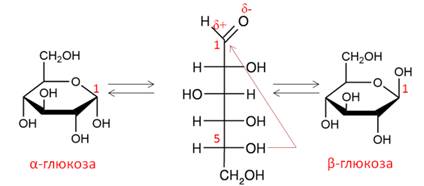
α-
и β-формы отличаются положением гидроксогруппы при первом атоме углерода,
а также температурами плавления.
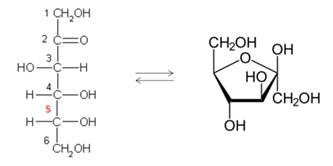
Фруктоза
является
изомером глюкозы. В отличие от молекулы глюкозы, в молекуле фруктозы содержится
карбонильная группа, в циклической форме фруктозы содержится пять атомов
углерода, а не шесть, как в молекуле глюкозы.
Глюкоза
– это бесцветное кристаллическое вещество, которое хорошо растворимо в воде,
сладкое на вкус (от лат. «глюкос» − сладкий). Глюкоза и фруктоза
содержится в плодах и цветках, листьях и корнях. Особенно много её в соке
винограда и спелых фруктах. Мёд также состоит из смеси глюкозы и фруктозы.
В
крови человека массовая доля глюкозы составляет 0,1 %. Содержание глюкозы в
крови регулируется гормоном инсулином. При сахарном диабете глюкоза содержится
в крови и моче в повышенной концентрации. Поэтому людям, страдающим от
сахарного диабета, следует ежедневно вводить инъекции инсулина.
Фруктоза представляет собой безводные кристаллы,
имеющие форму игл. Фруктоза легко растворяется в воде и спирте. Фруктоза вместе
с глюкозой содержится в сладких фруктах, мёде. Среди всех моносахаридов
фруктоза обладает самым сладким вкусом.
Химические свойства глюкозы обусловлены наличием альдегидной
группы и гидроксильных групп. То есть глюкоза – это альдегидоспирт.
Для глюкозы характерны реакции окисления по
альдегидной группе. Так, в реакции глюкозы с бромной водой образуется
глюконовая кислота и происходит обесцвечивание раствора брома. Поэтому эту
реакцию можно использовать для качественного определения альдегидной группы в
глюкозе.
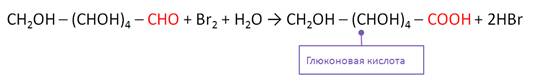
Кроме этого, глюкоза вступает в реакцию с
аммиачным раствором оксида серебра (I). При этом образуется глюконовая кислота. Эта реакция также является
качественной на альдегидную группу и называется реакцией «серебряного
зеркала».
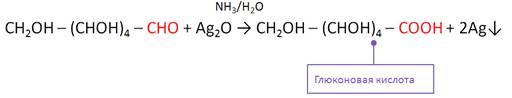
Если к свежеприготовленному раствору
гидроксида меди (II)
прилить раствор глюкозы, то появляется ярко-синее окрашивание раствора. Эта
реакция является качественной на многоатомные спирты, а в молекуле глюкозы 5
гидроксильных групп.

Если же эту смесь нагреть, то реакция идёт по
альдегидной группе, образуется глюконовая кислота и выпадает осадок красного
цвета – оксид меди (I). Эту
реакцию можно использовать для качественного обнаружения глюкозы.
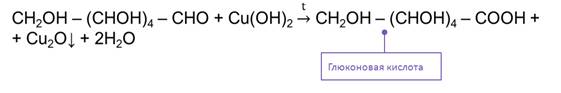
Кроме реакций окисления для глюкозы характерны
реакции восстановления. Так, при восстановлении глюкозы водородом в присутствии
катализатора, образуется шестиатомный спирт – сорбит.
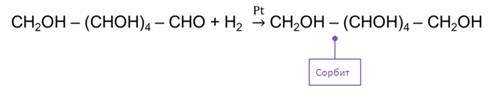
Глюкоза обладает и специфическими свойствами. К
таким реакциям относится реакция брожения. При этом под действием
ферментов образуются различные вещества. При спиртовом брожении глюкозы
образуется спирт этанол и углекислый газ. Этот процесс используют при
производстве спирта, вина, пива, в хлебопечении.
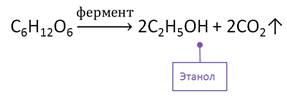
При молочнокислом брожении образуется молочная
кислота.
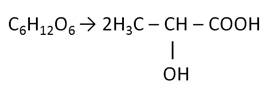
Молочнокислое
брожение вызвано бактериями рода Lactobacillus
и
используется для получения простокваши, кефира, творога, сметаны, сыра,
молочной кислоты. Молочная кислоты образуется при квашении капусты, силосовании
кормов. Молочная кислота применяется в текстильной и кожевенной промышленности.
Маслянокислое брожение глюкозы идёт с
образованием масляной кислоты, водорода и оксида углерода (IV).
В
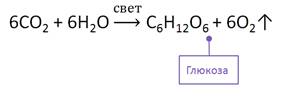
природе глюкоза образуется в процессе фотосинтеза в зелёных растениях
под действием солнечного света при участии хлорофилла.
Синтез
глюкозы из муравьиного альдегида осуществил в 1861 году А. М. Бутлеров.
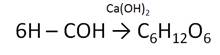
В
промышленности глюкозу получают гидролизом крахмала в присутствии серной
кислоты.
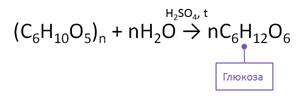
Глюкоза
– это ценный энергетический продукт, так как при окислении глюкозы образуется
энергия, необходимая для жизнедеятельности организма. Глюкозу применяют в
медицине как питательное вещество, её используют для получения аскорбиновой
кислоты, сорбита, биополимеров, в кондитерской промышленности (в составе
патоки), её используют для изготовления зеркал, ёлочных украшений (серебрение),
в текстильной промышленности глюкозу используют для отделки тканей.
Таким образом, молекула глюкозы содержит
альдегидную группу и пять гидроксильных групп. Глюкоза образует линейную и
циклическую формы. Изомером глюкозы является фруктоза. Для глюкозы характерны
реакции окисления, восстановления, брожения. В промышленности глюкозу получают
кислотным гидролизом из крахмала. Глюкоза имеет широкое применение.