История 1: treg-лимфоциты vs. th17-лимфоциты
Наивные CD4 T клетки в зависимости от микроокружения способны дифференцироваться в различные субпопуляции с весьма отличающимися друг от друга функциями: Th1, Th2, Tfh, Th17 и iTreg. Огромное внимание в вопросах аутоиммунных заболеваний и противоопухолевого иммунитета обращено к двум не так давно открытым популяциям T лимфоцитов — Th17 и iTreg [17].
Th17-клетки дифференцируются из наивных CD4 лимфоцитов под действием TGF-β и IL-6; критичным является активация транскрипционных факторов STAT3 и RORgt. Th17-лимфоциты обладают мощным бактерицидным и фунгицидным действием за счет секреции IL-17 и IL-22.
Индуцированные iTreg дифференцируются из наивных CD4 лимфоцитов под действием TGF-β и IL-2; критичным является активация транскрипционного фактора Foxp3. Treg вырабатывают IL-10, TGFβ, экспрессируют на своей поверхности много интересных молекул (типа рецептора к IL-2 СD25, ингибиторного корецептора CTLA-4), за счет которых проявляют свои иммуносупрессивные свойства.
Итого, мы имеем две субпопуляции лимфоцитов, обладающих диаметрально противоположными свойствами, не способными перепрограммироваться друг в друга и происходящие из единого предшественника — наивных CD4 лимфоцитов. Часто говорят о балансе Treg и Th17, сдвиге баланса либо в иммуносупрессивную, либо в провоспалительную сторону при разных заболеваниях, и подчеркивают первостепенную важность механизмов, определяющих дифференцировку по одному из двух путей. Кратко рассмотрим механизмы и попытаемся понять, в чем соль.
Первое, на что внимательный читатель обратит внимание, это общий для двух субпопуляций индуктор TGFβ. Известно, что сами по себе высокие концентрации TGFβ способны поддерживать активацию Foxp3 и коммитировать образование iTreg. Однако для Th17 также характерна активация Foxp3, которая в обязательном порядке должна быть подавлена.
Теперь о роли HIF-1. Для немиелоидных клеток показано, что активация STAT3 может приводить к негипоксической активации HIF-1. HIF-1, в свою очередь, способен ингибировать Foxp3, причем, вероятно, за счет механизма активации полиубиквитинирования с последующей протеасомной деградацией, т.е. механизма по которому HIF-1 разрушается сам.
Ингибируя Foxp3, HIF-1 способствует дифференцировке CD4 наивных лимфоцитов в Th17 направлении. Что интересно, данную STAT3-зависимую негипоксическую активацию HIF-1 с последующим ингибированием Foxp3 можно заменить циклами периодической гипоксии-нормоксии, которая приводит к стабилизации и накоплению HIF-1 (рис. 8).
Любопытно, что то же самое не случается в условиях длительной гипоксии. И виной здесь отрицательная обратная связь — длительная гипоксия повышает экспрессию HIF-зависимой микроРНК-210, которая способна подавлять трансляцию HIF-1α.
Приведенную выше концепцию особой роли HIF-1 в активации фактора RORgt (критичного для Th17) и ингибирования Foxp3 (критичного для Treg) подтверждает недавняя замечательная статья о роли фактора Deltex1 в поддержании стабильности Foxp3 за счет ингибирования его негативного регулятора HIF-1 [18].
Не так давно была открыта новая субпопуляция лимфоцитов — Tr1, обладающих иммуносупрессивными свойствами, при этом не экспрессирующих Foxp3 (маркер регуляторных T-лимфоцитов). Tr1 играют особую роль в супрессии воспаления в нервной системы и кишечнике [19].
Интересно, что гипоксия и повышенная концентрация внеклеточного АТФ — частые атрибуты воспаления — способны угнетать дифференцировку Tr1-лимфоцитов. Весьма красивым оказался механизм: критичным фактором для дифференцировки в Tr1 лимфоциты является фактор AHR, который при взаимодействии со своим ядерным переносчиком ARNT, переносится в ядро и активирует экспрессию IL-10, IL-21 и прочих факторов, определяющих иммуносупрессивные свойства Tr1-лимфоцитов.
Однако ARNT хорошо известен нам как HIF-1β, кислород независимая субъединица, с которой димеризуется HIF-1α. Между HIF-1α и AHR в указанных условиях происходит конкуренция за ARNT и HIF-1α в этой конкуренции побеждает. Впрочем, если условия позволяют, и в схватке побеждает ARNT, ему есть чем ответить — активируясь, он способствует деградации HIF-1α, предположительно за счет повышения экспрессии пролилгидроксилаз PHDs по кислород-зависимому механизму (рис. 9).
Хочется отметить также, что угнетающая роль HIF-1α на дифференцировку Tr1-лимфоцитов оказалась не столь уж однозначной — исследователи отмечают то, что активность HIF-1α важна на ранних стадиях дифференцировки, главным образом, за счет своей способности переключать метаболизм на гликолитический тип.
Некоторые современные сведения о факторах hif
Далее дорогой читатель будет вынужден простить мне несколько справочный раздел, суммирующий часть современных сведений о факторе HIF.
- Что есть гипоксия? Нормоксия — условие, при котором концентрация (напряжение) кислорода в окружающей организм/клетку среде «нормальное атмосферное», т.е. близко к 21%. Гипоксия, соответственно, это все, что ниже, гипероксия — все, что выше указанной цифры. На самом деле, понятия эти весьма условны. Классической нормоксии in vivo нет даже для дыхательного эпителия (~14,5%), а большинство тканей в норме прибывает в условиях так называемой физиологической гипоксии (2–9% в зависимости от ткани, обычно около 5%), которая для них и не гипоксия вовсе. Помимо этого, выделяют также умеренную гипоксию, собственно гипоксию и аноксию. Единой чёткой классификации гипоксий нет, но есть попытки (как в таблице 1).
- Как все начиналось. В самом начале протерозоя — 2,4 млрд. лет назад (или на 830 миллионов лет ранее, если верить совсем свежим данным [3]) — произошла так называемая кислородная катастрофа — довольно стремительное глобальное накопление кислорода в атмосфере Земли, что привело примерно 0,54 млрд. лет назад к формированию атмосферы, близкой к современной. Для многих организмов произошла смена восстановительного, анаэробного типа метаболизма на принципиально новый окислительный тип. Эволюционно возникла потребность в появлении кислород-чувствительного регулятора.
- Основные принципы работы кислород-чувствительных систем. Кислород-чувствительные системы прокариот и эукариот устроены сходным образом — в роли сенсора выступает фермент 2-оксоглутарат оксигеназа с двухвалентным железом в качестве кофактора [4]. Фермент в условиях нормоксии в присутствии 2-оксоглутара и молекулярного кислорода способен гидроксилировать остатки аминокислот (обычно пролина или аспарагина) в составе белка-регулятора транскрипции или трансляции, регулируя его функции (рис. 2).
Кислород-чувствительная система эукариот (PHD-HIF) претерпевала некоторую эволюцию. Уже довольно сходная с человеческой PHD-HIF система функционирует у Trichoplax adhaerens[5] — примитивного двухслойного животного, еще не обладающего билатеральной симметрией (рис. 3).
- Факторы HIFs и канонический кислород-зависимый путь регуляции их активности.У эукариот кислород-сенсорная система связана с функционированием важнейшего транскрипционного фактора HIF, регулирующего работу (по разным оценкам) 1–2% всех генов (что довольно приличная цифра). Факторы HIF представляет собой гетеродимерные белки, состоящие из конститутивно экспрессирующейся HIF-β субъединицы и одной из трех кислород-зависимых HIF-α субъединиц (HIF-1α, HIF-2α или HIF-3α), которые формируют при димеризации с β-субъединицами соответственно HIF-1, HIF-2 и HIF-3 (рис. 4). Лучше всего изучены факторы HIF-1 и HIF-2. Роль 2-оксоглутарат оксигеназы у эукариот выполняют пролилгидроксилазы (PHD 1-3), гидроксилирующие в условиях нормоксии остатки пролина в кислород-чувствительной α-субъединице, что приводит к ее деградации. В условиях гипоксии α- и β-субъединицы образуют гетеродимер, перемещаются в ядро и взаимодействуют с особыми последовательностями в промоторах генов HRE (hypoxia responsive elements), активируя экспрессию этих так называемых HIF-зависимых генов.
В условиях нормоксии транскрипционная активность HIF-1α и HIF-2α регулируется также за счет другого кислород-зависимого фермента — FIH-1 (factor inhibiting HIF-1), который, гидроксилируя остатки аспарагина, способен препятствовать взаимодействию HIFs с кофакторами [6]. - Неканонические пути регуляции активности факторов HIFs или та самая негипоксическая гипоксия. Помните пример с кобальтовой кардиомиопатией? Это был хороший пример так называемого неканонического пути активации HIF, когда он, по сути, активировался в условиях нормоксии. В данном случае Co2 выступает в качестве хелатора Fe2 (содержащегося в активном центре пролилгидроксилаз PHD), ингибирует их функцию и нарушает кислород-зависимое разрушение α-субъединицы. Это приводит к активации HIFs в условиях нормоксии. Так у любителей пива происходила постоянная активация HIFs и HIF-зависимого гена эритропоэтина — даже несмотря на то, что в их кровь была пересыщена гемоглобином, и никакой реальной гипоксии, разумеется, не наблюдалось. Воздействовать на Fe2 в составе пролилгидроксилаз PHD способны активные формы кислорода (АФК) [7], которые образуются в клетке в огромном количестве разнообразных процессов.
Позднее выяснилось, что активность HIF может регулироваться множеством других механизмов на уровне транскрипции, трансляции и посттрансляционных модификаций (фосфорилирование, ацетилирование/деацетилирование, убиквитинирование/деубиквитинирование, SUMO-илирование [8], S-нитрозилирование, NEDD-илирование). Механизмы эти могут быть как зависящими от кислорода, так и нет; как селективными, так и нет по отношению к HIF-1α и HIF-2α изоформам [9]. Но к этому мы вернемся несколько позже. - HIF-1 и HIF-2. В чем разница? А теперь еще один важный пункт — изоформоспецифические особенности фактора HIF. Напомню, что существуют главным образом две изоформы — HIF-1 и HIF-2; они обладают примерно 48%-идентичностью по аминокислотной последовательности, имеют один и тот же сайт для посадки — HRE — и, главным образом, один и тот же перечень контролируемых ими генов. Однако есть и особенности.
- Экспрессия первой изоформы повсеместна; экспрессия же HIF-2 тканеспецифична: это почечная ткань, кишечник, жировая ткань, эндотелий и другие.
- Существует специфика в активируемых изоформами генов: HIF-1 регулирует экспрессию ключевых ферментов гликолиза: 6-фосфофрукто-2-киназы/фруктозо-2,6-бифосфатазы 3, фосфоглицераткиназы, лактатдегидрогеназы А, карбангидразы-9; некоторых антиапоптотических факторов: BNIP3, BNIP3L; тогда как как HIF-2 (кстати, Семенза открыл именно фактор HIF-2) контролирует экспрессию «фактора стволовости» OCT-3/4 [10, 11], циклина D1, эритропоэтина и другие (рис. 5) [12].
- В настоящее время формируется парадигма кооперации двух факторов при гипоксии. Очень наглядно эта концепция продемонстрирована на модели динамики роста сосудов в ответ на ишемию и роста опухолевой массы (рис. 6). И в том, и в другом случае первоначально клетки находятся в состоянии выраженной гипоксии (аноксии) и активируются сразу оба фактора — HIF-1 и HIF-2, причем главным «игроком» является HIF-1. В это время происходят критические, быстрые события: стремительное переключение на гликолиз, защита от апоптоза, продукция ростовых факторов. Постепенно происходит переключение на изоформу HIF-2, которая активна при более умеренной гипоксии и более длительное время, экспрессируется другой спектр факторов, определяющих созревание сосудистой сети и дальнейший рост опухоли с метастазированием.
За переключение изоформ ответственна особая E3 лигаза, названная HAF — hypoxia-associated factor. В условиях продолжительной и незначительной гипоксии она способна связываться с С-концевым доменом HIF-2α, что приводит к его стабилизации и дополнительному повышению трансактивационных свойств HIF-2. В условиях острой, кратковременной гипоксии/аноксии активность ее подавлена. - Факторы HIF способны взаимодействовать с другими факторами, как связанными с регуляцией транскрипции (красивый пример — HIF-1 и HIF-2 по-разному взаимодействуют с участниками Notch-сигналинга и по-разному влияют на биологию стволовой клетки глиобластомы [13]), так и не связанными с транскрипцией (взаимодействие с g-секретазой при раке молочной железы [14]). Неканонические взаимодействия HIF-сигналинга, возможно, одна из самых интригующих и многообещающих областей.
- Случай из практики. В заключение данного раздела скажу, что явления негипоксической активации HIFs и различия в изоформной специфичности между HIF-1 и HIF-2 — это реальные вещи, с которыми я столкнулся лично. В своей дипломной работе я изучал экспрессию эндотелием различных хемокинов под действием ростовых факторов VEGF165 и HGF, по одиночке и в комбинации. Исследовалась закономерная активация киназ ERK-1/2, p38 и активация NF-kB. Экспрессия некоторых хемокинов и факторов адгезии (MCP-1, ICAM-1, VCAM-1) четко ложилась в нашу концепцию о «провоспалительном» действии VEGF165 и «противовоспалительном» действии HGF и согласовывалась с активностью провоспалительного фактора NFkB.
Однако экспрессия и продукция IL-8 (важнейшего провоспалительного хемокина) регулировалась загадочным и не совсем объяснимым образом. Позднее мы решили эту задачу и нашли, что в нашей системе фактор HGF способен стабилизировать и активировать HIF-2 в нормоксических условиях (скорее всего за счет прямого фосфорилирования HIF-2α и повышения стабильности) и, таким образом, повышать экспрессию и продукцию IL-8 (рис. 7), что и придавало загадочности в профиль его экспрессии [15].
Итак, дорогой читатель, я надеюсь, что вы не сильно утомились ознакомлением первой части рассказа. Скорее перейдем к его иммунологическому разделу!
Приступы удушья — причины появления, при каких заболеваниях возникает, диагностика и способы лечения
Приступы удушья: причины появления, при каких заболеваниях возникают, диагностика и способы лечения.
Определение
Удушье, или асфиксия, – мучительное, жизнеугрожающее, патологическое состояние, которое характеризуется нехваткой кислорода и накоплением углекислого газа в тканях.
Удушье является крайней степенью одышки, когда человек ощущает внезапную нехватку воздуха, учащение сердцебиения и страх.
Удушье является симптомом тяжелых заболеваний и состояний, для которых характерно нарушение проходимости дыхательных путей, наблюдается при некоторых патологиях сердечно-сосудистой, костно-мышечной и нервной системы.
Разновидности удушья
По механизму возникновения и развития выделяют следующие виды асфиксии:
- механическая асфиксия – это удушье, возникающее вследствие ограничения или прекращения притока воздуха в дыхательные пути при их сужении (например, из-за отека подсвязочного пространства при развитии ложного крупа у детей), обтурации (или иначе закупорке) дыхательных путей и их сдавлении (например, при опухолях).
- травматическая асфиксия – это удушье, возникающее из-за сильного сдавления грудной клетки. Часто происходит во время дорожно-транспортных происшествий.
- токсическая асфиксия – удушье, которое развивается в результате угнетения дыхательного центра, паралича дыхательной мускулатуры (диафрагмы) или при нарушении транспортной функции крови (при отравлении угарном газом).
Возможные причины удушья
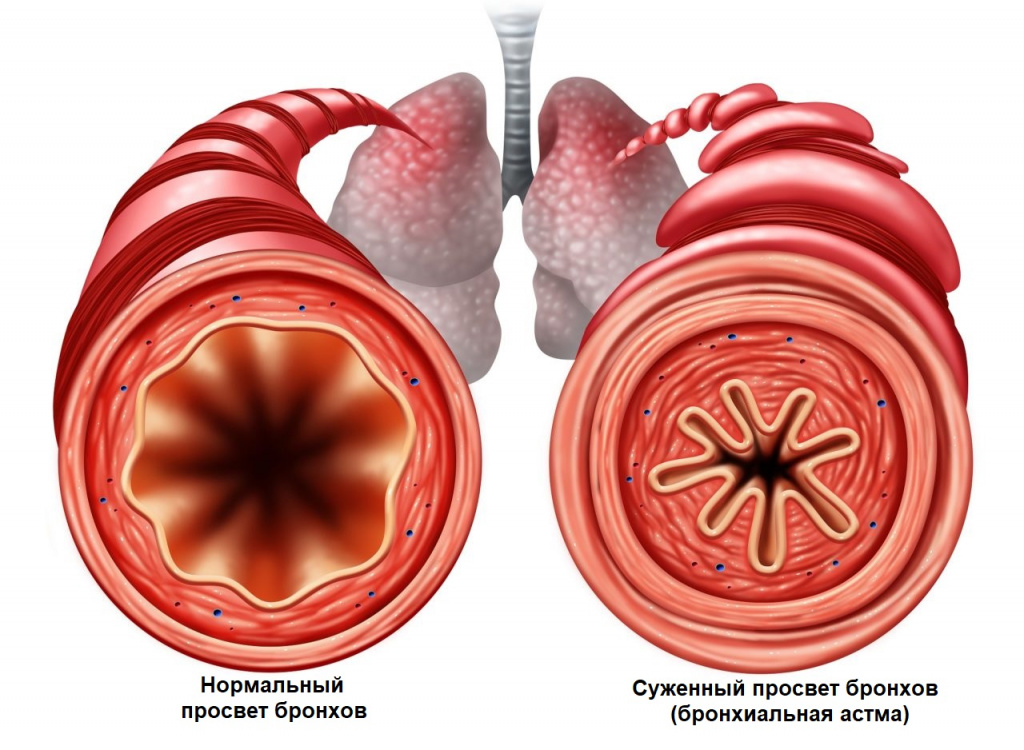
При развитии бронхиальной обструкции (уменьшении диаметра мелких бронхов вследствие спазма или отека) приступ развивается внезапно, может сопровождаться предвестниками: чувством давления за грудиной, беспокойством, а также кожным зудом.
Приступы бронхиальной астмы часто возникают после контакта с аллергеном, при острых респираторных заболеваниях.
Удушье постепенно нарастает, и человеку становится тяжело дышать, увеличивается частота дыхания, выдох удлиняется. Состояние несколько облегчает принятие специфической позы: сидя или стоя, упершись руками в стол, кровать или в подоконник. Так восстанавливается дыхание за счет вовлечения вспомогательной дыхательной мускулатуры. Приступ удушья может сопровождаться выраженными хрипами, которые слышны на расстоянии, цианозом (цвет кожи принимает синеватый оттенок) и набуханием вен. Продолжительность приступа может варьироваться от нескольких минут до нескольких часов. По окончании приступа появляется кашель с последующим отхождением бесцветной мокроты.
Удушье может быть проявлением развивающегося отека легких при болезнях сердечно-сосудистой системы. Образуется застой в кровеносной системе легких из-за снижения насосной функции сердца, поэтому ткань легких пропитывается жидкой частью крови. Скопившаяся жидкость попадает в дыхательные пути, затрудняет движение воздуха, вызывая удушье, и выходит в виде розовой пены.
Отек легких часто является следствием инфаркта миокарда.
Причиной удушья у детей часто становится попадание инородного тела в верхние дыхательные пути. Это случается из-за невнимательности и спешки при приеме пищи, смехе, кашле и чихании во время еды. Дети, оставленные без присмотра, могут проглотить мелкие игрушки или их части. У взрослых инородные тела нередко попадают в дыхательные пути при алкогольном опьянении. Для пожилых людей опасность представляют зубные протезы.
Удушье у детей может стать следствием развития ложного крупа. Из-за воспаления слизистой оболочки гортань отекает и просвет дыхательных путей значительно сужается. Сопутствующими симптомами являются лающий кашель, осиплость, грубый голос, небольшой подъем температуры тела и участие вспомогательной мускулатуры в процессе дыхания.
При термическом или химическом ожоге дыхательных путей возникает рефлекторный спазм (сужение) бронхов, вследствие чего человек не может сделать полноценный вдох.
Заболевания, при которых могут наблюдаться приступы удушья
Основной группой заболеваний, при которых возникают приступы удушья, являются болезни системы органов дыхания:
- бронхиальная астма,
- хроническая обструктивная болезнь легких (ХОБЛ),
- пневмоторакс (попадание воздуха в плевральную полость, вследствие чего легкое сжимается),
- опухоли органов средостения и дыхательных путей (гортани, трахеи, бронхов),
- острый стенозирующий ларинготрахеит, или ложный круп (характерен для детского дошкольного возраста),
- эпиглоттит (воспалительное заболевание надгортанника),
- рак легкого.
Среди других причин удушья выделяют следующие:
- тромбоэмболия легочной артерии (закупорка тромботическими массами сосуда, по которому кровь попадает в легкие. Тромбы чаще всего образуются в венах нижних конечностей, а когда отрываются, попадают в легочную артерию);
- отек легкого;
- черепно-мозговая травма;
- отек Квинке (аллергическая реакция);
- ожоги верхних дыхательных путей;
- эпилепсия;
- передозировка некоторых лекарственных и наркотических средств;
- панические атаки.
К каким врачам обращаться при возникновении приступов удушья
Прежде всего, в момент приступа удушья необходимо вызвать скорую медицинскую помощь.
Подбор основного лечения для профилактики дальнейших эпизодов удушья и одышки осуществляет
врач-терапевт
или
педиатр
. В зависимости от сопутствующих симптомов может потребоваться консультация узких специалистов, например,
кардиолога
, пульмонолога, врача-эндоскописта, аллерголога, токсиколога,
невролога
.
Диагностика и обследования при приступах удушья
В зависимости от сопутствующих симптомов могут быть назначены следующие обследования:
- клинический анализ крови;
Необходимо вызвать бригаду скорой медицинской помощи. Далее следует открыть окна и обеспечить больному приток свежего воздуха.
Если человек в момент начала приступа находился на улице и приступ начался из-за аллергической реакции (например, на пыльцу растений), нужно покинуть это место или перейти в помещение. Следует расстегнуть или снять стесняющую одежду (галстук, рубашку, бюстгальтер) — ничто не должно мешать процессу дыхания. По возможности необходимо, чтобы человек сел, уперся руками в сиденье или другой стул, постарался глубоко дышать. Если лечащим врачом было прописано лечение, следует использовать необходимые медикаменты.
Если пострадавший находится в бессознательном состоянии, следует повернуть его набок во избежание западения языка и аспирации рвотных масс.
При попадании инородного тела в дыхательные пути выполняется прием Геймлиха: нужно обхватить пострадавшего сзади и надавливать на область желудка кулаком. Вторую руку положить на кулак и сильно надавить снизу вверх (под грудную клетку).
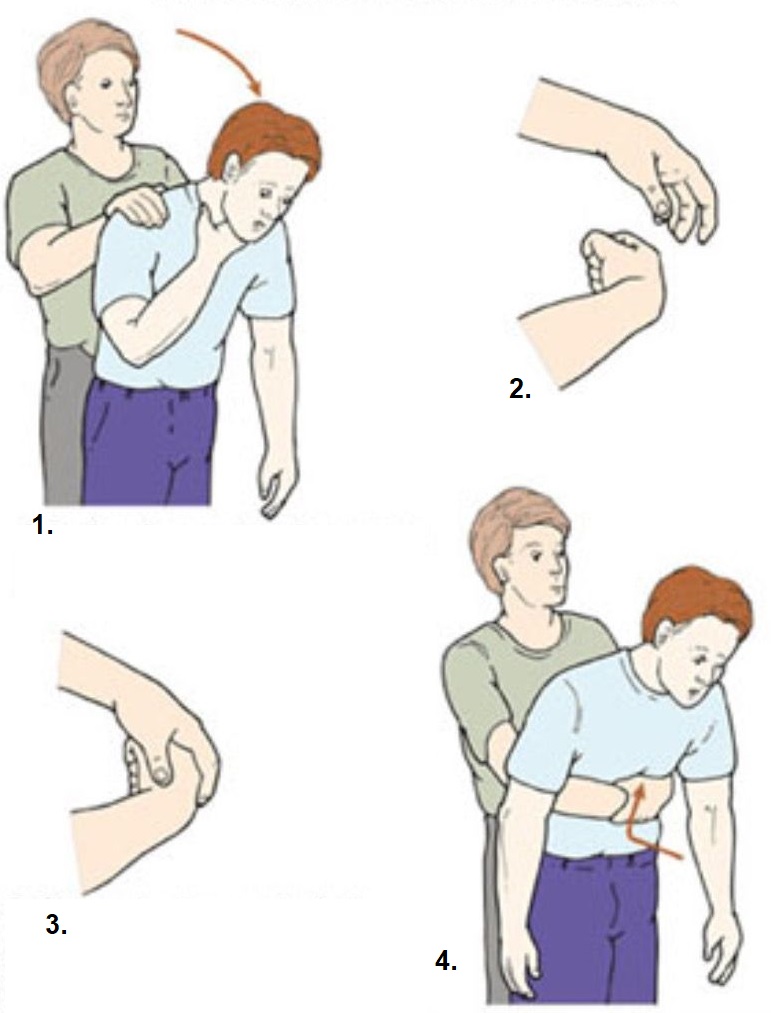 Прием Геймлиха
Прием Геймлиха
Если после принятых мер застрявший предмет не вышел, пострадавший потерял сознание, переходят к проведению сердечно-легочной реанимации до приезда скорой помощи. Компрессии могут способствовать выходу инородного тела, поэтому следует регулярно проверять ротовую полость.
Если ребенок подавился едой или мелким предметом и не может сделать вдох и откашляться самостоятельно, нужно положить ребенка на живот на свою руку, голова при этом должна находиться ниже туловища, и ребром ладони сделать пять похлопываний между лопатками. Важно придерживать голову ладонью для профилактики травм шеи.
 Помощь ребенку
Помощь ребенку
Второй вариант оказания помощи –взять ребенка за ножки, опустить вниз головой и похлопать между лопатками. Все производимые похлопывания должны быть не сильными, но резкими.
При приступе удушья важно не паниковать, быстро вызвать бригаду скорой помощи и эффективно оказать первую помощь.
Лечение приступов удушья
Удушье является симптомом многих заболеваний и состояний, поэтому в зависимости от причины его появления подходы к лечению существенно отличаются друг от друга.
Самостоятельный подбор медикаментов недопустим и опасен для здоровья.
При выявлении в ходе обследования тех или иных заболеваний специалист назначает соответствующее лечение. Так, при развитии отека легкого больного госпитализируют и проводят комплексное лечение, направленное на устранение причины возникновения отека и восстановление функций дыхания и кровообращения.
Для лечения бронхиальной астмы используется ступенчатая схема терапии, которая включает применение препаратов неотложной помощи – ингаляционных бета-адреномиметиков короткого действия, глюкокортикостероидов, а также препаратов основной (базовой) терапии – глюкокортикостероидов, бета-адреномиметиков длительного действия, м-холиноблокаторов. Схема лечения подбирается индивидуально врачом.
Для лечения ХОБЛ используют бронхорасширяющие препараты различных групп короткого и длительного действия.
Для лечения острого стенозирующего ларинготрахеита (ложного крупа) используются ингаляции глюкокортикостероидов.
При попадании инородного тела в дыхательные пути необходимо обратиться за медицинской помощью для его извлечения с помощью специальных методик и инструментов.
Источники:
- Думанский Ю.В., Кабанова Н.В. и соавт. Заболевания и поражения системы дыхания. Медицина неотложных состояний, журнал. № 3(42), 2022. С. 135-145.
- Клинические рекомендации «Бронхиальная астма». Разраб.: Российское респираторное общество, Российская ассоциация аллергологов и клинических иммунологов, Союз педиатров России. –2021.
- Клинические рекомендации «Хроническая обструктивная болезнь легких». Разраб.: Российское респираторное общество. – 2021.
- Клинические рекомендации «Острый обструктивный ларингит [круп] и эпиглоттит. Разраб.: Союз педиатров России, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии, Национальная медицинская ассоциация оториноларингологов. – 2021.
Вместо заключения
В настоящее время разработаны/разрабатываются методы селективного ингибирования HIF-1 и HIF-2; селективного ингибирования различных изоформ пролилгидроксилаз PHDs, за счет чего возможно активировать HIF-1 и HIF-2, причем также селективно; можно ингибировать фермент FIH-1и прочие участники пути регуляции кислород-зависимого пути деградации. При желании и достаточной фантазии можно пробовать воздействовать на кислород-независимые пути.
Все это, несомненно, должно найти и, я уверен, найдет применение в практической медицине. Но это потребует крайней обдуманности, многостадийного контроля и досконального изучения. Чем далеко ходить, лучше приведу пример.
Не так давно, в начале-середине 2000-х годов, наблюдался некоторый бум: для многих типов онкологических заболеваний была показана сверхэкспрессия HIF-1α, что вполне соответствовало понятиям об опухолевой биологии: быстрорастущая опухолевая масса в условиях жесткой гипоксии переходит на гликолитический анаэробный тип метаболизма [23], при этом активно секретируя вокруг себя многочисленные факторы роста сосудов, факторы инвазии и т.д. Что делать? Подавим экспрессию HIF-1α и дело в шляпе! Не тут-то было — реальность оказалась сложнее и запутанней.
Так, например, при применении siRNA против HIF-1α на культуре пигментного эпителия сетчатки и эндотелия сосудов, наблюдалось вполне закономерное снижение секреции таких ангиогенных факторов как VEGF, TGF-β (это очень хорошо), но росла секреция IL-8, мощного хемокина с ярко выраженными ангиогенными свойствами (это очень плохо)
[24]. Позднее, группой профессора Лобода был раскрыт механизм — дело в том, что HIF-1 подавляет экспрессию IL-8, а HIF-2 — активирует. Подавляя HIF-1 в клетках, исследователи добивались реципрокной активации HIF-2 и экспрессии IL-8 [25]. Такая неоднозначная выходила терапия.
Также нужно быть аккуратными с иммунной системой. Системное подавление HIF-1 при аутоиммунных заболеваниях, возможно, и приведет к снижению популяции Th17 и росту числа Treg, что теоретически способно облегчить течение заболевания, но также способно привести к искусственному комбинированному иммунодефициту за счет дисфункции M1-макрофагов, нейтрофилов, Th1, Th2, Th17 и СD8 T лимфоцитов.
Это, конечно, спекуляции, но все же.
- Alexander C.S. (1972). Cobalt-beer cardiomyopathy: a clinical and pathologic study of twenty-eight cases. Am. J. Med. 53 (4), 395–417;
- Gregg L. Semenza, M.D., Ph.D.Сайт The Johns Hopkins Hospital;
- Satkoski A.M., Beukes N.J., Li W., Beard B.L., Johnson C.M. (2022). A redox-stratified ocean 3.2 billion years ago. Earth Planet. Sci. Lett. 430, 43–53;
- Scotti J.S., Leung I.K., Ge W., Bentley M.A., Paps J., Kramer H.B. et al. (2022). Human oxygen sensing may have origins in prokaryotic elongation factor Tu prolyl-hydroxylation. Proc. Natl. Acad. Sci. USA.111 (37), 13331–13336;
- Loenarz C., Coleman M.L., Boleininger A., Schierwater B., Holland P. W., Ratcliffe P.J., Schofield C.J. (2022). The hypoxia‐inducible transcription factor pathway regulates oxygen sensing in the simplest animal, Trichoplax adhaerens. EMBO Rep. 12 (1), 63–70;
- Prabhakar N.R. and Semenza G.L. (2022). Oxygen sensing and homeostasis. Physiology. 30 (5), 340–348;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- SUMO: японская борьба или уникальная посттрансляционная модификация?;
- Agani F. and Jiang B.H. (2022). Oxygen-independent regulation of HIF-1: novel involvement of PI3K/AKT/mTOR pathway in cancer. Curr. Cancer. Drug Targets. 13 (3), 245–251;
- Была клетка простая, стала стволовая;
- Ствол и ветки: стволовые клетки;
- Koh M.Y. and Powis G. (2022). Passing the baton: the HIF switch. Trends Biochem. Sci. 37 (9), 364–372;
- Hu Y.Y., Fu L.A., Li S.Z., Chen Y., Li J.C., Han J. et al. (2022). Hif-1α and Hif-2α differentially regulate Notch signaling through competitive interaction with the intracellular domain of Notch receptors in glioma stem cells. Cancer Lett. 349 (1), 67–76;
- Villa J.C., Chiu D., Brandes A.H., Escorcia F.E., Villa C.H., Maguire W.F. et al. M. (2022). Nontranscriptional role of Hif-1α in activation of γ-secretase and notch signaling in breast cancer. Cell Rep. 8 (4), 1077–1092;
- Gluhanyuk E., Makarevich P., Gallinger J., Dergilev K., Beloglazova I., Parfyonova Ye. (2022). Diverse modulation of endothelial chemokine production by VEGF165 and HGF via NFkB and HIF-2. Материалы конференции Hypoxia: From Basic Mechanisms to Therapeutics;
- Palazon A., Goldrath A.W., Nizet V., Johnson R.S. (2022). HIF transcription factors, inflammation, and immunity. Immunity. 41 (4), 518–528;
- Phan A.T. and Goldrath A.W. (2022). Hypoxia-inducible factors regulate T cell metabolism and function. Mol. Immunol. doi: 10.1016/j.molimm.2022.08.004;
- Hsiao H.W., Hsu T.S., Liu W.H., Hsieh W.C., Chou T.F., Wu Y.J. et al. (2022). Deltex1 antagonizes HIF-1α and sustains the stability of regulatory T cells in vivo. Nat. Commun. 6, 6353;
- Yao Y., Vent-Schmidt J., McGeough M.D., Wong M., Hoffman H.M., Steiner T.S., Levings M.K. (2022). Tr1 cells, but not Foxp3 regulatory T cells, suppress NLRP3 inflammasome activation via an IL-10—dependent mechanism. J. Immunol. 195 (2), 488–497;
- Netea M.G., Latz E., Mills K.H., O’Neill L.A. (2022). Innate immune memory: a paradigm shift in understanding host defense. Nat. Immunol. 16 (7), 675–679;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Thomas A., Tambuwala M.M., McNicholas W.T., Roche H.M., Taylor C.T., Pepin J.L. et al. (2022). Chronic intermittent hypoxia contributes to pro-inflammatory macrophage alteration in visceral adipose tissue of lean and obese mice. Am. J. Respir. Crit. Care Med. 191, A2691;
- Страшней клешней на свете нет…;
- Forooghian F. and Das B. (2007). Anti-angiogenic effects of ribonucleic acid interference targeting vascular endothelial growth factor and hypoxia-inducible factor-1alpha. Am. J. Ophthalmol. 144 (5), 761–768;
- Loboda A., Jozkowicz A., Dulak J. (2022). HIF-1 versus HIF-2 — Is one more important than the other?Vascul. Pharmacol. 56 (5), 245–251..

