- Взаимодействие хлорбензола с щелочами
- 1. Взаимодействие с раствором щелочей
- 2. Взаимодействие с металлами (щелочными и щелочноземельными)
- Кумольный способ
- Реакции фенола по бензольному кольцу
- 1. Галогенирование
- 2. Нитрование
- Замещение сульфогруппы в бензол-сульфокислоте
- Кумольный способ
- Взаимодействие с хлоридом железа (III)
- Гидрирование (восстановление) фенола
- V. качественная реакция с хлоридом железа (iii)
- Vi. реакции окисления
- Атом кислорода в молекуле фенола образует
- По числу гидроксильных групп:
- Простейшие одноатомные фенолы
- Физические свойства
- Химические свойства фенолов
Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода. |
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например,при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Кумольный способ
Наряду с фенолом образуется имеющий важное практическое значение кетон — ацетон.
Фенол и ацетон разделяют путем ректификации (фракционной перегонки).
Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
V. качественная реакция с хлоридом железа (iii)
Одноатомные фенолы FeCl3 (р-р) → Сине-фиолетовая окраска, исчезающая при подкислении.
Многоатомные фенолы FeCl3 (р-р) → Окраска различных оттенков.
Vi. реакции окисления
При окислении фенола кислородом воздуха образуется гидрохинон

Атом кислорода в молекуле фенола образует
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Простейшие одноатомные фенолы
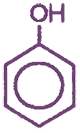
С6Н5ОН — фенол (гидроксибензол), тривиальное название — карболовая кислота.
Физические свойства
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом. Фенолы малорастворимы в воде, но хорошо растворяются в органических растворителях. Являются токсичными веществами, вызывают ожоги кожи.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода. Отличия:
|
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.

