- Горение и виды горючих веществ
- История открытия
- Как найти объемные отношения газов в смеси
- Коэффициенты для пересчета объемов газа из одних условий в другие
- Нахождение в природе
- Получение кислорода в лаборатории
- Применение кислорода в сварке
- Примеры решения задач
- Производство кислорода из воздуха
- Распространенность оксигена в природе
- Расчет объема газообразного кислорода в баллоне
- Свойства
- Свойства и применение кислорода
- Строение и физические свойства простых веществ
- Требования безопасности
- Химические свойства
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.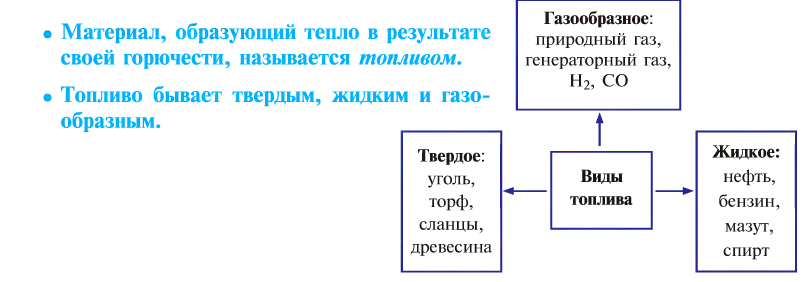
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO →ot 2Hg O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
Закон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
2H2 O2=2H2O
В процессе, записанном в виде уравнения 3Н2 N2=2NH3, объемы азота и водорода, между которыми протекает реакция, и объем образовавшегося аммиака связаны между собой, что можно выразить с помощью следующего соотношения:
V(Н2):V(N2):V(NH3)=3:2:1
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
Согласно первому следствию из закона Авогадро, при одинаковых условиях 1 моль любого газа занимает одинаковый объем. Объем газа количеством 1 моль в нормальных условиях носит название молярного объема и обозначается Vm. Таким образом:
n = V : Vm,
где V — объем газа,
n — количество газа.
Выразить молярный объем газов можно в л/моль:
Vm = 22,4 л/моль.
Коэффициенты для пересчета объемов газа из одних условий в другие
| Температура и даление газа | 0 °С и 760 мм рт. ст. | 15 °С и 760 мм рт. ст. | 20 °С и 760 мм рт. ст. | 15 °С (288,16 °К) и 1 бар |
| 0 °С и 760 мм рт. ст. (норм. условия) | 1 | 1,055 | 1,073 | 1,069 |
| 15 °С и 760 мм рт. ст. (в зар. литературе) | 0,948 | 1 | 1,019 | 1,013 |
| 20 °С и 760 мм рт. ст. (ст. условия) | 0,932 | 0,983 | 1 | 0,966 |
| 15 °С (288,16 °К) и 1 бар (СИ) | 0,936 | 0,987 | 1,003 | 1 |
Для приведения объемов газа к 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²), а также к 20 °С (293,16 °К) и 760 мм рт. ст. (1,033 кгс/см²) могут быть применены следующие формулы:
где V0 °С и 760 мм рт. ст. — объем газа при 0 °С и 760 мм рт. ст., м³;V20° С и 760 мм рт. ст. — объем газа при 20 °С и 760 мм рт. ст., м³;VP — объем газа в рабочих условиях, м³;р — абсолютное давление газа в рабочих условиях, мм рт. ст.;Т — абсолютная температура газа в рабочих условиях, °К.
Пересчет объемов газа, приведенных к 0 °С и 760 мм рт. ст., а также к 20 °С и 760 мм рт. ст., в объемы при других (рабочих) условиях можно производить по формулам:
Любой газ способен расширяться. Следовательно, знание объема, который занимает газ, недостаточно для определения его массы, так как в любом объеме, целиком заполненном газом, его масса может быть различной.
Масса — это мера вещества какого-либо тела (жидкости, газа) в состоянии покоя; скалярная величина, характеризующая инерционные и гравитационные свойства тела. Единицы массы в СИ — килограмм (кг).
Плотность, или масса единицы объема, обозначаемая буквой p, — это отношение массы тела m, кг, к его объему, V, м³:
p = m/V
или с учетом химической формулы газа:
p = M/VМ = M/22,4,
где M — молекулярная масса,VМ — молярный объем.
Единица плотности в СИ — килограмм на кубический метр (кг/м³).
Зная состав газовой смеси и плотность ее компонентов, определяем по правилу смешения среднюю плотность смеси:
pсм = (p1V1 p2V2 … pnVn)/100,
где p1, p2, …, pn — плотность компонентов газового топлива, кг/м³;V1, V2, …, Vn — содержание компонента, об. %.
Величину, обратную плотности, называют удельным, или массовым, объемом (ν) и измеряют в кубических метрах на килограмм (м³/кг).
Как правило, на практике, чтобы показать, на сколько 1 м³ газа легче или тяжелее 1 м³ воздуха, используют понятие относительная плотность d, которая представляет собой отношение плотности газа к плотности воздуха:
d = p/1,293
d = M/(22,4×1,293).
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган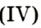
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 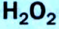 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган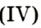
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 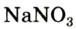

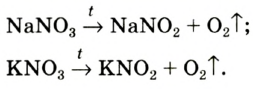
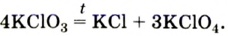
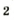 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: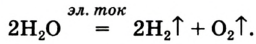
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки.
В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Примеры решения задач
1 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
1.1Параметры состояния тела
Примеры решения задач
1.Давлениевоздухапортутномубарометруравно770мм при0°С.Выразитьэто
давление в барах и Па.
Решение
1мм рт. ст. = 133,3 Па, 770 мм рт. ст. =102700 Па = 1,027 бар.
2. Определить абсолютное давление пара в котле, если манометрпоказывает Р= 1,3
бар, а атмосферное давление по ртутному барометру составляет 680 мм при t = 25° С.
Решение
Показание барометра получено при температуреt = 25°С. Это показание
необходимо привести к 0 ºС по уравнению (5):
Р
о
= Р
t
(1 — 0,000172 t) = 680 · 0,9957 = 677,1 мм рт. ст.
Абсолютное давление пара в котле по формуле (3) равно
Р
абс
= 130000 677,1 * 133,3 = 0,22 МПа.
3.ДавлениевпаровомкотлеР=0,4барприбарометрическомдавлении725ммрт.
ст.Чему будетравно избыточное давлениев котле, если показаниебарометра повысится до
785 ммрт.ст.,асостояниепаравкотлеостанетсяпрежним?Барометрическоедавление
приведено к 0 °С.
Решение
Абсолютное давление в котле
Р
абс
= 400000 725 * 133,3 = 136642 Па
Избыточное давление при показании барометра 785 мм рт. ст.
Р
изб
= 136642 – 785 * 133,3 = 32000 Па.
4. Ртутный вакуумметр, присоединенный к сосуду, показывает разрежение 420 мм при
температуре ртути в вакуумметре t = 20 °С. Давление атмосферы по ртутному барометру 768
мм при температуре t = 18 °С. Определить абсолютное давление в сосуде.
Решение
Приводимпоказаниявакуумметраибарометрактемпературертути0°С(уравнение
5):
Р
вак
= 420 (1—0,000172 * 20) = 418,5 мм рт. ст.
Р
атм
= 768 (1—0,000172 * 18) = 765,6 мм рт. ст.
Абсолютное давление в сосуде по формуле (4)
Рабс = 765,6 – 418,5 = 347,1 мм рт. ст. = 46,3 кПа.
5.Водянойпарперегретна45°С.Чемусоответствуетэтотперегревпотермометру
Фаренгейта?
Решение
Припереводеразноститемператур,выраженнойградусамишкалыЦельсия,в
градусыФаренгейтаинаоборотнадоисходитьтолькоизценыделениятогоидругого
термометров. Поэтому формула (8) принимает следующий вид:
Производство кислорода из воздуха
В промышленности технически чистый кислород получают двумя способами:
- из воздуха – методом глубоко охлаждения;
- из воды – путем электролиза.
Способ производства кислорода из воздуха более экономичный: на 1 м3 кислорода расходуется 0,5–1,6 кВт/ч электроэнергии. Чтобы получить 1 м3 кислорода путем электролиза воды требуется 10–21 кВт/ч.
Атмосферный осушенный воздух представляет собой смесь, содержащую 20,93 % кислорода и 78,03 % азота, остальное – инертные газы, углекислый газ и пр. Содержание водяных паров в воздухе может изменяться в зависимости от температуры и степени их насыщения.
Для получения технически чистого кислорода воздух подвергают глубокому охлаждению и сжижают (температура кипения жидкого воздуха при нормальном атмосферном давлении –194,5 °С). Полученный жидкий воздух подвергают дробной перегонке или ректификации в ректификационных колоннах.
Воздух, засасываемый многоступенчатым компрессором, проходит сначала через воздушный фильтр, где очищается от пыли, затем проходит последовательно ступени компрессора. За каждой ступенью компрессора давление воздуха возрастает и достигает 5–22 МПа в зависимости от системы установки и стадии производства.
Сжатый воздух из компрессора проходит через осушительную батарею из баллонов, заполненных кусками едкого натра, поглощающего влагу и остатки углекислоты. Затем сжатый воздух поступает в кислородный аппарат, где происходит охлаждение, сжижение и ректификация (разделением на кислород и азот). Газообразный азот применяют как защитный газ для сварки меди.
Кислород направляется в газгольдер и подается для наполнения кислородных баллонов под давлением до 16,5 МПа; масса 1 м3 кислорода при нормальном атмосферном давлении (0,1 МПа) и 0 °С составляет 1,43 кг, при 20 °С – 1,31 кг; масса 1 л жидкого кислорода равна 1,13 кг; в результате испарения образуется 0,79 м3 газообразного кислорода (при 0 °С и нормальном атмосферном давлении);
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 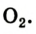
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха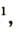
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 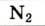 | 78,09 | 75,51 |
| Кислород | 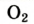 | 20,95 | 23,15 |
| Аргон | 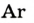 | 0,93 | 1,28 |
| углекислый газ | 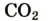 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 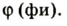
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 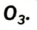 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 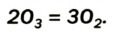
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Расчет объема газообразного кислорода в баллоне
Объем газообразного кислорода в баллоне (V) в кубических метрах при нормальных условиях вычисляют по формуле:
где
| Vб | — | вместимость баллона, дм3. В расчетах принимают среднюю статистическую величину вместимости баллонов не менее чем из 100 шт.; |
| K1 | — | коэффициент для определения объема кислорода в баллоне при нормальных условиях, вычисляемый по формуле: |
где
| P | — | давление газа в баллоне, измеренное манометром, кгс/см2; |
| 0,968 | — | коэффициент для пересчета технических атмосфер (кгс/см2) в физические; |
| t | — | температура газа в баллоне, °С; |
| Z | — | коэффициент сжигаемости кислорода при температуре t. |
Значения коэффициента K1 приведены в таблице 3.
| Температура газа в баллоне, °С | Значение коэффициента K1 при избыточном давлении, МПа (кгс/см2) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 13,7 (140) | 14,2 (145) | 14,7 (150) | 15,2 (155) | 15,7 (160) | 16,2 (165) | 16,7 (170) | 17,2 (175) | 17,7 (180) | 18,1 (185) | 18,6 (190) | 19,1 (195) | 19,6 (200) | 20,1 (205) | 20,6 (210) | |
| -50 | 0,232 | 0,242 | 0,251 | 0,260 | 0,269 | 0,278 | 0,286 | 0,296 | 0,303 | 0,311 | 0,319 | 0,327 | 0,335 | 0,342 | 0,349 |
| -40 | 0,212 | 0,221 | 0,229 | 0,236 | 0,245 | 0,253 | 0,260 | 0,269 | 0,275 | 0,284 | 0,290 | 0,298 | 0,305 | 0,312 | 0,319 |
| -35 | 0,203 | 0,211 | 0,219 | 0,226 | 0,234 | 0,242 | 0,249 | 0,257 | 0,264 | 0,272 | 0,278 | 0,286 | 0,293 | 0,299 | 0,306 |
| -30 | 0,195 | 0,202 | 0,211 | 0,217 | 0,225 | 0,232 | 0,239 | 0,248 | 0,253 | 0,261 | 0,267 | 0,274 | 0,281 | 0,288 | 0,294 |
| -25 | 0,188 | 0,195 | 0,202 | 0,209 | 0,217 | 0,223 | 0,230 | 0,238 | 0,243 | 0,251 | 0,257 | 0,264 | 0,270 | 0,277 | 0,283 |
| -20 | 0,182 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,229 | 0,235 | 0,242 | 0,248 | 0,255 | 0,261 | 0,267 | 0,273 |
| -15 | 0,176 | 0,182 | 0,189 | 0,196 | 0,202 | 0,208 | 0,215 | 0,221 | 0,227 | 0,234 | 0,240 | 0,246 | 0,252 | 0,258 | 0,263 |
| -10 | 0,171 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,214 | 0,220 | 0,226 | 0,232 | 0,238 | 0,244 | 0,250 | 0,255 |
| -5 | 0,165 | 0,172 | 0,178 | 0,184 | 0,190 | 0,195 | 0,202 | 0,207 | 0,213 | 0,219 | 0,225 | 0,231 | 0,236 | 0,242 | 0,247 |
| 0 | 0,161 | 0,167 | 0,172 | 0,179 | 0,184 | 0,190 | 0,196 | 0,201 | 0,207 | 0,213 | 0,219 | 0,224 | 0,229 | 0,235 | 0,240 |
| 5 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,196 | 0,201 | 0,207 | 0,212 | 0,217 | 0,223 | 0,228 | 0,233 |
| 10 | 0,153 | 0,158 | 0,163 | 0,169 | 0,174 | 0,180 | 0,185 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,217 | 0,222 | 0,227 |
| 15 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,180 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,216 | 0,221 |
| 20 | 0,145 | 0,150 | 0,156 | 0,160 | 0,166 | 0,171 | 0,176 | 0,181 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 | 0,215 |
| 25 | 0,142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,177 | 0,182 | 0,186 | 0,191 | 0,196 | 0,201 | 0,206 | 0,210 |
| 30 | 0,139 | 0,143 | 0,148 | 0,153 | 0,158 | 0,163 | 0,168 | 0,173 | 0,177 | 0,182 | 0,187 | 0,192 | 0,196 | 0,201 | 0,206 |
| 35 | 0,136 | 0,140 | 0,145 | 0,150 | 0,154 | 0,159 | 0,164 | 0,169 | 0,173 | 0,178 | 0,182 | 0,187 | 0,192 | 0,196 | 0,201 |
| 40 | 0,133 | 0,137 | 0,142 | 0,147 | 0,151 | 0,156 | 0,160 | 0,165 | 0,170 | 0,174 | 0,178 | 0,183 | 0,188 | 0,192 | 0,196 |
| 50 | 0,127 | 0,132 | 0,136 | 0,141 | 0,145 | 0,149 | 0,154 | 0,158 | 0,163 | 0,167 | 0,171 | 0,175 | 0,180 | 0,184 | 0,188 |
Свойства
Основные свойства кислорода приведены в таблице 1.
| Показатель | Данные показателя |
|---|---|
| Формула | О2 |
| Молекулярная масса | 31,9988 |
| Плотность (при 0 °С и давлении 760 мм рт. ст.), кг/м3 | 1,43 |
| Плотность (при 20 °С и давлении 760 мм рт. ст.), кг/м3 | 1,33 |
| Температура критическая, °С | -118,8 |
| Давление критическое, кгс/см2 | 51,35 |
| Температура кипения (при 760 мм рт. ст.), °С | -182,97 |
| Температура плавления (затвердевания) (при 760 мм рт. ст.), °С | -218,4 |
| Масса 1 л жидкости кислорода при -182,97 °С и 760 мм рт. ст., кг | 1,13 |
| Количество газообразного кислорода, получающегося из 1 л жидкого, л | 850 |
Массовая концентрация механических примесей в медицинском кислороде, предназначенном для авиации, – не более 0,001 г/м3 с размером частиц не более 0,1 мм при 15 °С и 101, 3 кПа (760 мм рт. ст.).
По физико-химическим показателям газообразный технический и медицинский кислород должен соответствовать нормам, указанным в таблице 2.
| Наименование показателя | Норма для марок | ||
|---|---|---|---|
| Технический кислород | Медицинский кислород | ||
| Первый сорт | Второй сорт | ||
| Объемная доля кислорода, %, не менее | 99,7 | 99,5 | 99,5 |
| Объемная доля водяных паров, %, не более | 0,007 | 0,009 | 0,009 |
| Объемная доля водорода, %, не более | 0,3 | 0,5 | — |
| Объемная доля двуокиси углерода, %, не более | Не нормируется | 0,01 | |
| Запах | Не нормируется | Отсутствие | |
1. По согласованию с потребителем допускается в медицинском кислороде объемная доля кислорода не менее 99,2 %.
2. Медицинский кислород, предназначенный для авиации, должен выпускаться с объемной долей водяных паров не более 0,0007 %.
3. В техническом кислороде 2-го сорта, вырабатываемом на установках высокого, среднего и двух давлений, оснащенных щелочными декарбонизаторами для очистки воздуха от двуокиси углерода, а также на установках типа СКДС-70М допускается объемная доля кислорода не менее 99,2 %.
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 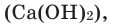
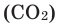
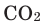
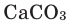
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (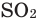
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (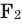
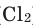
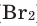
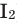
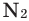
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (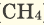
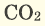
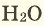
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 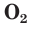 озона
озона 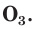
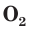
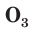
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 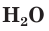
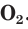
Требования безопасности
Кислород не токсичен, не горюч и не взрывоопасен, однако, являясь сильным окислителем, резко увеличивает способность других материалов к горению. Поэтому для работы в контакте с кислородом могут использоваться только разрешенные для этого материалы.
При соприкосновении сжатого газообразного кислорода с органическими веществами, маслами, жирами, угольной пылью, горючими пластмассами, даже в ничтожном количестве, может произойти их самовоспламенение в результате выделения теплоты при быстром сжатии кислорода, трении и ударе твердых частиц о металл, а также электростатического искрового разряда.
Поэтому при использовании кислорода необходимо тщательно следить за тем, чтобы он не находился в контакте с легковоспламеняющимися и горючими веществами. В кислороде могут загораться также углеродистые стали при достаточном количестве теплоты в месте контакта и небольшой массе металла (например, при трении тонких платин о массивные части машин, наличии стружки, частиц окалины или железного порошка).
Для предотвращения аварий всю кислородную аппаратуру, кислородопроводы и баллоны подвергают тщательному обезжириванию. Необходимо исключить возможность попадания и накопления масел и жиров на поверхности деталей, работающих в среде кислорода.
Цилиндры компрессоров, накачивающих кислород в баллоны, смазывают не маслом, а дистиллированной водой, в которую иногда добавляют 10 % глицерина. Кроме того, в кислородных компрессорах применяют поршневые кольца из графита и других антифрикционных материалов, работающие без смазки и не загрязняющие кислород органическими примесями.
Также опасны пропитанные жидким кислородом пористые горячие вещества (уголь, сажа, войлок, пакля, ветошь, вата и др.), которые в этом случае становятся взрывчатыми. Одежда и волосы, будучи насыщенны кислородом, легко загораются. Смеси кислорода с горючими газами, жидкостями и их парами взрывоопасны при определенных соотношениях кислорода и горючего в смеси.
Накопление кислорода в воздухе помещений создает опасность возникновения пожаров. Объемная доля кислорода в рабочих помещениях не должна превышать 23 %. В помещениях, где возможно увеличение объемной доли кислорода, должно быть ограничено пребывание людей и не должны находиться легковоспламеняющиеся материалы. Эти помещения должны быть оборудованы средствами контроля воздушной среды и вытяжной вентиляцией для проветривания.
Перед проведением ремонтных работ или освидетельствованием трубопроводов, баллонов, стационарных и передвижных реципиентов или другого оборудования, используемого для хранения и транспортирования газообразного кислорода, необходимо продуть все внутренние объемы воздухом. Разрешается начинать работы только после снижения объемной доли кислорода во внутренних объемах оборудования до 23 %.
После пребывания в среде, обогащенной кислородом, не разрешается курить, использовать открытый огонь и приближаться к огню. Одежда должна быть проветрена в течение 30 мин.
Баллоны, автореципиенты и трубопроводы, предназначенные для транспортирования технического и медицинского кислорода, запрещается использовать для хранения и транспортирования других газов, а также запрещается производить какие-либо операции, которые могут загрязнить их внутреннюю поверхность и ухудшить физико-химические показатели продукции.
При погрузке, разгрузке, транспортировании и хранении баллонов должны применяться меры, предотвращающие падение, удары друг о друга, повреждение и загрязнение баллонов маслом. Баллоны должны быть предохранены от атмосферных осадков и нагревания солнечными лучами и другими источниками тепла.
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li O2 → 2Li2O
- 2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2 → 12CO2 6H2O
- CH3CH2OH 3O2 → 2CO2 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2 → CH3COOH H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2 → Na2O2
- 2BaO O2 → 2BaO2
- H2 O2 → H2O2
- Na2O2 O2 → 2NaO2
- K O2 → KO2
- 3KOH 3O3 → 2KO3 KOH ∗ H2O 2O2↑
- PtF6 O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.

