Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом воздуха.
Широко используется кислород в медицине.
При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»).
Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях.
Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.
Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.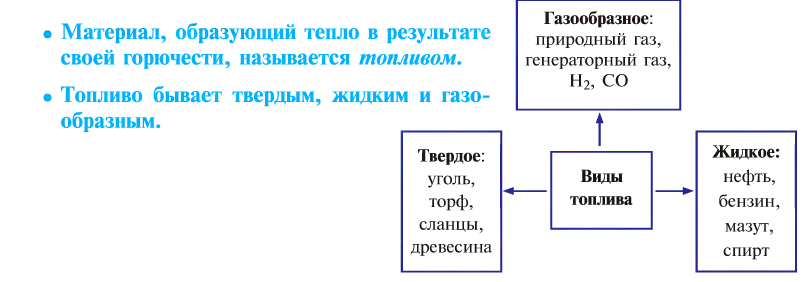
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
История открытия
Официально считается[2][3], что кислород был открыт английским химиком Джозефом Пристли1 августа1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»).
О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле.
Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Получение
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при t = 100 °C):
На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Примечания
- ↑Дикислород // Большая Энциклопедия Нефти Газа
- ↑J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 4,04,14,2Inorganic Crystal Structure Database
- ↑Margaret-Jane Crawford и Thomas M. Klapötke The trifluorooxonium cation, OF3 // Journal of Fluorine Chemistry. — 1999. — Т. 99. — С. 151-156.
- ↑Curie P., Curie M. (1899). «Effets chimiques produits par les rayons de Becquerel«. Comptes rendus de l’Académie des Sciences129: 823-825.
- ↑Радиационная химия // Энциклопедический словарь юного химика. 2-е изд.. — М.: 1990. — С. 200.
- ↑Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28-33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4. (см. ISBN )
- ↑Food-Info.net : E-numbers : E948 : Oxygen.
Ракетное топливо
В качестве окислителя для ракетноготоплива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
Медицинский кислород хранится в металлических газовых баллонах высокого давления (для сжатых или сжиженных газов) голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки.
Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха.
Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометруредуктора) умножают на величину ёмкости баллона в литрах.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавкиE948[9], как пропеллент и упаковочный газ.
Свойства и применение кислорода
Цель урока: изучить физические и химические
свойства кислорода, дать общее понятие об
оксидах, реакциях горения; рассмотреть
практическую значимость и применение; доказать,
что кислород — один из важнейших элементов на
Земле.
Задачи урока:
Образовательные
:
- Расширить представления обучающихся о
кислороде. - Познакомить со свойствами и применением
кислорода. - Совершенствовать умения составлять уравнения
химических реакций.
Воспитательные
:
- Формировать умения работать в парах у каждого
обучающегося, считаться с мнением соседа и
отстаивать свою точку зрения корректно, выполняя
упражнения. - Воспитывать бережное отношение к своему
здоровью, окружающей природе, учить понимать
прекрасное, ценить произведения искусства.
Развивающие
:
- Способствовать продолжению развития
устойчивого интереса к химической науке и
практике. - Совершенствовать навыки самостоятельной
работы, развивать умения наблюдать,
формулировать высказывания. - Способствовать развитию исследовательских
навыков, соблюдая правила техники безопасности. - Совершенствовать умения обобщать и делать
выводы.
Планируемые результаты:
личностные: готовность и способность
учащихся к саморазвитию, самоопределению;
ответственное отношение к учению; способность
ставить цели и строить жизненные планы;
формирование коммуникативной культуры, ценности
здорового и безопасного образа жизни;
планировать пути её достижения, выбирая более
рациональные способы решения данной проблемы;
учиться корректировать свои действия в связи с
изменением создавшейся ситуации; уметь
создавать, применять и преобразовывать знаки и
символы, модели и схемы для решения учебных и
познавательных задач; уметь осознанно
использовать речевые средства в соответствии с
задачей коммуникации для выражения своих мыслей
и потребностей; уметь организовывать совместную
работу со сверстниками в парах; уметь находить
информацию в различных источниках; владеть
навыками самоконтроля, самооценки;
- знать: основные химические понятия
“катализаторы”, “оксиды”, “реакции горения”,
“реакции окисления”; физические и химические
свойства кислорода; области применения
кислорода. - уметь: отличить кислород от других газов;
составлять уравнения реакций горения веществ в
кислороде; записывать химические формулы
оксидов и давать им названия; объяснять, как
происходит круговорот кислорода в природе.
Тип урока: урок формирования умений и навыков.
Форма работы: фронтальная,
групповая,
работа в парах, игровая.
Методы обучения: словесный,
частично-поисковый,
наглядный, демонстрационный, интерактивный.
Приемы обучения
: постановка проблемных
вопросов.
Оборудование:
компьютер, проектор,
презентация “Свойства и применение кислорода.
Круговорот кислорода в природе”, колбы, пинцет,
ложки для сжигания веществ, спиртовка.
Реактивы:
уголь, сера, красный фосфор,
железная пластина, вода, известковая вода.
ХОД УРОКА
І. Организационный момент. (1 мин.)
(Слайд № 1)
Учитель:
Добрый день! Прошу
всех садиться. Тема сегодняшнего урока
“Свойства и применение кислорода”.
(Слайд № 2)
Мы с вами рассмотрим физические и
химические свойства кислорода, сформулируем
общие понятия об оксидах, реакциях горения,
окисления; ознакомимся с практической
значимостью и применением кислорода; а также
докажем, что кислород — один из важнейших
элементов на Земле.
ІІ. Актуализация знаний. (7 мин.).
Работа с карточками.
От 2 до 4 обучающихся
получают задание на карточках и выполняют его у
доски.
(Слайд № 3) Фронтальный опрос “А ну-ка,
химики”.
Учитель:
Но перед тем как приступить к
изучению новой темы, вам следует ответить на
следующие вопросы:
Химический знак кислорода?
Ответ: О
Относительная атомная масса кислорода?
Ответ:
16.
Химическая формула кислорода?
Ответ: О2.
Относительная молекулярная масса кислорода?
Ответ:
32.
В соединениях кислород обычно какой
валентности?
Ответ: II.
Расскажите о нахождении кислорода в природе.
Ответ:
Кислород — самый распространенный химический
элемент в земной коре. Кислород — самый
распространенный на Земле элемент, на его долю
приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное
количествосвязанного кислорода — 85,5% (по
массе), в атмосфере содержание свободного
кислорода составляет 21% по объёму и 23% по массе.
Более 1500 соединений земной коры в своем составе
содержат кислород. Кислород входит в состав
многих органических веществ и присутствует во
всех живых клетках. По числу атомов в живых
клетках он составляет 20,9%, по массовой доле —
около 65 %.
Перечислите способы получения кислорода в
лаборатории?
Ответ:В лаборатории
кислород получают следующими способами:
1) Разложение перманганата калия. 2KMnO
4 =
K2MnO4 MnO2 O2![]()
2) Разложение перекиси водорода. 2H
2O2
= 2H2O O2![]()
3) Разложение бертолетовой соли. 2KClO
3 =
2KCl 3O2![]()
8. Перечислите способы получения кислорода в
промышленности.
Ответ: В промышленности
кислород получают:
1) Электролиз воды. 2H
2O = 2H2 O2![]()
2) Из воздуха. ВОЗДУХ давление, -183
oC=O2
(голубая жидкость).
В настоящее время в промышленности кислород
получают из воздуха. В лабораториях небольшие
количества кислорода можно получать нагреванием
перманганата калия (марганцовка) KMnO
4.
Кислород мало растворим в воде и тяжелее воздуха,
поэтому его можно получать двумя способами:
(Слайд № 4).9. Установите соответствие
между способом получения кислорода и уравнением
химической реакцией. Работа в парах.
Ответ: А-4; Б-2; В-1; Г-5; Д-3.
10. Что называют катализаторами? Где эти
вещества применяются?
Ответ: Вещества,
которые ускоряют химические реакции, но сами при
этом не расходуются, называют катализаторами.
Катализаторы широко применяют в химической
промышленности. С их помощью удается повысить
производительность химических процессов,
снизить себестоимость выпускаемой продукции и
более полно использовать сырье.
(Слайд № 5). На какой диаграмме распределение
массовых долей элементов отвечает
количественному составу (NH4)3PO4?
Ответ:
4.

ІІІ. Изучение нового материала. (12 мин.)
(Слайд № 6) Учитель:
Физические свойства.
Кислород
— бесцветный газ, без вкуса и запаха, относительно
малорастворим в воде (в 100 объемах воды при
температуре 20?С растворяется 3,1 объема
кислорода). Кислород немного тяжелее воздуха: 1л
кислорода при нормальных условиях весит 1,43 г, а 1л
воздуха — 1,29г. (Нормальные условия — сокращенно:
н.у. — температура 0
o
С и давление 760 мм.рт.ст.,
или 1 атм.
![]()
0,1 МПа). При
давлении 760 мм.рт.ст. и температуре -183
o
С
кислород сжижается, а при снижении температуры
до -218,8
o
С затвердевает.
(Слайд № 7)
Химические свойства.Техника
безопасности (провести инструктаж!)
Кислород при нагревании энергично реагирует
со многими веществами, при этом выделяются
теплота и свет. Такие реакции называют реакциями
горения. Если опустить в сосуд с кислородом O
2
тлеющий уголек, то он раскаляется добела и
сгорает, образуя оксид углерода (IV) СO
2
.
Чтобы определить, какое образовалось вещество, в
сосуд наливают известковую воду — раствор
гидроксида кальция Са(ОН)
2
. Она мутнеет, так
как при этом образуется нерастворимый карбонат
кальция СаСO
3
:
CO2 Ca(OH)2 = CaCO3![]() H2O
H2O
Видеодемонстрация №1 “Горение угля в
кислороде”
http://files.school-collection.edu.ru/dlrstore/695aa82a-e84a-fa4d-7b04-16d28ded2fbb/index.htm
(Слайд № 8) Сера горит в O2 ярким синим
пламенем с образованием газа с резким запахом —
оксида серы (IV)
S O2 = SO2
Видеодемонтсрация №2 “Горение серы в
кислороде”
http://files.school-collection.edu.ru/dlrstore/600cd365-f9f2-ae10-56e4-98ee0af7e4c6/index.htm
(Слайд № 9) Горение фосфора в кислороде
Видеодемонстрация №3 “Горение фосфора в
кислороде”
http://files.school-collection.edu.ru/dlrstore/f83beda5-449d-d3dc-442c-a474a89eeca6/index.htm
Опыт следует проводить под тягой. Следует
соблюдать правила обращения с нагревательными
приборами. Не допускать попадания горящего
фосфора на рабочую поверхность стола. Не вдыхать
выделяющийся дым фосфорного ангидрида.
Фосфор Р сгорает в O2 ярким пламенем с
образованием белого дыма, состоящего из твердых
частиц оксида фосфора (V).
4P 5O2 = 2P2O5
(Слайд № 10) Горение железа в кислороде
Видеодемонстрация №4 “Горение железа в
кислороде”
http://files.school-collection.edu.ru/dlrstore/deb6e939-f8c8-fea7-fe24-7b2c80013fd7/index.htm
В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо. Если
к тонкой стальной проволоке прикрепить спичку,
зажечь ее и опустить в сосуд с кислородом, то от
спички загорится и железо. Горение железа
происходит с треском и разбрасыванием ярких
раскаленных искр — расплавленных капель
железной окалины Fe3O4. В этом соединении два атома
железа трехвалентны и один двухвалентен. Поэтому
реакцию горения железа в кислороде можно
выразить следующим уравнением:
3Fe 2O2 = FeO * Fe2O3 или Fe3O4
(Слайд № 11) Взаимодействие вещества с
кислородом относится к реакциям окисления.
(Слайд № 12)
Горение — это химическая реакция,
при которой происходит окисление веществ с
выделением теплоты и света.
(Слайд № 13)
В большинстве случаев при
взаимодействии веществ с кислородом образуются
оксиды.
Оксиды — это сложные вещества,
которые состоят из двух элементов, одним из
которых является кислород.
(Слайд № 14)
Известны химические элементы,
которые непосредственно с кислородом не
соединяются. К ним относятся золото Au и некоторые
другие. Оксиды этих элементов получают косвенным
путем.
(Слайд № 15)
Применение кислорода.
Основано
на его химических свойствах. В больших
количествах кислород используют для ускорения
химических реакций в разных отраслях химической
промышленности и в металлургии. Например, при
выплавке чугуна для повышения
производительности доменных печей в них подают
воздух, обогащенный кислородом.
(Слайд № 16)
При сжигании смеси ацетилена или
водорода с кислородом в специальных горелках
температура пламени достигает 3000
o
С. Такое
пламя используется для сварки металлов. Если
берут кислород в избытке, то пламенем можно
резать металл.
(Слайд № 17)
Жидкий кислород применяют в
ракетных двигателях.
(Слайд № 18)
В медицине кислород служит для
облегчения затрудненного дыхания. В этом случае
кислородом заполняют специальные подушки.
Кислородные маски необходимы в высотных полетах,
в космосе и при работе под водой.
Кислород расходуется в громадных количествах
на многие химические реакции, например на
сжигание топлива.
(Слайд № 19)
Из сказанного видно, что очень
много кислорода расходуется на разнообразную
деятельность человека, тратится на процессы
дыхания человека, животных, растений, а также на
процессы гниения. Человек при дыхании в течение 1
мин в среднем употребляет 0,5 дм
3
кислорода,
в течении суток — 720 дм
3
, а в год — 262,8 м
3
кислорода, что все жители земного шара (5
миллиардов) в течение года для дыхания
используют 1578 миллиардов кубических метров
кислорода. Если такой объем кислорода при
нормальном давлении поместить в железнодорожные
цистерны, то поезд был бы протяженностью более 300
млн км, что равняется расстоянию до Солнца и
обратно.
(Слайд № 20)
Но все же общая масса кислорода в
воздухе заметно не изменяется. Это объясняется
процессом фотосинтеза, происходящим в зеленых
растениях на свету. В результате этого процесса
выделяется кислород. С фотосинтезом вы уже
знакомились в курсе ботаники. Упрощенно процесс
фотосинтеза изображают так:
6CO2 6H2O = C6H12O6
6O2.
Так в природе происходит непрерывный
круговорот кислорода.
В целях сохранения кислорода в воздухе вокруг
городов и крупных промышленных центров
создаются зоны зеленых насаждений. Специальная
служба систематически контролирует содержание
кислорода в воздухе. При необходимости применяют
меры по устранению загрязнения воздуха.
Физкультминутка. (1 мин.)
IV. Закрепление знаний. (6 мин.)
(Слайд № 21) Задание №1. “Правда или ложь? Если
знаешь — разберешь”
Для кислорода верны следующие утверждения:
а) Кислород – бесцветный газ, без вкуса и
запаха.
б) Кислород немного легче воздуха.
в) В кислороде горят и такие вещества, которые
обычно считают негорючими, например железо.
г) Известны химические элементы, которые
непосредственно с кислородом соединяются. К ним
относятся золото Au и некоторые другие.
д) Применение кислорода основано на его
физических свойствах.
е) Непрерывный круговорот кислорода
непосредственно связан с таким процессом, как
фотосинтез.
Ответ:
а; в; е.
(Слайд № 22) Задание №2. “Скорая помощь”
Вставьте пропущенные вещества в уравнениях
реакций:
а) …….. Ca(OH)2 = CaCO3![]() H2O
H2O
б) S ……. = SO2
в) ….. 2O2 = FeO * Fe2O3 или Fe3O4
Ответ: а)CO2 б)O2 в) 3Fe
(Слайд № 23) Задание №3. “Мозговой штурм”
Расставьте коэффициенты в уравнениях реакций.
а) CO2 H2O = C6H12O6 O2
б) P O2 = P2O5
(Слайды № 24-25) Задание №4. “Ассоциации”
С каким применением кислорода ассоциируется
данное изображение?
1) в металлургии;
2) для резки металлов;
3) в авиации для дыхания;
4) в авиации для двигателей;
5) для сварки металлов;
6) на взрывных работах;
7) в медицине.
(Слайд № 26) V. Домашнее задание. (1 мин.)
Параграф 20, 21; №6-9 (с.60). Решите задачи 1-2 (с.60).
Творческое задание:
подготовить сообщение
№10 с. 60 “Что делается в вашей местности для
поддержания определенного содержания кислорода
в воздухе? В чем может заключаться ваше участие в
этой деятельности?”
(Слайд № 27) VI. Рефлексия. (1 мин.)
Учитель:
- Сегодня я узнал…
- было трудно…
- я понял, что…
- я научился…
- я смог…
- было интересно узнать, что…
- меня удивило…
- мне захотелось…
VII. Подведение итогов урока. (1 мин.)
(Слайд № 28)
В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
Обучающиеся: кислорода
(Слайд № 29) Учитель: Правильно. Спасибо за
урок! До свидания!
Литература
[1] Горковенко М. Ю. Поурочные разработки по
химии 8 класс к учебникам О. С. Габриеляна, Л. С.
Гузея, Г. Е. Рудзитиса. — М: “ВАКО”, 2004;
[2] Радецкий А. М., Горшкова В. П. Дидактический
материал: химия 8-9 классы — М: Просвещение, 1997.
[3] Химия: неорганическая химия: учебник для 8
класса общеобразовательных учреждений/ Г. Е.
Рудзитис, Ф.Г. Фельдман. — М: “Просвещение”, 2022 г.
Интернет-ресурсы
- http://files.school-collection.edu.ru/
- http://www.e-osnova.ru/
Физические свойства
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой.
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C).
Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35°C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейкиa=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[4].
- β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[4].
- γ-О2 — существует при температурах от 43,65 до 54,21 К; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[4].
Ещё три фазы образуются при высоких давлениях:
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O

