- Безопасная доза
- Безопасность
- Биотрансформация
- Внешность
- Вязкость
- Гексан, формула, характеристики:
- Давление газа
- Длина волны максимальной оптической плотности
- Запах
- Изомеры
- Инциденты
- Использует
- Калорийность
- Коэффициент разделения октанол / вода
- Межмолекулярные взаимодействия
- Молярная масса
- Опасность гексана
- Относительная плотность пара с воздухом
- Плотность
- Поверхностное натяжение
- Показатель преломления
- Порог запаха
- Потенциал ионизации
- Применение
- Применение и использование гексана:
- Производство
- Растворимость в растворителях
- Растворимость воды
- Реактивность
- Рекомендации
- Стабильность
- Температура плавления
- Теплота испарения
- Теплота сгорания
- Точка воспламенения
- Точка кипения
- Физические гексана:
- Физические свойства
- Химические гексана:
Безопасная доза
Агентство по охране окружающей среды (EPA) рассчитало эталонную концентрацию (RfC) для гексана 0,2 мг / м3.3и контрольная доза (RfD) 0,06 мг / кг массы тела / день.
В 1960-х и 1970-х годах группа рабочих обувной промышленности в Японии страдала нервными расстройствами. Причина заключалась в том, что они дышали в атмосфере гексана с концентрацией 500-2500 частей на миллион в течение 8-14 часов в день.
Рабочие продемонстрировали известные симптомы хронического вдыхания гексана, обнаружив, что врачи повредили нервы, контролирующие мышцы рук и ног.
Безопасность
Острая токсичность гексана довольно низкая. Вдыхание п-гексан при 5000 ppm в течение 10 минут вызывает выраженное головокружение; 2500-1000 ppm в течение 12 часов производит сонливость, усталость, потеря аппетита и парестезия в дистальных отделах конечностей;
2500–5000 ppm производит мышца слабость, холодная пульсация в конечностях, нечеткость зрения, Головная боль и анорексия.[14] Было продемонстрировано, что хроническое профессиональное воздействие повышенных уровней н-гексана связано с: периферическая невропатия в автомеханика в США и нейротоксичность у рабочих типографий, обувных и мебельных фабрик Азии, Европы и Северной Америки.[15]
Соединенные штаты Национальный институт охраны труда и здоровья (NIOSH) установил рекомендуемый предел воздействия (REL) для изомеров гексана (не н-гексан) 100 частей на миллион (350 мг / м3 (0,15 г / куб фут)) в течение 8-часового рабочего дня.[16] Однако для н-гексана текущий REL NIOSH составляет 50 частей на миллион (180 мг / м3 (0,079 гр / куб футов))
в течение 8-часового рабочего дня.[17] Этот предел был предложен как допустимый предел воздействия (PEL) Управление по охране труда в 1989 г .; тем не менее, этот PEL был отменен в судах США в 1992 году.[18] Текущий PEL н-гексана в США составляет 500 частей на миллион (1800 мг / м3).3 (0,79 г / куб фут)).[17]
Гексан и другие летучие углеводороды (петролейный эфир) представить стремление риск.[19]п-Гексан иногда используется как денатурирующий агент для спирта и в качестве чистящего средства в текстиль, мебельи кожевенная промышленность. Его постепенно заменяют другими растворителями.[20]
Как и бензин, гексан очень летуч и опасен для взрыва.
Биотрансформация
п-Гексан биотрансформируется в 2-гексанол и далее к 2,5-гександиол в организме. Превращение катализируется ферментом цитохром P450 используя кислород из воздуха. 2,5-гександиол может быть дополнительно окислен до 2,5-гександион, который нейротоксичный и производит полинейропатия.[20] Ввиду такого поведения замена п-гексан как растворитель обсуждался. п-Гептан возможная альтернатива.[26]
Внешность
Бесцветная, прозрачная и легколетучая жидкость.
Вязкость
0,3 мПа с
Гексан, формула, характеристики:
Гексан – органическое вещество класса алканов, состоящий из шести атомов углерода и четырнадцати атомов водорода.
Химическая формула гексана C6H14. Имеет пять изомеров: н-гексан, 2-метилпентан (изогексан), 3-метилпентан, 2,3-диметилбутан (диизопропил) и 2,2-диметилбутан (неогексан). Изомеры гексана различаются между собой по своим физическим м.
Формула н-гексана CH3CH2CH2CH2CH2CH3, 2-метилпентана (изогексана) CH3CH(CH3)CH2CH2CH3, 3-метилпентана CH3CH2CH(CH3)
Строение молекулы н-гексана:
Строение молекулы 2-метилпентана (изогексана):
Строение молекулы 3-метилпентана:
Строение молекулы 2,3-диметилбутана (диизопропила):
Строение молекулы 2,2-диметилбутана (неогексана):
Все изомеры гексана – бесцветная жидкость со слабым запахом, который напоминает дихлорэтан.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти (в значительных количествах). Также содержится в сланцевой нефти, сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде. Растворяется в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и другие).
Токсичен. Гексан обладает сильным наркотическим действием. Класс опасности четвертый.
Давление газа
17,60 кПа при 20 ° C
Длина волны максимальной оптической плотности
200 нм
Запах
Похож на бензин
Изомеры
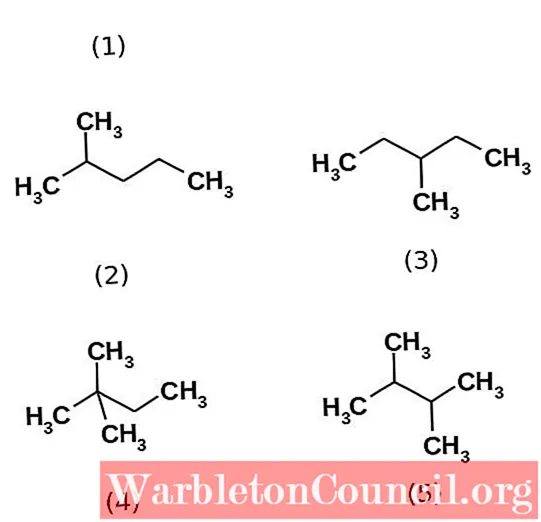
Углеводородный гексан фактически состоит из пяти изомеров, причем п-гексан наименее разветвленный, (1). Остальные четыре изомера в порядке возрастания:
2-метилпропан (2)
3-метилпропан (3)
2,2-диметилбутан (4)
2,3-диметилбутан (5)
Также обратите внимание, что структуры становятся более разветвленными от (1) до (5). При большей разветвленности дисперсионные силы уменьшаются, так как больше нет линейных участков, которые подходят эффективно. Это приводит к уменьшению и изменению температур кипения изомеров; хотя наблюдаются некоторые приемлемые расхождения.
И 2-метилпропан (точка кипения = 60,3 ° C), и 3-метилпропан (точка кипения = 63,3 ° C) одинаково разветвлены, но их точки кипения различаются. Затем следует 2,3-диметилбутан (точка кипения = 58 ° C), чтобы окончательно определить 2,2-диметилбутан как наиболее летучую жидкость (точка кипения = 49,7 ° C).
Инциденты
Профессиональные отравление гексаном произошло с Японскийсандалии рабочие, Итальянскийобувь рабочие,[21]Тайвань корректоры печати и другие.[22] Анализ тайваньских рабочих показал профессиональное воздействие веществ, включая п-гексан.[23] В 2022–2022 гг.
Гексан был идентифицирован как причина Луисвиллские взрывы канализации 13 февраля 1981 г., в результате чего было разрушено более 21 км канализационных сетей и улиц в центре г. Луисвилл в Кентукки, США
Использует
В промышленности гексаны используются в рецептурах клеи для обуви, натуральная кожа изделия и кровля. Они также используются для извлечения кулинарные масла (Такие как рапсовое масло или соевое масло) из семян, для очищения и обезжиривание различные предметы и в текстильном производстве.
Они обычно используются в пищевых продуктах. соевое масло экстракция в Соединенных Штатах и потенциально присутствует в качестве загрязнителей во всех соевых пищевых продуктах, в которых используется этот метод; отсутствие регулирования со стороны FDA об этом загрязнении вызывает некоторые разногласия.[7][8]
Типичное лабораторное использование гексанов — извлечение масло и смазывать загрязняющие вещества из воды и почвы для анализа.[9] Поскольку гексан нелегко депротонированный, он используется в лаборатории для реакций с участием очень сильных оснований, таких как получение литийорганические соединения.
Например, бутиллитий обычно поставляется в виде раствора в гексане.[нужна цитата]
Гексаны обычно используются в хроматография как неполярный растворитель. Высшие алканы, присутствующие в качестве примесей в гексанах, имеют такое же время удерживания, что и растворитель, что означает, что фракции, содержащие гексан, также будут содержать эти примеси.
В препаративной хроматографии концентрация большого объема гексанов может привести к тому, что образец будет значительно загрязнен алканами. Это может привести к получению твердого соединения в виде масло и алканы могут мешать анализу.[нужна цитата]
Калорийность
265,2 JK-1Моль-1
Коэффициент разделения октанол / вода
Журнал P = 3764
Межмолекулярные взаимодействия
На первом изображении показана молекула п-гексан представлен моделью сфер и стержней. Черные сферы соответствуют атомам углерода, составляя зигзагообразный углеродный скелет, а белые сферы — атомам водорода. В п-гексан, следовательно, углеводород, линейный и очень динамичный.
Поскольку все ее связи C-H имеют низкую полярность, у молекулы отсутствует дипольный момент. При этом их межмолекулярные взаимодействия не являются диполь-дипольными, а зависят исключительно от молекулярной массы и дисперсионных сил Лондона.
Каждая молекула п-гексан «накладывается» один на другой при очень низких температурах, как это предполагалось по его кристаллической структуре. С другой стороны, в жидкости их скелеты изгибаются и вращают свои связи C-H, в результате чего указанная жидкость становится летучей и кипит при 68,7 ° C.
Молярная масса
86,178 г / моль
Опасность гексана

При регулярном вдыхании паров гексана возникает хроническое отравление, приводящее к серьезным заболеваниям нервной системы, которые проявляются понижением чувствительности ног, быстрой утомляемостью, снижением мышечного тонуса, головными болями и даже параличом конечностей.
Гексан огне- и взрывоопасен. Работать с ним допускается только в помещениях с хорошей вентиляцией или в вытяжном шкафу, с соблюдением правил пожарной безопасности, с использованием всех средств защиты, включая противогазы с автономным запасом воздуха.
Транспортировка гексана должна производиться в герметичной таре со специальной информационной маркировкой, отдельно от легковоспламеняющихся веществ. Хранение — в помещении с вентиляцией, защищенном от света, сухом и прохладном.
Относительная плотность пара с воздухом
2,97 (воздух = 1)
Плотность
0,6606 г / мл
Поверхностное натяжение
17,89 мН / м при 25 ºC
Показатель преломления
1,375
Порог запаха
1,5 частей на миллион
Потенциал ионизации
10,18 эВ
Применение
— Нейтральный растворитель лакокрасочных материалов, клеев для мебели и обуви, 
— Производство бензина и добавок к бензину (изомеров гексана) для улучшения его свойств.
— Сырье для производства бензола, синтетических резин, полиолефинов.
— В химической индустрии для фракционной очистки веществ.
— В качестве промышленного средства для обезжиривания и очистки.
— Для экстракционной очистки растительных масел в пищепроме.
— В лабораторной практике — для анализа качества воды, лекарственных средств, продуктов питания, продуктов нефтепереработки. Используется в сложных и точных исследованиях (флюориметрия, УФ-спектроскопия, газохроматография). Неполярный растворитель в химических реакциях.
— В качестве индикаторной жидкости в термометрах с диапазоном минусовых значений.
— Гексан отличный растворитель парафиновых пробок при добыче нефти.
— В электронной, шинной промышленности.
У нас в магазине можно купить гексан «ч» (чистый) и гексан «хч» (химический чистый), средства защиты, широкий спектр хим реактивов и товаров для лабораторий.
Применение и использование гексана:
– входит в состав бензина,
– при экстрагировании растительных масел,
– входит в состав клеев,
– как органический растворитель,
– как сырье для производства бензола.
Производство
Гексаны в основном получают очисткасырая нефть. Точный состав фракции во многом зависит от источника нефти (сырой или реформированной) и ограничений переработки. Промышленный продукт (обычно около 50% по весу изомера с прямой цепью) представляет собой фракцию, кипящую при 65–70 ° C (149–158 ° F).
Растворимость в растворителях
Хорошо растворим в этаноле, растворим в этиловом эфире и хлороформе. Смешивается со спиртом, хлороформом и эфиром.
Растворимость воды
9,5 мг / л (практически не смешивается с водой)
Реактивность
Как и большинство алканов, гексан характеризуется низкой реакционной способностью и является подходящим растворителем для реакционноспособных соединений. Однако коммерческие образцы н-гексана часто содержат метилциклопентан, который имеет третичные связи C-H, которые несовместимы с некоторыми радикальными реакциями.[13]
Рекомендации
- ^Хофманн, Август Вильгельм Фон (1 января 1867 г.). «I. О действии трихлорида фосфора на соли ароматических монаминов». Труды Лондонского королевского общества. 15: 54–62. Дои:10.1098 / rspl.1866.0018. S2CID 98496840.
- ^«н-гексан — Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Идентификационные и связанные записи. В архиве из оригинала 8 марта 2022 г.. Получено 31 декабря 2022.
- ^Уильям М. Хейнс (2022). CRC Справочник по химии и физике (97-е изд.). Бока-Ратон: CRC Press. С. 3–298. ISBN 978-1-4987-5429-3.
- ^Классификация GHS по [PubChem]
- ^ абcКарманный справочник NIOSH по химической опасности. «#0322». Национальный институт охраны труда и здоровья (NIOSH).
- ^ аб«н-гексан». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^«Компания Тофурки: наши ингредиенты». Tofurky.com. Архивировано из оригинал 17 марта 2022 г.. Получено 17 марта 2022.
- ^Палмер, Брайан (26 апреля 2022 г.). «Исследование обнаружило гексан в соевом белке. Следует ли вам перестать есть вегетарианские гамбургеры?». Slate.com. В архиве из оригинала 9 марта 2022 г.. Получено 17 марта 2022.
- ^Использование озоноразрушающих веществ в лабораториях. Северный совет (2003 г.). ISBN 92-893-0884-2
- ^«Органическая химия-I»(PDF). Nsdl.niscair.res.in. Архивировано из оригинал(PDF) 29 октября 2022 г.. Получено 17 февраля 2022.
- ^«13. Углеводороды | Учебники». Textbook.s-anand.net. Архивировано из оригинал 6 октября 2022 г.. Получено 17 февраля 2022.
- ^Уильям Д. Маккейн (1990). Свойства нефтяных жидкостей. PennWell. ISBN 978-0-87814-335-1.
- ^Koch, H .; Хааф, В. (1973). «1-Адамантанкарбоновая кислота». Органический синтез.; Коллективный объем, 5, п. 20
- ^«Н-ГЕКСАН». Сеть токсикологических данных Банк данных по опасным веществам. Национальная медицинская библиотека. В архиве из оригинала от 4 сентября 2022 г.
- ^Центры по контролю и профилактике заболеваний (CDC) (16 ноября 2001 г.). «Связанная с n-гексаном периферическая невропатия среди автомобильных техников — Калифорния, 1999-2000». MMWR. Еженедельный отчет о заболеваемости и смертности. 50 (45): 1011–1013. ISSN 0149-2195. PMID 11724159.
- ^«CDC — Карманный справочник NIOSH по химической опасности — изомеры гексана (за исключением н-гексана)». cdc.gov. В архиве из оригинала 31 октября 2022 г.. Получено 3 ноября 2022.
- ^ абCDC (28 марта 2022 г.). «н-гексан». Центры по контролю и профилактике заболеваний. Получено 3 мая 2020.
- ^«Приложение G: Проект обновления данных о загрязнении воздуха 1989 года — Пределы воздействия НЕ действуют». www.cdc.gov. 20 февраля 2020 г.. Получено 3 мая 2020.
- ^Гад, Шейн C (2005), «Нефтяные углеводороды», Энциклопедия токсикологии, 3 (2-е изд.), Elsevier, стр. 377–379.
- ^ абКлаф, Стивен Р.; Малхолланд, Лейна (2005). «Гексан». Энциклопедия токсикологии. 2 (2-е изд.). Эльзевир. С. 522–525.
- ^Риццуто, N; Де Грандис, Д; Ди Трапани, Дж; Пазинато, Э (1980). «Н-гексановая полинейропатия. Профессиональное заболевание сапожников». Европейская неврология. 19 (5): 308–15. Дои:10.1159/000115166. PMID 6249607.
- ^н-гексан, Критерии гигиены окружающей среды, Всемирная организация здравоохранения, 1991 г., в архиве из оригинала 19 марта 2022 г.
- ^Liu, C.H .; Huang, C.Y .; Хуанг, К. С. (2022). «Профессиональные нейротоксические заболевания на Тайване». Безопасность и здоровье на работе. 3 (4): 257–67. Дои:10.5491 / SHAW.2022.3.4.257. ЧВК 3521924. PMID 23251841.
- ^«Рабочие были отравлены при изготовлении iPhone — ABC News (Австралийская радиовещательная корпорация)». Австралийская радиовещательная корпорация. 26 октября 2022 г. В архиве из оригинала от 8 апреля 2022 г.. Получено 17 марта 2022.
- ^Давид Барбоза (22 февраля 2022 г.). «Рабочие заболели у поставщика Apple в Китае». Нью-Йорк Таймс. В архиве из оригинала 7 апреля 2022 г.. Получено 17 марта 2022.
- ^Filser JG, Csanády GA, Dietz W., Kessler W., Kreuzer PE, Richter M, Störmer A (1996). «Сравнительная оценка нейротоксических рисков н-гексана и н-гептана у крыс и людей на основе образования метаболитов 2,5-гександиона и 2,5-гептандиона». Adv Exp Med Biol. Успехи экспериментальной медицины и биологии. 387: 411–427. Дои:10.1007/978-1-4757-9480-9_50. ISBN 978-1-4757-9482-3. PMID 8794236.
Стабильность
Стабильный. Несовместим с окислителями, хлором, фтором, перхлоратом магния. Образует с воздухом взрывоопасную смесь.
Температура плавления
От -96 до -94 ºC
Теплота испарения
31,56 кДж моль-1
Теплота сгорания
4163,2 кДж моль-1
Точка воспламенения
-22 ºC (закрытая чашка).
Точка кипения
От 68,5 до 69,1 ºC
Физические гексана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | слабый запахом, который напоминает дихлорэтан |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность н-гексана (при 20 °C и атмосферном давлении 1 атм.), кг/м3 | 654,8 |
| Плотность н-гексана (при 0 °C и атмосферном давлении 1 атм.), кг/м3 | 677,4 |
| Температура плавления н-гексана, °C | -95,3 |
| Температура плавления 2-метилпентана (изогексана), °C | -153,7 |
| Температура плавления 3-метилпентана, °C | -118 |
| Температура плавления 2,3-диметилбутана (диизопропила), °C | -128,5 |
| Температура плавления 2,2-диметилбутана (неогексана), °C | -99,9 |
| Температура кипения н-гексана, °C | 68,7 |
| Температура кипения 2-метилпентана (изогексана), °C | 60,3 |
| Температура кипения 3-метилпентана, °C | 63,3 |
| Температура кипения 2,3-диметилбутана (диизопропила), °C | 58 |
| Температура кипения 2,2-диметилбутана (неогексана), °C | 49,73 |
| Температура самовоспламенения н-гексана, °C | 233 |
| Температура вспышки н-гексана, °C | -23 |
| Критическая температура н-гексана, °C | 234,7 |
| Критическое давление н-гексана, МПа | 3,032 |
| Взрывоопасные концентрации смеси газа н-гексана с воздухом, % объёмных | от 1,24 до 7,5 |
| Удельная теплота сгорания н-гексана, МДж/кг | 45,105 |
| Молярная масса, г/моль | 86,17848 |
Физические свойства
Все алканы бесцветны.[10][11] Температуры кипения различных гексанов в некоторой степени схожи и, как и для других алканов, обычно ниже для более разветвленных форм.
Гексан имеет значительные давление газа при комнатной температуре:
Химические гексана:
Химические гексана аналогичны м других представителей ряда алканов. Поэтому для него характерны аналогичные химические реакции.
См. Химические бутана.

