- История открытия
- Кислород плотность — справочник химика 21
- Нахождение в природе
- Плотность — кислород
- Плотность газов при нормальных условиях – таблица
- Плотность газов при нормальных условиях (таблица)
- Плотность кислорода жидкого — справочник химика 21
- Получение кислорода
- Применение кислорода
- Применение при сварке и резке
- Студопедия — примеры решения задач. задача 1. определить плотность смеси газов водорода массой 8 г и кислорода массой 64 г при температуре 290 к и давлении 0,1 мпа
- Таблица плотности газов
- Физические свойства
- Химические свойства
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO →ot 2Hg O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Кислород плотность — справочник химика 21
Установите молекулярную формулу вещества, содержащего 81,6% хлора и 18,4 % кислорода. Плотность этого вещества по водороду 43,5.
[c.142]
Соединение содержит 39,14% углерода, 8,7% водорода, 52,16% кислорода. Плотность паров по водороду равна 46. Определить истинную формулу соединения. [c.16]
Пример. Анализ уксусной кислоты показывает, что в ней на 2,1 весовой части углерода приходится 0,35 весовой части водорода и 2,8 весовой части кислорода. Плотность пара уксусной кислоты по водороду равна [c.46]
Один из оксидов хлора содержит 47,4% кислорода. Плотность по водороду этого оксида в газообразном состоянии равна 33,75. Установите формулу оксида.
[c.219]
Содержание кислорода, % Плотность при 20 °С, г/см з [c.540]
Электрофлотационный способ является одним из наиболее эффективных при очистке воды нефтепродуктов, тонкодисперсных частиц, растворенных органических соединений. Наиболее высокая степень очистки сточных вод достигается в электрофлотационных аппаратах, имеющих наряду с флотационной камерой и камеру электрокоагуляции.
В этом случае сточные воды предварительно подвергаются воздействию как электрического поля, так и образующихся при электрокоагуляции оксидов металлов — продуктов растворения анодных электродных пластин. В качестве таких пластин используют сталь Ст.З.
В камере электрокоагуляции в результате адсорбции загрязнений на хлопьях гидрооксида железа образуются агрегаты, которые включают также пузырьки выделяющихся при электролизе водорода и кислорода. Плотность этих агрегатов меньше, чем плотность воды. Однако скорость их флотационного отделения от воды невелика.
Для интенсификации отделения этих агрегатов от воды и доочистки осветленной жидкости используют электрофлотацию с применением нерастворимого анода. Как показали экспериментальные исследования, продолжительность электрокоагуляции и флотации сточных вод должна быть одинаковой.
Кислород малорастворим в воде (5 объемов в 100 объемах воды), ко все же лучше, чем другие газы атмосферы, поэтому вода обогащается кислородом. Плотность кислорода при нормальных условиях р = 1,429 г/л. При —183 °С кислород конденсируется в бледно-голубую жидкость (р = 1,13 г/см ), а при —218,7 С образует синие кристаллы. [c.111]
Кислород — наиболее распространенный элемент земной коры. Он составляет 89% массы воды, 23% массы воздуха (21% по объему) и почти 50% массы обычных минералов (силикатов). В элементном состоянии кислород состоит из двухатомных молекул, строение которых описано ниже.
Зто бесцветный газ, не имеющий запаха и слабо растворимый в воде 1 л еоды при 0°С и 1 атм растворяет 48,9 мл газообразного кислорода. Плотность кислорода при 0°С и 1 атм равна 1,429 Г-Л-. Кислород конденсируется в бледно-голубую жидкость при температуре кипения —183,0 °С и при дальнейшем охлаждении отвердевает при —218,4 °С, образуя бледно-голубое кристаллическое вещество. [c.178]
Имеется смесь метана и кислорода плотностью [c.10]
В эвдиометре сожгли 20 мл газовой смеси, состоящей из азота, водорода и кислорода. Плотность смеси по водороду равна 14,0. После конденсации воды и приведения газовой смеси к начальным условиям объем ее был равен 17 мл. К образовавшейся смеси прибавили 50 мл воздуха и снова сожгли. Объем смеси не изменился. Определить процентный состав взятой газовой смеси. [c.11]
Определить формулу соединения, содержащего 39,14% углерода, 8,7% водорода и 52,16% кислорода. Плотность пара этого вещества по водороду равна 46. [c.64]
Задача 5. Анализ показал, что соединение состоит из 30,43% азота и69,57% кислорода. Плотность этого вещества по водороду равна 46. Определить его молекулярный вес и формулу. [c.56]
В обоих случаях защищаемая конструкция подвергается катодной поляризации, которая смещает ее потенциал к отрицательным значениям, а pH электролита, контактирующего непосредственно с металлом, сдвигается в щелочную область. Благодаря высокому pH на поверхности металла осаждаются гидроокись магния, карбонаты кальция и магния, образуя пленку подобно накипи.
Вывести истинную формулу кислоты, в составе которой на 2,1 в. ч. углерода приходится 0,35 в. ч. водорода и 2,8 в. ч. кислорода. Плотность пара кислоты по водороду Вп = 30. [c.35]
Составьте уравнение реакции получения кислорода из перманганата калия (КМпО ) и вычислите массу перманганата калия, необходимого для получения 10 л (при н.у.) кислорода (плотность кислорода 1,43 г/л). [c.36]
Для цинкования берут железный гвоздь или стальную пластинку. Работу проводят, как и в предыдуш,ем опыте. На катоде выделяется цинк и водород, на аноде — кислород. Плотность тока около [c.254]
Пример 3. Вывести молекулярную формулу вещества, содержащего 40,00% углерода, 6,70% водорода и 53,30%о кислорода. Плотность пара по водороду равна 30. [c.6]
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильней катион, тем сильнее основание. Стабильность катиона определяется суммой тех же факторов, что и стабильность аниона, с той лишь разницей, что влияние этих факторов на основность противоположно тому влиянию, которое они оказывали на кислотность.
Например, наличие в углеводородном радикале электронодонорных заместителей будет способствовать стабилизации катиона и, следовательно, повышать силу основания. Напротив, электроноакцетхзрные заместители будут дестабилизировать катион и уменьшать основность соединения.
Исходя из природы атомов кислорода, азота и серы, можно сделать вывод, что наиболее электроотрицательный атом кислорода за счет более прочного удерживания неподеленной пары электронов менее склонен присоединять протон по сравнению, например, с атомом азота.
Действительно, амины обычно более сильные основания, чем спирты. Электроны атомов азота и серы менее прочно удерживаются ядром и более доступны для связи с протоном. Однако у атома серы электронная плотность рассредоточена в большем объеме по сравнению с атомом азота и кислорода.
www.chem21.info
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Плотность — кислород
Cтраница 2
Какой объем озона следует добавить к 1 л воздуха, чтобы получить газовую смесь, плотность которой равна плотности кислорода при той же температуре.
[16]
Для отделения азота от кислорода нельзя воспользоваться различием в плотностях обоих газов, потому что они очень близки: плотность кислорода в 16, азота в 14 раз более плотности водорода, а потому здесь нельзя употребить пористых сосудов; разность во времени просачивания для обоих газов будет ничтожною.
[17]
К — температура газа, / 71 6 — 105 н / м2 — давление газа, ро1 43 кг / м3 — плотность кислорода при нормальных условиях, ро 1 013 — 105 н / м2 — нормальное атмосферное давление, i 32 кг / кмоль — масса киломоля кислорода, R 8314 дж / кмоль-град — универсальная газовая постоянная.
[18]
Статья Рэлея, написанная в марте 1893 г. [18], свидетельствует о новом подходе к исследованию плотности газа, а именно вместо измерений отношения плотностей кислорода и водорода на первый план выступило измерение отношения плотностей кислорода и азота.
[19]
Далее, Беккером, применившим для исследования эмиссионный микроскоп-проектор [18], было опубликовано доказательство существования на поверхности вольфрама адсорбционных центров двух видов, различающихся по плотности кислорода. Эти два вида центров характеризуются различными энергиями связи, причем одна из них соответствует теплоте адсорбции 4 эв, а вторая — 2 эв.
Подобное доказательство можно вывести из данных по адсорбции азота, полученных Гринхальфом и сотрудниками [19], которые показали, что на некоторых металлах наблюдается необратимый и обратимый тип хемосорб-ции, особенности которой зависят от рода металла и адсорбата.
Дано: У 200 0 м8 — объем газа, Г300 К — температура газа, р1 6 105 Па — давление газа, р01 43 кг / м3 — плотность кислорода при нормальных условиях, р0 1 013 — 105 Па — нормальное атмосферное давление, М 32 — 10 3 кг / моль — молярная масса кислорода, R 8 314 Дж / ( моль — К) — газовая постоянная.
[21]
Дано: У200 0м3 — объем газа, Г300 К — температура газа, р1, 6 — 105 Па — давление газа, р 1 43 кг / м3 — плотность кислорода при нормальных условиях, р0 1 013 — 105 Па — нормальное атмосферное давление, р32 — 10 3 кг / моль — молярная масса кислорода, 8 314 Дж / ( моль — К) — молярная газовая постоянная.
[22]
Дано: V200 0 м3 — объем газа, Г300 К — температура газа, р1 6 — 105 Па — давление газа, р 1 43 кг / м3 — плотность кислорода при нормальных условиях, рв1 013 — 105 Па — нормальное атмосферное давление, ц32 — 10 — 3 кг / моль — молярная масса кислорода, Я8 314 Дж / ( моль — К) — молярная газовая постоянная.
[23]
Статья Рэлея, написанная в марте 1893 г. [18], свидетельствует о новом подходе к исследованию плотности газа, а именно вместо измерений отношения плотностей кислорода и водорода на первый план выступило измерение отношения плотностей кислорода и азота.
[24]
Дано: V-50 л5 0 — 10-а м — 8 — объем выделенного кислорода, Т300 К — температура кислорода, р0Ю1 3 кПа — нормальное атмосферное давление, р01 43 кг / м3 — плотность кислорода при нормальных условиях, 8 29 — 10 — 8 кг / Кл — электрохимический эквивалент кислорода.
[25]
Дано: V5 л5 — 10 — 3 м — 3 — объем выделенного кислорода, Т300 К — температура кислорода, ра 101 3 кПа — нормальное атмосферное давление, р01 43 кг / м3 — плотность кислорода при нормальных условиях, / г — 8 29 X X 10 — 8 кг / Кл — электрохимический эквивалент кислорода.
[26]
Дано: V 5 0 л — 5 0 — 10 — 3 м — объем выделенного кислорода, / 27 С; Т 300 К — температура кислорода, ро 760 мм рт. ст. — нормальное атмосферное давление, ро 1 43 кг / л3 — плотность кислорода при нормальных условиях, Дг 8 29 — 10 — кг / к — электрохимический эквивалент кислорода.
[27]
При температуре 20 С в одном литре воды растворяется 28 см3 кислорода. Какова плотность кислорода в воде, свободная поверхность которой граничит с атмосферным воздухом, при нормальном давлении. Принять, что масса кислорода составляет 23 % массы воздуха.
[28]
Кислород ( как и любой из газов) в зависимости от условий может находиться в газообразном, жидком или твердом состоянии. В каком из состояний плотность кислорода наибольшая; наименьшая.
[29]
Одновременно он указал на возможность использования ее для установления атомного состава сложных газообразных веществ и дал новый метод определения атомных и молекулярных весов: Исходя из этой гипотезы, видно, что мы имеем средство легко определять относительные массы молекул для тех веществ, которые можно перевести в газообразное состояние, а также относительное число молекул в соединениях, потому что отношения молекулярных масс те же самые, что и отношения плотностей различных газов, при одинаковой температуре и давлении, а относительное число молекул в соединении дано непосредственно отношением объемов тех газов, которые образуют данное соединение.
Например, числа 1 10359 и 0 07321 выражают плотности кислорода и водорода, если принять плотность воздуха равной единице; отношение же этих двух чисел показывает, следовательно, отношение между массами двух равных объемов данных газов; это же самое отношение выразит, согласно Предложенной гипотезе, отношение масс их молекул.
Так, масса молекулы кислорода будет приблизительно в 15 раз больше массы молекулы водорода [ 20, стр. С другой стороны, так как мы знаем, что отношение объемов водорода и кислорода при образовании воды равняется 2: 1, то отсюда следует, что вода образуется путем соединения одной молекулы кислорода с двумя молекулами водорода.
Таким же образом — согласно объемным отношениям, установленным Гей-Люссаком для элементов, составляющих аммиак, окись азота, селитряный газ и азотную кислоту — аммиак должен образовываться путем соединения одной молекулы азота с тремя молекулами водорода, закись азота — из одной молекулы кислорода и двух молекул азота, селитряный газ — из одной молекулы азота и одной молекулы кислорода…
[30]
Страницы:
1
2
3
Плотность газов при нормальных условиях – таблица
| Газ (газовая фаза) | Хим. формула | Плотность | ||
| г/см3 | г/л | кг/м3 | ||
| Азот | N2 | 1.251⋅10−3 | 1.251 | 1.251 |
| Аммиак | NH3 | 7,723⋅10−4 | 0,7723 | 0,7723 |
| Аргон | Ar | 1,784⋅10−3 | 1,784 | 1,784 |
| Арсин (мышьяковистый водород) | H3As | 3,48⋅10−3 | 3,48 | 3,48 |
| Ацетилен | C2H2 | 1,16⋅10−3 | 1,16 | 1,16 |
| Бромоводород (бромистый водород) | HBr | 3.664⋅10−3 | 3.664 | 3.664 |
| Бутан | C4H10 | 2,7⋅10−3 | 2,7 | 2,703 |
| Водород | H2 | 8,987⋅10−5 | 0.08987 | 0.08987 |
| Гелий | He | 1,785⋅10−4 | 0,1785 | 0,1785 |
| Герман (германия тетрагидрид) | GeH4 | 3,42⋅10−3 | 3,42 | 3,420 |
| Диметиламин | (CH3)2NH | 2,0125⋅10−3 | 2,0125 | 2,0125 |
| Диметиловый эфир (метиловый эфир, метоксиметан, древесный эфир) | C2H6O | 2,1098⋅10−3 | 2,1098 | 2,1098 |
| Диоксид углерода (двуокись углерода, углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) | CO2 | 1,9768⋅10−3 | 1,9768 | 1,9768 |
| Диоксид хлора (двуокись хлора) | ClO2 | 3,01⋅10−3 | 3,01 | 3,01 |
| Дифтордихлорметан (дихлордифторметан, Фреон R 12, Фреон-12, Хладон-12, CFC-12, R-12) | CF2Cl2 | 5,51⋅10−3 | 5,51 | 5,510 |
| Закись азота (оксид диазота, оксид азота(I), веселящий газ) | N2O | 1,978⋅10−3 | 1,978 | 1,978 |
| Изобутан | C4H10 | 2,673⋅10−3 | 2,673 | 2,673 |
| Иодоводород (водород иодистый) | HI | 5,789⋅10−3 | 5,789 | 5,789 |
| Кислород | O2 | 1,429⋅10−3 | 1,429 | 1,429 |
| Кремния гексагидрид | Si2H6 | 2,85⋅10−3 | 2,85 | 2,85 |
| Криптон | Kr | 3,74⋅10−3 | 3,74 | 3,74 |
| Ксенон | Xe | 5,89⋅10−3 | 5,89 | 5,89 |
| Метан | CH4 | 7,168⋅10−4 | 0,7168 | 0,7168 |
| Метиламин | CH5N | 1,388⋅10−3 | 1,388 | 1,388 |
| Метилфторид | CH3F | 1,545⋅10−3 | 1,545 | 1,545 |
| Монооксид углерода (угарный газ, окись углерода, оксид углерода(II)) | CO | 1,25⋅10−3 | 1,25 | 1,25 |
| Моносилан (тетрагидрид кремния) | SiH4 | 1,44⋅10−3 | 1,44 | 1,44 |
| Неон | Ne | 0,9⋅10−3 | 0,9 | 0,900 |
| Озон | O3 | 2,14⋅10−3 | 2,14 | 2,14 |
| Оксид азота(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) | NO | 1,3402⋅10−3 | 1,3402 | 1,3402 |
| Оксид серы(IV) (диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид) | SO2 | 2,9263⋅10−3 | 2,9263 | 2,9263 |
| Оксид хлора(I) (окись хлора) | Cl2O | 3,88⋅10−3 | 3,88 | 3,88 |
| Оксифторид фосфора | POF3 | 4,8⋅10−3 | 4,8 | 4,8 |
| Пропан | C3H8 | 2,0037⋅10−3 | 2,0037 | 2,0037 |
| Пропилен | C3H6 | 1,915⋅10−3 | 1,915 | 1,915 |
| Радон | Rn | 9,81⋅10−3 | 9,81 | 9,81 |
| Селеноводород | H2Se | 3,6643⋅10−3 | 3,6643 | 3,6643 |
| Сероводород (сернистый водород) | H2S | 1,5206⋅10−3 | 1,5206 | 1,5206 |
| Сероокись углерода (карбонилсульфид) | COS | 2,72⋅10−3 | 2,72 | 2,72 |
| Стибин (сурьмянистый водород) | H3Sb | 5,48⋅10−3 | 5,48 | 5,48 |
| Теллуроводород (теллуран) | H2Te | 5,81⋅10−3 | 5,81 | 5,81 |
| Тетрафторид кремния | SiF4 | 4,96⋅10−3 | 4,96 | 4,96 |
| Триметиламин | C3H9N | 2,64⋅10−3 | 2,64 | 2,64 |
| Триметилбор | C3H9B | 2,52⋅10−3 | 2,52 | 2,52 |
| Трифторид мышьяка (мышьяк фтористый) | AsF5 | 7,71⋅10−3 | 7,71 | 7,71 |
| Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора) | PH3 | 1,53⋅10−3 | 1,53 | 1,53 |
| Фтор | F2 | 1,695⋅10−3 | 1,695 | 1,695 |
| Фторид бора (III), (трифторид бора, бор трехфтористый) | BF3 | 3,028⋅10−3 | 3,028 | 3,028 |
| Фторид нитрила (фторокись азота) | (NO2)F | 2,9⋅10−3 | 2,90 | 2,90 |
| Фторид нитрозила (нитрозил фтористый) | (NO)F | 2,1875⋅10−3 | 2,1875 | 2,1875 |
| Фторид серы(VI) (Гексафторид серы, элегаз, шестифтористая сера) | SF6 | 6,56⋅10−3 | 6,56 | 6,56 |
| Фторид фосфора(III) | PF3 | 3,91⋅10−3 | 3,91 | 3,91 |
| Фторид фосфора(V) (пентафторид фосфора) | PF5 | 5,81⋅10−3 | 5,81 | 5,81 |
| Хлор | Cl2 | 3,22⋅10−3 | 3,22 | 3,22 |
| Хлорид нитрозила (нитрозилхлорид, хлористый нитрозил, оксид-хлорид азота) | NOCl | 2,992⋅10−3 | 2,992 | 2,992 |
| Хлорметан (метилхлорид) | CH3Cl | 2,307⋅10−3 | 2,307 | 2,307 |
| Хлороводород (хлористый водород) | HCl | 1,6391⋅10−3 | 1,6391 | 1,6391 |
| Хлорокись азота | NO2Cl | 2,57⋅10−3 | 2,57 | 2,57 |
| Циан (дициан) | C2N2 | 2,38⋅10−4 | 0,238 | 0,238 |
| Этан | C2H6 | 1,356⋅10−3 | 1,356 | 1,356 |
| Этилен | C2H4 | 1,26⋅10−3 | 1,26 | 1,2605 |
В различных источниках информация может немного различаться.
Нормальные условия (н. у.) — физические условия, определяемые давление p=0,1013 МПа = 760 мм рт. ст. (нормальная атмосфера) и температурой 273,15 К (0 °С).
Плотность газов при нормальных условиях (таблица)
Газы
Формула
Плотность при нормальных условиях ρ, кг/м3
Азот
N2
1,2505
Аммиак
NH3
0,7714
Аргон
Ar
1,7839
Ацетилен
C2H2
1,1709
Ацетон
C3H6O
2,595
Бор фтористый
BF3
2,99
Бромистый водород
HBr
3,664
Н-бутан
C4H10
2,703
Изо-бутан
C4H10
2,668
Н-бутиловый спирт
C4H10O
3,244
Вода
H2O
0,768
Водород
H2
0,08987
Воздух (сухой)
—
1,2928
Н-гексан
C6H14
3,845
Гелий
He
0,1785
Н-гептан
C7H16
4,459
Германия тетрагидрид
GeH4
3,42
Двуокись углерода
CO2
1,9768
Н-декан
C10H22
6,35
Диметиламин
(CH3)2NH
1,966*
Дифтордихлорметан
CF2Cl2
5,51
Дифенил
C12H10
6,89
Дифениловый эфир
C12H10O
7,54
Дихлорметан
CH2Cl2
3,79
Диэтиловый эфир
C4H10O
3,30
Закись азота
N2O
1,978
Йодистый водород
HI
5,789
Кислород
O2
1,42895
Кремний фтористый
SiF4
4,9605
Кремний гексагидрид
Si2H5
2,85
Кремний тетрагидрид
SiH4
1,44
Криптон
Kr
3,74
Ксенон
Xe
5,89
Метан
CH4
0,7168
Метиламин
CH5N
1,388
Метиловый спирт
CH4O
1,426
Мышьяк фтористый
AsF5
7,71
Неон
Ne
0,8999
Нитрозилфторид
NOF
2,176*
Нитрозилхлорид
NOCl
2,9919
Озон
O3
2,22
Окись азота
NO
1,3402
Окись углерода
CO
1,25
Н-октан
C8H18
5,03
Н-пентан
C5H12 (CH3(CH2)3СН3)
3,457
Изо-пентан
C5H12 (СН3)2СНСН2СН3
3,22
Пропан
C3H8
2,0037
Пропилен
C3H6
1,915
Радон
Rn
9,73
Силан диметил
SiH2(CH3)2
2,73
Силан метил
SiH3CH3
2,08
Силан хлористый
SiH3Cl
3,03
Cилан трифтористый
SiHF3
3,89
Стибин (15°С, 754 мм.рт.ст.)
SbH3
5,30
Селеновая кислота
H2Se
3,6643
Сернистый газ
SO2
2,9263
Сернистый ангидрид
SO3
3,575
Сероводород
H2S
1,5392
Сероокись углерода
COS
2,72
Сульфурил фтористый
SO2F2
3,72*
Триметиламин
(CH3)3N
2,58*
Триметилбор
(CH3)3B
2,52
Фосфористый водород
PH3
1,53
Фосфор фтористый
PF3
3,907*
Фосфор оксифторид
POF3
4,8
Фосфор пентафторид
PF5
5,81
Фреон-11
CF3CI
6,13
Фреон-12 (дифтордихлорметан)
CF2CI2
5,51
Фреон-13
CFCI3
5,11
Фтор
F2
1,695
Фтористый кремний
SiF4
4,6905
Фтористый метил
CH3F
1,545
Фторокись азота
NO2F
2,9
Хлор
Cl2
3,22
Хлор двуокись
ClO2
3,09*
Хлор окись
Cl2O
3,89*
Хлористый водород
HCl
1,6391
Хлористый метил (метилхлорид)
CH3Cl
2,307
Хлористый этил
C2H5Cl
2,88
Хлороформ
CHCl3
5,283
Хлорокись азота
NO2Cl
2,57
Циан, дициан
C2N2
2,765 (2,335*)
Цианистая кислота
HCN
1,205
Этан
C2H6
1,356
Этиламин
C2H7N
2,0141
Этилен
C2H4
1,2605
Этиловый спирт
C2H6O
2,043
Плотность кислорода жидкого — справочник химика 21
Кислород жидкий — прозрачная легкоподвижная жидкость голубоватого цвета, быстро испаряющаяся при обычных т-рах. Кипит при —183° С имеет плотность 1,13.
[c.274]
Плотность жидкого кислорода при—183°С 1,14 г/см . Во сколько раз увеличится объем кислорода при переходе его из жидкого в газообразное состояние при нормальных условиях [c.28]
Метод пьезометра постоянного объема был использован при исследовании плотности жидкого кислорода при низких температурах [17]. Количество вещества, выпускаемого из пьезометра, измерялось в специальном термостатированном устройстве (газометре) следующим образом.
Предварительно точно устанавливался объем газометра. Измерялось давление кислорода, заполнившего газометр. После установления равновесия массу вещества в газометре определяли по известной плотности кислорода при низком давлении и температуре термостата.
[c.438]
Озон — один из наиболее сильных окислителей. Он является аллотропическим видоизменением кислорода. Молекула его содержит три атома кислорода. Жидкий озон имеет темно-синий цвет, кипит при температуре —112 и замерзает при температуре —251° С, плотность его равна 1,46. [c.125]
Для выявления условий накопления опасных примесей В воздухоразделительных аппаратах немаловажную роль играют данные по их плотности в жидком кислороде. [c.95]
Так, плотность кислорода в жидком состоянии при температуре кипения равна 1,14, а жидкого фтора — 1,51. Этим отчасти и объясняется большая эффективность фтора как окислителя по сравнению с кислородом.
[c.225]
Помимо удельной тяги, на скорость и дальность полета ракеты в значительной степени влияет плотность топлива, определяющаяся плотностью его компонентов. Плотность фтора в жидком состоянии при температуре кипения 1,51, а соответствующая плотность кислорода 1,14. Этим отчасти объясняется большая эффективность фтора как окислителя по сравнению с кислородом. [c.36]
Эти свойства кислорода требуют применения специальных материалов для изготовления сосудов, трубопроводов, арматуры и деталей, соприкасающихся с кислородом. Кроме того, при работе с жидким и газообразным кислородом в помещениях, в которых производится, хранится и газифицируется кислород, а также там, где проходят кислородопроводы, требуется соблюдать специальные меры предосторожности.
Следует иметь в виду во всех случаях, что плотность кислорода больше, чем воздуха (плотность кислорода по отношению к воздуху составляет 1,1). При утечках кислород вытесняет воздух и смешивается с ним, создавая опасность взрыва, особенно в нижней части помещений, в траншеях и углублениях, где может оставаться долгое время. [c.369]
На рис. 14 представлены кривые распределения средней плотности пропитанного жидким кислородом [c.33]
Кремнийорганическими соединениями называют большую группу веществ, представляющих собой соединения кремния с водородом или кислородом и различными органическими радикалами. Кремнийорганические соединения являются продуктами различной плотности —от жидких до твердых.
Этот же метод позволяет проверить, в какой степени различные исследуемые парафиновые углеводороды — метан, этан, пропан и бутан — смешиваются между собой в пределах изучаемой температуры. Из соображений удобства опыты проводились при температуре кипения сжиженного кислорода (—183° С) и сжиженного метана (—161° С).
Чистота всех изучаемых газов находилась в пределах 99—99,9%. Полученные значения плотности наносились на график (рис. 10), где одновременно представлены взятые из литературы плотности в жидком состоянии чистых метана, этана, пропана и бутана при различных температурах. Плотность чистого бутана, [c.44]
Плотность растворов кислорода во фторе найдена при допущении, что растворы являются идеальными. При этом плотность жидкого фтора принята согласно работе Джерри и Миллера [47], а плотность кислорода взята из справочника Варгафтика [14]. [c.20]
На рис. V. 9 показан общий вид контактного трехзажимного (трехэлектродного) коаксиального преобразователя для опреде-j ления диэлектрической проницаемости криогенных жидкостей и газов в широком диапазоне температур и давлений [137] на осно- вании отношения измеренной емкости преобразователя с веществом к емкости с вакуумом (и
www.chem21.info
Получение кислорода
Получают кислород несколькими способами. В лаборатории кислород получают из Кислородсодержащих веществ, которые могут легко его отщеплять, например из перманганата калия КМnO4 (рис. 41) или из бертолетовой соли КСlO3: 2КМnО4 = K2MnO4 МnО2 O2↑
2КСlO3 = 2КСl O2↑ При получении кислорода из бертолетовой соли для ускорения реакции должен присутствовать катализатор — двуокись марганца. Катализатор ускоряет разложение и делает его более равномерным. Без катализатора может
Рис. 41. Прибор для получения кислорода лабораторный способом из перманганата калия. 1 — перманганат калия; 2 — кислород; 3 — вата; 4 — цилиндр — сборник.
произойти взрыв, если бертолетова соль взята в большом количестве и особенно если она загрязнена органическими веществами. Из перекиси водорода кислород получают также в присутствии катализатора — двуокиси марганца МnО2 по уравнению: 2Н2O2[МnО2] = 2Н2O О2
■ 17. Зачем при разложении бертолетовой соли добавляют МnО2? (См. Ответ) 18. Образующийся при разложении КМnO4 кислород можно собирать над водой. Отразите это в схеме прибора. 19. Иногда при отсутствии в лаборатории двуокиси марганца вместо нее в бертолетову соль добавляют немного остатка после прокаливания перманганата калия. Почему возможна такая замена? 20. Какой объем кислорода выделится при разложении 5 молей бертолетовой соли? (См. Ответ)
Кислород может быть получен также разложением Нитратов при нагревании выше температуры плавления: 2KNO3 = 2KNO2 О2 В промышленности кислород получают в основном из жидкого воздуха. Переведенный в жидкое состояние воздух подвергают испарению. Сначала улетучивается азот (его температура кипения — 195,8°), а кислород остается (его температура кипения —183°).
■ 21. Перечислите известные вам лабораторные и промышленные способы получения кислорода. Запищите их в тетрадь, сопровождая каждый способ уравнением реакции. (См. Ответ) 22. Являются ли реакции, используемые для получения кислорода, окислительно-восстановительными?
Дайте обоснованный ответ. 23. Взято по 10 г следующих веществ; перманганата калия, бертолетовой соли, нитрата калия. В каком случае удастся получить наибольший объем кислорода? 24. В кислороде, полученном при нагревании 20 г перманганата калия, сожгли 1 г угля. Какой процент перманганата подвергся разложению? (См. Ответ)
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.
В химической промышленности его применяет:
- при получении ацетилена из природного газа (метана);
- при производстве кислот (азотной, серной);
- для газификации твердого топлива;
- для производства аммиака, формальдегида и метанола.
В металлургии его используют:
- при получении цветных металлов из руд;
- при выплавке чугуна в доменных печах;
- при выплавке стали в мартеновских и электрических печах;
- кислородно-конверторной выплавке стали.
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O 2 в воздухе или дают дышать непродолжительное время чистым O 2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O 2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки.
При полуавтоматической сварке (MIG/MAG) кислород O 2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO 2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O 2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Применение при сварке и резке
Кислород – важнейший газ для сварки и резки. При сжигании горючего газа в воздухе образуется пламя с температурой не более 2000°C, а в технически чистом кислороде она может превышать 2500–3000°C. Именно такая температура пламени практически пригодна для сварки многих металлов.
При газопламенной обработке обычно используется кислород с объемным содержанием 99,2–99,5% и выше. Для неответственных видов газовой сварки, пайки, поверхностной закалки и других способов нагрева газовым пламенем может применяться кислород чистотой 92–98%.
Для сварки и резки используют кислород в газообразном виде, поступающий от баллона, газификационной установки (СГУ-1, СГУ-4, СГУ-7К, СГУ-8К, ГХ-0,75, ГХК-3 и др.) или автономной станции (КГСН-150, К-0,15, К-0,4, К-0,5 и др.). При значительных объемах потребления кислород безопаснее и экономически целесообразнее хранить и транспортировать в жидком, а не газообразном виде, несмотря на неизбежные потери при испарении сжиженного газа.
Превращение жидкого кислорода в газообразный осуществляется в газификационных установках – насосных или безнасосных. Примером насосной установки может служить стационарная установка АГУ-2М, предназначенная для газификации непереохлажденного кислорода и наполнения реципиентов и баллонов под давлением до 240 кгс/см2 (24 МПа).
При испарении 1 л жидкого кислорода образуется около 860 л газообразного (при нормальном атмосферном давлении и температуре 20°С). При транспортировке жидкого кислорода масса тары, приходящаяся на 1кг кислорода, в 10 и более раз меньше, чем при транспортировке газообразного. При хранении, перевозке и газификации сжиженного газа неизбежны потери на его испарение.
Расчета объема газообразного кислорода в баллоне.
Для расчета объема газообразного кислорода в баллоне в м3 при нормальных условиях используют формулу (ГОСТ 5583-78):
V = K1 • Vб,
где K1 – коэффициент, Vб – вместимость баллона в дм3 (л).
Некоторые значения коэффициента K1 для расчета объема газообразного кислорода при нормальных условиях
| t газа в бал- лоне, °С | Значение K1 при избыточном давлении, кгс/см2 (МПа) | |||||||||||
| 140 (13,7) | 145 (14,2) | 150 (14,7) | 155 (15,2) | 160 (15,7) | 165 (16,2) | 170 (16,7) | 175 (17,2) | 180 (17,7) | 185 (18,1) | 190 (18,6) | 195 (19,1) | |
| -50 | 0,232 | 0,242 | 0,251 | 0,260 | 0,269 | 0,278 | 0,286 | 0,296 | 0,303 | 0,311 | 0,319 | 0,327 |
| -40 | 0,212 | 0,221 | 0,229 | 0,236 | 0,245 | 0,253 | 0,260 | 0,269 | 0,275 | 0,284 | 0,290 | 0,298 |
| -30 | 0,195 | 0,202 | 0,211 | 0,217 | 0,225 | 0,232 | 0,239 | 0,248 | 0,253 | 0,261 | 0,267 | 0,274 |
| -20 | 0,182 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,229 | 0,235 | 0,242 | 0,248 | 0,255 |
| -10 | 0,171 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,214 | 0,220 | 0,226 | 0,232 | 0,238 |
| 0,161 | 0,167 | 0,172 | 0,179 | 0,184 | 0,190 | 0,196 | 0,201 | 0,207 | 0,213 | 0,219 | 0,224 | |
| 10 | 0,153 | 0,158 | 0,163 | 0,169 | 0,174 | 0,180 | 0,185 | 0,191 | 0,196 | 0,201 | 0,206 | 0,211 |
| 20 | 0,145 | 0,150 | 0,156 | 0,160 | 0,166 | 0,171 | 0,176 | 0,181 | 0,186 | 0,191 | 0,196 | 0,201 |
| 30 | 0,139 | 0,143 | 0,148 | 0,153 | 0,158 | 0,163 | 0,168 | 0,173 | 0,177 | 0,182 | 0,187 | 0,192 |
| 40 | 0,133 | 0,137 | 0,142 | 0,147 | 0,151 | 0,156 | 0,160 | 0,165 | 0,170 | 0,174 | 0,178 | 0,183 |
| 50 | 0,127 | 0,132 | 0,136 | 0,141 | 0,145 | 0,149 | 0,154 | 0,158 | 0,163 | 0,167 | 0,171 | 0,175 |
Характеристики марок газообразного технического кислорода (ГОСТ 5583-78)
| Параметр | Кислород газообразный технический | |
| Первого сорта | Второго сорта | |
| Объемная доля кислорода O2, %, не менее | 99,7 | 99,5 (в ряде случаев – 99,2) |
| Объемная доля водяных паров, %, не более | 0,007 | 0,009 |
| Объемная доля водорода H2, %, не более (только для кислорода, полученного электролизом воды) | 0,3 | 0,5 |
| Содержание углекислоты CO2, окиси углерода CO, газообразных кислот и оснований, озона O3 и других газов-окислителей | Не нормируется | |
| Содержание щелочи (только для кислорода, полученного электролизом воды) | Кусок фильтровальной бумаги (смоченный раствором фенолфталеина, разбавленного водой в соотношении 1:10) в стеклянной трубке с пропускаемым кислородом (0,1–0,2 дм3/мин в течение 8–10 минут) не должен окраситься в красный или розовый цвет | |
| Запах | Не нормируется | |
Студопедия — примеры решения задач. задача 1. определить плотность смеси газов водорода массой 8 г и кислорода массой 64 г при температуре 290 к и давлении 0,1 мпа
Задача 1. Определить плотность смеси газов водорода массой 8 г и кислорода массой 64 г при температуре 290 К и давлении 0,1 МПа. Газы считать идеальными.
Количество вещества смеси:
 . (1.7)
. (1.7)
Уравнение Менделеева-Клапейрона для смеси газов:
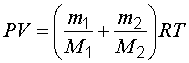 . (1.8)
. (1.8)
Определим объем смеси газов из уравнения (1.8):
 , (1.9)
, (1.9)
Подставив в формулу (1.6) значение объема (1.9), получим:
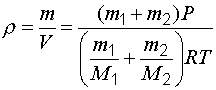 . (1.10)
. (1.10)
Проверим размерность:
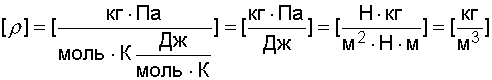 .
.
Произведем вычисления:
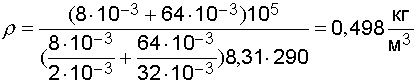 .
.
Ответ: плотность смеси 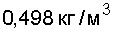 .
.
Задача 2. В сосуде вместимостью 0,3 л при температуре 290 К находится некоторый газ. На сколько понизится давление газа в сосуде, если из него в результате утечки выйдет 1019молекул?
Определим давление газа в первом и во втором состояниях:
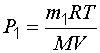 и
и 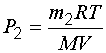 . (1.12)
. (1.12)
Изменение давления
 . (1.13)
. (1.13)
Число молекул, покинувших сосуд:
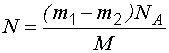 . (1.14)
. (1.14)
Следовательно, 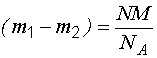 , подставив это значение в формулу изменения давления, получим:
, подставив это значение в формулу изменения давления, получим:
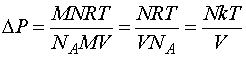 .
.
Проверим размерность:
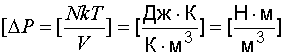 = [Па].
= [Па].
Произведем вычисления:
 (Па).
(Па).
Ответ: давление газа понизилось на 133 Па.
Задача 3. В баллоне объемом 10 л находится гелий под давлением 1 МПа при температуре 300 К. После того как из баллона было израсходовано 10 г гелия, температура понизилась до 290 К. Определить давление гелия, оставшегося в баллоне.
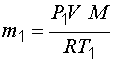 и
и 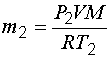 . (1.17)
. (1.17)
Масса израсходованного гелия:
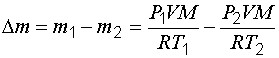 , (1.18)
, (1.18)
Из этого уравнения выразим искомое давление:
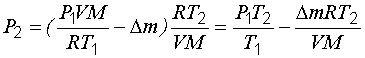 . (1.19)
. (1.19)
Проверим размерность:
 [Па].
[Па].
Произведем вычисления:
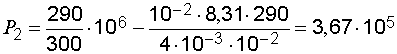 (Па).
(Па).
Ответ: давление газа оставшегося в сосуде равно 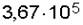 Па.
Па.
Задача 4. Найти среднюю кинетическую энергию одной молекулы аммиака NH3 при температуре 27 оС и среднюю энергию вращательного движения одной молекулы при той же температуре.
где i – число степеней свободы, k – постоянная Больцмана, Т – термодинамическая температура.
Для четырех атомных молекул полное число степеней свободы равно 6, из них 3 поступательного и 3 вращательного движения.
Средняя энергия вращательного движения молекулы определится по формуле
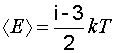 , (1.21)
, (1.21)
Проверим размерность:
 .
.
Подставим значения величин в формулы (1.20), (1.21) и вычислим энергии
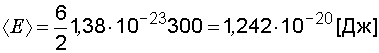 ;
;
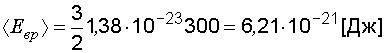 .
.
Ответ: полная энергия молекулы 1,242  10-20 Дж, энергия вращательного движения молекулы 6,21
10-20 Дж, энергия вращательного движения молекулы 6,21  10-21 Дж.
10-21 Дж.
Таблица плотности газов
| Вещество | Плотность, кг/м3 |
| Азот | 1,251 |
| Аммиак | 0,7714 |
| Аргон | 1,7839 |
| Ацетилен | 1,1709 |
| Водород | 0,08987 |
| Воздух | 1,2928 |
| Гелий | 0,1785 |
| Закись азота | 1,978 |
| Кислород | 1,429 |
| Криптон | 3,74 |
| Ксенон | 5,89 |
| Метан | 0,7168 |
| Неон | 0,8999 |
| Озон | 2,22 |
| Окись азота | 1,3402 |
| Пропан | 2,0037 |
| Радон | 9,73 |
| Триметиламин | 2,58 |
| Двуокись углерода | 1,9768 |
| Окись углерода | 1,25 |
| Сплав ВМЛ9 | 1850 |
| Сероокись углерода | 2,72 |
| Фтористый фосфор | 3,907 |
| Фтор | 1,695 |
| Фтороокись азота | 2,9 |
| Хлор | 3,22 |
| Двуокись хлора | 3,09 |
| Окись хлора | 3,89 |
| Этан | 1,356 |
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при 50 °C) и спирте (2,78 мл/100 г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы. Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-O2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li O2 → 2Li2O
- 2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2 → 12CO2 6H2O
- CH3CH2OH 3O2 → 2CO2 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2 → CH3COOH H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2 → Na2O2
- 2BaO O2 → 2BaO2
- H2 O2 → H2O2
- Na2O2 O2 → 2NaO2
- K O2 → KO2
- 3KOH 3O3 → 2KO3 KOH ∗ H2O 2O2↑
- PtF6 O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.

