Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
История открытия
Что такое воздух? Древние народы глубоко задумывались над этим вопросом. И это не удивительно, когда понимаешь, насколько важен воздух для многих процессов. Объекты не могут гореть без воздуха. Человек не может выжить без воздуха. На самом деле, древние народы думали, что воздух должен быть «элементом».
Но они использовали слово «элемент» в несколько ином значении, нежели современные учёные. Для древних людей элемент был чем-то очень важным и основным. Воздух соответствует этому описанию, наряду с огнём, водой и землёй. Впоследствии многие учёные повлияли на открытие такого элемента, как кислород:
- Первым человеком в Западной Европе, который описал «части» воздуха, был итальянский художник и учёный Леонардо да Винчи (1452−1519). Леонардо отметил, что воздух не полностью расходуется, когда в нем что-то сжигается. Поэтому он сказал, что воздух должен состоять из двух частей: одной части, которая расходуется на горение, и одной части, которая не участвует в процессе. В течение многих лет идеи Леонардо были не очень популярны среди учёных. Проблема заключалась в том, что у первых химиков не было хорошего оборудования, как в современных лабораториях. Им было сложно собрать образцы воздуха, а затем изучить его.
- В начале 1700-х химики начали узнавать больше о воздухе, но несколько окольным путём. Например, в 1771 и 1772 годах Карл Вильельм Шееле изучал влияние тепла на ряд соединений. В одном эксперименте он использовал карбонат серебра (Ag 2 CO 3), карбонат ртути (HgCO 3) и нитрат магния (Mg (NO 3) 2). Когда он нагревал эти соединения, он обнаружил, что выделялся газ. Затем он изучил свойства этого газа и обнаружил, что пламя ярко горело в нём. Он также заметил, что животные в нём могут безболезненно находиться. Не зная этого, Шееле открыл кислород.
- Примерно через два года Джозеф Пристли провёл аналогичные эксперименты, нагревая оксид ртути (HgO) в пламени. Соединение распалось, в результате чего образовались жидкая металлическая ртуть и газ. Когда Пристли проверил новый газ, он обнаружил те же свойства и характеристики, что и Шееле. Пристли даже пытался вдохнуть тот газ, получение которого ему удалось осуществить.
- Антуана-Лорана Лавуазье (1743−94) часто называют отцом современной химии. Он получил это звание по ряду причин. Наиболее важной из них является объяснение, которое он открыл для процесса сгорания (горения). До исследования Лавуазье химики считали, что горящий объект выделяет вещество в воздух. Они назвали это вещество флогистоном. Например, когда горело дерево, химики говорили, что флогистон перешёл из дерева в воздух. Лавуазье показал, что эта идея неверна. Когда что-то горит, это на самом деле происходит реакция с кислородом в воздухе. Горение, сказал Лавуазье, — это просто окисление (процесс, при котором какое-либо вещество соединяется с О2). Это открытие дало химикам совершенно новый взгляд на химические изменения. Теория флогистона постепенно начала вымирать. Начали развитие многие идеи, которые сегодня используются в современной химии.
Некоторые люди думают, что Шееле следует отдать должное за открытие кислорода. Он завершил свои эксперименты раньше, чем Пристли. Но его издатель очень медленно печатал отчёты учёного. Они действительно вышли после отчётов Пристли. Таким образом, большинство историков сходится во мнении, что Шееле и Пристли должны разделить между собой право на открытие кислорода.
Ни Шееле, ни Пристли до конца не понимали важность их открытия. Этот шаг был предпринят французским химиком Антуаном-Лораном Лавуазье (1743−94). Лавуазье был первым человеком, который объявил, что новый газ является элементом. Он был также первым человеком, который объяснил, как кислород участвует в горении. Кроме того, он предложил название для газа.
Слово oxygenium («кислород») происходит от греческих слов, обозначающих «рождающий кислоту». Лавуазье выбрал такое название, потому что думал, что все кислоты содержат О2. Поэтому новый элемент отвечал за «образование кислот». Однако в этом отношении Лавуазье ошибся. Не все кислоты содержат кислород.
Конспект урока по химии: «свойства и применение кислорода»
Тема урока:Свойства и применение кислорода.
Цель урока: изучить физические и химические свойства кислорода, дать общее понятие об оксидах, реакциях горения; рассмотреть практическую значимость и применение; доказать, что кислород — один из важнейших элементов на Земле.
Задачи урока:
Образовательные:
Расширить представления обучающихся о кислороде.
Познакомить со свойствами и применением кислорода.
Совершенствовать умения составлять уравнения химических реакций.
Воспитательные:
Формировать умения работать в парах у каждого обучающегося, считаться с мнением соседа и отстаивать свою точку зрения корректно, выполняя упражнения.
Воспитывать бережное отношение к своему здоровью, окружающей природе, учить понимать прекрасное, ценить произведения искусства.
Развивающие:
Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Совершенствовать навыки самостоятельной работы, развивать умения наблюдать, формулировать высказывания.
Способствовать развитию исследовательских навыков, соблюдая правила техники безопасности.
Совершенствовать умения обобщать и делать выводы.
Планируемые результаты:
личностные: готовность и способность учащихся к саморазвитию, самоопределению; ответственное отношение к учению; способность ставить цели и строить жизненные планы; формирование коммуникативной культуры, ценности здорового и безопасного образа жизни;
метапредметные: уметь ставить цель и планировать пути её достижения, выбирая более рациональные способы решения данной проблемы; учиться корректировать свои действия в связи с изменением создавшейся ситуации; уметь создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач; уметь осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих мыслей и потребностей; уметь организовывать совместную работу со сверстниками в парах; уметь находить информацию в различных источниках; владеть навыками самоконтроля, самооценки;
предметные:
знать: основные химические понятия «катализаторы», «оксиды», «реакции горения», «реакции окисления»; физические и химические свойства кислорода; области применения кислорода.
уметь:отличить кислород от других газов; составлять уравнения реакций горения веществ в кислороде; записывать химические формулы оксидов и давать им названия; объяснять, как происходит круговорот кислорода в природе.
Тип урока: урок формирования умений и навыков.
Форма работы: фронтальная, групповая, работа в парах, игровая.
Методы обучения: словесный,частично-поисковый, наглядный, демонстрационный, интерактивный.
Приемы обучения: постановка проблемных вопросов.
Оборудование: компьютер, проектор, презентация «Свойства и применение кислорода. Круговорот кислорода в природе», колбы, пинцет, ложки для сжигания веществ, спиртовка.
Реактивы: уголь, сера, красный фосфор, железная пластина, вода, известковая вода.
ХОД УРОКА
І. Организационный момент. (1 мин.)
(Слайд № 1)Учитель: Добрый день! Прошу всех садиться. Тема сегодняшнего урока «Свойства и применение кислорода».
(Слайд № 2)Мы с вами рассмотрим физические и химические свойства кислорода, сформулируем общие понятия об оксидах, реакциях горения, окисления; ознакомимся с практической значимостью и применением кислорода; а также докажем, что кислород — один из важнейших элементов на Земле.
ІІ. Актуализация знаний. (7 мин.).
Работа с карточками. От 2 до 4обучающихся получают задание на карточках и выполняют его у доски.
(Слайд № 3)Фронтальный опрос «А ну-ка, химики».
Учитель:Но перед тем как приступить к изучению новой темы, вам следует ответить на следующие вопросы:
Химический знак кислорода?Ответ: О
Относительная атомная масса кислорода?Ответ: 16.
Химическая формула кислорода?Ответ: О2.
Относительная молекулярная масса кислорода?Ответ: 32.
В соединениях кислород обычно какой валентности?Ответ: II.
Расскажите о нахождении кислорода в природе.Ответ: Кислород — самый распространенный химический элемент в земной коре. Кислород — самый распространенный на Земле элемент, на его долю приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количествосвязанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет 20,9%, по массовой доле — около 65 %.
Перечислите способы получения кислорода в лаборатории?Ответ:В лаборатории кислород получают следующими способами:
1) Разложение перманганата калия. 2KMnO4 = K2MnO4 MnO2 O2↑
2) Разложение перекиси водорода. 2H2O2 = 2H2O O2↑
3) Разложение бертолетовой соли. 2KClO3 = 2KCl 3O2↑
8. Перечислите способы получения кислорода в промышленности. Ответ: В промышленности кислород получают:
1) Электролиз воды. 2H2O = 2H2 O2↑
2) Из воздуха. ВОЗДУХ давление, -183˚C=O2 (голубая жидкость).
В настоящее время в промышленности кислород получают из воздуха. В лабораториях небольшие количества кислорода можно получать нагреванием перманганата калия (марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
(Слайд № 4. Рисунок1).9. Установите соответствие между способом получения кислорода и уравнением химической реакцией. Работа в парах.
Способы получения кислорода | Уравнения химических реакций |
А. Разложение перманганата калия. Б. Разложение перекиси водорода. В. Разложение бертолетовой соли. Г. Электролиз воды. Д. Из воздуха. | 1) 2KClO3 = 2KCl 3O2↑ 2) 2H2O2 = 2H2O O2↑ 3) ВОЗДУХ = O2 4) 2KMnO4 = K2MnO4 MnO2 O2↑ 5) 2H2O = 2H2 O2↑ |
Ответ: А-4; Б-2; В-1; Г-5; Д-3.
10. Что называют катализаторами? Где эти вещества применяются? Ответ: Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами. Катализаторы широко применяют в химической промышленности. С их помощью удается повысить производительность химических процессов, снизить себестоимость выпускаемой продукции и более полно использовать сырье.
(Слайд № 5. Рисунок2). На какой диаграмме распределение массовых долей элементов отвечает количественному составу (NH4)3PO4? Ответ: 4.
ІІІ. Изучение нового материала. (12 мин.)
(Слайд № 6) Учитель:Физические свойства. Кислород — бесцветный газ, без вкуса и запаха, относительно малорастворим в воде (в 100 объемах воды при температуре 20ºС растворяется 3,1 объема кислорода). Кислород немного тяжелее воздуха: 1л кислорода при нормальных условиях весит 1,43 г, а 1л воздуха — 1,29г. (Нормальные условия — сокращенно: н.у. — температура 0ºС и давление 760 мм.рт.ст., или 1 атм. ≈ 0,1 МПа). При давлении 760 мм.рт.ст. и температуре -183ºС кислород сжижается, а при снижении температуры до -218,8ºС затвердевает.
(Слайд № 7)Химические свойства.Техника безопасности (провести инструктаж!)
Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называют реакциями горения. Если опустить в сосуд с кислородом O2 тлеющий уголек, то он раскаляется добела и сгорает, образуя оксид углерода(IV) СO2. Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — раствор гидроксида кальция Са(ОН)2. Она мутнеет, так как при этом образуется нерастворимый карбонат кальция СаСO3:
CO2 Ca(OH)2 = CaCO3↓ H2O
Видеодемонстрация №1 «Горение угля в кислороде»
(Слайд № 8)Сера горит в O2 ярким синим пламенем с образованием газа с резким запахом — оксида серы(IV)
S O2 = SO2
Видеодемонтсрация №2 «Горение серы в кислороде»
(Слайд № 9)Горение фосфора в кислороде
Видеодемонстрация №3 «Горение фосфора в кислороде»
Опыт следует проводить под тягой. Следует соблюдать правила обращения с нагревательными приборами. Не допускать попадания горящего фосфора на рабочую поверхность стола. Не вдыхать выделяющийся дым фосфорного ангидрида.
Фосфор Р сгорает в O2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора(V).
4P 5O2 = 2P2O5
(Слайд № 10) Горение железа в кислороде
Видеодемонстрация №4 «Горение железа в кислороде»
В кислороде горят и такие вещества, которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. В этом соединении два атома железа трехвалентны и один двухвалентен. Поэтому реакцию горения железа в кислороде можно выразить следующим уравнением:
3Fe 2O2 = FeO * Fe2O3 или Fe3O4
(Слайд № 11)Взаимодействие вещества с кислородом относится к реакциям окисления.
(Слайд № 12)Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
(Слайд № 13)В большинстве случаев при взаимодействии веществ с кислородом образуются оксиды.Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
(Слайд № 14)Известны химические элементы, которые непосредственно с кислородом не соединяются. К ним относятся золото Au и некоторые другие. Оксиды этих элементов получают косвенным путем.
(Слайд № 15)Применение кислорода. Основано на его химических свойствах. В больших количествах кислород используют для ускорения химических реакций в разных отраслях химической промышленности и в металлургии. Например, при выплавке чугуна для повышения производительности доменных печей в них подают воздух, обогащенный кислородом.
(Слайд № 16)При сжигании смеси ацетилена или водорода с кислородом в специальных горелках температура пламени достигает 3000ºС. Такое пламя используется для сварки металлов. Если берут кислород в избытке, то пламенем можно резать металл.
(Слайд № 17)Жидкий кислород применяют в ракетных двигателях.
(Слайд № 18)В медицине кислород служит для облегчения затрудненного дыхания. В этом случае кислородом заполняют специальные подушки. Кислородные маски необходимы в высотных полетах, в космосе и при работе под водой.
Кислород расходуется в громадных количествах на многие химические реакции, например на сжигание топлива.
(Слайд № 19)Из сказанного видно, что очень много кислорода расходуется на разнообразную деятельность человека, тратится на процессы дыхания человека, животных, растений, а также на процессы гниения. Человек при дыхании в течение 1 мин в среднем употребляет 0,5 дм³ кислорода, в течении суток — 720 дм³, а в год — 262,8 м³ кислорода, что все жители земного шара (5 миллиардов) в течение года для дыхания используют 1578 миллиардов кубических метров кислорода. Если такой объем кислорода при нормальном давлении поместить в железнодорожные цистерны, то поезд был бы протяженностью более 300 млн км, что равняется расстоянию до Солнца и обратно.
(Слайд № 20)Но все же общая масса кислорода в воздухе заметно не изменяется. Это объясняется процессом фотосинтеза, происходящим в зеленых растениях на свету. В результате этого процесса выделяется кислород. Анимация «Фотосинтез» .
С фотосинтезом вы уже знакомились в курсе ботаники. Упрощенно процесс фотосинтеза изображают так:
6CO2 6H2O = C6H12O6 6O2.
Так в природе происходит непрерывный круговорот кислорода.
В целях сохранения кислорода в воздухе вокруг городов и крупных промышленных центров создаются зоны зеленых насаждений. Специальная служба систематически контролирует содержание кислорода в воздухе. При необходимости применяют меры по устранению загрязнения воздуха.
Физкультминутка. (1 мин.)
IV. Закрепление знаний. (6 мин.)
(Слайд № 21)Задание №1. «Правда или ложь? Если знаешь — разберешь»
Для кислорода верны следующие утверждения:
а) Кислород – бесцветный газ, без вкуса и запаха.
б) Кислород немного легче воздуха.
в) В кислороде горят и такие вещества, которые обычно считают негорючими, например железо.
г) Известны химические элементы, которые непосредственно с кислородом соединяются. К ним относятся золото Au и некоторые другие.
д) Применение кислорода основано на его физических свойствах.
е) Непрерывный круговорот кислорода непосредственно связан с таким процессом, как фотосинтез.
Ответ: а; в; е.
(Слайд № 22)Задание №2. «Скорая помощь»
Вставьте пропущенные вещества в уравнениях реакций:
а) …….. Ca(OH)2 = CaCO3↓ H2O
б) S ……. = SO2
в) ….. 2O2 = FeO * Fe2O3 или Fe3O4
Ответ: а)CO2 б)O2 в) 3Fe
(Слайд № 23)Задание №3. «Мозговой штурм»
Расставьте коэффициенты в уравнениях реакций.
а) CO2 H2O = C6H12O6 O2
б) P O2 = P2O5
(Слайды № 24-25)Задание №4. «Ассоциации»
С каким применением кислорода ассоциируется данное изображение?
1) в металлургии;
2) для резки металлов;
3) в авиации для дыхания;
4) в авиации для двигателей;
5) для сварки металлов;
6) на взрывных работах;
7) в медицине.
(Слайд № 26)V. Домашнее задание. (1 мин.)
§20,21; №6-9 (с.60). Решите задачи 1-2 (с.60).
Творческое задание: подготовить сообщение №10 с. 60 «Что делается в вашей местности для поддержания определенного содержания кислорода в воздухе? В чем может заключаться ваше участие в этой деятельности?»
(Слайд № 27)VI. Рефлексия. (1 мин.)
Учитель:
Сегодня я узнал…
было трудно…
я понял, что…
я научился…
я смог…
было интересно узнать, что…
меня удивило…
мне захотелось…
VII. Подведение итогов урока. (1 мин.)
(Слайд № 28)В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
Обучающиеся: кислорода
(Слайд № 29) Учитель: Правильно. Спасибо за урок! До свидания!
Литература:
[1] Горковенко М. Ю. Поурочные разработки по химии 8 класс к учебникам О. С. Габриеляна, Л. С. Гузея, Г. Е. Рудзитиса. — М: «ВАКО», 2004;
[2] Радецкий А. М., Горшкова В. П. Дидактический материал: химия 8-9 классы — М: Просвещение, 1997.
[3] Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. — М: «Просвещение», 2022 г.
Интернет-ресурсы:
. alhimik.ru/
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
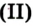 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган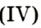
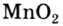
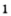 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 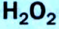 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 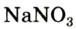

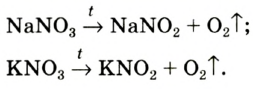
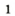
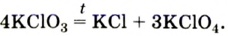
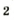 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: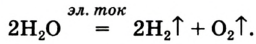
Распространённость в природе.
К. – самый распространённый химич. элемент на Земле: содержание химически связанного К. в гидросфере составляет 85,82% (гл. обр. в виде воды), в земной коре – 49% по массе. Известно более 1400 минералов, в состав которых входит К. Среди них преобладают минералы, образованные солями кислородсодержащих кислот (важнейшие классы – карбонаты природные, силикаты природные, сульфаты природные, фосфаты природные), и горные породы на их основе (напр., известняк, мрамор), а также разл. оксиды природные, гидроксиды природные и горные породы (напр., базальт). Молекулярный К. составляет 20,95% по объёму (23,10% по массе) земной атмосферы. К. атмосферы имеет биологич. происхождение и образуется в зелёных растениях, содержащих хлорофилл, из воды и диоксида углерода при фотосинтезе. Количество К., выделяемое растениями, компенсирует количество К., расходуемое в процессах гниения, горения, дыхания. К. – биогенный элемент – входит в состав важнейших классов природных органич. соединений (белков, жиров, нуклеиновых кислот, углеводов и др.) и в состав неорганич. соединений скелета.
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 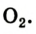
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 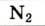 | 78,09 | 75,51 |
| Кислород | 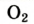 | 20,95 | 23,15 |
| Аргон | 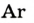 | 0,93 | 1,28 |
| углекислый газ | 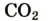 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 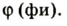
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 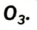 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 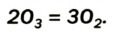
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
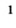
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Свойства
Строение внешней электронной оболочки атома К. 2s22p4; в соединениях проявляет степени окисления –2, –1, редко 1, 2; электроотрицательность по Полингу 3,44 (наиболее электроотрицательный элемент после фтора); атомный радиус 60 пм; радиус иона О2– 121 пм (координац. число 2). В газообразном, жидком и твёрдом состояниях К. существует в виде двухатомных молекул О2. Молекулы О2 парамагнитны. Существует также аллотропная модификация К. – озон, состоящая из трёхатомных молекул О3.
В осн. состоянии атом К. имеет чётное число валентных электронов, два из которых не спарены. Поэтому К., не имеющий низкой по энергии вакантной d-орбитали, в большинстве химич. соединений двухвалентен. В зависимости от характера химич. связи и типа кристаллич. структуры соединения координац. число К. может быть разным: 0 (атомарный К.), 1 (напр., О2, СО2), 2 (напр., Н2О, Н2О2), 3 (напр., Н3О ), 4 (напр., оксоацетаты Ве и Zn), 6 (напр., MgO, CdO), 8 (напр., Na2O, Cs2O). За счёт небольшого радиуса атома К. способен образовывать прочные π-связи с др. атомами, напр. с атомами К. (О2, О3), углерода, азота, серы, фосфора. Поэтому для К. одна двойная связь (494 кДж/моль) энергетически более выгодна, чем две простые (146 кДж/моль).
Парамагнетизм молекул О2 объясняется наличием двух неспаренных электронов с параллельными спинами на дважды вырожденных разрыхляющих π*-орбиталях. Поскольку на связывающих орбиталях молекулы находится на четыре электрона больше, чем на разрыхляющих, порядок связи в О2 равен 2, т. е. связь между атомами К. двойная. Если при фотохимич. или химич. воздействии на одной π*-орбитали оказываются два электрона с противоположными спинами, возникает первое возбуждённое состояние, по энергии расположенное на 92 кДж/моль выше основного. Если при возбуждении атома К. два электрона занимают две разные π*-орбитали и имеют противоположные спины, возникает второе возбуждённое состояние, энергия которого на 155 кДж/моль больше, чем основного. Возбуждение сопровождается увеличением межатомных расстояний О–О: от 120,74 пм в осн. состоянии до 121,55 пм для первого и до 122,77 пм для второго возбуждённого состояния, что, в свою очередь, приводит к ослаблению связи О–О и к усилению химич. активности К. Оба возбуждённых состояния молекулы О2 играют важную роль в реакциях окисления в газовой фазе.
К. – газ без цвета, запаха и вкуса; tпл –218,3 °C, tкип –182,9 °C, плотность газообразного К. 1428,97 кг/дм3 (при 0 °C и нормальном давлении). Жидкий К. – бледно-голубая жидкость, твёрдый К. – синее кристаллич. вещество. При 0 °C теплопроводность 24,65·10—3 Вт/(м·К), молярная теплоёмкость при постоянном давлении 29,27 Дж/(моль·К), диэлектрич. проницаемость газообразного К. 1,000547, жидкого 1,491. К. плохо растворим в воде (3,1% К. по объёму при 20 °C), хорошо растворим в некоторых фторорганич. растворителях, напр. перфтордекалине (4500% К. по объёму при 0 °C). Значит. количество К. растворяют благородные металлы: серебро, золото и платина. Растворимость газа в расплавленном серебре (2200% по объёму при 962 °C) резко понижается с уменьшением темп-ры, поэтому при охлаждении на воздухе расплав серебра «закипает» и разбрызгивается вследствие интенсивного выделения растворённого кислорода.
К. обладает высокой реакционной способностью, сильный окислитель: взаимодействует с большинством простых веществ при нормальных условиях, в осн. с образованием соответствующих оксидов (мн. реакции, протекающие медленно при комнатной и более низких темп-рах, при нагревании сопровождаются взрывом и выделением большого количества теплоты). К. взаимодействует при нормальных условиях с водородом (образуется вода Н2О; смеси К. с водородом взрывоопасны – см. Гремучий газ), при нагревании – с серой (серы диоксид SO2 и серы триоксид SO3), углеродом (углерода оксид СО, углерода диоксид СО2), фосфором (фосфора оксиды), мн. металлами (оксиды металлов), особенно легко со щелочными и щёлочноземельными (в осн. пероксиды и надпероксиды металлов, напр. пероксид бария BaO2, надпероксид калия KO2). С азотом К. взаимодействует при темп-ре выше 1200 °C или при воздействии электрич. разряда (образуется монооксид азота NO). Соединения К. с ксеноном, криптоном, галогенами, золотом и платиной получают косвенным путём. К. не образует химич. соединений с гелием, неоном и аргоном. Жидкий К. также является сильным окислителем: пропитанная им вата при поджигании мгновенно сгорает, некоторые летучие органич. вещества способны самовоспламеняться, когда находятся на расстоянии нескольких метров от открытого сосуда с жидким кислородом.
К. образует три ионные формы, каждая из которых определяет свойства отд. класса химич. соединений: $ce{O2^-}$– супероксидов (формальная степень окисления атома К. –0,5), $ce{O2^2^-}$ – пероксидных соединений (степень окисления атома К. –1, напр. водорода пероксид Н2О2), О2– – оксидов (степень окисления атома К. –2). Положительные степени окисления 1 и 2 К. проявляет во фторидах O2F2 и ОF2 соответственно. Фториды К. неустойчивы, являются сильными окислителями и фторирующими реагентами.
Молекулярный К. является слабым лигандом и присоединяется к некоторым комплексам Fe, Co, Mn, Cu. Среди таких комплексов наиболее важен железопорфирин, входящий в состав гемоглобина – белка, который осуществляет перенос К. в организме теплокровных.
Химические свойства
Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:4K O2 → 2K2O2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:2NO O2 → 2NO2
Окисляет большинство органических соединений:CH3CH2OH 3O2 → 2CO2 3H2O
При определенных условиях можно провести мягкое окисление органического соединения:CH3CH2OH O2 → CH3COOH H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.— Например, пероксиды получаются при сгорании щелочных металлов в кислороде:2Na O2 → Na2O2
— Некоторые окислы поглощают кислород:2BaO O2 → 2BaO2
— По принципам горения, разработанным А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:H2 O2 → H2O2
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2-). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:Na2O2 O2 → 2NaO2
Озониды содержат ион O3- со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:КОН(тв.) О3 → КО3 КОН O2
Ион диоксигенил O2 имеет степень окисления 1/2. Получают по реакции:PtF6 O2 → O2PtF6
Фториды кислородаДифторид кислорода, OF2 степень окисления 2, получают пропусканием фтора через раствор щелочи:2F2 2NaOH → OF2 2NaF H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления 1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.

