Моносахариды
Глюкоза: строение и физические свойства:
Примерно половина энергии, необходимой для деятельности человека, производится за счет превращений глюкозы, растворенной в крови.
В природе глюкоза содержится в виноградном соке, меде, спелых фруктах и ягодах. В организме человека глюкоза, наряду с мышцами, содержится в крови (около 0,1%) и в меньшем количестве во всех тканях. Образуется при фотосинтезе растений:
Получение: Глюкоза впервые была синтезирована из формальдегида (А. Бутлеров, 1861):
В промышленности глюкозу получают гидролизом крахмала или целлюлозы:
Примечание: В нашей республике глюкозу получают из промежуточных продуктов обработки кукурузы на Огузском заводе но производству глюкозы.
Изомерия: Глюкоза имеет несколько изомеров. Два из них называются фруктозой и галактозой.
Физические свойства: Глюкоза — белое кристаллическое вещество со сладким вкусом, хорошо растворимое в воде и малорастворимое в спирте. Из водного раствора она выделяется в виде кристаллогидрата 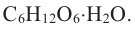 Строение: Молекула глюкозы в водном растворе существует в трех изомерных формах — пятиатомного альдегидоспирта и в двух циклических —
Строение: Молекула глюкозы в водном растворе существует в трех изомерных формах — пятиатомного альдегидоспирта и в двух циклических — 
В каждой из циклических форм глюкозы также содержится 5 -ОН групп, но альдегидная группа отсутствует:
Альдегидоспиртовая и две циклические формы молекулы глюкозы (атомы углерода кольца не показаны)
В водном растворе глюкозы альдегидоспиртовая форма присутствует в очень малом количестве 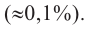
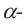 1 и C2 атомами углерода, расположены по одну сторону цикла молекулы, а в
1 и C2 атомами углерода, расположены по одну сторону цикла молекулы, а в 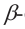
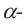
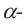
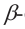
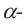
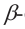 таутомерией,
таутомерией, 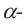
 таутомерами. В растворах таутомеры находятся в динамическом равновесии.
таутомерами. В растворах таутомеры находятся в динамическом равновесии.
Глюкоза: химические свойства и применение:
Одной из наиболее частых процедур в биохимических лабораториях является определение глюкозы в крови, моче или в других биологических жидкостях. С этой целью используется фермент глюкозооксидаза.
Реакции альдегидной группы глюкозы:
Восстановление глюкозы. В присутствии катализатора глюкоза восстанавливается водородом, образуя шестиатомный спирт — сорбит:
Знаете ли вы … Сладость сорбита составляет 60% сладости обычного сахара; сорбит используют в качестве сахарозаменителя для больных диабетом.
Окисление глюкозы: Глюкоза при действии оксида серебра (I) и при слабом нагревании с гидроксидом меди (II) окисляется в глюконовую кислоту. Обе реакции подтверждают наличие альдегидной группы в молекуле глюкозы:
Поскольку в этих реакциях углевод восстанавливает окислитель, то подобные углеводы называют восстанавливающими сахарами.
В организме в результате постадийного окисления глюкозы выделяется энергия, необходимая для жизнедеятельности живых существ.
Определение количества глюкозы в биологических жидкостях (крови, моче, и т.д.).
В ходе теста фермент глюкозооксидаза превращает глюкозу в глюконовую кислоту:
Образующийся пероксид водорода окисляет предварительно добавленный в систему бесцветный 2-метиланилин в окрашенный продукт:
Цветовые оттенки раствора позволяют определить количество глюкозы в образце.
Реакции гидроксильных групп глюкозы:
С активными металлами глюкоза образует сахараты типа алкоголятов; это подтверждает наличие в ее молекуле -ОН группы:
С гидроксидом меди (II) глюкоза образует ярко-синий раствор сахарата меди (II), что подтверждает наличие нескольких -ОН групп в ее молекуле:
Образование сложного эфира — пептаацетилглюкозы при взаимодействии глюкозы с уксусным ангидридом (или уксусной кислотой) указывает на наличие в ее молекуле 5 -ОН групп:
Реакция гликозидной -ОН группы (образование гликозидов):
B циклических формах глюкозы атом водорода -ОН группы, связанной с первым атомом углерода является более подвижным, чем атомы Н других 4-х -ОН групп. Например, глюкоза со спиртами реагирует только с участием этой -ОН группы, образуя гликозиды:
По этой причине-ОН группу, связанную с атомом углерода 1С, называют гликозидной.
Специфические свойства глюкозы:
Под действием ферментов глюкоза подвергается спиртовому(а), масляно-кислому(b) и молочнокислому(с) брожению:
Применение: Глюкоза — легкоусвояемое питательное вещество. Поэтому в медицине ее используют при консервации крови, а также как средство для укрепления организма. Она используется в текстильной промышленности при нанесении узоров на ткани, в кондитерской промышленности, а также при синтезе витамина С (аскорбиновой кислоты). На практике брожением глюкозы получают этиловый спирт (а).
Фруктоза, рибоза и дезоксирибоза:
Фруктоза, называемая также и плодовым сахаром, является уникальным A питательным веществом, которое может принимать любой из нас. В отличие от глюкозы, фруктоза медленно всасывается в кишечнике, однако быстро расщепляется. В это время выделяется много энергии.
A Фруктоза:
Фруктоза (С6Н12О6: плодовый сахар), являясь изомером глюкозы, вместе с ней встречается в сладких фруктах. Она слаще сахарозы в 1,5 раза и глюкозы в 3 раза. Большая сладость меда связана с присутствием в его составе фруктозы. В отличие от глюкозы, фруктоза — пятиатомный кетоноспирт:
В растворе фруктоза также существует в циклических 
Как и многоатомные спирты, она реагирует с активными металлами, основаниями [Си(ОН)2, Са(ОН)2 и др.], образуя сахараты типа алкоголятов, а с кислородсодержащими кислотами -сложные эфиры. Поскольку в ее составе нет альдегидной группы, она, в отличие от глюкозы, не реагирует с оксидом серебра (I) и гидроксидом меди (II).
Под действием сильных окислителей фруктоза окисляется, образуя щавелевую и винную кислоты.
Другой изомер глюкозы называют галактозой. Она отличается от глюкозы только по расположению в пространстве атома Н и -ОН группы при четвертом атоме углерода (4С) цикла:
Рибоза (С5Н10О5) и дезоксирибоза (С5Н10О4) — представители пентоз. В альдегидоспиртовой форме рибоза — четырехатомный, а дезоксирибоза — пятиатомный альдегидоспирт.
В молекуле дезоксирибозы у 2-го атома углерода вместо -ОН группы расположен атом водорода. По этой причине состав дезоксирибозы (С5Н10О4) не соответствует общей формуле углеводов — Cn(H2O)m.
Как многоатомные альдегидоспирты, рибоза и дезоксирибоза окисляются по реакции «серебряного зеркала» и под действием гидроксида меди (II) восстанавливаются водородом, с гидроксидом меди (II) также образуют сахараты ярко-синего цвета, а с карболовыми кислотами — сложные эфиры.
При восстановлении рибозы водородом образуется пятиатомный спирт — рибит, а при окислении — рибоновая кислота:
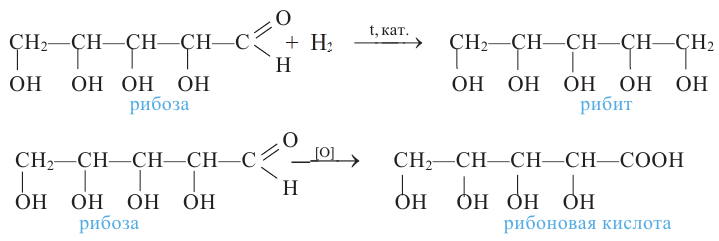
Рибоза входит в состав рибонуклеиновых кислот (РНК), а дезоксирибоза -дезоксирибонуклеиновых кислот (ДНК). В составе нуклеиновых кислот рибоза и дезоксирибоза находятся в 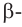
Полисахариды
Крахмал:
В процессе созревания фруктов содержание крахмала в нем, как правило, уменьшается; например, в неспелых бананах содержание крахмала — 18%, а в спелых — 2%, в неспелом яблоке — 4-5%, а в спелом -1%.
Крахмал [(С6Н10О5)n] и целлюлоза в растительном мире широко распространенные полисахариды. Молекулы крахмала, целлюлозы, а также полисахарида гликогена состоят из большого числа остатков глюкозы, соединенных между собой гликозидной связью.
Крахмал накапливается в картофеле 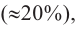

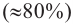
Получение: Крахмал получают в основном из картофеля, риса и кукурузы. С этой целью из размельченного продукта крахмал вымывается на сите водой. Из суспензии крахмала, прошедшей через сито в виде «картофельного молока», крахмал осаждают методом отстаивания, раствор фильтруют и оставшийся крахмал высушивают.
Строение: Крахмал — природный полимер состава (С6Н10О5)n, состоящий из остатков 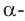
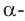 (а):(а)получение крахмала неразветвленного строения (амилозы) поликонденсацией
(а):(а)получение крахмала неразветвленного строения (амилозы) поликонденсацией 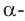 глюкозы
глюкозы
Крахмал состоит из смеси двух полисахаридов — амилозы, неразветвленного строения (b), и амилопектина, разветвленного строения (c). В большинстве случаев крахмал содержит примерно 20-25% амилозы и 75-80% амилопектина. Молекулы амилозы скручены в форме спирали (b, d).
Из схемы а видно, что образование крахмала происходит с участием -ОН групп глюкозы, расположенных в положениях 1,4. Другими словами, В реакции поликонденсации Схемы макромолекул амилозы (b) участвуют гликозидные -ОН группы. По этой и амилопектина (с). причине в растворе в С6Н10О5 звеньях макромолекулы крахмала не могут образоваться альдегидные группы, и потому крахмал не восстанавливает оксид cepeбpa (I) и гидроксид меди (II).
Разветвление в амилопектине происходит за счет 1,6-гликозидных связей.
Физические свойства: Крахмал — белый порошок без вкуса, нерастворимый в холодной воде. В горячей воде набухает, образуя крахмальный клейстер.
Химические свойства: 1. Под действием ферментов или при нагревании с кислотами крахмал подвергается гидролизу. Конечный продукт гидролиза — глюкоза. В промышленности глюкозу получают этим путем:
В зависимости от условий гидролиз крахмала может протекать ступенчато, с образованием промежуточных продуктов:
2. Качественной реакцией па крахмал является образование синего окрашивания при действии на него йода (I2). В этом процессе молекулы йода проникают в пустоты, образованные молекулами амилозы при их скручивании в спираль (d).
За счет -ОН групп крахмал образует сложные эфиры, однако, ОНИ не имеют практического применения.
Применение: Крахмал, как питательный продукт, удовлетворяет потребность человека в углеводах. В организме в результате гидролиза крахмала (точнее, продуктов его частичного гидролиза — декстринов) образуется глюкоза. Часть глюкозы усваивается организмом, а избыток ее превращается в гликоген (животный крахмал) и откладывается в печени как резервное вещество.
Из крахмала получают декстрины, патоку (смесь декстринов с глюкозой), используемые в производстве карамельных изделий, а также глюкозу и этанол. Он используется для приготовления клея, накрахмаливания белья, в бумажной и полиграфической промышленности. На его основе приготавливают антибиотики, витамины, присыпки, капсулы для лекарств и др.
Гликоген:
В отличие от крахмала — резервного полисахарида растений, гликоген (е) — резервное вещество для организма животных и человека. По составу он одинаков с крахмалом: (С6Н10O5)n. Однако макромолекулы гликогена имеют большую относительную молекулярную массу и более разветвленное строение.
В организме нормально развитого человека содержится около 350 г гликогена, равномерно распределённого в мышцах и печени. При возникновении потребности организма в глюкозе гликоген подвергается гидролизу, образуя глюкозу.
При термической обработке картофеля и хлеба химические превращения, происходящие с крахмалом, придают продуктам обработки больший вкус, а продукты превращения еще легче подвергаются гидролизу.
Целлюлоза:
Целлюлоза — наиболее распространенное в природе органическое вещество. В отличие от крахмала, целлюлоза в растениях встречается в виде волокон.
Целлюлоза [(С6Н10O5)n], по сравнению с крахмалом, более распространенный углевод. Она образует стенки всех растительных клеток; в древесине содержится около 50%, а в волокнах хлопка и фильтровальной бумаге -порядка 98% целлюлозы.
Получение: Целлюлозу выделяют из хлопка, древесины, тростника и др. Из древесины ее выделяют, в основном, сульфитным способом: измельченная древесина под давлением и в щелочной среде нагревается с раствором гидросульфита кальция Ca(HSO3)2.
Строение: Целлюлоза, как и крахмал, — природный полимер состава (С6Н10O5)n. Однако они имеют ряд различий. Так, средняя относительная молекулярная масса целлюлозы больше молекулярной массы крахмала и достигает значения в несколько миллионов.
Наконец, макромолекулы целлюлозы состоят не из остатков 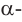
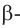 (b)образование целлюлозы поликонденсацией
(b)образование целлюлозы поликонденсацией  глюкозыНеразветвлённое строение молекулы целлюлозы и ее образование из остатков
глюкозыНеразветвлённое строение молекулы целлюлозы и ее образование из остатков 
Учитывая наличие трех -ОН групп в каждой структурной единице С6Н10O5, формулу целлюлозы можно представить и в следующем виде:
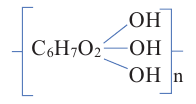
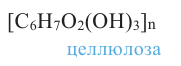 r(волокна льна)
r(волокна льна) 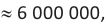 r(волокна хлопка)
r(волокна хлопка) 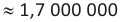
 глюкозидазы. Поскольку этот фермент присутствует в пищеварительной системе только жвачных животных, то целлюлоза не переваривается в организме нежвачных животных и человека.
глюкозидазы. Поскольку этот фермент присутствует в пищеварительной системе только жвачных животных, то целлюлоза не переваривается в организме нежвачных животных и человека.
Организм человека переваривает из полисахаридов только крахмал и гликоген.
Физические свойства: Целлюлоза — белое твердое волокнистое вещество, не растворимое в воде и обычных растворителях (спирте, эфире, ацетоне). Нерастворимость целлюлозы и механическая прочность ее волокон обусловлены возникновением большого числа водородных связей между макромолекулами, имеющими неразветвлённое строение.
Однако, целлюлоза хорошо растворяется в растворе гидроксида меди (I) в аммиачной воде — реактиве Швейцера.
Химические свойства: При нагревании с разбавленными кислотами целлюлоза подвергается гидролизу, образуя глюкозу:
Гидролиз целлюлозы также протекает постадийно.
В присутствии концентрированной серной кислоты с концентрированной азотной кислотой образует сложные эфиры — моно-, ди- и тринитроцеллюлозу:
Тринитроцеллюлоза используется как мощное взрывчатое вещество и в изготовлении бездымного пороха. В технике продукт на основе тринитроцеллюлозы называют пироксилином, а на основе динитроцеллюлозы — коллоксилином. Из коллоксилина изготавливают коллодиум, применяемый в медицине, а из смеси коллоксилина с камфорой — целлулоид.
С уксусной кислотой или с уксусным ангидридом целлюлоза образует сложные эфиры — моно-, ди- и триацетилцеллюлозу. Они используются в производстве ацетатного шелка, негорючей фотопленки и органического стекла, пропускающего ультрафиолетовые лучи.
Из целлюлозы получают вискозный шелк и целлофан. Оба продукта по составу состоят из целлюлозы. Однако в отличие от обычной целлюлозы, в нитях вискозного шелка и в целлофане макромолекулы расположены в одном направлении. Это достигается в ходе ряда химических и физических превращений.
Поскольку в составе целлюлозы отсутствует альдегидная группа, то она, как и крахмал, не вступает в реакцию «серебряного зеркала». Целлюлоза хорошо горит:
При сильном нагревании в отсутствии воздуха целлюлоза разлагается -подвергается пиролизу. При пиролизе образуются древесный уголь, вода и органические вещества — метан, метанол, уксусная кислота, ацетон и др. В виде льна и хлопка целлюлоза используется в производстве тканей. Большое ее количество расходуется на производство бумаги и этилового спирта.
Выводы:
- Большинство углеводов — природные полимеры с общей формулой Cn(H2O)m.
- Углеводы подразделяются на моносахариды, дисахариды и полисахариды.
- Моносахариды — углеводы, не подвергающиеся гидролизу.
- Дисахариды — углеводы, при гидролизе которых из одной молекулы образуются две молекулы моносахаридов.
- Полисахариды — углеводы, при гидролизе которых из одной молекулы образуется много молекул моносахарида.
- Окончание «-оза» в названии вещества означает его принадлежность к углеводам.
- Фруктоза и галактоза — изомеры глюкозы.
- В растворе глюкоза существует в форме пятиатомного альдегидоспирта, а также в
 и
и 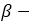 циклических формах.
циклических формах. - Явление превращения
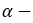 и
и 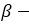 форм глюкозы друг в друга называется таутомерией, а
форм глюкозы друг в друга называется таутомерией, а 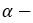 и
и 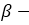 формы — таутомерами.
формы — таутомерами. - В кристаллическом состоянии глюкоза находится в циклической
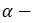 форме.
форме. - Под действием оксида серебра (I) или при слабом нагревании с гидроксидом меди (II) глюкоза окисляется в глюконовую кислоту.
- В щелочной среде глюкоза с гидроксидом меди (II) образует ярко-синий раствор сахарата меди (II).
- В зависимости от условий глюкоза подвергается брожению и превращается в этиловый спирт, масляную кислоту и молочную кислоту.
- Фруктоза — пятиатомный кетоноспирт; она не окисляется оксидом серебра (I) и гидроксидом меди (II).
- В молекуле сахарозы остатки
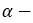 глюкозы и
глюкозы и 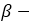 фруктозы соединены между собой гликозидной связью.
фруктозы соединены между собой гликозидной связью. - Сахароза не окисляется оксидом серебра (I) и гидроксидом меди (II).
- Мальтоза, лактоза, а также глюкоза, рибоза и дезоксирибоза относятся к восстанавливающим углеводам.
- Крахмал, целлюлоза и гликоген — полисахариды.
- Крахмал состоит из остатков
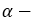 глюкозы, а целлюлоза —
глюкозы, а целлюлоза — 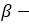 глюкозы.
глюкозы. - Макромолекулы крахмала имеют как разветвленное, так и неразветвлённое строение.
- Макромолекулы крахмала неразветвлённого строения называются амилозой, а разветвленного строения — амилопектином.
- В горячей воде крахмал образует крахмальный клейстер.
- Под действием йода крахмал окрашивается в синий цвет.
- Целлюлоза — биополимер неразветвлённого строения.
- Целлюлоза хорошо растворяется в растворе гидроксида меди (II) в аммиачной воде.
- Сложные эфиры целлюлозы находят широкое применение.
Пример №14
Назовите альдегиды а и b по Международной номенклатуре.
Решение:
По рациональной номенклатуре альдегиды называют как производные уксусного альдегида; например, вышеприведенный 2-метилпропаналь называется как диметилуксусный альдегид. Однако, этот способ применяется редко.
Тривиальные названия альдегидов производят от тривиальных названий карбоновых кислот, в которые они превращаются при окислении, например, муравьиный альдегид, уксусный альдегид, пропионовый альдегид и др.
Изомерия:Внутриклассовая структурная изомерия альдегидов обусловлена строением углеродной цепи, к которой присоединена альдегидная группа, и начинается с четвертого представителя гомологического ряда:
Предельные альдегиды и кетоны с одинаковым числом атомов углерода образуют межклассовую изомерию:
У альдегидов оптическая изомерия начинается с 2-метилбутаналя. В ее молекуле третичный атом углерода связан с четырьмя разными атомами и атомными группами (-Н, -СН3, -СНО, -С2Н5), в результате чего она существует в виде двух оптических изомеров:
Названия кетонов по Международной номенклатуре образуют из названия алкана, соответствующего самой длинной углеродной цепи, содержащей атом углерода С=O группы, с добавлением окончания «-он»:
Начиная с кетона состава С5Н10О указывают и номер атома углерода, связанного с атомом кислорода. Нумерация цепи начинается с того конца, к которому ближе 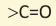 рациональной номенклатуре к названиям радикалов, связанных
рациональной номенклатуре к названиям радикалов, связанных 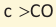 кетон«; при этом название меньшего радикала указывают вначале:
кетон«; при этом название меньшего радикала указывают вначале:
В кетонах межклассовая изомерия начинается с первого представителя гомологического ряда, а внутриклассовая — с третьего (С5Н10О).
Получение, строение и физические свойства:
Для консервации анатомических препаратов, а также для обработки хирургических инструментов, с целью их дезинфекции, используют формалин.
Альдегиды получают следующими способами.
1. Окисление или дегидрирование первичных спиртов. Альдегиды можно получить окислением первичных спиртов:
Например, при пропускании воздуха и паров этанола над раскаленной медной сеткой, покрытой пленкой оксида меди (II), образуется ацетальдегид:
В промышленности каталитическим окислением метанола кислородом воздуха получают формальдегид:
При пропускании паров первичных спиртов над катализатором (Сu, Ag или Pt) при 200-300°С спирты дегидрируются с образованием альдегидов:
При окислении одноатомных вторичных спиртов R1CH(OH)R2 образуются кетоны:
2. Окисление углеводородов. В промышленности каталитическим окислением метана кислородом воздуха получают формальдегид:
Для предотвращения окисления формальдегида в муравьиную кислоту смесь метана и воздуха пропускают через реакционную зону с большой скоростью.
Каталитическим окислением этилена получают ацетальдегид:
3. Гидратация ацетилена. В промышленности ацетальдегид получают также каталитической гидратацией ацетилена по реакции Кучерова:
При гидратации гомологов ацетилена образуются кетоны:
В промышленности ацетон получают сухой перегонкой древесины, окислением изопропилбензола и пропанола-2.
Строение: Электронное строение альдегидов на примере молекулы формальдегида приведено ниже:
Электронное строение молекулы формальдегида (а) и образование 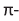 (b).В альдегидной группе атом углерода находится в состоянии sp2-гибридизации. Три
(b).В альдегидной группе атом углерода находится в состоянии sp2-гибридизации. Три 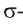 (а). По этой причине молекула формальдегида имеет плоское строение, р-орбиталь атома углерода, не участвующего в гибридизации путем бокового перекрывания с р-орбиталью атома кислорода, образует
(а). По этой причине молекула формальдегида имеет плоское строение, р-орбиталь атома углерода, не участвующего в гибридизации путем бокового перекрывания с р-орбиталью атома кислорода, образует 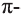
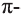
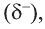
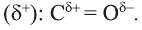
Поляризация С=0 связи наглядно видна на карте электронной плотности молекулы формальдегида: частичный отрицательный заряд (красная область) располагается вокруг атома кислорода, а частичный положительный (синяя область) — вокруг атома углерода.
Примечание. На карте электронной плотности двойную С=0 связь указывают одним стержнем.
Поляризация 
Физические свойства: Из-за отсутствия в составе альдегидов -ОН группы их молекулы не образуют между собой водородные связи. Поэтому температура кипения альдегидов ниже температуры кипения спиртов и карбоновых кислот с тем же числом атомов углерода в молекуле.
Первый представитель гомологического ряда альдегидов — формальдегид -газообразное вещество, следующие — жидкости, а высшие — твердые вещества.
Формальдегид и ацетальдегид хорошо растворяются в воде. С ростом молекулярной массы растворимость альдегидов в воде уменьшается; бутаналь в воде практически не растворим.
Запах альдегидов различный. Например, формальдегид имеет неприятный запах; у высших альдегидов приятный запах, поэтому они широко используются в парфюмерии.
Разработал способы получения новых представителей альдегидов, кетонов и спиртов, пригодных для применения в качестве синтетических душистых веществ.
Формальдегид — бесцветный газ с резким запахом, очень ядовит; его 40%-ный водный раствор называют формалином.
Ацетальдегид — легколетучая 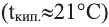 ядовита.
ядовита.
Ацетон — бесцветная, горючая жидкость с характерным запахом. Он в воде хорошо растворим; кипит при температуре 56°С. Хорошо растворяет жиры, смолы и другие вещества; поэтому является одним из наиболее широко применяемых растворителей.
Химические свойства и применение:
Мебельные гарнитуры, изготовленные из прессованных древесных опилок и фенолформальдегидной смолы, обычно содержат до 0,01% формальдегида. Формальдегид, постепенно испаряющийся с поверхности этой мебели, представляет определенную опасность для человека.
Химические свойства: Альдегиды из-за наличия в их молекулах полярной С=O связи являются реакционноспособными веществами. Для них характерны реакции окисления и присоединения.
I. Реакции окисления. Альдегиды при нагревании с раствором оксида се-ребра (I) в аммиачной воде 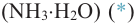
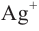 (а), например:
(а), например:
Эта реакция называется реакцией «серебряного зеркала» и используется для определения альдегидов (качественная реакция альдегидов).
* — из-за нерастворимости Ag2O в воде обычно используют раствор оксида серебра (I) в аммиачной воде (реактив Толленса).
Примечание: Поскольку в реакции «серебряного зеркала» аммичная вода берется в избытке, то карбоновая кислота образуется в виде аммонийной соли.
Альдегиды окисляются также и под действием свежеосажденного гидроксида меди (II). При этом вначале образуется желтый осадок гидроксида меди (I), который при слабом нагревании разлагается до оксида меди (I) красного цвета (b):
Эта реакция также является характерной реакцией альдегидов и применяется для их определения (качественная реакция альдегидов).
Общее уравнение горения альдегидов и кетонов (СnН2nО) выражают следующим образом:
Альдегиды окисляются даже кислородом воздуха. Поэтому при длительном хранении альдегиды держат в запаянной посуде в атмосфере азота.
В отличие от альдегидов, кетоны не окисляются ни гидроксидом меди (II), ни по реакции «серебряного зеркала «.
II. Реакции присоединения. Реакции присоединения к альдегидам и кетонам происходят в результате разрыва 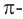
При гидрировании альдегидов образуются первичные спирты, а кетонов — вторичные спирты.
Пример №18
Почему метановая кислота самая сильная в ряду предельных одноосновных карбоновых кислот?
Объяснение: За исключением метановой кислоты (Н-СООН) во всех членах ряда карбоксильная группа связана с алкильным радикалом (R): R-COOH. Поскольку алкильный радикал имеет электронодонорные свойства, то он отталкивает электронную плотность связи 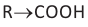 а). В результате связь О-Н упрочняется и в водном растворе отщепление водорода в виде иона от молекулы RCOOH затрудняется:
а). В результате связь О-Н упрочняется и в водном растворе отщепление водорода в виде иона от молекулы RCOOH затрудняется:
Углеводородный радикал (R) уменьшает кислотные свойства
Карбоновые кислоты взаимодействуют с активными металлами, щелочами, основными оксидами, с солями более слабых кислот и аммиаком:
При действии дегидратирующих веществ карбоновые кислоты, за исключением муравьиной кислоты, превращаются в соответствующие ангидриды:
Реакции этерификации: Карбоновые кислоты в присутствии серной кислоты реагируют со спиртами, образуя сложные эфиры, например:
Такой тип реакций называют реакциями этерификации. Вода в реакции образуется из -ОН группы карбоновой кислоты и атома Н (-ОН) группы спирта.
Замещение атомов водорода в углеводородном радикале:
В карбоновых кислотах атомы водорода углеродного атома, связанного непосредственно с карбоксильной группой, легко замещаются атомами хлора или брома:
Муравьиную кислоту в промышленности получают каталитическим окислением метана:
Ее получают также действием разбавленной серной кислоты на формиат натрия, полученный взаимодействием оксида углерода (II) с гидроксидом
Знаете ли вы… В природе муравьиная кислота встречается в выделениях муравьев, в крапиве и еловых иглах. Жжение кожи крапивой обусловлено действием содержащейся в ее соке муравьиной кислоты.
Муравьиная кислота — бесцветная жидкость с резким запахом, кипит при 101°С. С водой она смешивается в любых соотношениях. На коже образует ожоги. По ряду свойств муравьиная кислота отличается от других карбоновых кислот:
- В гомологическом ряду она самая сильная кислота; по степени диссоциации близка к ортофосфорной кислоте (кислотам средней силы).
- Муравьиная кислота и ее соли, в отличие от других карбоновых кислот, окисляются оксидом серебра (I) и гидроксидом меди (II):
3. Разложением муравьиной кислоты в лаборатории получают монооксид углерода (II):
Применение: Муравьиная кислота применяется в качестве восстановителя при синтезе органических соединений, а также для получения щавелевой кислоты. Кроме того, она применяется в пищевой промышленности для консервирования и дезинфекции, при крашении тканей и бумаги, в медицине под названием муравьиный спирт для лечения ревматизма (муравьиный спирт -1,25%-ный спиртовой раствор муравьиной кислоты). Ее сложные эфиры используются в качестве растворителей и душистых веществ.
Уксусную кислоту получают несколькими способами; например, каталитическим окислением уксусного альдегида и бутана:
Второй способ экономически более выгодный.
Ее получают и окислением этанола в присутствии катализатора или бактерий:
Уксусную кислоту получают также взаимодействием метанола с оксидом углерода (II) и из продуктов пиролиза древесины:
Уксусная кислота — бесцветная жидкость с резким запахом. Ниже 16,6°С она превращается в похожую на лед массу. Поэтому ее иногда называют «ледяной» уксусной кислотой. Смешивается с водой в любых соотношениях. Ее 3-5%-ный водный раствор называют уксусом («столовый уксус»), а 70-80%-ный раствор -«уксусной эссенцией».
Применение: Уксусная кислота применяется в производстве пластмасс, красителей (индиго), лекарств (аспирин, фенацетин), ацетатного волокна, негорючей кино- и фотопленок, пропускающих ультрафиолетовые лучи стекол и др.
Соли уксусной кислоты применяются при крашении тканей, ацетат свинца (II) — в качестве белой краски. Ацетат меди (II) и некоторые производные уксусной кислоты, например, натриевая соль 2,4-дихлорфеноксиуксусной кислоты (b) применяются в сельском хозяйстве в качестве гербицидов в борьбе с сорняками.
Уксусная кислота применяется при консервировании овощей, а ее эфиры — в кондитерской промышленности и в производстве духов.
В быту под названием «столовый уксус» (с) она используется как приправа к пище.
Уксусную кислоту можно отличить по характерному запаху.
Предельные и непредельные высшие карбоновые кислоты:
Одни из веществ, которые составляют наш ежедневный рацион, — это жиры. Как вам известно из жиров подсолнечное, оливковое и др. масла — жидкие, сливочное, козье и др. масла -твердые вещества.
В молекулах высших карбоновых кислот, как правило, содержатся от 10-ти до 20-ти атомов углерода. Многие из них в виде сложных эфиров глицерина входят в состав жиров. Высшие карбоновые кислоты, образующие жиры, называют жирными кислотами.
Жирные кислоты подразделяются па предельные и непредельные. В молекуле непредельных жирных кислот содержится минимум одна двойная С=С связь.
Особенности жирных кислот:
- В неразветвленной цепи молекул жирных кислот содержится четное число, как правило от 10-ти до 20-ти атомов углерода.
- В природе (в виде триглицеридов) наиболее распространены пальмитиновая, стеариновая и олеиновая кислоты.
- Остатки непредельных жирных кислот в составе жиров встречаются, главным образом, в форме цис-изомера.
- Если не считать С=С связь в непредельных кислотах, то в молекулах жирных кислот, кроме карбоксильной группы, нет других функциональных групп.
- Температура плавления непредельных жирных кислот ниже, чем температура плавления предельных жирных кислот, содержащих столько же атомов углерода. С ростом числа С=С связей в молекулах жирных кислот температура их плавления уменьшается.
К предельным жирным кислотам относятся пальмитиновая (С15Н31СООН) и стериновая (С17Н35СООН) кислоты, а к непредельным — олеиновая (С17Н33СООН), линолевая (С17Н31СООН) и линоленовая (С17Н29СООН) кислоты. Пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты.
(а) Шаро-стержневая модель молекулы пальмитиновой кислоты
Обе кислоты вступают в реакции, характерные для предельных карбоновых кислот, например:
Соли пальмитиновой и стеариновой кислот называются, соответственно, папьмитатами и стеаратами. Их натриевые и калиевые соли являются основными компонентами мыл.
Смесь пальмитиновой и стеариновой кислот применяется для изготовления * стеариновых свеч.
Высшие карболовые кислоты получают гидролизом жиров (стр. 107) и каталитическим окислением парафинов (стр. 78).
Примечание. Кальциевые и магниевые соли высших карбоновых кислот в воде не растворимы.
Непредельныекарбоновые кислоты:
Олеиновая кислота — непредельная одноосновная карбоновая кислота, содержащая в молекуле одну С=С связь:
Олеиновая кислота относится к гомологическому ряду непредельных карбоновых кислот с общей формулой CnH2n-1COOH 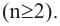
Олеиновая кислота с основаниями образует соли, а со спиртами — сложные эфиры. Как непредельное соединение она вступает в реакции присоединения:
Олеиновая кислота является цис-изомером кислоты состава С17Н33СООН. Транс-изомер этой кислоты называют элаидииовой кислотой. В отличие от жидкой олеиновой кислоты, элаидиновая кислота при обычных условиях (20°С) — твердое вещество и в природе в составе жиров не встречается.
Молекулы линолевой (С17Н31ООН) и линоленовой (С17Н29СООН) кислот содержат, соответственно, две и три С=С связи. Обе кислоты, вместе с олеиновой кислотой, в виде сложных эфиров глицерина входят в состав растительных жиров — оливкового, подсолнечного, кукурузного и миндального масел.
Спирты. учебный портал acetyl
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

