Количество атомов, линия заданий 34, тесты егэ по химии
1) Общая формула вещества — CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 — 13,33 — 10,48 — 30,48 = 45,71%
x : y : z : m = 45,71/12 : 10,48/1 : 30,48/16 : 13,33/14
Соотношение атомов С, H, O и N
x : y : z : m = 3,81 : 10,48 : 1,91 : 0,95 = 4 : 11 : 2 : 1
Молекулярная формула — C4H11O2N
2) Структурная формула
CH3COO[NH3CH2CH3]
3) Уравнение реакции
CH3COOAg Br[NH3CH2CH3] = CH3COO[NH3CH2CH3] AgBr
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса — 7691.
Часть 2 — 2022 задание 36

Часть 2 — 2022

Задание 36 • • • Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель. KIO 3 KI . . . → I 2 K 2 SO 4 . . Na 2 SO 3 . . . H 2 SO 4 →. . . Mn. SO 4 K 2 SO 4 H 2 O Cr 2(SO 4)3 Cl 2 . . . → K 2 Cr. O 4 KCl . . . H 2 O Cr. O 3 . . . H 2 SO 4 → Br 2 . . . K 2 SO 4 H 2 O Mn. O 2 KCl. O 3 . . . → K 2 Mn. O 4 . . . CO 2

Задание 36 • • Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель. K 2 SO 3 . . . H 2 O →. . . Mn. O 2 KOH H 2 S . . . H 2 SO 4 → S Mn. SO 4 . . . H 2 O Cl 2 NH 3 • H 2 O →. . . NH 4 Cl … NH 3 Na. Cl. O →. . . Na. Cl …

Задание 37 • Оксид железа (III) сплавили с твёрдым карбонатом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. Через образовавшийся раствор пропустили аммиак, в результате образовался бурый осадок. Осадок отделили и прокалили. Напишите уравнения четырёх описанных реакций.

Задание 37 • Гидросульфит калия обработали бромоводородной кислотой. Выделившийся при этом газ смешали с сероводородом. Полученное твёрдое вещество растворили в горячей концентрированной азотной кислоте, при этом наблюдалось интенсивное выделение бурого газа. Газ при охлаждении пропустили через раствор гидроксида натрия. Напишите уравнения четырёх описанных реакций.

Задание 37 • Карбид алюминия полностью растворили в бромоводородной кислоте. К полученному раствору добавили раствор сульфита калия, при этом наблюдали образование белого осадка и выделение бесцветного газа. Газ поглотили раствором дихромата калия в присутствии серной кислоты. Образовавшуюся соль хрома выделили и добавили к раствору нитрата бария, наблюдали выделение осадка. Напишите уравнения четырёх описанных реакций.

Задание 37 • Натрий сожгли на воздухе. Образовавшееся вещество при нагревании обработали хлороводородом. Полученное простое вещество жёлто-зелёного цвета при нагревании вступило в реакцию с оксидом хрома (III) в присутствии гидроксида калия. При обработке раствора одной из образовавшихся солей хлоридом бария выпал жёлтый осадок. Напишите уравнения четырёх описанных реакций.

Задание 37 • Цинк полностью растворили в концентрированном растворе гидроксида калия. Образовавшийся прозрачный раствор выпарили, а затем прокалили. Твёрдый остаток растворили в необходимом количестве соляной кислоты. К образовавшемуся прозрачному раствору добавили сульфид аммония и наблюдали образование белого осадка. Напишите уравнения четырёх описанных реакций.

Задание 37 • Железную окалину растворили в концентрированной азотной кислоте. К полученному раствору добавили раствор гидроксида натрия. Выделившийся осадок отделили и прокалили. Образовавшийся твёрдый остаток сплавили с железом. Напишите уравнения четырёх описанных реакций.

Задание 37 • Гидрокарбонат натрия обработали раствором гидроксида натрия. Полученный раствор смешали с раствором бромида железа (III), в результате чего выпал бурый осадок и образовался газ. Осадок отделили и прокалили. Твёрдый остаток растворили в йодоводородной кислоте. Напишите уравнения четырёх описанных реакций.

Задание 37 • Оксид цинка сплавили с твердым карбонатом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид натрия, в результате чего образовался белый осадок. Осадок отделили, высушили, а затем сожгли в избытке кислорода. Напишите уравнения четырёх описанных реакций.
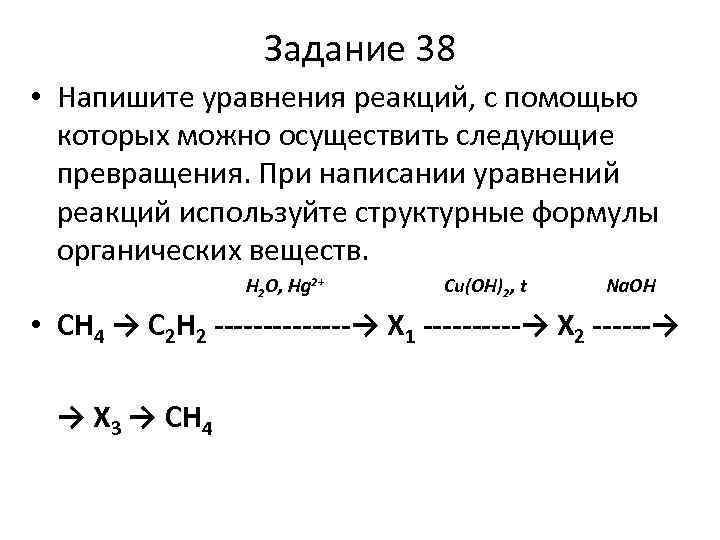
Задание 38 • Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. При написании уравнений реакций используйте структурные формулы органических веществ. Н 2 О, Hg 2 Cu(OH)2, t Na. OH • СН 4 → С 2 Н 2 ——-→ Х 1 ——→ Х 2 ——→ → Х 3 → СН 4
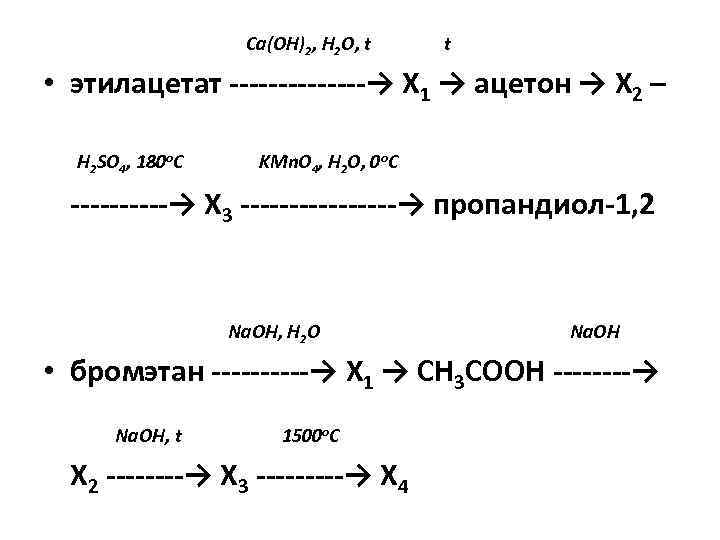
Са(ОН)2, Н 2 О, t t • этилацетат ——-→ Х 1 → ацетон → Х 2 – H 2 SO 4, 180 o. C KMn. O 4, H 2 O, 0 o. C ——→ Х 3 ———→ пропандиол-1, 2 Na. OH, Н 2 О Na. OH • бромэтан ——→ X 1 → CH 3 COOH —-→ Na. OH, t 1500 o. C Х 2 —-→ Х 3 ——→ X 4
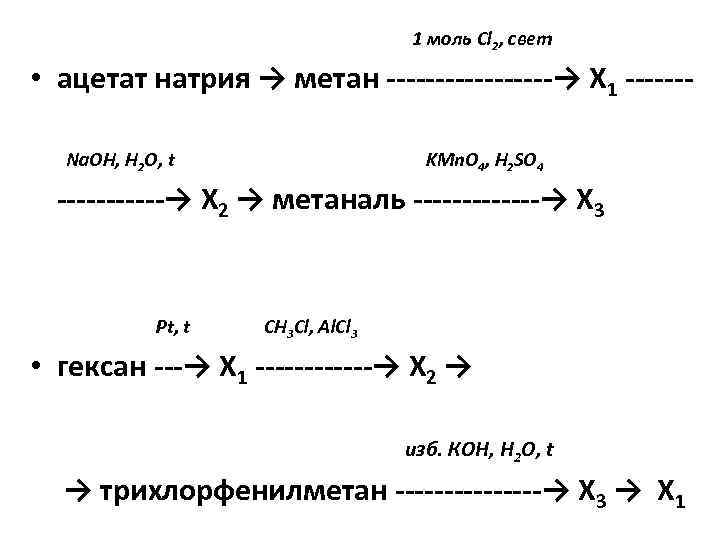
1 моль Cl 2, свет • ацетат натрия → метан ———→ X 1 ——Na. OH, H 2 O, t KMn. O 4, H 2 SO 4 ——→ Х 2 → метаналь ——-→ X 3 Pt, t CH 3 Cl, Al. Cl 3 • гексан —→ Х 1 ——→ X 2 → изб. КОН, H 2 O, t → трихлорфенилметан ———→ Х 3 → X 1
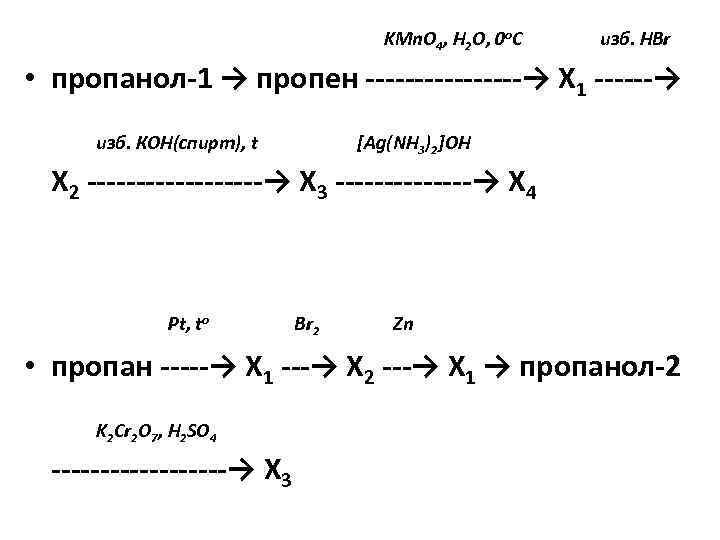
KMn. O 4, H 2 O, 0 o. C изб. НBr • пропанол-1 → пропен ———→ Х 1 ——→ изб. КОН(спирт), t [Ag(NH 3)2]OH Х 2 ———→ Х 3 ——-→ Х 4 Pt, to Br 2 Zn • пропан ——→ X 1 —→ Х 2 —→ Х 1 → пропанол-2 K 2 Cr 2 O 7, H 2 SO 4 ———→ X 3

Задание 39 • В 250 мл воды растворили 13, 8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе. • Газ, выделившийся при взаимодействии 7, 4 г нитрида кальция с 9 г воды, полностью поглощён 200 мл 3, 5%-ного раствора соляной кислоты (ρ= 1, 05 г/мл). Определите массовую долю хлорида аммония в образовавшемся растворе.

Задание 39 • При растворении пероксида лития Li 2 O 2 в тёплой воде выделяется кислород. Определите массовую долю гидроксида лития в растворе, полученном растворением 2, 3 г пероксида лития в 62 г воды. Какой максимальный объем углекислого газа (н. у. ) может быть поглощён получившейся щёлочью? • При сливании 160 г 10%-ного раствора нитрата бария и 50 г 11%-ного раствора хромата калия выпал осадок. Рассчитайте массовую долю нитрата бария в образовавшемся растворе.

Задание 39 • Рассчитайте массовую долю азотной кислоты в растворе, полученном при пропускании 0, 672 л (н. у. ) сероводорода через 180 г 9%ного раствора нитрата серебра. • В 110 мл 9%-ной хлороводородной кислоты (плотностью 1, 04 г/мл) растворили газообразный аммиак, выделившийся при полном гидролизе 2, 96 г нитрида кальция. Определите массовую долю хлороводорода в полученном при этом растворе.

Задание 39 • Смесь безводных сульфата алюминия и хлорида меди (II) растворили в воде и добавили к избытку раствора гидроксида натрия. При этом образовалось 19, 6 г осадка. А если тот же раствор солей добавить к раствору нитрата бария, то выделится 69, 9 г осадка. Определите массовую долю сульфата алюминия в исходной смеси. • При взаимодействии 24, 3 г бромоводорода с 80 мл 95%-ной серной кислоты (плотность равна 1, 8 г/мл) выделился оксид серы (IV). Этот газ полностью поглотили раствором гидроксида бария массой 570 г с массовой долей 15%. Вычислите массовую долю гидроксида бария в полученном растворе.

Задание 40 • При сгорании 37, 8 г нециклического органического вещества получили 123, 2 г углекислого газа и 37, 8 г воды. Известно, что в результате присоединения 1 моль брома к 1 моль этого вещества преимущественно образуется соединение, содержащее атомы брома, связанные с первичными атомами углерода. На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции данного вещества с бромом, если реагенты взяты в молярном соотношении 1: 1.

Задание 40 • При сгорании 18, 4 г органического вещества получили 17, 92 л углекислого газа (н. у. ) и 21, 6 г воды. Известно, что это органическое вещество вступает в реакцию замещения с хлороводородом. На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции данного вещества с хлороводородом.

Задание 40 • Некоторое органическое соединение содержит 69, 6% кислорода по массе. Молярная масса этого соединения в 1, 586 раза больше молярной массы воздуха. Известно также, что это вещество способно вступать в реакцию этерификации с пропанолом-2. На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции данного вещества с пропанолом-2.

Задание 40 • При сгорании 4, 48 л (н. у. ) газообразного органического вещества получили 35, 2 г углекислого газа и 10, 8 мл воды. Плотность этого вещества составляет 2, 41 г/л (н. у. ). Известно также, что это вещество не реагирует с аммиачным раствором оксида серебра, а при реакции его с избытком бромной воды происходит присоединение атомов брома только ко вторичным атомам углерода. На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции этого вещества с избытком бромной воды.

Задание 40 • Некоторое органическое соединение содержит 40, 0% углерода и 53, 3% кислорода по массе. Известно, что это соединение реагирует с оксидом меди (II). На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции данного вещества с оксидом меди (II).

Задание 40 • При сгорании 11, 6 г органического вещества получили 13, 44 л (н. у. ) углекислого газа и 10, 8 мл воды. Плотность паров этого вещества 2, 59 г/л (н. у. ). Известно, что это вещество реагирует с гидроксидом меди (II). На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) запишите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции данного вещества с гидроксидом меди (II).

Задание 40 • При сжигании органического вещества массой 11, 25 г выделилось 5, 6 л (н. у. ) углекислого газа и 2, 25 г воды. Известно, что вещество при нагревании разлагается на три составляющих. Продукты разложения содержат одинаковое количество воды, углекислого и угарного газов. Также известно, что при реакции с хлором образуется равное количество хлороводорода и углекислого газа. На основании данных условия задачи: 1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества; 2) установите молекулярную формулу органического вещества; 3) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение разложения этого вещества, а также уравнение реакции его с хлором.

