- Видео
- Получение кислорода
- Правила составления уравнений овр методом полуреакций
- Пример составления уравнения овр для кислотной среды
- Пример составления уравнения овр для нейтральной среды
- Составление и решение химических уравнений
- Тренировочные задания
- Урок 1: окислительно-восстановительные реакции ✎
- Физические свойства кислорода
- Химические свойства кислорода
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 MnO2 O2↑
4K2Cr2O7 = 4K2CrO4 2Cr2O3 3 O2↑
2KNO3 = 2KNO2 O2↑
2KClO3 = 2KCl 3 O2↑
Правила составления уравнений овр методом полуреакций
- На первом этапе в ионном виде записывают полуреакцию окисления и полуреакцию восстановления, в которых указывают вещество-восстановитель и вещество-окислитель, с продуктами их реакции.
- Сильные электролиты записываются в виде ионов.
- Слабые электролиты, газы и твердые вещества, выпадающие в осадок — в виде молекул.
- Продукты реакции между восстановителем и окислителем устанавливаются по справочникам или по «шпаргалке«, приведенной на странице «Определение продуктов ОВР» (это самый сложный этап для начинающих).
- Записывают схему реакции, в которой многоточием обозначают неизвестные продукты реакции.
- Что делать с кислородом:
- Если в исходном веществе кислорода содержится больше, чем в продуктах реакции, то «лишний» кислород в растворах с кислой средой связывается с катионами водорода, образуя молекулы воды (O-2 2H =H2O); в нейтральных растворах — в гидроксид-ионы: O-2 H2O=2OH—;
- Если в исходном веществе кислорода содержится меньше, чем в продуктах реакции, то «недостающий» кислород «забирается» из молекул воды (в растворах с кислой и нейтральной средой): H2O=O-2 2H ; в щелочных растворах — за счет гидроксид-ионов: 2OH—=O-2 H2O.
- В левой и правой частях уравнения должны быть равны суммарное число и знак электрических зарядов.
Достоинства метода полуреакций:
- Работают с реально существующими ионами (MnO4—), а не виртуальными (Mn 7).
- Нет необходимости знать степени окисления атомов.
- Прослеживается роль среды, в которой происходит взаимодействие веществ.
- Не нужно знать все продукты реакции, они выводятся «сами собой» в процессе составления уравнения.
Пример составления уравнения овр для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
- S HNO3
- S0 → SO42- — процесс окисления восстановителя.
- NO3— → NO — процесс восстановления окислителя.
- Приводим в «порядок» первую полуреакцию окисления:
- S0 → SO42- — отличник должен здесь спросить, откуда справа взялся кислород? Немного терпения, сейчас все станет ясно.
- в правую часть схемы, где присутствует избыток кислорода, добавляется катион водорода:
S0 → SO42- H - у внимательного читателя тут же должен возникнуть вопрос — а откуда взялся катион водорода? Отвечаем: из молекулы воды, которая добавляется в левую часть схемы:
S0 H2O → SO42- H - Вот теперь настало время уравнять в обеих частях схемы кислород, который, теперь понятно, откуда взялся:
S0 4H2O → SO42- H - Теперь надо уравнять водород:
S0 4H2O → SO42- 8H - С атомами элементов в обеих частях схемы полный порядок, осталось разобраться с зарядами — в левой части заряд нулевой; в правой: (-2) 8( 1)= 6:
S0 4H2O-6e— → SO42- 8H
- Делаем аналогичную работу со второй полуреакцией восстановления:
- NO3— → NO
- Добавляем водород, в левую часть, где присутствует «лишний» кислород:
NO3— H → NO - В правую часть добавляем воду:
NO3— H → NO H2O - Уравниваем кислород:
NO3— H → NO 2H2O - Уравниваем водород:
NO3— 4H → NO 2H2O - Уравниваем заряды:
NO3— 4H 3e— → NO 2H2O
- Уравниваем кол-во электронов, которые были отданы и приняты в двух полуреакциях:
1| S0 4H2O-6e- → SO42- 8H 2| NO3- 4H 3e- → NO 2H2O
- Суммируем левые и правые части, предварительно умножив на коэффициент (2) члены второй полуреакции:
S0 4H2O-6e- = SO42- 8H 2NO3- 8H 6e- = 2NO 4H2O ------------------ S 4H2O 2NO3- 8H = SO42- 8H 2NO 4H2O
- Проводим сокращение одинаковых членов в левой и правой частях схемы и добавляем в пару к анионам «нужные» катионы, чтобы образовались молекулы, в нашем случае это будут молекулы азотной и серной кислоты, для этого мы добавим катион водорода (2H ):
S 2NO3- = SO42- 2NO 2H 2H
- Суммарное молекулярное уравнение:
S 2HNO3 = H2SO4 2NO — в результате взаимодействия серы с азотной кислотой получается серная кислота и оксид азота (II).
Пример составления уравнения овр для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Составляя уравнение ОВР методом полуреакций для нейтральной среды, одну полуреакцию составляют, как для кислотной среды — в левую часть схемы добавляют молекулу воды, в правую — катион водорода), вторую — как для щелочной (в левую часть добавляют молекулу воды, в правую — гидроксид-ион).
- Na2SO3 KMnO4 H2O
- SO32- → SO42- — процесс окисления восстановителя;
- MnO4— → MnO2 — процесс восстановления окислителя;
- Схема реакции:
SO32- MnO4— → SO42- MnO2 … - Составляем уравнения полуреакций:
3| SO32- H2O-2e- = SO42- 2H 2| MnO4- 2H2O 3e- = MnO2 4OH- ------------------------ 3SO32- 2MnO4- H2O = 3SO42- 2MnO2 2OH-
- Молекулярное уравнение:
3Na2SO3 2KMnO4 H2O = 3Na2SO4 2MnO2 2KOH
Еще один пример:
- S KMnO4 → ?
- S → SO42-
- MnO4— → MnO2
- Первую полуреакцию оформляем, как для кислотной среды; вторую — как для щелочной:
1| S 4H2O-6e- = SO42- 8H 2| MnO4- 2H2O 3e- = MnO2 4OH- ------------------ S 4H2O 4H2O 2MnO4- = SO42- 8H 8OH- 2MnO2
- Сокращаем обе части равенства на 8 молекул воды, и добавляем катионы калия:
S 4H2O 2MnO4- = SO42- 2MnO2 2K 2K - Молекулярное уравнение:
S 2KMnO4 = K2SO4 2MnO2
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Составление и решение химических уравнений
Химия – это наука о веществах, их свойствах и превращениях.
То есть, если с окружающими нас веществами ничего не происходит, то это не относится к химии. Но что значит, «ничего не происходит»? Если в поле нас вдруг застала гроза, и мы все промокли, как говорится «до нитки», то это ли не превращение: ведь одежда была сухой, а стала мокрой.
Если, к примеру взять железный гвоздь, обработать его напильником, а затем собрать железные опилки (Fe), то это ли так же не превращение: был гвоздь – стал порошок. Но если после этого собрать прибор и провести получение кислорода (О2): нагреть перманганат калия (КМпО4) и собрать в пробирку кислород, а затем в неё поместить раскалённые «до красна» эти железные опилки, то они вспыхнут ярким пламенем и после сгорания превратятся в порошок бурого цвета. И это так же превращение. Так где же химия? Несмотря на то, что в этих примерах меняется форма (железный гвоздь) и состояние одежды (сухая, мокрая) – это не превращения. Дело в том, что сам по себе гвоздь как был веществом (железо), так им и остался, несмотря на другую свою форму, а воду от дождя как впитала наша одежда, так потом его и испарила в атмосферу. Сама вода не изменилась. Так что же такое превращения с точки зрения химии?
Превращениями с точки зрения химии называются такие явления, которые сопровождаются изменением состава вещества. Возьмём в качестве примера тот же гвоздь. Не важно, какую форму он принял после обработки напильником, но после того как собранные от него железные опилки поместили в атмосферу кислорода — он превратился в оксид железа (Fe2O3). Значит, что-то всё-таки изменилось? Да, изменилось. Было вещество гвоздь, но под воздействием кислорода сформировалось новое вещество – оксид элемента железа. Молекулярное уравнение этого превращения можно отобразить следующими химическими символами:
4Fe 3O2 = 2Fe2O3 (1)
Для непосвящённого в химии человека сразу возникают вопросы. Что такое «молекулярное уравнение», что такое Fe? Почему поставлены цифры «4», «3», «2»? Что такое маленькие цифры «2» и «3» в формуле Fe2O3 ? Это значит, наступило время во всём разобраться по порядку.
Знаки химических элементов.
Несмотря на то, что химию начинают изучать в 8-м классе, а некоторые даже раньше, многим известен великий русский химик Д. И. Менделеев. И конечно же, его знаменитая «Периодическая система химических элементов». Иначе, проще, её называют «Таблица Менделеева».

В этой таблице, в соответствующем порядке, располагаются элементы. К настоящему времени их известно около 120. Названия многих элементов нам были известны ещё давно. Это: железо, алюминий, кислород, углерод, золото, кремний. Раньше мы не задумываясь применяли эти слова, отождествляя их с предметами: железный болт, алюминиевая проволока, кислород в атмосфере, золотое кольцо и т.д. и т.д. Но на самом деле все эти вещества (болт, проволока, кольцо) состоят из соответствующих им элементов. Весь парадокс состоит в том, что элемент нельзя потрогать, взять в руки. Как же так? В таблице Менделеева они есть, а взять их нельзя! Да, именно так. Химический элемент – это абстрактное (то есть отвлечённое) понятие, и используется в химии, впрочем как и в других науках, для расчётов, составления уравнений, при решении задач. Каждый элемент отличается от другого тем, что для него характерна своя электронная конфигурация атома. Количество протонов в ядре атома равно количеству электронов в его орбиталях. К примеру, водород – элемент №1. Его атом состоит из 1-го протона и 1-го электрона. Гелий – элемент №2. Его атом состоит из 2-х протонов и 2-х электронов. Литий – элемент №3. Его атом состоит из 3-х протонов и 3-х электронов. Дармштадтий – элемент №110. Его атом состоит из 110-и протонов и 110-и электронов.
Каждый элемент обозначается определённым символом, латинскими буквами, и имеет определённое прочтение в переводе с латинского. Например, водород имеет символ «Н», читается как «гидрогениум» или «аш». Кремний имеет символ «Si» читается как «силициум». Ртуть имеет символ «Нg» и читается как «гидраргирум». И так далее. Все эти обозначения можно найти в любом учебнике химии за 8-й класс. Для нас сейчас главное уяснить то, что при составлении химических уравнений, необходимо оперировать указанными символами элементов.
Простые и сложные вещества.
Обозначая единичными символами химических элементов различные вещества (Hg ртуть, Fe железо, Cu медь, Zn цинк, Al алюминий) мы по сути обозначаем простые вещества, то есть вещества, состоящие из атомов одного вида (содержащие одно и то же количество протонов и нейтронов в атоме). Например, если во взаимодействие вступают вещества железо и сера, то уравнение примет следующую форму записи:
Fe S = FeS (2)
К простым веществам относятся металлы (Ва, К, Na, Mg, Ag), а так же неметаллы (S, P, Si, Cl2, N2, O2, H2). Причём следует обратить
особое внимание на то, что все металлы обозначаются единичными символами: К, Ва, Са, Аl, V, Mg и т.д., а неметаллы – либо простыми символами: C,S,P или могут иметь различные индексы, которые указывают на их молекулярное строение: H2, Сl2, О2, J2, P4, S8. В дальнейшем это будет иметь очень большое значение при составлении уравнений. Совсем не трудно догадаться, что сложными веществами являются вещества, образованные из атомов разного вида, например,
1). Оксиды:
оксид алюминия Al2O3,  оксид натрия Na2O,
оксид натрия Na2O,
оксид меди CuO,
оксид цинка ZnO,
оксид титана Ti2O3 ,
угарный газ или оксид углерода ( 2) CO,
оксид серы ( 6) SO3
2). Основания:
гидроксид железа ( 3) Fe(OH)3,
гидроксид меди Cu(OH)2 ,
гидроксид калия или щёлочь калия КOH,
гидроксид натрия NaOH.
3). Кислоты:
соляная кислота HCl,
сернистая кислота H2SO3,
азотная кислота HNO3
4). Соли:
тиосульфат натрия Na2S2O3,
сульфат натрия или глауберова соль Na2SO4 ,
карбонат кальция или известняк СаCO3,
хлорид меди CuCl2
5). Органические вещества:
ацетат натрия СН3СООNa,
метан СН4,
ацетилен С2Н2 ,
глюкоза С6Н12О6
Наконец, после того как мы выяснили структуру различных веществ, можно приступать к составлению химических уравнений.
Химическое уравнение.
Само слово «уравнение» производное от слова «уравнять», т.е. разделить нечто на равные части. В математике уравнения составляют чуть ли не самую сущность этой науки. К примеру, можно привести такое простое уравнение, в котором левая и правая части будут равны «2» :
40 : (9 11) = (50 х 2) : ( 80 – 30 );
И в химических уравнениях тот же принцип: левая и правая части уравнения должны соответствовать одинаковым количествам атомов, участвующим в них элементов. Или, если приводится ионное уравнение, то в нём число частицтак же должно соответствовать этому требованию. Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков . Химическое уравнение по своей сути отражает ту или иную химическую реакцию, то есть процесс взаимодействия веществ, в процессе которых возникают новые вещества. Например, необходимо написать молекулярное уравнение реакции, в которой принимают участие хлорид бария ВаСl2 и серная кислота H2SO4. В результате этой реакции образуется нерастворимый осадок – сульфат бария ВаSO4 и соляная кислота НСl :
ВаСl2 H2SO4 = BaSO4 2НСl (3)
Прежде всего необходимо уяснить, что большая цифра «2», стоящая перед веществом НСlназывается коэффициентом, а малые цифры «2», «4» под формулами ВаСl2, H2SO4 ,BaSO4 называются индексами. И коэффициенты и индексы в химических уравнениях выполняют роль множителей, а не слагаемых. Что бы правильно записать химическое уравнение, необходимо расставить коэффициенты в уравнении реакции. Теперь приступим к подсчёту атомов элементов в левой и правой частях уравнения. В левой части уравнения: в веществе ВаСl2 содержатся 1 атом бария (Ва), 2 атома хлора (Сl). В веществе H2SO4: 2 атома водорода (Н), 1 атом серы (S) и 4 атома кислорода (О) . В правой части уравнения: в веществе BaSO4 1 атом бария (Ва) 1 атом серы (S) и 4 атома кислорода (О), в веществе НСl: 1 атом водорода (Н) и 1 атом хлора (Сl). Откуда следует, что в правой части уравнения количество атомов водорода и хлора вдвое меньше, чем в левой части. Следовательно, перед формулой НСl в правой части уравнения необходимо поставить коэффициент «2». Если теперь сложить количества атомов элементов, участвующих в данной реакции, и слева и справа, то получим следующий баланс:

В обеих частях уравнения количества атомов элементов, участвующих в реакции, равны, следовательно оно составлено правильно.

Химические уравнение и химические реакции
Как мы уже выяснили, химические уравнения являются отражением химических реакций. Химическими реакциями называются такие явления, в процессе которых происходит превращение одних веществ в другие. Среди их многообразия можно выделить два основных типа:
1). Реакции соединения
2). Реакции разложения.
В подавляющем своём большинстве химические реакции принадлежат к реакциям присоединения, поскольку с отдельно взятым веществом редко могут происходить изменения в его составе, если оно не подвергается воздействиям извне (растворению, нагреванию, действию света). Ничто так не характеризует химическое явление, или реакцию, как изменения, происходящие при взаимодействии двух и более веществ. Такие явления могут осуществляться самопроизвольно и сопровождаться повышением или понижением температуры, световыми эффектами, изменением цвета, образованием осадка, выделением газообразных продуктов, шумом.
Для наглядности приведём несколько уравнений, отражающих процессы реакций соединения, в процессе которых получаются хлорид натрия (NaCl), хлорид цинка (ZnCl2), осадок хлорида серебра (AgCl), хлорид алюминия (AlCl3)
Cl2 2Nа = 2NaCl (4)
СuCl2 Zn= ZnCl2 Сu (5)
AgNO3 КCl = AgCl 2KNO3 (6)
3HCl Al(OH)3 = AlCl3 3Н2О (7)
Cреди реакций соединения следует особым образом отметить следующие: замещения (5), обмена (6), и как частный случай реакции обмена – реакцию нейтрализации (7).
К реакциям замещения относятся такие, при осуществлении которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. В примере (5) атомы цинка замещают из раствора СuCl2 атомы меди, при этом цинк переходит в растворимую соль ZnCl2, а медь выделяется из раствора в металлическом состоянии.
К реакциям обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.В случае реакции (6) растворимые соли AgNO3 и КCl при сливании обоих растворов образуют нерастворимый осадок соли AgCl. При этом они обмениваются своими составными частями – катионами и анионами. Катионы калия К присоединяются к анионам NO3, а катионы серебра Ag – к анионам Cl—.
К особому, частному случаю, реакций обмена относится реакция нейтрализации. К реакциям нейтрализации относятся такие реакции, в процессе которых кислоты реагируют с основаниями, в результате образуется соль и вода. В примере (7) соляная кислота HCl, реагируя с основанием Al(OH)3 образует соль AlCl3 и воду. При этом катионы алюминия Al3 от основания обмениваются с анионами Сl— от кислоты. В итоге происходит нейтрализация соляной кислоты.
К реакциям разложения относятся такие, при котором из одного сложного образуются два и более новых простых или сложных веществ, но более простого состава. В качестве реакций можно привести такие, в процессе которых разлагаются 1). Нитрат калия(КNO3) с образованием нитрита калия (КNO2) и кислорода (O2); 2). Перманганат калия (KMnO4): образуются манганат калия (К2МnO4), оксид марганца (MnO2) и кислород (O2); 3). Карбонат кальция или мрамор; в процессе образуются углекислый газ (CO2) и оксид кальция (СаО)
2КNO3 =2КNO2 O2 (8)
2KMnO4 = К2МnO4 MnO2 O2 (9)
СаCO3 = CaO CO2 (10)
В реакции (8) из сложного вещества образуется одно сложное и одно простое. В реакции (9) – два сложных и одно простое. В реакции (10) – два сложных вещества , но более простых по составу
Разложению подвергаются все классы сложных веществ:
1). Оксиды: оксид серебра 2Ag2O = 4Ag O2 (11)
2). Гидроксиды: гидроксид железа 2Fe(OH)3 = Fe2O3 3H2O (12)
3). Кислоты: серная кислота H2SO4 = SO3 H2O (13)
4). Соли: карбонат кальция СаCO3 = СаO CO2 (14)
5). Органические вещества: спиртовое брожение глюкозы
С6Н12О6 = 2С2Н5ОH 2CO2 (15)
Согласно другой классификации, все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты – эндотермические. Критерием таких процессов является тепловой эффект реакции. Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана:
СН4 2O2 = СО2 2Н2О Q (16)
а к эндотермическим реакциям – реакции разложения, уже приводимые выше (11) – (15). Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции ( Q) или поглощается (-Q):
СаCO3 = СаO CO2 — Q (17)
Можно так же рассматривать все химические реакции по типу изменения степени окисления, участвующих в их превращениях элементов. К примеру, в реакции (17) участвующие в ней элементы не меняют свои степени окисления:
Са 2C 4O3-2 = Са 2O-2 C 4O2-2 (18)
А в реакции (16) элементы меняют свои степени окисления:
2Mg0 O20 = 2Mg 2O-2
Реакции такого типа относятся к окислительно-восстановительным. Они будут рассматриваться отдельно. Для составления уравнений по реакциям такого типа необходимо использовать метод полуреакцийи применять уравнение электронного баланса.
После приведения различных типов химических реакций, можно приступать к принципу составлений химических уравнений, иначе, подбору коэффициентов в левой и правой их частях.
СЛОЖНА-А-А 🙀 Ты же знаешь, что если не разобраться в теме сейчас, то потом придется исправлять оценки. Беги на бесплатное онлайн-занятие с репетитором (подробности тут 🎁).
Механизмы составления химических уравнений.
К какому бы типу ни относилась та или иная химическая реакция, её запись ( химическое уравнение) должна соответствовать условию равенства количества атомов до реакции и после реакции.
Существуют такие уравнения (17), которые не требуют уравнивания, т.е. расстановки коэффициентов. Но в большинстве случаях, как в примерах (3), (7), (15), необходимо предпринимать действия, направленные на уравнивание левой и правой частей уравнения. Какими же принципами необходимо руководствоваться в таких случаях? Существует ли какая ни будь система в подборе коэффициентов? Существует, и не одна. К таковым системам относятся:
1). Подбор коэффициентов по заданным формулам.
2). Составление по валентностям реагирующих веществ.
3). Составление по степеням окисления реагирующих веществ.
В первом случае полагается, что нам известны формулы реагирующих веществ как до реакции, так и после. К примеру, дано следующее уравнение:
N2 О2 →N2О3 (19)
Принято считать, что пока не установлено равенство между атомами элементов до реакции и после, знак равенства (=) в уравнении не ставится, а заменяется стрелкой (→). Теперь приступим к собственно уравниванию. В левой части уравнения имеются 2 атома азота (N2) и два атома кислорода (О2), а в правой – два атома азота (N2) и три атома кислорода (О3). По количеству атомов азота его уравнивать не надо, но по кислороду необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало три атома. Составим следующую схему:
до реакции после реакции
О2 О3
Определим наименьшее кратное между данными количествами атомов, это будет «6».
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение:
N2 3О2 →N2О3
Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
N2 3О2 → 2N2О3
Количества атомов кислорода и в левой и в правой частях уравнения стали равны, соответственно по 6 атомов:
3О2 → 2О3
Но количество атомов азота в обеих частях уравнения не будут соответствовать друг другу:
N2→ 2N2
В левой – два атома, в правой – четыре атома. Следовательно, что бы добиться равенства, необходимо удвоить количество азота в левой части уравнения, поставив коэффициент «2»:
2N2→ 2N2
Таким образом, равенство по азоту соблюдено и в целом, уравнение примет вид:
2N2 3О2 → 2N2О3
Теперь в уравнении можно вместо стрелки поставит знак равенства:
2N2 3О2 = 2N2О3 (20)
Приведём другой пример. Дано следующее уравнение реакции:
Р Cl2→ РCl5
В левой части уравнения имеется 1 атом фосфора (Р) и два атома хлора (Cl2), а в правой – один атом фосфора (Р) и пять атомов кислорода (Cl5). По количеству атомов фосфора его уравнивать не надо, но по хлору необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало пять атома. Составим следующую схему:
до реакции после реакции
Cl2 Cl5
Определим наименьшее кратное между данными количествами атомов, это будет «10».
Cl2 Cl5
10 /
Разделим это число в левой части уравнения по хлору на «2». Получим число «5», поставим его в решаемое уравнение:
Р 5Cl2→ РCl5
Так же разделим число «10» для правой части уравнения на «5». Получим число «2», так же поставим его в решаемое уравнение:
Р 5Cl2→ 2РCl5
Количества атомов хлора и в левой и в правой частях уравнения стали равны, соответственно по 10 атомов:
5Cl2→ 2Cl5
Но количество атомов фосфора в обеих частях уравнения не будут соответствовать друг другу:
Р → 2Р
Следовательно, что бы добиться равенства, необходимо удвоить количество фосфора в левой части уравнения, поставив коэффициент «2»:
2Р → 2Р
Таким образом, равенство по фосфору соблюдено и в целом, уравнение примет вид:
2Р 5Cl2= 2РCl5 (21)
При составлении уравнений по валентностям необходимо дать определение валентности и установить значения для наиболее известных элементов. Валентность – это одно из ранее применяемых понятий, в настоящее время в ряде школьных программ не используется. Но при его помощи легче объяснить принципы составления уравнений химических реакций. Под валентностью понимают число химических связей, которые тот или иной атом может образовывать с другим, или другими атомами. Валентность не имеет знака ( или — ) и обозначается римскими цифрами, как правило, над символами химических элементов, например:
I II III IV V
H O N S Р
Откуда берутся эти значения? Как их применять при составлении химических уравнений? Числовые значения валентностей элементов совпадают с их номером группы Периодической системы химических элементов Д. И. Менделеева (Таблица 1).

Для других элементов значения валентностей могут иметь иные значения, но никогда не больше номера группы, в которой они расположены. Причём для чётных номеров групп (IV и VI ) валентности элементов принимают только чётные значения, а для нечётных – могут иметь как чётные, так и нечётные значения (Таблица.2).

Конечно же, в значениях валентностей для некоторых элементов имеются исключения, но в каждом конкретном случае эти моменты обычно оговариваются. Теперь рассмотрим общий принцип составления химических уравнений по заданным валентностям для тех или иных элементов. Чаще всего данный метод приемлем в случае составления уравнений химических реакций соединения простых веществ, например, при взаимодействии с кислородом (реакции окисления). Допустим, необходимо отобразить реакцию окисления алюминия. Но напомним, что металлы обозначаются единичными атомами (Al), а неметаллы, находящиеся в газообразном состоянии – с индексами «2» — (О2). Сначала напишем общую схему реакции:
Al О2 →AlО
На данном этапе ещё не известно, какое правильное написание должно быть у оксида алюминия. И вот именно на данном этапе нам на помощь придёт знание валентностей элементов. Для алюминия и кислорода проставим их над предполагаемой формулой этого оксида:
III II
Al О
После чего «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III II
Al2 О3
Состав химического соединения Al2О3 определён. Дальнейшая схема уравнения реакции примет вид:
Al О2 →Al2О3
Остаётся только уравнять левую и правую его части. Поступим таким же способом, как в случае составления уравнения (19). Количества атомов кислорода уравняем, прибегая к нахождению наименьшего кратного:
до реакции после реакции
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение. Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
Al 3О2 → 2Al2О3
Что бы добиться равенства по алюминию, необходимо скорректировать его количество в левой части уравнения, поставив коэффициент «4»:
4Al 3О2 → 2Al2О3
Таким образом, равенство по алюминию и кислороду соблюдено и в целом, уравнение примет окончательный вид:
4Al 3О2 = 2Al2О3 (22)
Применяя метод валентностей, можно прогнозировать, какое вещество образуется в процессе химической реакции, как будет выглядеть его формула. Допустим, в реакцию соединения вступили азот и водород с соответствующими валентностями III и I. Напишем общую схему реакции:
N2 Н2 → NН
Для азота и водорода проставим валентности над предполагаемой формулой этого соединения:
III I
N Н
Как и прежде «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III I
N Н3
Дальнейшая схема уравнения реакции примет вид:
N2 Н2 → NН3
Уравнивая уже известным способом, через наименьшее кратное для водорода, равное «6»,получим искомые коэффициенты, и уравнение в целом:
N2 3Н2 = 2NН3 (23)
При составлении уравнений по степеням окисления реагирующих веществ необходимо напомнить, что степенью окисления того или иного элемента называется число принятых или отданных в процессе химической реакции электронов. Степень окисления в соединениях в основном, численно совпадает со значениями валентностей элемента. Но отличаются знаком. Например, для водорода валентность равна I, а степень окисления ( 1) или (-1). Для кислорода валентность равна II, а степень окисления (-2). Для азота валентности равны I,II,III,IV,V, а степени окисления (-3), ( 1), ( 2), ( 3), ( 4), ( 5) и т.д. Степени окисления наиболее часто применяемых в уравнениях элементов, приведены в таблице 3.

В случае реакций соединения принцип составления уравнений по степеням окисления такой же, как и при составлении по валентностям. Например, приведём уравнение реакции окисления хлора кислородом, в которой хлор образует соединение со степенью окисления 7. Запишем предполагаемое уравнение:
Cl2 О2 →ClО
Поставим над предполагаемым соединением ClО степени окисления соответствующих атомов:
7 -2
Cl О
Как и в предыдущих случаях установим, что искомая формула соединения примет вид:
7 -2
Cl2О7
Уравнение реакции примет следующий вид:
Cl2 О2 → Cl2О7
Уравнивая по кислороду, найдя наименьшее кратное между двумя и семи, равное «14», установим в итоге равенство:
2Cl2 7О2 = 2Cl2О7 (24)
Несколько иной способ необходимо применять со степенями окисления при составлении реакций обмена, нейтрализации, замещения. В ряде случаев предоставляется затруднительным узнать: какие соединения образуются при взаимодействии сложных веществ?
Как узнать: что получится в процессе реакции?
Действительно, как узнать: какие продукты реакции могут возникнут в ходе конкретной реакции? К примеру, что образуется при взаимодействии нитрата бария и сульфата калия?
Ва(NО3) 2 К2SO4 → ?
Может быть ВаК2(NО3) 2 SO4 ?Или Ва NО3SO4 К2? Или ещё что-то? Конечно же, в процессе этой реакции образуются соединения: ВаSO4 и КNО3 . А откуда это известно? И как правильно написать формулы веществ? Начнём с того, что чаще всего упускается из вида: с самого понятия «реакция обмена». Это значит, что при данных реакциях вещества меняются друг с другом составными частями. Поскольку реакции обмена в большинстве своём осуществляются межу основаниями, кислотами или солями, то частями, которыми они будут меняться, являются катионы металлов ( Na , Mg2 ,Al3 ,Ca2 ,Cr3 ), ионов Н или ОН—, анионов – остатков кислот,(Cl—, NO32-,SO32-, SO42-, CO32-, PO43-). В общем виде реакцию обмена можно привести в следующей записи:
Kt1An1 Kt2An1 = Kt1An2 Kt2An1 (25)
Где Kt1 и Kt2 – катионы металлов (1) и (2), а An1 и An2 – соответствующие им анионы (1) и (2). При этом обязательно надо учитывать, что в соединениях до реакции и после реакции на первом месте всегда устанавливаются катионы, а анионы – на втором. Следовательно, если в реакцию вступит хлорид калия и нитрат серебра, оба в растворённом состоянии
KCl AgNO3→
то в процессе её образуются вещества KNO3 и AgClи соответствующее уравнение примет вид:
KCl AgNO3=KNO3 AgCl (26)
При реакциях нейтрализации протоны от кислот (Н ) будут соединяться с анионами гидроксила (ОН—) с образованием воды (Н2О):
НCl КОН = КCl Н2O (27)
Степени окисления катионов металлов и заряды анионов кислотных остатков указаны в таблице растворимости веществ (кислот, солей и оснований в воде). По горизонтали приведены катионы металлов, а по вертикали – анионы кислотных остатков.
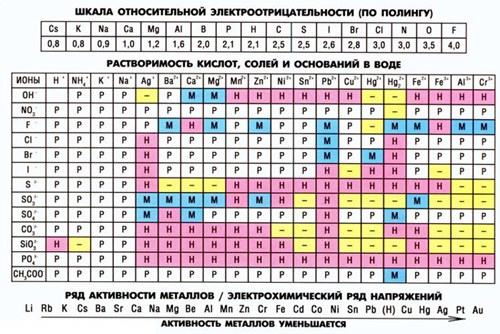
Исходя из этого, при составлении уравнения реакции обмена, необходимо вначале в левой его части установить степени окисления принимающих в этом химическом процессе частиц. Например, требуется написать уравнение взаимодействия между хлоридом кальция и карбонатом натрия.Составим исходную схему этой реакции:
СаCl NаСО3 →
Над катионами и анионами проставим соответствующие заряды:
Са2 Cl— Nа СО32- →
Совершив уже известное действие «крест»-на-«крест», определим реальные формулы исходных веществ:
СаCl2 Nа2СО3 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ:
СаCl2 Nа2СО3 → СаСО3 NаCl
Над их катионами и анионами проставим соответствующие заряды:
Са2 СО32- Nа Cl—
Формулы веществ записаны правильно, в соответствии с зарядами катионов и анионов. Составим полное уравнение, уравняв левую и правую его части по натрию и хлору:
СаCl2 Nа2СО3 = СаСО3 2NаCl (28)
В качестве другого примера приведём уравнение реакции нейтрализации между гидроксидом бария и ортофосфорной кислотой:
ВаОН НРО4 →
Над катионами и анионами проставим соответствующие заряды:
Ва2 ОН— Н РО43- →
Определим реальные формулы исходных веществ:
Ва(ОН)2 Н3РО4 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ, учитывая, что при реакции обмена одним из веществ обязательно должна быть вода:
Ва(ОН)2 Н3РО4 → Ва2 РО43- Н2O
Определим правильную запись формулы соли, образовавшейся в процессе реакции:
Ва(ОН)2 Н3РО4 → Ва3(РО4)2 Н2O
Уравняем левую часть уравнения по барию:
3Ва (ОН)2 Н3РО4 → Ва3(РО4)2 Н2O
Поскольку в правой части уравнения остаток ортофосфорной кислоты взят дважды, (РО4)2, то слева необходимо также удвоить её количество:
3Ва (ОН)2 2Н3РО4 → Ва3(РО4)2 Н2O
Осталось привести в соответствие количество атомов водорода и кислорода в правой части у воды. Так как слева общее количество атомов водорода равно 12, то справа оно так же должно соответствовать двенадцати, поэтому перед формулой воды необходимо поставить коэффициент «6» (поскольку в молекуле воды уже имеется 2 атома водорода). По кислороду так же соблюдено равенство: слева 14 и справа 14. Итак, уравнение имеет правильную форму записи:
3Ва (ОН)2 2Н3РО4 → Ва3(РО4)2 6Н2O (29)
Возможность осуществления химических реакций
Мир состоит из великого множества веществ. Неисчислимо так же количество вариантов химических реакций между ними. Но можем ли мы, написав на бумаге то или иное уравнение утверждать, что ему будет соответствовать химическая реакция? Существует ошибочное мнение, что если правильно расставить коэффициенты в уравнении, то оно будет осуществимо и на практике. Например, если взять раствор серной кислоты и опустить в него цинк, то можно наблюдать процесс выделения водорода:
Zn H2SO4 = ZnSO4 H2 (30)
Но если в этот же раствор опустить медь, то процесс выделения газа наблюдаться не будет. Реакция не осуществима.
Cu H2SO4≠
В случае, если будет взята концентрированная серная кислота, она будет реагировать с медью:
Cu 2H2SO4 = CuSO4 SO2 2Н2O (31)
В реакции (23) между газами азотом и водородом наблюдается термодинамическое равновесие, т.е. сколько молекул аммиака NН3 образуется в единицу времени, столько же их и распадётся обратно на азот и водород. Смещение химического равновесия можно добиться повышением давления и понижением температуры
N2 3Н2 = 2NН3
Если взять раствор гидроксида калия и прилить к нему раствор сульфата натрия, то никаких изменений наблюдаться не будет, реакция будет не осуществима:

КОН Na2SO4 ≠
Раствор хлорида натрия при взаимодействии с бромом не будет образовывать бром, несмотря на то, что данная реакция может быть отнесена к реакции замещения:
NаCl Br2≠
В чём же причины таких несоответствий? Дело в том, что оказывается недостаточно только правильно определять формулы соединений, необходимо знать специфику взаимодействия металлов с кислотами, умело пользоваться таблицей растворимости веществ, знать правила замещения в ряду активности металлов и галогенов. В этой статье излагаются только самые основные принципы как расставить коэффициенты в уравнениях реакций, как написать молекулярные уравнения, как определить состав химического соединения.
Химия, как наука, чрезвычайно разнообразна и многогранна. В приведённой статье отражена лишь малая часть процессов, происходящих в реальном мире. Не рассмотрены типы окислительно-восстановительных реакций, термохимические уравнения, электролиз, процессы органического синтеза и многое, многое другое. Но об этом в следующих статьях.
Молодец! Раз ты дочитал это до конца, вероятно, ты все отлично усвоил. Но если вдруг что-то еще непонятно — попробуй онлайн-занятие с репетитором (подробности тут 🎁).
© lifeo2.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al H2O KNO3 KOH → K[Al(OH)4] NH3↑.
2. KNO3 Al → KAlO2 Al2O3 N2.
3. Na2O2 H2SO4 KMnO4 → O2↑ MnSO4 Na2SO4 K2SO4 H2O.
4. NaCl H2SO4 MnO2 → Cl2 MnSO4 Na2SO4 H2O.
5. NaCl H2SO4 KMnO4 → Cl2 MnSO4 Na2SO4 K2SO4 H2O.
6. KNO2 H2SO4 MnO2 → MnSO4 KNO H2O.
7. KI H2SO4 KMnO4 → I2 MnSO4 K2SO4 H2O.
8. KI K2Cr2O7 H2SO4 → I2 Cr2(SO4)3 K2SO4 H2O.
9. C K2Cr2O7 H2SO4 → CO2 Cr2(SO4)3 K2SO4 H2O.
10. PbO2 HNO3 KI → Pb(NO3)2 I2 KNO3 H2O.
11. PbO2 HNO3 Mn(NO3)2 → Pb(NO3)2 HMnO4 H2O.
12. NaNO2 KMnO4 H2SO4 → NaNO3 MnSO4 K2SO4 H2O.
13. KNO2 KMnO4 H2SO4 → KNO3 MnSO4 K2SO4 H2O.
14. KNO2 K2Cr2O7 H2SO4 → KNO3 Cr2(SO4)3 K2SO4 H2O.
15. KNO2 KI H2SO4 → NO I2 K2SO4 H2O.
16. KNO2 FeSO4 H2SO4 → NO Fe2(SO4)3 K2SO4 H2O.
17. Ca3(PO4)2 C SiO2 → CaSiO3 P CO.
18. Sb HNO3 → Sb2O5 NO2 H2O.
19. H2O2 H2SO4 KMnO4 → MnSO4 O2 H2O K2SO4.
20. S HNO3 → H2SO4 NO2 H2O.
21. H2S HNO3 → H2SO4 NO2 H2O.
22. H2S KMnO4 → MnO2 S H2O KOH.
23. H2S K2Cr2O7 H2SO4 → S Cr2(SO4)3 K2SO4 H2O.
24. KMnO4 Na2SO3 H2SO4 → MnSO4 Na2SO4 K2SO4 H2O.
25. KMnO4 Na2SO3 H2O → MnO2 Na2SO4 KOH.
26. KMnO4 Na2SO3 KOH → K2MnO4 Na2SO4 H2O.
27. K2Cr2O7 K2SO3 H2SO4 → Cr2(SO4)3 K2SO4 H2O.
28. H2SO4 C → SO2 CO2 H2O.
29. H2SO4 Zn → ZnSO4 H2S H2O.
30. H2SO4 KBr → SO2 Br2 KHSO4 H2O.
31. H2SO4 KI → H2S I2 K2SO4 H2O.
32. PbO2 HCl → PbCl2 Cl2 H2O.
33. K2Cr2O7 HCl → CrCl3 Cl2 KCl H2O.
34. KMnO4 HCl → MnCl2 Cl2 KCl H2O.
35. KClO3 HCl → KCl Cl2 H2O.
36. HClO3 FeSO4 H2SO4 → Fe2(SO4)3 HCl H2O.
37. NaBrO3 NaBr H2SO4 → Br2 Na2SO4 H2O.
38. HNO3 I2 → HIO3 NO2 H2O.
39. HNO3 I2 → HIO3 NO H2O.
40. H2SO4 HI → I2 H2S S H2O.
41. Fe2(SO4)3 HI → FeSO4 I2 H2SO4.
42. HIO3 FeSO4 H2SO4 → Fe2(SO4)3 I2 H2O.
43. NaIO3 NaI H2SO4 → I2 Na2SO4 H2O.
44. KMnO4 Cu2O H2SO4 → MnSO4 CuSO4 K2SO4 H2O.
45. HNO3 Cu2S → CuSO4 Cu(NO3)2 NO2 H2O.
46. H2SO4 Cu2S → CuSO4 SO2 H2O.
47. Ag HNO3 → AgNO3 NO H2O.
48. Zn HNO3 → Zn(NO3)2 N2O H2O.
49. PH3 KMnO4 H2SO4 → H3PO4 MnSO4 K2SO4 H2O.
50. FeSO4 KMnO4 H2SO4 → Fe2(SO4)3 MnSO4 K2SO4 H2O.
51. H2S KMnO4 H2SO4 → S MnSO4 K2SO4 H2O.
52. Ca3P2 KMnO4 H2SO4 → CaSO4 H3PO4 MnSO4 K2SO4 H2O.
Урок 1: окислительно-восстановительные реакции ✎

Привет)
Сегодня я хочу разобрать одну из самых интересных тем в неорганической химии, которая навевает на некоторых страх и непонимание, -это окислительно-восстановительные реакции.
Процесс окисления и восстановления заключается в том, что любое сложное вещество образуется тогда, когда один элемент отдает электроны, а другой забирает.
Рассмотрим этот процесс на известной всем реакции образования гремучего газа — Н2О (это та же реакция, что и образование воды, но, в отличие от последней, она осуществима при обычных условиях).

Итак, вначале мы пишем химическую реакцию (смотри пункт А), и расставляем степени окисления всех элементов.
Для удобства можно подчеркнуть те элементы, которые изменили свои степени окисления. В этой реакции это произошло с водородом и кислородом.
Разбираем детально этот процесс: у водорода до стрелки стоит степень окисления 0, почему?
Любое простое вещество, которое не входит в состав сложного вещества, всегда пишется со знаком 0, потому что это атом, а атом электронейтрален, соответственно, заряд должен быть равен 0.
Это же самое мы пишем у кислорода, так как до стрелки он представлен в виде свободного атома.
Теперь смотрим молекулу гремучего газа, Н2О: у водорода степень окисления равна 1, так как он отдал один электрон, а кислород имеет степень окисления -2, так как он принял два электрона, но это не логично.
Если элемент отдал электрон, то у него по сути должен быть знак -, а если принял, то .
Теперь наступает самый сложный момент, как показать переход электронов. Смотрим пункт Б: рассматриваем первый процесс с водородом.
Слева пишем водород который стоит до стрелки, справа- после стрелки, между ними- количество электронов.
В первую очередь необходимо посмотреть как меняется степень окисления водорода: сначала Н2 имеет степень окисления 0, а после стрелки 1, и было бы естественно написать что водород отдал один электрон, но в итоге получается -2, почему? Когда элемент отдает электроны, он теряет их, и соответственно, ставим-2, а не 2; теперь рассматриваем другой аспект- почему -2, а не -1.
Если вышеперечисленный процесс понятен, переходим к аналогичному с кислородом:
Почему 4? В процессе присоединения электронов элемент, в нашем случае кислород забирает два электрона, умноженное на два, то есть 4, у него становится больше, поэтому ставим « ».
Теперь пришло время немного расслабиться, потому что осталось совсем чуть-чуть).
В пункте Д, напротив процесса водорода за чертой стоит цифра 4, а напротив кислорода-2, может возникнуть непонимание, зачем это нужно и откуда взялись эти цифры. Цифры, стоящие за чертой, это количество электронов, отданные водородом и принятые кислородом, в сумме.
Важный аспект в том, что эти цифры нужно переместить крест-накрест, и поставить за черту,- они и выполняют роль коэффициентов при уравнивании. Если эти цифры имеют общее кратное, необходимо их сократить, и начать уравнивать- перед водородом нужно поставить 2, перед кислородом 1, но как ты знаешь, коэффициент 1 мы не ставим; смотри пункт Г.
В последнюю очередь нужно записать, какой элемент является окислителем, а какой восстановителем (это нужно для решения задач), пункт В.
Ну вот и все, реакция уравнена, мучения закончились).
Подведем итог, чтобы быстро и правильно решать реакции ОВР, нужно:
— верно указать степени окисления всех элементов в реакции;
— запомнить, что если у элемента увеличилась степень окисления, что он восстановитель, и над стрелкой ставим «-е», а если степень окисления уменьшилась, то этот элемент-окислитель, и над стрелкой при указании перехода ставим » е»;
— внимательно расставлять коэффициенты, кислород уравнивать в самую последнюю очередь.
На этой прекрасной ноте я заканчиваю урок.
Внизу представлены задания по этой теме для самостоятельного решения.
При возникновении вопросов, пиши)




Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20![]()
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона.
Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li O2 = 2Li2O;
2Na O2 = Na2O2;
K O2 = KO2;
2Ca O2 = 2CaO;
4Al 3O2 = 2Al2O3;
2Cu O2 = 2CuO;
3Fe 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000![]()
4P 5O2 = 2P2O5;
S O2 = SO2;
С O2 = СО2;
2Н2 O2 = 2Н2О;
N2 O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S 3O2 = 2SO2↑ 2H2O (t![]() 3 3O2 = 2N2↑ 6H2O (t
3 3O2 = 2N2↑ 6H2O (t![]() 3 3O2 = 2N2↑ 6H2O (t
3 3O2 = 2N2↑ 6H2O (t 3 5O2 = 4NO↑ 6H2O (t
3 5O2 = 4NO↑ 6H2O (t![]() 3 4O2 = 2H3PO4 (t
3 4O2 = 2H3PO4 (t![]() 3 4O2 = 2H3PO4 (t
3 4O2 = 2H3PO4 (t
SiH4 2O2 = SiO2 2H2O;
4FeS2 11O2 = 2Fe2O3 8 SO2↑ (t![]()
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO O2 = 2CO2 (t![]() 2 O2 = 2SO3 (t
2 O2 = 2SO3 (t![]() 2 O2 = 2SO3 (t
2 O2 = 2SO3 (t 2O5);
2O5);
2NO O2 = 2NO2;
4FeO O2 = 2Fe2O3 (t![]()
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 2O2 = CO2↑ H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
Окисление углеводов, белков и жиров служит источником энергии в живом организме.

