- Раствор аммиака
- Общее описание
- Получение
- Свойства
- Что мы узнали?
- Тест по теме
- Оценка доклада
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакологические свойства
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Форма выпуска
- Условия хранения
- Срок годности
- Заказ в аптеках
- Отзывы
- Получение водных растворов
- Применение
- Как приобрести вещество у ПраймКемикалсГрупп
- Строение
- Физические
- Химические
- Аммиак – опасный, но важный газ!
- Определение
- История открытия аммиака
- Аппарат для отгонки аммиака
- Применение аммиака
- Меры предосторожности
- Структурная формула
- Русское название
- Брутто формула
- Характеристика
- Фармакология
- Применение вещества Аммиак
- Побочные действия вещества Аммиак
- Взаимодействие
- Торговые названия с действующим веществом Аммиак
Раствор аммиака

Нашатырный спирт – это раствор аммиака или гидроксид аммония. Вещество используется для медицинских и бытовых нужд. О химических свойствах аммиака, о его реакции с другими веществами – говорим ниже.
Общее описание
Формула раствор аммиака – NH4OH. Нашатырный спирт – гидрат или гидроксид аммиака. Поэтому более точная запись – NH3·H2O. Нашатырный спирт также называется аммиачной водой или едким аммиаком. Это бесцветная прозрачная жидкость с резким запахом.

Рис. 1. Раствор аммиака.
Аммиак отлично растворяется в воде. В одном объёме воды при комнатной температуре можно растворить 1200 объёмов аммиака. Концентрированный раствор обычно содержит 25 % NH3.
Раствор, используемый в медицине, содержит 10 % NH3.
При увеличении объёма воды и уменьшении количества аммиака плотность раствора увеличивается. Поэтому плотность 30 % раствора – 0,897 г/см3, плотность 5 % раствора – 0,978 г/см3.
При нагревании концентрированного раствора растворимость NH3 уменьшается, т.к. аммиак переходит в газообразное состояние.
Получение
Гидрат аммония можно получить двумя основными способами:
- непосредственным взаимодействием аммиака и воды –
- гидролизом нитрата аммония –
NH4NO3 + H2O ↔ NH4OH + HNO3
Реакция образования нашатырного спирта обратима, гидроксид аммония находится в равновесии с аммиаком. Именно поэтому нашатырный спирт имеет резкий аммиачный запах.
Свойства
Раствор обладает слабыми щелочными свойствами. При этом гидроксид аммония может проявлять свойства растворимого и нерастворимого основания.
Свойства, показывающие, что аммиачная вода – щёлочь (растворимое основание):
- меняет окраску индикатора – метилоранж становится жёлтого цвета, лакмус – синего, фенолфталеин – малинового;
- реагирует с кислотами, образуя средние и кислые соли –
- реагирует с кислотными оксидами с образованием нормальной соли –
- реагирует с солями –

Рис. 2. Реакция на индикатор.
Сходство с нерастворимыми основаниями:
- реагирует с кислотами;
- не реагирует с амфотерными металлами, их оксидами и гидроксидами.
Рис. 3. Амфотерные металлы.
Гидроксид аммония, реагируя с перманганатом калия, проявляет восстановительные свойства:
Нашатырный спирт используется в медицине, в изготовлении удобрений, красителей, соды. В пищевой промышленности используется в качестве добавки E527. В быту аммиачную воду применяют для очистки стёкол, мебели, текстиля.

Что мы узнали?
Раствор аммиака, нашатырный спирт, аммиачная вода – это гидроксид или гидрат аммония (NH3·H2O), образующийся за счёт хорошей растворимости аммиака в воде. Помимо непосредственного взаимодействия аммиака с водой нашатырный спирт можно получить реакцией нитрата аммония с водой. Раствор проявляет свойства растворимых и нерастворимых оснований, реагируя с кислотами, солями, кислотными оксидами и не реагируя с амфотерными металлами и их соединениями.
Тест по теме
Чтобы попасть сюда — пройдите тест.
Оценка доклада
А какая ваша оценка?
Дата последнего изменения: 28.06.2021
Лекарственная форма
Раствор
для наружного применения и ингаляций.
Состав
Аммиака
водного концентрированного — от 375 до 440 мл,
Воды
очищенной — до 1000 мл.
Описание лекарственной формы
Прозрачная,
бесцветная, летучая жидкость с резким запахом.
Фармакологические свойства
При
вдыхании вызывает раздражение слизистой оболочки дыхательных путей и
рефлекторно возбуждает дыхательный и сосудодвигательный центры.
Оказывает
дезинфицирующее действие на кожу.
В
больших дозах раствор аммиака может вызвать рефлекторную остановку дыхания.
Показания
Применяется
как средство скорой помощи при обморочных состояниях, отравлениях алкоголем и
другими веществами.
В
хирургической практике для мытья рук, а также для нейтрализации кислых токсинов
и при укусах насекомых и змей.
Противопоказания
Местное
применение раствора аммиака противопоказано при дерматитах, экземе и других
кожных заболеваниях.
Данные
о влиянии на организм при беременности и лактации отсутствуют.
Способ применения и дозы
Применяют
как средство скорой помощи для возбуждения дыхания и выведения больных
из обморочного состояния, для чего ингаляционно, осторожно (не ближе
0,5–1 см) подносят к носовым отверстиям смоченный препаратом кусочек ваты.
Для
проявления рвотного действия препарат назначают внутрь по 5 капель на
100 мл воды.
Для
мытья рук применяют раствор аммиака (25 мл на 5 л теплой кипяченой
воды).
При
укусах насекомых применяют наружно в виде примочек.
Побочные действия
Остановка
дыхания (рефлекторная, при вдыхании в высокой концентрации), гиперсаливация,
першение в горле, гиперемия слизистой оболочки ротовой полости.
Ожог
пищевода и желудка (прием препарата внутрь).
Форма выпуска
По
10 мл во флаконы‑капельницы с винтовой горловиной, укупоренные
пробками из полиэтилена высокого или низкого давления и крышками
навинчиваемыми; во флаконы из стекломассы с винтовой горловиной, укупоренные
пробками из полиэтилена высокого или низкого давления или пробками и крышками
навинчиваемыми из полиэтилена высокого или низкого давления; во флаконы из
стекломассы с винтовой горловиной, укупоренные крышками навинчиваемыми из
полиэтилена высокого или низкого давления.
По
40 мл, 50 мл и 100 мл препарата во флаконы из стекломассы с
винтовой горловиной, укупоренные пробками из полиэтилена высокого или низкого
давления и крышками навинчиваемыми из полиэтилена высокого или низкого
давления.
По
40 мл, 50 мл, 100 мл, 500 мл и 1000 мл во флаконы из
полиэтилена высокого давления нестабилизированного и неокрашенного или из
полиэтилена низкого давления, укупоренные навинчиваемыми крышками с пробками из
полиэтилена высокого или низкого давления.
По
10 мл, 40 мл, 50 мл, 100 мл во флаконы из полиэтилена
высокого или низкого давления или полиэтилентерефталата, укупоренные пробками
из полиэтилена высокого или низкого давления или пробками с уплотнительными
элементами из полиэтилена высокого или низкого давления и крышками из
полиэтилена высокого или низкого давления или пропилена, или укупоренные
крышками из полиэтилена высокого или низкого давления или пропилена.
Каждый
флакон, флакон‑капельницу по 10 мл, 40 мл, 50 мл и
100 мл вместе с инструкцией по применению помещают в пачку из картона для
потребительской тары или из картона хром‑эрзац для складных коробок, или
из картона хром‑эрзац макулатурного, или импортного, разрешенного к
применению МЗ РФ.
Допускается
выпуск препарата во флаконах, флаконах‑капельницах вместимостью
10 мл, 40 мл, 50 мл и 100 мл без пачки картонной с
инструкциями по применению, приложенными в количестве, равном количеству
флаконов.
Пачки
или флаконы и флаконы‑капельницы без пачек помещают в гофрокоробки или
упаковывают в термоусадочную пленку.
Флаконы
по 500 мл в количестве 12 штук и флаконы по 1000 мл в количестве
8 штук вместе с инструкциями по применению в количестве, равном количеству
флаконов, помещают в коробку из картона коробочного или импортного,
разрешенного к применению МЗ РФ (для стационаров).
По
5 кг, 10 кг и 20 кг (для
стационаров) в канистры из полиэтилена высокого давления
нестабилизированного и неокрашенного или из полиэтилена низкого давления,
укупоренные навинчиваемыми крышками из полиэтилена высокого или низкого
давления с прокладками.
Каждая
канистра сопровождается инструкцией по применению препарата, помещенной в пакет
из полиэтилена.
На
флаконы, флаконы‑капельницы, пачки, канистры, гофрокоробки, пленку или
коробку для стационаров наклеивают этикетки из бумаги этикеточной или писчей,
или самоклеящиеся этикетки.
Условия хранения
В
обычных условиях.
В
недоступном для детей месте.
Срок годности
Не
использовать по истечении срока годности.
Заказ в аптеках
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Отзывы
Аммиак — это газообразное вещество с формулой NH3,
соединение атомов азота и водорода. Молекула соединения по форме похожа на пирамиду: верхняя вершина — крупный атом азота; к нему присоединены более мелкие атомы водорода.
Газ бесцветный, с резким «аммиачным» запахом. Вдвое менее плотный, чем воздух, горюч, токсичен. Относится к 4-му классу опасности (малоопасен). Легко растворяется в воде.
При t -33,4 °С газ переходит в состояние бесцветной жидкости, значительно менее плотной и вязкой, чем вода. Жидкий реактив легко растворяет многие орг. и неорг. вещества.
При t -77,7 °С вещество замораживается в твердые кристаллы.
Получение водных растворов
Водные растворы аммиака получают растворением реактива в воде. Для массового использования производят методом взаимодействия водных паров с аммиаком в газообразной форме. Аммиачная вода (нашатырный спирт, едкий аммоний, гидроксид аммония) нестабильна. Часть газа испаряется, придавая растворам резкий характерный запах.
Наиболее распространен аммиак водный с концентрацией 25%. Раствор с содержанием 10% газа называют нашатырным спиртом.
Применение

Водный раствор аммиака 25%-ной концентрации, очищенный до состояния ЧДА востребован:• в лабораториях как буфер;• в химпроме как растворитель орг. веществ, как связующий агент;• в фармакологии для получения нашатырного спирта аптечного качества — это противообморочное средство, он снимает зуд, облегчает лечение кашля, обладает свойствами антисептика, входит в состав аммиачно-камфарной суспензии от болей различной природы;• в пищепроме как ограниченно используемая добавка Е527 — регулятор кислотности, для изготовления кондитерских изделий из какао и шоколада;• в косметологии входит в состав красок и средств для волос, туши и подводки для глаз, пилингов, отбеливающих масок;• на предприятиях, выпускающих соду, красители, азотные удобрения для капельного полива и пр.
Аммиак водный трудногорюч, малотоксичен, но капли жидкости вызывают ожоги кожи и слизистых. Выделяющийся газ раздражает глаза и органы дыхания, вреден для нервной системы. Вещество постепенно «теряет» газообразный реагент, его концентрация снижается при длительном хранении. Поэтому реактив хранят в герметично закрытой таре (пластиковые, стеклянные бутыли и канистры) в крытых помещениях.
Как приобрести вещество у ПраймКемикалсГрупп
Водный аммиак квалификации ЧДА 25%-ной концентрации можно купить в магазине ПраймКемикалсГрупп, расфасованный в тару разного объема и типа. Позвоните по телефону, указанному в шапке сайта pcgroup.ru или закажите обратный звонок. Менеджер поможет оформить заказ, уточнив стоимость партии, сроки и адрес доставки. Кроме этого заказать реактив можно:
• по электронной почте;
• через мессенджеры WhatsApp и Telegram, по мобильному телефону +7(929) 635 82 73;• на странице товара кнопкой «Купить»;• приехав на склад в городе Мытищи (см. страницу Контакты).
Мы предлагаем пластиковые канистры и стеклянные бутыли объемом от 1 л до 20 л. Можно обсудить и поставку в другой таре, а также опт.

Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.
Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
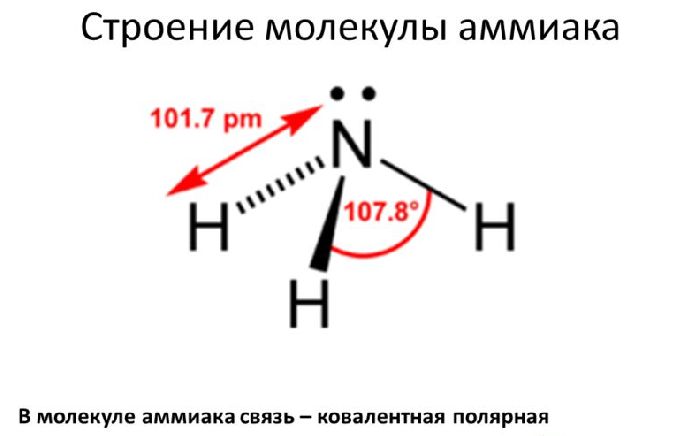
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.

Рис. 3. Горение аммиака.
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Цена указана за 1 кг
Будьте осторожны и внимательны при использовании вещества, оно едкое! При превышении концентрации, а также при нарушении техники безопасности можно получить серьезный ожог или отравление.
Аммиак водный 25%-ной концентрации, химически чистый — это легкая прозрачная бесцветная жидкость с выраженным запахом нашатыря. Водорастворим в любых соотношениях. Не горит, умеренно токсична. Сам раствор не взрывоопасен, но пары, достигнув определенной концентрации, могут вызвать взрыв. Пары оказывают выраженное раздражающее действие на органы дыхания и слизистые глаз. Реагент получают растворением аммиака в химически очищенной воде в пропорции 1:3 (одна часть аммиака на 3 части воды).
Водный аммиак широко применяется в промышленности и в сельском хозяйстве. Особенно востребован в сельском хозяйстве как источник азота для растений и животных. Используется как удобрение под любые культуры, для улучшения кормов для скота. Аммиачная вода нужна в химпроме для получения кальцинированной соды; в металлургии для выплавки марганца и ферросплавов; в пищепроме и фармацевтике.
9 кг (канистра 10 литров)
Аммиак водный 25% хч, 1 кг (канистра 1 литр) в каталоге интернет-магазина
PCGroup по цене 98 рублей .
Возможно купить товар оптом и в розницу. Стоимость и сроки доставки по Москве и России
рассчитываются индивидуально, в зависимости от региона и габаритов груза. Оплата производится
наличными или переводом на расчетный счет.
Аммиак – опасный, но важный газ!
Химические реактивы, лабораторное оборудование и приборы – это главные
составляющие любой лаборатории. Независимо от важности свойств и воздействия химреактивы всегда были и будут основой всех лабораторных исследований, опытов или экспериментов. Их огромное количество дает обширное поле для деятельности многим химикам и фармакологам. При соединении они могут превращаться как в безвредные, так и в ядовитые вещества, способные наносить серьезный вред. Хотя такие химические реактивы, как йод кристаллический, азотная кислота, аммиак водный являются опасными, их употребление в лабораторной практике имеет особую важность.
Определение
Аммиак (в евр. языках – «аммониак») – это бесцветный газ, запах которого знаком каждому, даже тем, кто очень далек от химии. Он крайне острый, специфический, напоминающий запах нашатырного спирта, способный вызвать слезотечение. Аммиак очень ядовит, вдвое легче воздуха, смесь с которым взрывоопасна. Хорошо смешивается со спиртом и некоторыми другими органическими растворителями во всех соотношениях. При температуре 10 °C он сгущается в жидкость, кипящую при 33,7 °C. Этот химический реактив легко растворяется в воде с активным выделением тепла. Данный раствор называется аммиак водный или аммиачная вода. В пищевой промышленности – как добавка E527.
Раствор аммиака не совместим с: — органическими кислотами;- солями валентных металлов;- крахмалом;- солями ртути;- йодом и др..
История открытия аммиака
В переводе с греческого он означает амонова соль, – так в древности называли нашатырь. Аммиак был открыт британским химиком Д. Пристлеем, который известен как первооткрыватель кислорода и углекислого газа. Именно он назвал этот газ «щелочным воздухом или летучей щелочью», так как водный раствор аммиака обладал всеми свойствами и признаками щелочи. Благодаря французскому химику Бертолле он получил официальный термин «нашатырь». Это определение употребляется во многих западноевропейских языках.
Аппарат для отгонки аммиака
Основной задачей данного лабораторного оборудования является дистилляция и отгонка аммиака с водяным паром, измерение массовой доли белка в пастеризованном, стерилизованном или сыром молоке, кисломолочных напитках.
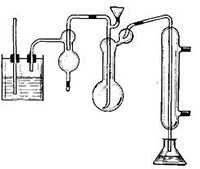
Этот аппарат состоит из:- конической колбы;- воронки капельной с краном;- переходника из лабораторного стекла;- стеклянной колбы Кьельдаля;- Т-образной, изогнутой соединительной и резиновых трубок;- делительной воронки;- холодильника шарового;- каплеуловителя;- стеклянных деталей (соединенных резиновыми трубками).
Применение аммиака
За последние несколько десятилетий производство аммиак на мировом рынке занимает одно из лидирующих мест, составляя приблизительно 100 миллионов т. Он может выпускаться как в жидкой форме, так и в виде аммиачной воды. Сфера применения его очень обширна, но главным образом это охватывает промышленность и медицину.
1. Промышленность:- получение азотной кислоты для производства искусственных удобрений;- изготовление солей аммония, уротропина, мочевины;- для нейтрализации кислотных отходов;- применение как дешевый хладагент при производстве холодильников;- получение синтетических волокон (нейлона, капрона);- при очистке и крашении шерсти, шелка и хлопка.
2. Медицина. Благодаря раздражающему действию аммиак в виде водного

раствора (нашатырный спирт) широко распространен как в медицинских учреждения, так и в быту: он раздражает слизистые оболочки верхних дыхательных путей, что способствует выведению человека из обморочного состояния, возбуждая его дыхательный центр. Однако при вдыхании аммиак может вызвать сильное слезотечение, кашель, потерю зрения, покраснение кожи и зуд, боль в глазах, иногда поражение нервной системы и отёк лёгких.
В хирургической практике раствор применяется в качестве средство для дезинфекции. Кроме того, примочки с раствором аммиака используются для нейтрализации токсинов при укусах насекомых и змей.
Меры предосторожности
Аммиак – токсичный газ, смертельный яд для человека, следовательно, его использование требует соблюдения особых мер безопасности. При обращении с ним, как и с любыми другими ядовитыми газами, для защиты органов дыхания, слизистых оболочек глаз и кожи необходимо использовать респиратор, перчатки нитриловые, защитные очки, халат, а также другие резинотехнические изделия для защиты кожных покровов.
Качественные химреактивы по доступной цене!
Высококачественный аппарат для аммиака можно купить в специализированном online магазине химических реактивов Москва розница «Прайм Кемикалс Групп». Всегда в наличии имеется аммиак, лабораторная посуда, мешалка магнитная и весы электронные лабораторные для работы с ним.
Широкий ассортимент приборов, аппаратов, химреактивов, оборудования и лабораторной посуды купить в Москве также можно на нашем сайте. Весь товар сертифицирован и соответствуют нормам ГОСТ.
“Prime Chemicals Group” – с нами сотрудничать надежно и выгодно!
Структурная формула
Русское название
Liquor Ammonii caustici (род. Liquoris Ammonii caustici)
Брутто формула
—
аналептическое, антисептическое.
Характеристика
Бесцветный газ с резким, раздражающим запахом. Применяют 10% водный раствор (нашатырный спирт), представляющий собой бесцветную летучую жидкость с острым характерным запахом и сильной щелочной реакцией.
Фармакология
Раздражает экстерорецепторы кожи и вызывает местное высвобождение биологически активных веществ (гистамина, , кининов). В спинном мозге способствует либерации противоболевых пептидов (эндорфинов и энкефалинов), блокирующих поток болевых импульсов из патологического очага. При вдыхании взаимодействует с рецепторами верхних дыхательных путей (окончания тройничного нерва) и возбуждает (рефлекторно) дыхательный центр. В высоких концентрациях рыхло коагулирует (колликвация) белки микробной клетки. Быстро выводится из организма при любом способе введения, главным образом легкими и бронхиальными железами. Рефлекторно влияет на деятельность сердца и сосудистый тонус. На месте аппликации расширяет сосуды, улучшает трофику и регенерацию тканей и отток метаболитов. Аналогичные эффекты через кожно-висцеральные рефлексы (без участия головного мозга) вызывает в сегментарно расположенных внутренних органах и мышцах, способствуя восстановлению нарушенных структур и функций. Подавляет доминантный очаг возбуждения, поддерживающий патологический процесс, снижает гипералгезию, напряжение мышц, сосудистый спазм («отвлекающее действие»). При длительном контакте раздражающее действие на кожу и слизистые оболочки может переходить в прижигающее (коагуляция белков) с развитием гиперемии, отечности и болезненности. Прием внутрь в небольших концентрациях усиливает секрецию желез, рефлекторно повышает возбудимость рвотного центра и вызывает рвоту. Активирует мерцательный эпителий дыхательных путей.
Применение вещества Аммиак
Обморочные состояния (для возбуждения дыхания), стимуляция рвоты; наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга.
Дерматит, экзема, кожные заболевания (для местного применения).
Побочные действия вещества Аммиак
Ожоги пищевода и желудка (в случае приема неразведенного раствора); рефлекторная остановка дыхания (при вдыхании в высокой концентрации).
Взаимодействие
Местно, ингаляционно, внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носовым отверстиям больного (на 0,5–1 с) или применяют ампулу с оплеткой.
Внутрь (только в разведении) — по 5–10 капель на 100 мл воды для индукции рвоты.
При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом.
В хирургической практике разводят — 25 мл в 5 л теплой кипяченой воды и моют руки.
Торговые названия с действующим веществом Аммиак
Торговое название
Цена за упаковку, руб.
Аммиак
от 9.50 до 118.00
Аммиака раствор
от 37.20 до 214.00
