Методы окисления целлюлозы — химия —
1.4 Методы окисления целлюлозы
Окисление целлюлозы может быть осуществлено как в гомогенной, так и в гетерогенной среде.
Окисление целлюлозы в гомогенной среде имеет сравнительно ограниченное значение. Наиболее исследованным является окисление целлюлозы, растворенной в медноаммиачном растворе, кислородом воздуха.
Из методов окисления целлюлозы в гетерогенной среде наибольшее практическое значение имеют следующие методы:
Окисление солями хлорноватистой кислоты (гипохлоритом натрия) в нейтральной и щелочной среде. Эти окислители наиболее доступны и получили широкое промышленное применение при отбелке хлопчатобумажных тканей, целлюлозы и искусственных волокон. К этой группе окислителей относятся также и гипобромиты.
Окисление кислородом воздуха в щелочной среде. Этот метод окисления получил промышленное применение при процессе предварительного созревания щелочной целлюлозы в производстве вискозного волокна. Возможность окисления целлюлозы кислородом воздуха в щелочной среде необходимо учитывать при отварке хлопка щелочью при высокой температуре, а также при мерсеризации.
Окисление озоном. Этот метод окисления имеет практическое значение при так называемом луговом способе отбелки льна, а также при одновременном действии на целлюлозу кислорода воздуха и ультрафиолетовых лучей.
Окисление перекисями (перекисью водорода и перекисью натрия). Этот метод окисления получает в последнее время практическое значение при отбелке искусственных и натуральных целлюлозных волокон, как один из методов, не приводящий к разрушению целлюлозных материалов.
Окисление кислыми окислителями (разбавленной азотной кислотой, хромовой кислотой, гипохлоритом в кислой среде, галоидами, перманга- натом калия в кислой среде и др.). При действии этих окислителей наряду с окислением целлюлозы происходит и ее гидролиз, что приводит к значительной деструкции целлюлозы и к понижению прочности материала.
1.5 Биологически активные полиэлектролиты
Полиэлектролиты находят самое широкое применение в различных областях промышленности и медицины в качестве физиологически-активных веществ, как носители лекарственных форм, иммуностимуляторы, антимикробные препараты и др. [27].
В настоящий момент трудно найти группу материалов, на которую микроорганизмы не оказывают разрушающего действия. Жизнедеятельность различных патогенных микробов вызывает не только нежелательные изменения структурных и функциональных характеристик материалов и изделий, но они также реализуют свое губительное действие внутри живых клеток организма. Кардинальной задачей современной химии биоцидных соединений является повышение эффективности противобактериальной терапии. Для решения этих задач перспективным представляется использование биоцидных полимеров. Полимеры позволяют включать в структуру одной макромолекулы различные биологически активные вещества, отличающиеся механизмом действия на бактериальную клетку, а также обеспечивать транспорт лечебной формулы к бактериальной клетке-мишени. Сорби- руясь на клетке и взаимодействуя с клеточными мембранами, они могут влиять на их функционирование, в частности на барьерные функции, а также создавать более высокие локальные концентрации биоцидного агента на поверхности бактериальных клеток и образовывать на обработанных поверхностях длительно сохраняющуюся полимерную пленку, обеспечивающую пролонгированный биоцидный эффект.
Наибольшая биоцидная активность отмечена у полиэлектролитов, содержащих четвертичные аммониевые группы как в основной, так и в боковой цепи макромолекулы [25-31]. Минимальные концентрации этих полимеров, подавляющие, например, рост стафилококков, составляют 50-250 мкг мл1 [32] .
В работах [33-36] было показано, что диаллильные катионные полиэлектролиты, содержащие четвертичные аммониевые группы, оказывают бактерицидное действие на Treponema pallidum (возбудитель сифилиса).
Японскими исследователями в работах [37,38,39] изучены полимеры четвертичных аммониевых соединений и бигуанидов и исследована их сравнительная антимикробная активность в зависимости от молекулярной массы. Ими выявлено, что полимерные бигуаниды с молекулярной массой 11 900 обладали значительно более высоким бактерицидным действием в отношении золотистого стафилококка по сравнению с мономером и полимерами на основе четвертичных аммониевых соединений с молекулярной массой 14 300.
Поскольку аминогуанидиновые производные значительно эффективнее четвертичных аммониевых соединений, они находят широкое применение в качестве физиологически активных веществ: лекарств, антисептиков, пестицидов [40]. Аминогуанидиновые соединения щироко распространены в природе. К ним относятся: аминокислота аргинин, фолиевая кислота, многочисленные белки и нуклеиновые кислоты, в которые производные амино- гуанидина входят в качестве различных структурных элементов. Аминогуа- нидиновая группировка служит началом многих лекарственных веществ (сульгин, исмелин, фарингосепт) и антибиотиков (стрептомицин, бластици- дин, мильдомицин). Производные аминогуанидина представлены и среди специфических веществ, с помощью которых растения защищаются от атаки микроорганизмов [41].
Первые данные о биоцидных свойствах аминогуанидиновых производных и полимеров на их основе были опубликованы в патентной литературе [например, 38-41]. В указанных патентах описывается применение подобных соединений в качестве инсектицидов и отмечается, что соответствующие соединения особенно активны против грибковых заболеваний на фруктовых деревьях.
К наиболее сильным из известных аминогуанидиновых антисептиков относятся 1,6-бис-4,4-хлорфеноксибигуанидогексин («хлоргексидин») и низкомолекулярный полигексаметиленбигуанидин («вантоцил» или «кос- моцил») [37-40]. 9-3 Так, например, хлоргексидин используется в качестве дезинфицирующего средства в виде солей (гидрохлорида, ацетата, глюкона- та). До последнего времени хлоргексидин широко рекомендовался в виде растворов, мазей, присыпок как эффективное дезинфицирующее средство в хирургии для борьбы с внутрибольничными инфекциями, лечения кожных заболеваний и бытовых целей. Однако следует отметить, что это вещество получают по сложной 4-х стадийной технологической схеме, кроме того, при его синтезе исходным сырьем служит хлорциан, поэтому технологический процесс дорог и опасен.
В России (в ИНХС РАН) был разработан процесс производства полимерного гуанидинового антисептика — полигексаметиленаминогуанидингид- рохлорида (ПГМАГ) («полисепт») [42], исходя из гексаметилендиамина и гидрохлорида аминогуанидина.
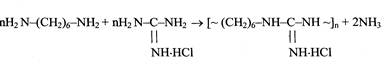
Так как аминогруппы аминогуанидингидрохлорида имеют различную реакционную способность, то молекулярную массу и структуру «полисепта» удается регулировать, изменяя условия реакции и содержание гексаметилендиамина в исходной смеси [6, 27]. Так, при сравнительно низких температурах для процесса поликонденсации (120-130°С) в реакцию с гексамети- лендиамином вступают преимущественно одна аминогруппа аминогуанидингидрохлорида, образуя хорошо растворимый линейный олигомер с молекулярной массой (1.7-12.5) х103. При увеличении количества гексамети- лендиамина в реакционной смеси сверх одного моля на 1 моль аминогуани- дингидрохлорида и повышении температуры до 180-200°С в реакцию может вступать третья аминогруппа и образуется разветвленный полимер, который имеет молекулярную массу (20-43) x103.
Различные соли ПГМГ (фосфат, глюконат, сорбат, фторид, сульфат, нитрат, силикат, ацетат, стеарат, олеат, фумарат, сукцинат, адипинат, себа- цинат) были получены при действии различных кислот или их солей на основание или карбонат ПГМГ [6]. Среди указанных полимерных солей наибольшее практическое значение помимо гидрохлорида имеют фосфат и глюконат. По данным, указанным в работе [6], растворы гидрохлорида в концентрации 0.1-0.05 вес.% вызывают гибель грамположительных и грамот- рицательных микроорганизмов: коринебактерий дифтерии (с. Duphtheretiae), золотистого стафилококка (St.aureus), а также St.aibus и St. faekalis, брюшно-тифозной палочки (S.typhi), шигелл Зонне и Флекснера (Shigella Sonnae, Flexneri), кишечной палочки (E.Coli), сальмонелл Бреслау и Гертне- ра (Salmonella th.murum), вульгарного протея (Proteus Vulgarus), синегной- ной палочки (Ps.aeruginosa) в течение 5-25 минут.
По сравнению с другими катионными полиэлектролитами использование гуанидинсодержащих биоцидных полимеров имеет еще одно положительное преимущество. При использовании синтетических биоцидных полимеров следует учитывать их биодеградируемость в живом организме. В случае использования небиодеградируемых синтетических полимеров существенное значение имеет их молекулярная масса, поскольку полимеры с молекулярной массой выше 50000 не могут выводиться через почки, а накапливаются в почечных канальцах, вызывая выраженные токсические эффекты. В этом отношении биоцидный эффект аминогуанидиновых соединений может оказаться физиологичным, т.к. в живом организме имеются ферментные системы, способные вызывать деградацию этих соединений, предотвращая их кумуляцию [43]. Однако, как уже отмечалось, для каждого нового аминогуанидинсодержащего соединения данный факт требует отдельной проверки.
С учетом вышесказанного и приведенных примеров, разработка новых биоцидных препаратов, несомненно, является актуальной задачей. По аналогии с предложенными в работе [31] критериями, применяемыми в подходе к лекарственным препаратам, значительная часть которых является и биоцидными препаратами, можно эти ключевые моменты рассматривать в применении к противомикробным средствам, именуемыми также биоцидными и бактерицидными.
Биоцидное вещество должно обладать высокой активностью, избирательностью и продолжительностью своего действия;
Оно должно быть нетоксичным для человека и животных и не должно вызывать нежелательных побочных действий;
Оно должно быть чистым и иметь высокую стабильность при хранении;
Себестоимость его производства не должна быть слишком высокой;
Оно должно быть доступным, а доходность его на рынке биоцидных препаратов — достаточно высокой;
Все эти факторы при правильном сочетании будут определять время жизни данного препарата среди применяемых аналогично действующих биоцидных средств.
Стратегия и тактика создания новых биоцидных веществ может опираться на следующие ключевые моменты [44].
Принцип химического модифицирования структуры известных синтетических и природных биоцидных веществ, при этом предполагается, что биологическая активность нового соединения окажется более высокой.
Принцип введения биоцидной группы известного вещества в молекулу нового вещества.
Принцип молекулярного моделирования, в котором учитывается пространственное строение биоцида и биорецепторного участка его захвата.
Стратегия пробиоцида, когда действующее начало доставляется к месту действия некоей комбинированной молекулой, из которой в необходимом месте выделяется собственно биоцидное вещество.
Концепция антиметаболитов, веществ, которые подменяют метаболит в естественных биореакциях и нарушают их нормальное протекание, т.к. не могут в полном объеме заменить природный объект.
Принцип использования полимерной матрицы или полимерного вещества, который в первую очередь приводит к пролонгированному действию и контролю подачи необходимого биоцида.
§
1.3 Методы определения содержания карбонильных и карбоксильных групп в препаратах окисленной целлюлозы
Для характеристики получаемых препаратов окисленной целлюлозы необходимо определить содержание в них карбонильных или карбоксильных групп. Точное определение содержания этих групп необходимо и для исследования механизма реакции окисления и свойств различных типов ок- сицеллюлозы. Этим объясняется большое количество работ, опубликованных по методике определения карбонильных и карбоксильных групп в препаратах окисленной целлюлозы. Систематическая разработка количественных методов определения содержания различных функциональных групп в препаратах окисленной целлюлозы проводится в последнее время Каверзневой. Ею было впервые показано наличие оксикетонных и лактонных групп в препаратах окисленной целлюлозы и проведена большая работа по определению кетонных групп в этих препаратах
Определение содержания карбонильных групп. В отличие от препаратов гидролизованной целлюлозы, в макромолекуле окисленной целлюлозы могут находиться как альдегидные группы в скрытой форме (на конце макромолекулы у 1-го атома углерода), так и альдегидные группы, образующиеся в результате окисления спиртовых групп. При определении содержания альдегидных групп в препаратах окисленной целлюлозы необходимо учитывать малую устойчивость этих групп в щелочной среде, в результате чего содержание альдегидных групп в препаратах окисленной целлюлозы понижается. Кроме того, в макромолекуле окисленной целлюлозы, содержащей в элементарном звене две альдегидные группы в положении 2 и 3 или карбоксильную группу в положении 6, глюкозидная связь также малоустойчива к действию щелочей [24,26]. Если определение альдегидных групп проводить в щелочной среде, то при действии щелочи происходит разрыв глюкозидных связей между элементарными звеньями макромолекулы, содержащей альдегидные или карбоксильные группы. В результате этой реакции появляются новые альдегидные группы (в скрытой форме), которых не было в исходном препарате окисленной целлюлозы. Учитывая эти данные, необходимо для определения количества альдегидных групп в препаратах окисленной целлюлозы применять такие методы, при которых возможность действия щелочей исключается или сводится к минимуму.
Для количественного определения содержания альдегидных групп в препаратах окисленной целлюлозы предложены следующие методы: 1. Определение медного числа. Определение медного числа для препаратов окисленной целлюлозы, содержащих свободные альдегидные группы, до настоящего времени все еще применяется некоторыми исследователями. Однако, учитывая все указанные недостатки определения содержания аль- дегидных групп в щелочной среде, этот метод нельзя считать достаточно надежным.
Определение йодного числа. Принципиально более точным методом, чем определение медного числа, является определение йодного числа. Это определение, особенно для препаратов окисленной целлюлозы, содержащей две альдегидные группы в элементарном звене, необходимо проводить при минимальном содержании щелочи в растворе. Поэтому целесообразнее проводить определение йодного числа в препаратах окисленных целлюлоз не в щелочном растворе, а в буферном растворе (бура борная кислота). При соблюдении стандартных условий и проведении определения в присутствии буферных веществ (при рН = 9 — 9,5) определение содержания альдегидных групп по йодному числу даже для препаратов окисленной целлюлозы дает достаточно точные и воспроизводимые результаты.
Определение гидроксиламинового числа. Суммарное содержание карбонильных групп (как альдегидных, так и кетонных) в препаратах окисленной целлюлозы может быть определено при помощи реакции с солянокислым гидроксиламином; при этом образуется альдоксим и выделяется хлористый водород. Выделяющийся хлористый водород оттитровывается щелочью в присутствии индикатора (бромфеноловый синий). Содержание карбонильных групп может быть определено также и по количеству азота в оксимах целлюлозы, образующихся при этой реакции. Этот метод позволяет определить общее количество карбонильных групп, находящихся в оксицеллюлозе. Для раздельного определения альдегидных групп и кетогрупп препараты окисленной целлюлозы, содержащие карбонильные группы, могут быть окислены хлоритом. Все альдегидные группы при этой обработке окисляются до карбоксильных групп, а кетогруппы остаются без изменения. Зная общее количество карбонильных групп и определив количество карбоксильных групп, образовавшихся при окислении хлоритом, можно определить раздельно количество альдегидных групп и кетогрупп в препарате оксицеллюлозы.
Определение содержания карбоксильных групп.
Содержание карбоксильных групп в препаратах окисленной целлюлозы может быть определено следующими методами:
Непосредственным титрованием щелочью. Содержание карбоксильных групп в целлюлозе может быть определено непосредственным титрованием 0,01—0,02 N раствором едкого натра или обратным титрованием избытка щелочи 0,02 N раствором соляной кислоты. Индикатор — фенолфталеин или тимолфталеин. При применении этого метода для определения карбоксильных групп в препаратах окисленной целлюлозы, содержащей наряду с карбоксильными группами большое число альдегидных групп, получаются завышенные результаты. Это объясняется, по-видимому, частичным превращением альдегидных групп в щелочной среде и образованием дополнительного количества карбоксильных групп.
Обменной реакцией с ацетатом кальция или с ацетатом серебра, а также обменной реакцией с о-нитрофенолятом серебра. Такое определение содержания карбоксильных групп основано на том, что окисленная целлюлоза, содержащая карбоксильную группу, является более сильной кислотой, чем уксусная кислота, и поэтому вытесняет уксусную кислоту из ее солей. Выделяющаяся уксусная кислота оттитровывается щелочью. Определение содержания карбоксильных групп по этому методу дает правильные результаты, если карбоксильные группы в препарате окисленной целлюлозы находятся в положении 6; следовательно, входят в состав остатка глюкуро- новой кислоты, являющейся сравнительно сильной кислотой. Если карбоксильные группы образуются в результате окисления вторичных спиртовых групп и, следовательно, соединены с остатками глиоксалевой или аритроно- вой кислоты (константа диссоциации этих кислот значительно меньше), то взаимодействие этих кислот с ацетатом кальция не идет до конца. В этом случае для получения правильных результатов необходимо применять для реакции обменного разложения соли более слабых кислот, в частности — о- нитрофенолят серебра. Взаимодействие всех карбоксильных групп окисленной целлюлозы с солями серебра происходит количественно при рН=8.
Взаимодействием с аминами. Для определения карбоксильных групп в препаратах окисленной целлюлозы предложено использовать реакцию взаимодействия с диаминами и моноаминами. При последующем диазотирова- нии и сочетании с азосоединениями (для диаминов) или с диазосоединения- ми (для моноаминов) получаются окрашенные препараты различных цветов (в зависимости от характера примененных соединений). Авторы предложили использовать эти реакции для качественного и даже для количественного определения содержания карбоксильных групп. Эти реакции, однако, не однозначны, так как с аминами могут реагировать также и альдегидные группы, имеющиеся в окисленной целлюлозе
Взаимодействием с метиленовым голубым (определение по количеству связанного красителя). Введение карбоксильных групп в молекулу целлюлозы резко повышает ее сродство к основным красителям и к аминам. Основные красители, ‘в частности метиленовый голубой, при рН > 7 количественно реагируют с карбоксильными группами оксицеллюлозы. Это используется для определения содержания карбоксильных групп. Определение количества красителей производится колориметрически (по изменению концентрации красителя в растворе после взаимодействия его с препаратами окисленной целлюлозы) или титрованием.
По количеству углекислого газа, выделившегося при нагревании оксицеллюлозы с 12%-ной соляной кислотой. Принцип этого метода основан на том, что глюкуроновая кислота при кипячении с 12%-ным раствором соляной кислоты отщепляет углекислый газ и превращается в ксилозу, которая при дегидратации дает фурфурол. Препараты окисленной целлюлозы, содержащие остатки глюкуроновой кислоты, так же как и полиуроновые кислоты, будут выделять углекислый газ при кипячении с разбавленной НС1. По количеству выделившегося углекислого газа могут быть определены только карбоксильные группы в положении 6, т. е. образующие остаток глюкуроновой кислоты. Карбоксильные группы, находящиеся в положениях 2 и 3, незначительно отщепляются при кипячении оксицеллюлоз с разбавленной соляной кислотой.
При определении содержания карбоксильных групп по любому методу препарат окисленной целлюлозы должен быть предварительно обработан разбавленным раствором минеральной кислоты для разложения солей кар- боновых кислот и затем тщательно отмыт дестиллированной водой от кислоты, удерживаемой волокном.
Все приведенные методы определения содержания карбоксильных групп могут быть использованы для определения только свободных карбоксильных групп.
Интересным и многообещающим методом качественной, и до известной степени, количественной характеристики содержания функциональных групп в молекуле окисленной целлюлозы является определение инфракрасных спектров поглощения этих продуктов [25]. Каждая из функциональных групп, имеющихся в макромолекулах окисленной целлюлозы (альдегидная, кетонная, карбоксильная и гидроксильная группа), имеет свои характерные спектры поглощения. По изменению спектров поглощения инфракрасных лучей препаратами окисленной целлюлозы, по сравнению с исходной целлюлозой, можно приблизительно определить содержание тех или иных функциональных групп. Этим методом начали пользоваться для исследования процесса окисления целлюлозы сравнительно недавно.
§
1. При действии на целлюлозу двуокиси азота происходит преимущественное окисление первичных спиртовых групп до карбоксильных групп.
Окисление целлюлозы двуокисью азота происходит по следующей схеме:
Окисление целлюлозы может быть осуществлено действием на нее газообразной двуокиси азота (N02), жидкого азотноватого ангидрида (N204) или действием раствора азотноватого ангидрида в индифферентном органическом растворителе (обычно в четыреххлористом углероде). Степень окисления целлюлозы, т. е. количество окисленных первичных спиртовых групп, зависит от длительности окисления, температуры и количества двуокиси азота. Изменяя эти условия, можно регулировать степень окисления целлюлозы. Максимальное содержание карбоксильных групп в целллюлозе составляет 25% по массе, что отвечает окислению всех вторичных спиртовых групп, т. е. введению одной карбоксильной группы в каждое элементарное звено макромолекулы.
Получаемый продукт окисления целлюлозы, названный монокарбок- силцеллюлозой [1-4] значительно отличается по свойствам от целлюлозы. При частичном окислении первичных спиртовых групп двуокисью азота макромолекула полученной окисицеллюлозы содержит элементарные зве нья глюкопиранозы и глюкуроновой кислоты. При окислении всех первичных спиртовых групп получаемый продукт представляет собой полиангид- роглюкуроновую кислоту. При содержании в монокарбоксилцеллюлозе более 13% карбоксильных групп, т. е. при окислении более 50% первичных спиртовых групп получается продукт, полностью растворимый в разбавленных растворах щелочи, аммиака и соды с образованием соответствующих солей, растворимых в воде. Препараты монокарбоксилцеллюлозы начинают в последнее время получать практическое применение в качестве кровеостанавливающих средств. С поливалентными металлами такая окисленная целлюлоза дает нерастворимые соли в результате образования химических связей между макромолекулами. Монокарбоксилцеллюлоза является сравнительно сильной кислотой; она вытесняет уксусную кислоту из ее солей, и на этом свойстве основан метод определения содержания карбоксильных групп в окисленной целлюлозе. Наличие карбоксильных групп в макромолекуле окисленной целлюлозы изменяет (по сравнению с исходной целлюлозой) отношение к красителям [19]. Монокарбоксилцеллюлоза, содержащая всего 2-3% карбоксильных групп, уже интенсивно окрашивается основными красителями, которые почти не окрашивают неокисленную целлюлозу. На поглощении основных красителей основывается один из методов количественного определения содержания карбоксильных групп в окисленной целлюлозе.
2. При действии на целлюлозу йодной кислоты и ее солей или ацетата свинца происходит одновременное окисление обеих вторичных спиртовых групп до альдегидных групп, сопровождающееся разрывом пиранового кольца элементарного звена макромолекулы целлюлозы. При обработке продуктов окисления бромидом или хлоритом натрия альдегидные группы окисляются до карбоксильных.
Метод одновременного окисления обеих вторичных спиртовых групп целлюлозы, также как других полисахаридов (крахмал) и моносахаридов до альдегидных был разработан в 1935 — 1938 гг. Гудсоном и Джексоном.
При действии йодной кислоты на многоатомные спирты, в частности на моно- и полисахариды, происходит одновременное окисление в альдегидные группы двух соседних спиртовых групп (гликолевая группировка) с одновременным разрывом углерод-углеродной связи между ними. Для целлюлозы процесс окисления протекает с разрывом пиранового кольца по следующей схеме:

Эта схема реакции была доказана исследованием продуктов гидролиза целлюлозы и крахмала, окисленных йодной кислотой. Окисления первичных спиртовых групп при действии йодной кислоты или ее солей не происходит. Продукт окисления целлюлозы йодной кислотой, представляющий полиполуацеталь эритрозы и глиоксаля, названный Роговиным ди- альдегидцеллюлозой, может быть отнесен к оксицеллюлозам только условно, поскольку один из основных признаков, характерных для строения как самой целлюлозы, так и продуктов превращения, — наличие пиранового цикла — у этих соединений отсутствует.
Аналогичное избирательное окисление гликолевой группировки, в частности вторичных спиртовых групп в молекуле моносахаридов и полисахаридов, может быть осуществлено также при действии раствора тетраацетата свинца.
Окисление вторичных спиртовых групп макромолекулы целлюлозы раствором йодной кислоты или ее солей производится в водных растворах, в отличие от окисления раствором тетраацетата свинца, которое проводится в органических растворителях. Проведение реакции в водных растворах обеспечивает большее набухание целлюлозы и, соответственно, более равномерное проведение реакции. Введение в элементарное звено макромолекулы целлюлозы двух альдегидных групп в положение 2 и 3 значительно изменяет свойства препаратов [20-23].
При окислении диальдегидцеллюлозы в мягких условиях получается препарат окисленной целлюлозы, у которой в элементарном звене в положениях 2 и 3 имеются вместо вторичных спиртовых групп карбоксильные группы. Получение этого препарата, названного дикарбоксилцеллюлозой, происходит при обработке диальдегидцеллюлозы бромом или хлоритом натрия. Оба реагента в определенных условиях не окисляют спиртовых групп, но окисляют альдегидные группы:

Окисление вторичных спиртовых групп до карбоксильных в одну стадию до настоящего времени не разработано.
Так же, как и диальдегидцеллюлоза, дикарбоксилцеллюлоза, представляющая собой полиполуацеталь глиоксиловой кислоты, может быть отнесена к препаратам окисленной целлюлозы только условно, так как и в этих продуктах пирановый цикл разорван.
Введение даже в небольшое число элементарных звеньев макромолекулы целлюлозы двух альдегидных групп путем частичного окисления вторичных спиртовых групп резко влияет на свойства получаемых эфиров окисленной целлюлозы и на устойчивость глюкозидной связи к действию разбавленных щелочей. В этом отношении влияние альдегидных групп в положениях 2 и 3 аналогично влиянию карбоксильной группы в положении 6, образующейся при окислении первичной спиртовой группы.
Введение в молекулу целлюлозы диальдегидных группировок понижает устойчивость глюкозидной связи к действию щелочей, но не изменяет ее устойчивость к действию кислот. Если провести в мягких условиях дополнительное окисление альдегидных групп до карбоксильных, то устойчивость окисленного волокна к действию щелочей значительно повышается.
Приведенные методы окисления спиртовых групп целлюлозы исчерпывают известные до настоящего времени возможности избирательного окисления целлюлозы. Все остальные окислители, применяемые для окисления целлюлозы, вызывают окисление как первичных, так и вторичных спиртовых групп, причем, в зависимости от условий окисления и характера окислителя, спиртовые группы окисляются до карбонильных (альдегидная и кетогруппы) или до карбоксильных групп.
Все продукты окисления целлюлозы, получаемые при действии большинства окислителей, могут быть схематически разделены на два типа:
а)продукты восстановительного характера
б)продукты кислотного характера.
Окисленные препараты целлюлозы обоих типов имеют ряд общих свойств и ряд отличий, характерных для каждой группы этих препаратов.
Общими свойствами для всех типов оксицеллюлоз являются: 1. повышенное содержание кислорода по сравнению с содержанием кислорода в исходной целлюлозе;
— наличие в заметных количествах карбонильных или карбоксильных групп, содержание которых в макромолекулах исходной целлюлозы очень мало;
— пониженная устойчивость глюкозидных связей в макромолекуле к действию щелочи;
— повышенная растворимость в щелочи.
Препараты окисленной целлюлозы восстановительного типа характеризуются дополнительно следующими свойствами:
— высокими значениями медных и йодных чисел;
— возможностью взаимодействия с гидроксиламином, фенилидразином и другими веществами, реагирующими с карбонильными группами;
— большими потерями в массе при нагреваний с разбавленными растворами щелочей и окрашиванием этих растворов в желтый цвет при кипячении со щелочью (в результате протекания процессов изомеризации);
— низким содержанием карбоксильных групп и отсутствием сродства к основным красителям.
Препараты оксицеллюлоз кислотного типа характеризуются:
— высоким содержанием карбоксильных групп;
— сродством к основным красителям;
— низким значением медных и йодных чисел.
Устойчивость к действию щелочей этих типов окисленной целлюлозы будет различна, в зависимости от места положения карбоксильных групп в элементарном звене макромолекулы.
Окисление целлюлозы различными окислителями может привести к получению продуктов, приближающихся к первому или ко второму типу оксицеллюлоз. Кроме указанных выше методов избирательного окисления, при которых реакция окисления протекает преимущественно в одном направлении, препараты окисленной целлюлозы содержат как карбоксильные, так и карбонильные группы.
Препараты окисленной целлюлозы восстановительного типа образуются, как правило, при действии окислителей в кислой или нейтральной среде. При окислении целлюлозы в щелочной среде происходит постепенное превращение альдегидных групп в карбоксильные группы, и полученные продукты окисления содержат преимущественно карбоксильные группы. Если применять для окисления целлюлозы одни и те же окислители, то, в зависимости от рН среды, полученные препараты содержат различные количества карбонильных и карбоксильных групп.
При окислении раствором гипобромита натрия в щелочной среде получают окисленную целлюлозу кислотного типа, содержащую большое количество карбоксильных и незначительное количество альдегидных и ке- тонных групп. При окислении перманганатом калия в кислой среде получается окисленная целлюлоза, занимающая промежуточное положение между указанными типами оксицеллюлоз и содержащая сравнительно большое количество как карбоксильных, так и альдегидных групп.
§
1.2 Окисление целлюлозы
Действие окислителей на целлюлозу имеет место во многих производственных процессах, основанных на переработке целлюлозы или содержащих целлюлозу растительных материалов.
Возможность окисления целлюлозы необходимо учитывать при отварке хлопчатобумажных и льняных тканей (действие кислорода воздуха в щелочной среде), при отбелке тканей (действие солей хлорноватистой кислоты или перекисных соединений), при производстве вискозного волокна (процессы мерсеризации и предварительного созревания — действие кислорода воздуха в щелочной среде), при получении медноаммиачного искусственного волокна, в производстве целлюлозы (отбелка) и в ряде других производств. Прогрессирующее окисление целлюлозы, активируемое действием световых лучей и приводящее к постепенному разрушению материала, одит и в процессе эксплуатации хлопчатобумажных и других целлю- тканей.
Указанными обстоятельствами объясняется то, что изучению процес- окисления целлюлозы различными окислителями посвящено большое исследований [8-10]. Процесс окисления целлюлозы представляет большой научный интерес, так как путем избирательного окисления первичных спиртовых групп удается ввести в макромолекулу целлюлозы функциональные группы — карбонильные (альдегидные и кетонные) карбоксильные, — и получить препараты окисленной целлюлозы, обла- хей новыми свойствами.
В качестве окислителей целлюлозы могут быть применены любые реа- I, окисляющие первичные или вторичные спиртовые группы или при- мдащие к Образованию перекисных соединений.
Продукты, которые получаются при действии окислителей на целлюлозу и которые в результате частичного окисления гидроксильных групп отличаются по химическому составу от исходной целлюлозы, носят название оксицеллюлоз [11]. В большинстве случаев процесс частичного окисления спиртовых групп сопровождается понижением степени полимеризации целлюлозы. Известен, однако, ряд методов получения оксицеллюлоз, при которых деструкции целлюлозы не происходит.
В начальной стадии процесса окисления целлюлозы происходит час- тачное окисление гидроксильных групп или, возможно образование перекисных соединений [16-17]. На более глубоких стадиях процесса окисления целлюлозы происходит деструкция макромолекул целлюлозы с образованием низкомолекулярных моно- и дикарбоновых оксикислот. При полном окислении целлюлозы образуются двуокись кислорода и вода.
Кроме того, при окислении целлюлозы могут получаться вещества с различным положением образовавшихся функциональных групп в элементарных звеньях макромолекул окисленной целлюлозы, т. е. изомерные. Поэтому продукты окисления целлюлозы, получаемые по разным способам, значительно различаются как по составу, так и по свойствам. При действии окислителей на целлюлозу могут иметь место следующее реакции избирательного окисления отдельных групп [18]:
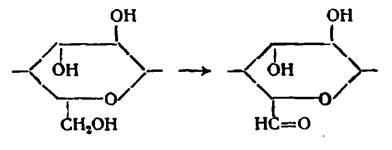
Окисление первичных спиртовых групп элементарного звена до альдегидных групп:
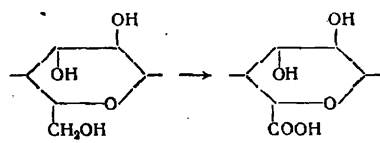
Окисление первичных спиртовых групп до карбоксильных
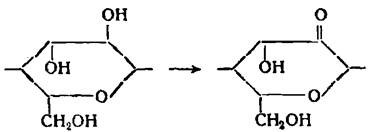
Окисление вторичных спиртовых групп элементарного звена (в положении 2 или 3) до кетогрупп, например
Одновременное окисление вторичных спиртовых групп в положениях 2 и 3 до альдегидных групп, сопровождающееся разрывом пиранового цикла элементарного звена.
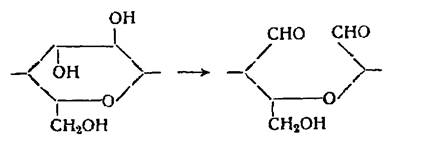
При комбинированном действии окислителей может произойти дальнейшее окисление альдегидных групп, образующихся при окислении вторичных спиртовых групп до карбоксильных групп:
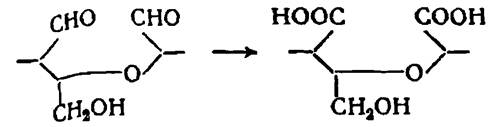
Кроме того, принципиально возможно присоединение кислорода к «кислородному мостику» между элементарными звеньями макромолекул целлюлозы или к амиленоксидному кольцу элементарного звена макромолекулы с образованием перекисей. Перекиси затем распадаются и обуславливают разрыв глюкозидной связи между звеньями или расщепление пира- неового цикла.
До настоящего времени удалось осуществить не все перечисленные схемы избирательного окисления различных спиртовых групп целлюлозы. В большинстве случаев при действии различных окислителей на целлюлозу происходит одновременное окисление как первичных, так и вторичных спиртовых групп с образованием в различном соотношении альдегидных, кетонных и карбоксильных групп, находящихся у различных атомов углерода элементарного звена макромолекулы. В зависимости от условий проведения процесса, в частности от рН среды, в отдельных случаях удается изменять соотношение карбонильных и карбоксильных групп в макромоле кулах окисленной целлюлозы. В последние годы разработаны методы избирательного окисления спиртовых групп молекул целлюлозы. Избирательное окисление. Избирательное окисление целлюлозы может быть осуществлено по двум основным схемам:
Химические свойства аминов
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

