Взаимодействие оксидов с водой
Вы убедились, насколько активным веществом является кислород. Способны ли оксиды — продукты взаимодействия кислорода с простыми и сложными веществами — к взаимодействию с другими веществами? Выясним это на опытах и начнем со взаимодействия оксидов с самым распространенным в природе оксидом — оксидом водорода, или водой.
Опыт 1. Получим оксид фосфора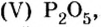
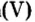
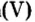
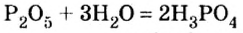
Воды было добавлено в избытке, поэтому оставшаяся ее часть растворила в себе образовавшуюся кислоту, раствор которой мы и обнаружили с помощью индикатора.
Немало оксидов неметаллов, а также оксиды некоторых металлов с высоким значением валентности 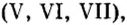
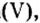
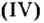
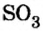
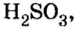
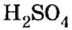
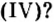
Существует правило: чтобы определить валентность кислотообразующего элемента в молекуле кислородсодержащей кислоты, необходимо от суммы единиц валентности кисло рода отнять сумму единиц валентности водорода.
Воспользуемся этим правилом и определим валентность серы в сернистой и серной кислотах.
Вычисления показали, что сера в сернистой кислоте четырехвалентна, а в серной — шестивалентна.
Следовательно, вступая в реакцию с водой, оксид серы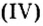
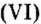
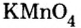
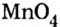
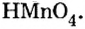
Пример №5
Составить формулу оксида, соответствующего марганцевой кислоте.
Решение
1. Воспользовавшись данным правилом, определим валентность марганца в марганцевой кислоте:
2. Составим формулу семивалентного оксида марганца.
Наименьшее общее кратное для единиц валентности марганца и кислорода — 14. По очереди разделив его на 7 (валентность марганца) и на 2 (валентность кислорода ), получим индексы 2 и 7.
Ответ: 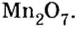
Опыт 2. В фарфоровую чашку поместим немного негашеной извести, или оксида кальция и осторожно дольем немного воды (рис. 6, о). Наблюдается «вскипание» образовавшейся смеси (рис. 6, б). Оно вызвано тем, что негашеная известь активно реагирует с водой и реакция сопровождается сильным разогретом.
В дальнейшем будем работать с прозрачным фильтратом, который разделим на 3 пробирки. В первую пробирку добавим несколько капель лакмуса и будем наблюдать, как раствор сразу же начнет синеть. До этих пор вы знали, что в растворах кислот лакмус приобретает розовый цвет. Появление другого цвета индикатора свидетельствует о наличии в растворе другого вещества.
Рассмотрим уравнение реакции между оксидом кальция и водой и выясним, что это за вещество:
Таким образом, в растворе есть основание. Выдвигаем гипотезу (предположение), что лакмус можно использовать в качестве индикатора для обнаружения оснований. Чтобы проверить это, проведем следующий опыт.
Опыт 3. Нальем в пробирку 1—2 мл раствора гидроксида натрия 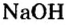
В растворе оснований лакмус изменяет свой цвет на синий.
Опыт 4. Во вторую пробирку с гидроксидом кальция, полученным в опыте 2, добавим несколько капель метилового оранжевого. Наблюдается появление желтой окраски раствора.
Опыт 5. Прибавим несколько капель метилового оранжевого к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат — раствор приобретает желтый цвет.
В растворе оснований метиловый оранжевый приобретает желтый цвет.
Есть еще одно вещество, чувствительное к наличию в растворе оснований. Это — фенолфталеин. Вспомните, раствор этого вещества в воде бесцветен. Проведем опыт.
Опыт 6. В пробирку с водой добавим несколько капель раствора фенолфталеина. Цвет раствора не изменился.
Опыт 7. В третью пробирку с раствором гидроксида кальция, полученного в опыте 2, добавим несколько капель фенолфталеина — раствор сразу становится ярко-малинового цвета.
Опыт 8. Добавим несколько капель фенолфталеина к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат, как и в опыте 7.
В растворе оснований фенолфталеин приобретает малиновый цвет.
Опыт 9. Поместим в химический стакан немного оксида меди
 гидроксиды для таких оксидов не характерны. Так, всем хорошо известна ржавчина —
гидроксиды для таких оксидов не характерны. Так, всем хорошо известна ржавчина — 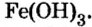
Валентность металла в основании равна валентности металла в соответствующем оксиде:
Таким образом, одни оксиды металлов взаимодействуют с водой и образуют растворимые основания, или щелочи, другие с водой не взаимодействуют, но соответствующие им нерастворимые в воде основания существуют.
Большинство оксидов неметаллов взаимодействуют с водой при обычных условиях и образуют кислоты.
Оксиды, которые взаимодействуют с водой и образуют основания, и оксиды, которые не взаимодействуют с водой, но им соответствуют основания, называют основными.
Итоги:
- Оксиды способны к взаимодействию с другими веществами.
- Оксидам отвечают гидроксиды — кислоты и основания.
- Валентность кислотообразующего элемента в кислоте равна его валентности в соответствующем оксиде.
- Валентность металла в основании совпадает с его валентностью в соответствующем оксиде.
- Присутствие щелочи в растворе (щелочной среды) обнаруживают с помощью индикаторов: лакмуса, фенолфталеина, метилового оранжевого.
Первый индикатор был изготовлен из природного сырья. Случилось это так. Как-то английскому ученому Роберту Бойлю (1627— 1691 гг.) понадобился сосуд, в котором он изготовил водную настойку лакмусового лишайника. Он освободил сосуд от настойки, налил в нее соляной кислоты и заметил, что бесцветный до этого раствор кислоты стал красным.
Потом он добавил несколько капель настойки в раствор гидроксида натрия. Теперь раствор стал синим. Так был открыт и впервые использован индикатор для определения кислой и щелочной среды, который назвали лакмусом. Впоследствии настойкой стали пропитывать бумажные полоски, а зятем высушивать их и использовать в химических лабораториях.
Оксид цинка, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
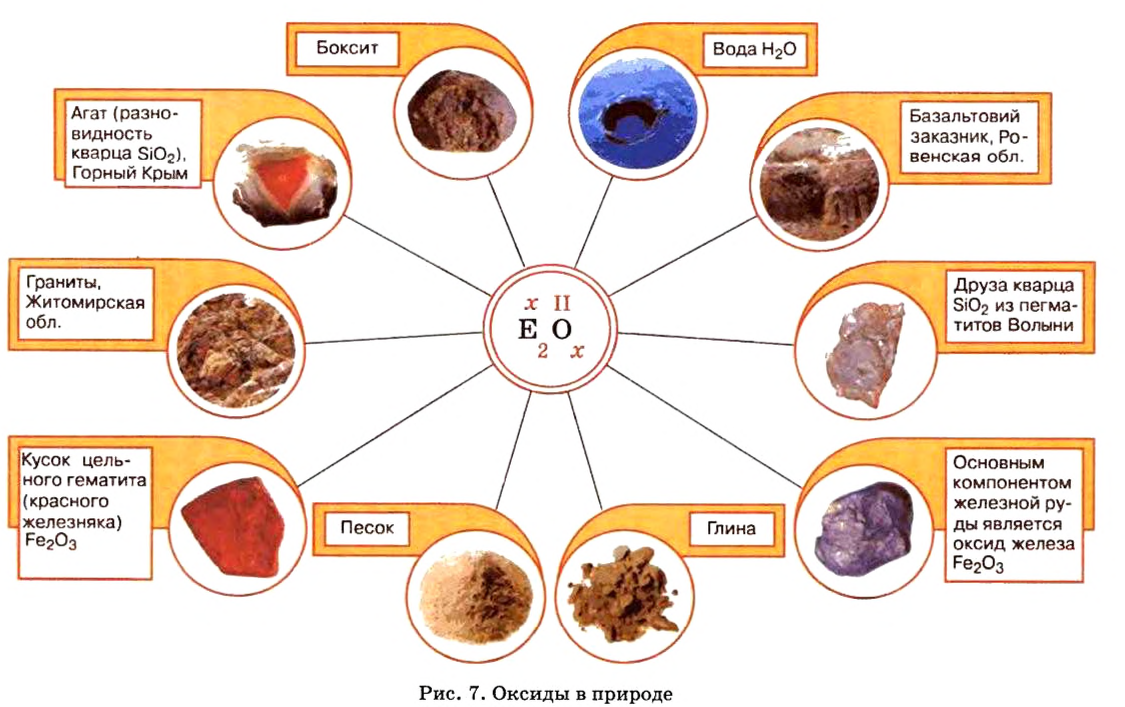
Оксиды в природе
Вы уже знаете, что среди химических элементов чемпионами по распространению в природе является кислород, кремний, алюминий, железо. Своим первенством они обязаны оксидам. Оксиды — самые распространенные вещества на нашей планете. Больше всего оксидов содержится в оболочках Земли: атмосфере (оксид углерода
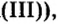
Из уроков природоведения вы узнали, что воздух приблизительно на 0,03 % состоит из углекислого газа. На первый взгляд, это вроде бы немного. Однако, если учесть, что воздушная оболочка Земли достигает до 15 км в высоту, становится понятным, насколько распространен этот газообразный оксид.
А что уж говорить о другом оксиде неметалла — оксиде водорода, которым покрыто 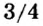
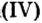
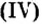
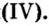
Залежи оксидов железа в Украине в большом количестве находятся вблизи Кривого Рога.
По рисунку 7 вы сможете дополнительно ознакомиться с распространением оксидов в природе.
Применение оксидов основывается на разнообразии их химических и физических свойств. Так, свойство оксидов взаимодействовать с другими веществами используют при получении сплавов железа: чугуна и стали, кислот.
Без использования свойства оксида водорода (воды) растворять другие вещества, образуя растворы, нельзя представить быт, пищевую промышленность, производства лекарств и т. п. Высокая теплоемкость воды дает возможность использовать ее для отопления помещений, в теплообменниках на заводах по производству кислот, в производстве удобрений и т. п.
Однако не следует забывать, что в воде зародилась жизнь и без воды живая природа существовать не может. Поэтому забота о сохранении чистоты водоемов — дело каждого.
Оксид кремния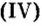
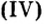
Из оксида алюминия приблизительно на 50 % состоят бокситовые руды, залежи которых есть в Украине. Из этого оксида на алюминиевых заводах получают «крылатый» металл алюминий. Вам хорошо известно, что самолетов и ракетостроение без него было бы невозможным.
Твердость оксида алюминия и оксида кремния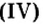 рудах — оксидах железа (буром, красном, магнитном железняках) работают доменные печи. Так называют сооружения, в которых из руд выплавляют железо в виде чугуна. Из руды магнитного железняка, в состав которой входит железная окалина
рудах — оксидах железа (буром, красном, магнитном железняках) работают доменные печи. Так называют сооружения, в которых из руд выплавляют железо в виде чугуна. Из руды магнитного железняка, в состав которой входит железная окалина 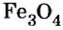
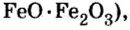
 Оксид серы
Оксид серы  — производство
— производство 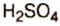
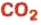 оксид углеводорода
оксид углеводорода  — производство сахара, газированных вод, соды.
— производство сахара, газированных вод, соды. оксид бериллия- в ядерных реакторах.
оксид бериллия- в ядерных реакторах. оксид титана
оксид титана — изготовление белой краски( титановые белила)
— изготовление белой краски( титановые белила) 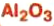 оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)
оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)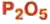 оксид фосфора — осушитель газов и жидкостей
оксид фосфора — осушитель газов и жидкостей оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве
оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве Оксид Ванадия
Оксид Ванадия  — катализатор в производстве аммиака и серной кислоты
— катализатор в производстве аммиака и серной кислоты Оксид кремния
Оксид кремния — производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз.
— производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз. Оксид магния — производство резины, огнеупорных материалов
Оксид магния — производство резины, огнеупорных материалов Оксид углерода — восстановление металлов из руд в металлургии
Оксид углерода — восстановление металлов из руд в металлургии Оксид серы
Оксид серы — производство
— производство 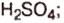 в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод
в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод Оксид хрома
Оксид хрома — производство абразивных материалов; изготовление зеленой краски
— производство абразивных материалов; изготовление зеленой краски оксид железа
оксид железа — производство чугуна и стали; изготовление красок
— производство чугуна и стали; изготовление красок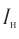 Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах
Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах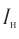 Оксид азота
Оксид азота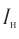 — производство
— производство  окислитель жидкого ракетного топлива
окислитель жидкого ракетного топлива
Относительно использования оксида углерода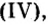
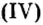
Рассмотренные оксиды распространены в природе и используются человеком в больших количествах. Однако многие другие оксиды, хотя и уступают по распространению и масштабах использования, являются не менее важными. Приведем конкретные примеры.
Многие химические производства прекратили бы свою работу без катализаторов, в том числе и оксида ванадия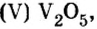 оксида марганца
оксида марганца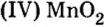
Белая, зеленая, коричневая и некоторые другие краски своим цветом обязаны оксидам металлических элементов — цинка, хрома, железа, кобальта и т. п.
Оксид серы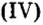
Оксид магния применяют для производства огнеупорных материалов, из которых изготавливают тигли и огнеупорный кирпич.
Добавляя в стекло вместо части оксида кремния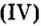 оксид бора
оксид бора 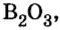
В медицине применяют оксид цинка, оксид магния, оксид алюминия и другие.
Строительство было бы невозможным без оксида кремния
По рисунку 8 вы можете еще раз убедиться в разностороннем применении оксидов.
Итоги:
- По распространению в природе оксиды занимают первое место среди сложных неорганических веществ.
- Благодаря разнообразию физических и химических свойств оксиды находят широкое применение в разных отраслях народного хозяйства и быту.
Было рассмотрено применение каждого из оксидов. Однако существуют производства, где задействованы сразу несколько оксидов, например производство чугуна в специально построенных печах, которые называются доменными, или домнами. Во-первых, железо добывают из руд, которые содержат 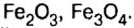
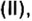
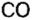
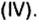


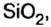
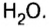
Получение оксидов
Оксиды получают различными методами. Ознакомимся с некоторыми из них.
Непосредственное взаимодействие простых веществ с кислородом.
4 Li O2 2O 4P 5O2
2O 4P 5O2 2O5
2O5
Разложение гидроксидов малоактивных металлов (т.е. нерастворимых в воде оснований).
Mg(OH)2 2O 2A1(OH)3
2O 2A1(OH)3 2O3 3H2O
2O3 3H2O
Разложение неустойчивых или слабых кислородсодержащих кислот.
H2CO3 2 ↑ H2O H2SO3
2 ↑ H2O H2SO3 2 ↑ H2OРазложение некоторых солей.
2 ↑ H2OРазложение некоторых солей.
CaCO3  2↑Если элемент образует несколько оксидов, путем окисления оксида с низковалентным элементом или, наоборот, восстановления оксида с высоковалентным элементам можно получить новые оксиды:
2↑Если элемент образует несколько оксидов, путем окисления оксида с низковалентным элементом или, наоборот, восстановления оксида с высоковалентным элементам можно получить новые оксиды:
2NO O2 → 2NO2
CO2 C 
Вытеснение одного оксида другим оксидам из их солей. Малолетучие кислотные оксиды вытесняют летучие оксиды из их солей.
Na2CO3 SiO2 2SiO3 CO2↑Na2SiO3 CO2 ↑
2SiO3 CO2↑Na2SiO3 CO2 ↑ 
| Оксид | Оксид, вытесненный из своей соли |
| SiO2 | P2O5, NO2, CO2 |
| P2O5 | CO2 |
| NO2 | CO2 |
Эти реакции являются необратимыми.
В результате горения некоторых сложных веществ.
CH4 2O2 2↑ 2H2O ↑
2↑ 2H2O ↑
Химические свойства оксидов. Изучим химические свойства каждого типа оксидов в отдельности. Каждый вид оксида обладает присущими ему химическими свойствами.
| Основные оксиды не вступают в реакцию с щелочами. |
Взаимодействие основных оксидов с водой. Из основных оксидов лишь те оксиды, которые образованы щелочными и щелочноземельными металлами, вступая в обычных условиях в реакцию соединения с водой, образуют гидроксиды (щелочи).
Na2O H2O → 2NaOHCaO H2O → Ca(OH)2
Другие основные оксиды не вступают в реакцию с водой.Взаимодействие основных оксидов с кислотами и кислотными оксидами. Основные оксиды, вступая во взаимодействие с кислотными оксидами, образуют соли. При реакции с кислотами образуют соль и воду.
CaO CO2 з CuO H2SO4 → CuSO4 H2O
з CuO H2SO4 → CuSO4 H2O
Взаимодействие основных оксидов малоактивных металлов с восстановителями. Основные оксиды малоактивных металлов восстанавливаются посредством H2, С, СО до металла. Li2O, Na2O, K2O, CaO, BaO и др. в эти реакции не вступают, т.е. не восстанавливаются до металла.
CuO C 
Взаимодействие кислотных оксидов с водой. Кроме оксида кремния (IV) (SiO2), все другие кислотные оксиды, вступая в реакцию соединения с водой, образуют кислоты. Эти реакции называются реакциями гидратации. Реакция взаимодействия NO2 с водой не является реакцией гидратации.
3NO2 H2O 3 NO
3 NO
SO3 H2O → H2SO4
Кислотные оксиды не вступают в реакцию с большинством кислот. Амфотерные оксиды ни при каких условиях не вступают в реакцию с водой. Поскольку амфотерным оксидам присущи двойственные свойства, они вступают в реакции как с кислотами, так и с щелочами.
ZnO 2NaOH 2ZnO2 H2O
2ZnO2 H2O
Na2ZnO2 — цинкат натрия
ZnO H2SO4 → ZnSO4 H2O
ZnSO4 — сульфат цинка
Взаимодействие амфотерных оксидов с восстановителями. Амфотерные оксиды, взаимодействуя с восстановителями H2, С, СО, востанавливаются до свободного металла.
ZnO C 
Смешанные оксиды ни при каких условиях не вступают в реакцию с водой.Взаимодействие сметанных оксидов с кислотами. При реакции этих оксидов с кислотами образуются две различные соли.
Fe3O4 8НС1 → FeCl2 2FeCl3 4H2O
Взаимодействие смешанных оксидов с восстановителями. Смешанные оксиды, взаимодействуя с восстановителями H2, С, СО, восстанавливаются до свободного металла.
Fe3O4 4С0  2Разложение оксидов. Некоторые оксиды при нагревании разлагаются до свободного металла.
2Разложение оксидов. Некоторые оксиды при нагревании разлагаются до свободного металла.
2HgO  2 ↑
2 ↑
Задача:
Определите оксиды:
| X | Y | Z |
| A) K2O | Fc2O3 | CrO3 |
| В) Fe2O3 | CrO3 | CrO |
| С) K2O | CrO3 | Fc2O3 |
| D) CrO3 | K2O | Fc2O3 |
| Е) Fe2O3 | K2O | CrO3 |
| Оксид металла | Вещества, вступившие в реакцию | ||
| H2O | NaOH | НCl | |
| XaOb | |||
| YaOb | |||
| ZaOb | |||
Решение: Li2O, Na2O, K2O, CaO, BaO в нормальных условиях вступают в реакцию как с водой, так и с кислотами.
В таком случае, XaOb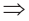 2O.Амфотерные оксиды (ВеО, ZnO, Fe2O3, Cr2O3, Al2O3) вступают в реакцию как с щелочами, так и с кислотами. В таком случае, YaOb
2O.Амфотерные оксиды (ВеО, ZnO, Fe2O3, Cr2O3, Al2O3) вступают в реакцию как с щелочами, так и с кислотами. В таком случае, YaOb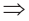 2O3.Из кислотных оксидов CO2, SO2, SO3, NO2, N2O5, Р2О3, P2O5, CrO3, Cl2O7 взаимодействуют как с водой, так и с щелочами. В таком случае, ZaOb
2O3.Из кислотных оксидов CO2, SO2, SO3, NO2, N2O5, Р2О3, P2O5, CrO3, Cl2O7 взаимодействуют как с водой, так и с щелочами. В таком случае, ZaOb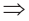 3.
3.
Ответ: А
Задача:
Какие выражения верные?1) X неметалл2) Y2O3 кислотный оксид3) Z2O3 амфотерный оксид4) Y неметалл5) X металл
| Оксиды | Вещества, вступившие в реакцию | ||
| NaOH | H2O | ||
| XO | |||
| Y2O3 | |||
| Z2O3 | |||
Решение: Если XO вступает в реакцию как с щелочами, так и с кислотами, то это амфотерный оксид (BeO, ZnO). Если Y2O3 вступает в реакцию только с щелочами, то это кислотный оксид (N2O3, Р2О3).
Расчеты по химическим уравнениям
В средние века алхимики не знали, что с помощью вычислений можно определить, какая масса вещества должна вступить в реакцию или образоваться в результате реакции. Они брали для экспериментов произвольные порции веществ и по их остаткам выясняли, какая масса каждого вещества прореагировала.
В настоящее время расчеты не только масс, но и количеств вещества реагентов и продуктов реакций, объемов газов осуществляют по химическим уравнениям. При этом используют значения относительных атомных, молекулярных, формульных или молярных масс. Благодаря таким расчетам химик или инженер-технолог может целенаправленно осуществлять химические превращения, получать продукты реакций в необходимом количестве, избегая избытка исходных веществ.
В этом параграфе рассмотрены решения нескольких задач с использованием химических уравнений. Напомним, что коэффициенты в уравнениях указывают на соотношение количеств вещества реагентов и продуктов реакций:
Пример №1
Какое количество вещества литий гидроксида образуется в результате реакции 4 моль литий оксида с достаточным количеством воды?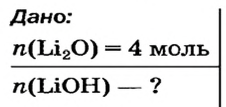
Решение
1. Составляем химическое уравнение:
2. Готовим запись для составления пропорции. Под формулами соединений 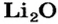
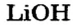 х моль):3. Рассчитываем количество вещества литий гидроксида. Составляем пропорцию и решаем ее: по уравнению реакции из 1 моль
х моль):3. Рассчитываем количество вещества литий гидроксида. Составляем пропорцию и решаем ее: по уравнению реакции из 1 моль 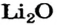
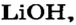
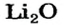 х моль
х моль 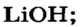
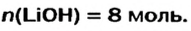
Пример №2
Какая масса углекислого газа прореагирует с 28 г кальций оксида?
Решение
1-й способ
1. Составляем химическое уравнение:
Согласно уравнению, в реакцию вступают одинаковые количества вещества оксидов, например 1 моль 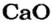
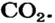
2. Определяем молярные массы веществ, указанных в условии задачи:
Масса 1 моль 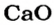
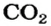
3. Записываем под формулами реагентов в химическом уравнении массы 1 моль каждого соединения, а над формулами — известную из условия задачи массу кальций оксида и неизвестную массу углекислого газа:
4. Вычисляем массу углекислого газа. Составляем пропорцию и решаем ее: по уравнению реакции
56 г 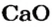
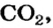
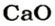 х г
х г 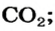
2-й способ
1. Составляем химическое уравнение:
2. Рассчитываем количество вещества кальций оксида:
3. Записываем под формулами реагентов в химическом уравнении их количества вещества согласно коэффициентам, а над формулами — вычисленное количество вещества кальций оксида и неизвестное количество вещества углекислого газа:
4. Вычисляем количество вещества углекислого газа:
5. Находим массу углекислого газа:
Ответ: 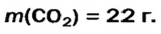
Пример №3
Какой объем сернистого газа (н. у.) прореагирует с натрий гидроксидом с образованием натрий сульфита количеством вещества 0,2 моль?
Решение
1. Записываем химическое уравнение и готовим запись для составления пропорции:
2. Находим количество вещества сернистого газа. Составляем пропорцию и решаем ее:
из 1 моль 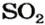
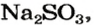
из х моль 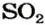
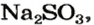
3. Вычисляем объем сернистого газа при нормальных условиях:
Ответ: 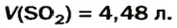
В некоторых задачах речь идет о двух одновременно протекающих реакциях. Способ их решения заключается в составлении математического уравнения с одним неизвестным (или системы двух уравнений с двумя неизвестными).
Пример №4
После добавления достаточного количества воды к 11,6 г смеси оксидов Лития и Кальция образовалось 17,0 г смеси гидроксидов. Найти массы оксидов в смеси.
Решение
1. Принимаем массу литий оксида за х г. Тогда масса кальций оксида будет равна (в граммах):
2. Вычисляем молярные массы оксидов и гидроксидов Лития и Кальция:
3. Составляем уравнения реакций с записями масс реагентов и продуктов, обозначив неизвестные массы соединений 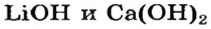
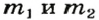
4. Записываем две пропорции и получаем математические выражения для масс гидроксидов:
5. Приравниваем сумму найденных масс гидроксидов к 17,0 г, решаем уравнение и находим массы оксидов:
Ответ: 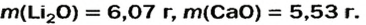
Выводы:
Для того чтобы вычислять массы, количества вещества реагентов и продуктов реакций, объемы газов, используют химические уравнения.
Решение задач осуществляют составлением пропорций, а также по формулам, которые отображают связь между соответствующими физическими величинами.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ), CO2 (оксид углерода(IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ), NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора), P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты), ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия), V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома), Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца), Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа), Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта), Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия), Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена), MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag 1Ag 3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия(II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова(IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты), TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I 12O (монооксид дийода), I 2O (монооксид йода), I 4O2 (диоксид йода), I 3, 52O4 или I 3O(I 5O3) или (I 3, 5O2)2 (тетраоксид дийода, иодноватокислый йод), I 52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I 3, 54O9 или I 3(I 5O3)3 или I 3(OI 5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |
