Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Озон, физико-химические свойства, применение
ОБЩИЕ СВЕДЕНИЯ.
Озон — О3, аллотропная форма кислорода, являющаяся мощным окислителем химических и других загрязняющих веществ, разрушающихся при контакте. В отличие от молекулы кислорода, молекула озона состоит из трех атомов и имеет более длинные связи между атомами кислорода. По своей реакционной способности озон занимает второе место, уступая только фтору.
История открытия
В 1785 г. голландский физик Ван Ма-рум, проводя опыты с электричеством, обратил внимание на запах при образовании искр в электрической машине и на окислительные способности воздуха после пропускания через него электрических искр.
В 1840 г. немецкий ученый Шейнбейн занимаясь гидролизом воды пытался с помощью электрической дуги разложить её на кислород и водород. И тогда он обнаружил, что образовался новый, доселе не известный науке газ со специфическим запахом. Имя “озон” было присвоено газу Шейнбейном из-за характерного запаха и происходит от греческого слова “озиен”, что значит “пахнуть”.
22 сентября 1896 г. изобретатель Н. Тесла запатентовал первый генератор озона.
Физические свойства озона.
Озон может существовать во всех трех агрегатных состояниях. При нормальных условиях озон — газ голубоватого цвета. Температура кипения озона — 1120С, а температура плавления составляет — 1920С .
Благодаря своей химической активности озон имеет очень низкую предельно-допустимую концентрацию в воздухе (соизмеримую с ПДК боевых отравляющих веществ) 5·10-8 % или 0,1 мг/м3, что в 10 раз больше обонятельного порога для человека.
Химические свойства озона.
Следует отметить прежде всего два основных свойства озона:
O3 -> О О 2
О3 О -> 2 О2
О2 E- -> О2-
Озон является одним из сильнейших природных окислителей. Окислительный потенциал озона составляет 2,07 В (для сравнения у фтора 2,4 В, а у хлора 1,7 В).
Озон окисляет все металлы за исключением золота и группы платины, доокисляет оксиды серы и азота, окисляет аммиак с образованием нитрита аммония.
Озон активно вступает в реакцию с ароматическими соединениями с разрушением ароматического ядра. В частности озон реагирует с фенолом с разрушением ядра. Озон активно взаимодействует с насыщенными углеводородами с разрушением двойных углеродных связей.
Взаимодействие озона с органическими соединениями находит широкое применение в химической промышленности и в смежных отраслях. Реакции озона с ароматическими соединениями легли в основу технологий дезодорации различных сред, помещений и сточных вод.
Биологические свойства озона.
Несмотря на большое количество исследований механизм недостаточно раскрыт. Известно, что при высоких концентрациях озона наблюдаются поражения дыхательных путей, легких и слизистой оболочки. Длительное воздействие озона приводит к развитию хронических заболеваний легких и верхних дыхательных путей.
Воздействие малыми дозами озона оказывает профилактическое и терапевтическое воздействие и начинает активно использоваться в медицине — в первую очередь для дерматологии и косметологии.
Кроме большой способности уничтожения бактерий озон обладает высокой эффективностью в уничтожении спор, цист (плотные оболочки, образующиеся вокруг одноклеточных организмов, например, жгутиковых и корненожек, при их размножении, а также в неблагоприятных для них условиях) и многих других патогенных микробов.
Технологическое применение озона
В последние 20 лет области применения озона значительно расширились и во всем мире ведутся новые разработки. Столь бурному развитию технологий с использованием озона способствует его экологическая чистота. В отличие от других окислителей озон в процессе реакций разлагается на молекулярный и атомарный кислород и предельные оксиды. Все эти продукты, как правило, не загрязняют окружающую среду и не приводят к образованию канцерогенных веществ как, например, при окислении хлором или фтором.
Вода:
В 1857 г. с помощью созданной Вернером фон Сименсом «совершенной трубки магнитной индукции» удалось построить первую техническую озоновую установку. В 1901 г. фирмой «Сименс» построена первая гидростанция с озонаторной установкой в Висбанде.
Исторически применение озона началось с установок по подготовке питьевой воды, когда в 1898 году в городе Сан Мор (Франция) прошли испытания первой опытно-промышленной установки. Уже в 1907 году был построен первый завод по озонированию воды в городе Бон Вуаяж (Франция) для нужд города Ниццы. В 1911 году была пущена в эксплуатацию станция озонирования питьевой воды в Санкт-Петербурге.
В настоящее время 95% питьевой воды в Европе проходит озонную подготовку. В США идет процесс перевода с хлорирования на озонирование. В России действуют несколько крупных станций (в Москве, Нижнем Новгороде и других городах).
Воздух:
Применение озона в системах очистки воды доказано в высшей степени эффективным, однако до сих пор не создано таких же эффективных и доказано безопасных воздухоочистительных систем. Озонирование считается нехимическим способом очистки и поэтому популярно среди населения. Вместе с тем, хроническое воздействие микро-концентраций озона на организм человека достаточно не изучено.
При очень незначительной концентрации озона воздух в помещении чувствуется приятным и свежим, а неприятные запахи ощущаются гораздо слабее. В противоположность распространенному мнению о благоприятном воздействии этого газа, которое приписывают в некоторых проспектах богатому озоном лесному воздуху, в действительности озон даже при большом разбавлении представляет собой очень токсичный и опасный раздражающий газ. Даже малые концентрации озона могут оказывать раздражающее действие на слизистые оболочки и вызывать нарушения центральной нервной системы, что ведет к появлению бронхита и головных болей.
Медицинское применение озона
В 1873 г. Фоке наблюдал уничтожение микроорганизмов под воздействием озона и это уникальное свойство озона привлекло к себе внимание медиков.
История использования озона в медицинских целях берет свое начало в 1885 г., когда Чарли Кенворф впервые опубликовал свой доклад в Медицинской Ассоциации Флориды, США. Краткие сведения о применении озона в медицине обнаружены и до этой даты.
В 1911 г. М. Eberhart использовал озон при лечении туберкулеза, анемии, пневмонии, диабета и др. заболеваний. А. Вольф (1916) в период первой мировой войны применяет кислородно-озоновую смесь у раненых при сложных переломах, флегмонах, абсцессах, гнойных ранах. Н. Kleinmann (1921) применил озон для общего лечения “полостей тела”. В 30-х гг. 20 века Е.А. Фиш, зубной врач, начинает лечение озоном на практике.
В заявке на изобретение первого лабораторного прибора Фишем был предложен термин «CYTOZON», который и сегодня значится на генераторах озона, используемых в зубоврачебной практике. Йоахим Хэнзлер (1908-1981) создал первый медицинский генератор озона, который позволял точно дозировать озоно-кислородную смесь, и тем самым дал возможность широко применять озонотерапию.
Р. Auborg (1936) выявил эффект рубцевания язв толстой кишки под действием озона и обратил внимание на характер его общего воздействия на организм. Работы по изучению лечебного действия озона во время второй мировой войны активно продолжались в Германии, немцы успешно применяли озон для местного лечения ран и ожогов. Однако после войны практически на два десятилетия исследования были прерваны, что обусловлено появлением антибиотиков, отсутствием надежных, компактных генераторов озона и озоно-стойких материалов. Обширные и систематические исследования в области озонотерапии начались в середине 70-х гг., когда в повседневной медицинской практике появились стойкие к озону полимерные материалы и удобные для работы озонаторные установки.
Исследования in vitro, то есть в идеальных лабораторных условиях, показали что при взаимодействии с клетками организма озон окисляет жиры и образует пероксиды — вещества, губительные для всех известных вирусов, бактерий и грибков. По действию озон можно сравнить с антибиотиками, с той разницей, что он не “сажает” печень и почки, не имеет побочных явлений. Но, к сожалению, in vivo — в реальных условиях всё обстоит гораздо сложнее.
Озонотерапия одно время была весьма популярна — многие считали озон чуть ли панацеей от всех недугов. Но детальное изучение воздействия озона показало, что вместе с больными озон поражает и здоровые клетки кожи, легких. В результате в живых клетках начинаются непредвиденные и непрогнозируемые мутации. Озонотерапия так и не прижилась в Европе, а в США и Канаде официальное медицинское применение озона не легализовано, за исключением альтернативной медицины.
В России, к сожалению, официальная медицина так и не отказалась от столь опасного и недостаточно проверенного способа терапии. В настоящее время воздушные озонаторы и озонаторные установки получили широкое распространение. Малые генераторы озона используются в присутствии людей.
ПРИНЦИП ДЕЙСТВИЯ.
Озон образуется из кислорода. Существует несколько способов получения озона, среди которых наиболее распространенными являются: электролитический, фотохимический и электросинтез в плазме газового разряда. Дабы избежать нежелательных окисей предпочтительнее получать озон из чистого медицинского кислорода используя электросинтез. Концентрацию получаемой озоно-кислородной смеси в таких аппаратах легко варьировать — либо задавая определенную мощность электрического разряда, либо регулируя поток входящего кислорода (чем быстрее кислород проходит через озонатор, тем меньше озона образуется).
Электролитический метод синтеза озона осуществляется в специальных электролитических ячейках. В качестве электролитов используются растворы различных кислот и их соли (H2SO4, HClO4, NaClO4, KClO4). Образование озона происходит за счет разложения воды и образования атомарного кислорода, который присоединяясь к молекуле кислорода образует озон и молекулу водорода. Этот метод позволяет получить концентрированный озон, однако он весьма энергоемкий, и поэтому он не нашел широкого распространения.
Фото-химический метод получения озона представляет из себя наиболее распространенный в природе способ. Образование озона происходит при диссоциации молекулы кислорода под действием коротковолнового УФ излучения. Этот метод не позволяет получать озон высокой концентрации. Приборы, основанные на этом методе, получили распространение для лабораторных целей, в медицине и пищевой промышленности.
Электросинтез озона получил наибольшее распространение. Этот метод сочетает в себе возможность получения озона высоких концентраций с большой производительностью и относительно невысокими энергозатратами.
В результате многочисленных исследований по использованию различных видов газового разряда для электросинтеза озона распространение получили аппараты использующие три формы разряда:
- Барьерный разряд — получивший наибольшее распространение, представляет из себя большую совокупность импульсных микроразрядов в газовом промежутке длиной 1-3 мм между двумя электродами, разделенными одним или двумя диэлектрическими барьерами при питании электродов переменным высоким напряжением частотой от 50 Гц до нескольких килогерц. Производительность одной установки может составлять от граммов до 150 кг озона в час.
- Поверхностный разряд— близкий по форме к барьерному разряду, получивший распространение в последнее десятилетие благодаря своей простоте и надежности. Так же представляет из себя совокупность микроразрядов, развивающихся вдоль поверхности твердого диэлектрика при питании электродов переменным напряжением частотой от 50 Гц до 15-40 кГц.
- Импульсный разряд — как правило стримерный коронный разряд, возникающий в промежутке между двумя электродами при питании электродов импульсным напряжением длительностью от сотен наносекунд до единиц микросекунд.
ЭФФЕКТ СТЕРИЛИЗАЦИИ.
К стерилизующим достоинствам озона относят широкий спектр его биоцидного действия при низкой концентрации, возможность использования для обеззараживания труднодоступных поверхностей, более короткий период полураспада в сравнении с другими газами, а также наличие дезодорирующего эффекта.
Механизм инактивации воздушной микрофлоры озоном очень похож на действие озона в воде. Сперва озон воздействует на оболочку микроорганизмов путем реакции с двойными связями липоидов. Затем, благодаря способности разрушать дегидрогеназы клетки, озон воздействует на ее дыхание. В результате нарушения проницаемости оболочки и изменения растворимости белков клетка лизируется. Обнаружено проникновение озона внутрь микробной клетки, вступление его в реакцию с веществами цитоплазмы и превращение замкнутого плазмида ДНК в открытую ДНК, что снижает пролиферацию бактерий.
Противовирусное действие озона связывается с разрушением вирусных частиц, инактивацией обратной транскриптазы и влиянием на способность вируса связываться с клеточными рецепторами. Капсулированные вирусы более чувствительны к действию озона, чем некапсулированные. Это объясняется тем, что капсула содержит много липидов, которые легко взаимодействуют с озоном.
Наблюдается известное различие между разными видами микроорганизмов по их сопротивляемости действию озона. Довольно быстро погибают возбудители ангины, дифтерии, различные плесени. Как правило, наиболее устойчивы микробы, покрытые оболочкой, как например туберкулезная палочка и микробные споры.
Эффективность стерилизующего действия озона зависит от его концентрации, экспозиции, температуры, влажности, вида микроорганизма, pH и исходной обсемененности обеззараживаемого воздуха.
Озон в низких концентрациях (около 0,2 мг/м3) не очень эффективен для уничтожения бактерий, т.к. они восстанавливаются спустя некоторое время после обработки. В этих случаях озон оказывает лишь поверхностное действие (контактируя с внешней оболочкой клетки) и незначительно проникает вглубь. Для полной инактивации микрофлоры помещения необходима высокая концентрация озона и длительное время для контакта с микроорганизмами.
Оксиды азота (N2О, N2O5, NO и др.) усиливают бактерицидные свойства озона, которые в значительной степени зависят от влажности воздуха. При относительной влажности воздуха ниже 45 % озон почти не оказывает бактерицидного действия, а оптимум его активности лежит между 60-80 % влажности.
В профессиональных целях для стерилизации воздуха помещения в присутствии людей генератор озона служить не может, поскольку концентрация озона в несколько раз превышает ПДК для человека. Высокая концентрация выделяющегося озона приводит к деструкции полимеров и натуральной резины, окислению металлов и порче электронного оборудования.
ЭФФЕКТ ФИЛЬТРАЦИИ.
Способность озона окислять органический и неорганический материал еще окончательно не доказана и его эффективность при удалении загрязняющих веществ типа пыльцы, пыли, оксида углерода, формальдегидов из воздуха весьма сомнительна (вопреки заявлениям некоторых производителей). Озон, как показывает практика, взаимодействуя с другими загрязняющими веществами, способен произвести даже более вредные химические соединения чем те, которые намеревались удалить из воздуха.
На основе проведённых испытаний Федеральная Торговая Комиссия США выпустила специальное постановление 5 января 1998 г., в котором производителям озонаторных установок запретили заявлять в рекламе о способности их устройств очищать воздух.
ПРИСУТСТВИЕ ЛЮДЕЙ.
Наружные методы озонотерапии применяются при различных ранах, гнойниках, воспалениях, язвенных поражениях, варикозах, ожогах, атопическом дерматите, тяжелых формах экземы, диабетической гангрене. На конечности надевается герметичный “сапог” или “рукав”, в который подается озон высокой концентрации — до 80 мг на литр кислорода. Газ “убивает” гнойный налет, рана очищается и заживает. После процедуры количество бактерий на пораженных участках уменьшается в несколько десятков раз. При наружном (на кожные покровы и раневую поверхность), энтеральном (per os et per rectum) и парентеральном введении в терапевтическом диапазоне концентраций озон не оказывает токсического действия на организм человека.
Озон — газ, токсичный при вдыхании. Он раздражает слизистую оболочку глаз и дыхательных путей, повреждает сурфактант легких. Последовательность болезненных проявлений при вдыхании озона была описана Флюгге. Сначала наступает сонливость, затем изменяется дыхание: оно становится глубоким, неритмичным. В конце появляются перерывы в дыхании. Смерть наступает, видимо, в результате паралича дыхания. Патологоанатомические исследования показали характерную картину отравления озоном: кровь не свертывается, легкие пронизаны множеством сливных кровоизлияний.
Озон ядовит, имеет очень низкую предельно-допустимую концентрацию в воздухе, соизмеримую с ПДК боевых отравляющих веществ и поэтому необходим тщательный контроль его содержания в окружающей среде. Требуемая для уничтожения патогенных агентов концентрация озона в несколько раз превышает ПДК для человека. По этой причине присутствие людей в озонируемом помещении запрещено.
На сегодняшний день применение озонирующих воздух установок в помещениях с людьми не было одобрено или рекомендовано ни одним агентством федерального правительства США, Канады, Европы. Ассоциации здравоохранения США и Канады обратились к своим гражданам с призывом не использовать озонаторы в помещениях с людьми.
С 1995 г. Федеральной Торговой Комиссией США (в целях защиты национального здоровья населения) производителям озонаторов запрещено заявлять, что их устройства:
- Эффективны в очистке воздуха помещений.
- Не производят вредных побочных продуктов.
- Облегчают условия для аллергиков, астматиков и др.
В 1997 г. компании-производители озонаторов Living Air Corporation, Alpine Industries Inc.(ныне “Ecoguest”), Quantum Electronics Corp. и другие, нарушившие предписание ФТК США, решением судов были наказаны в административном порядке, включая запрет на дальнейшую деятельность некоторых из них на территории США. В тоже время частные предприниматели, продававшие генераторы озона c рекомендациями использовать их в помещениях с людьми, получили тюремные сроки заключения от 1 до 6 лет.
В настоящее время некоторые из этих западных компаний успешно развивают активную деятельность по реализации своей продукции в России.
Недостатки озонаторов:
Любая система стерилизации, использующая озон, требует тщательного контроля техники безопасности, тестирование константы концентрации озона газоанализаторами, а также аварийного управления чрезмерной концентрацией озона.
Озонатор не рассчитан для работы в:
- среде, насыщенной электропроводящей пылью и водяными парами,
- местах, содержащих активные газы и пары, разрушающие металл,
- местах с относительной влажностью свыше 95 %,
- во взрыво- и пожароопасных помещениях.
Применение озонаторов для стерилизации воздуха в помещениях:
- удлиняет по времени процесс стерилизации,
- увеличивает токсичность и окисление воздушной среды,
- приводит к опасности взрыва,
- возращение людей в продезинфицированное помещение возможно только после полного разложения озона.
РЕЗЮМЕ.
Озонирование высокоэффективно для стерилизации поверхностей и воздушной среды помещения, однако эффект очистки воздуха от механических примесей отсутствует. Невозможность использования метода в присутствии людей и необходимость проводить обеззараживание в герметичном помещении серьезно ограничивает сферу его профессионального применения.
Применение кислорода, озона, воды, пероксида водорода
В медицине и фармации
Oxygenium (кислород). Применяется при гипоксии, при гипоксемии; вдыхание газовой смеси, содержащей 40-50% кислорода, улучшает состояние больных. Оксигенотерапия показана также при отравлении угарным газом СО.
Carbogenum (карбоген)95-97% О2; 5-3% СО2. Применяют при отравлении угарным газом для улучшения легочной вентиляции, используют также при шоковых состояниях, для возбуждения дыхательного центра во время наркоза.
Aqua purificata (вода очищенная). Используется для приготовления жидких лекарственных форм, растворов для иньекций, отваров, настоев; для приготовления реактивов, используемых в фарманализе.
Препараты водорода пероксида применяют наружно для обработки ран, полосканий полости рта и горла в качестве антисептических и дезодорирующих средств, а также кровоостанавливающих средств в стоматологии, отоларингологии, дерматологии.
Solutio Hydrogenii peroxydi diluta (раствор водорода перекиси 3%).
Perhydrolum (пергидрол) 28-30%.
Magnesii perox у dum (магния перекись) (MgO2 MgO).
Hydroperitum (гидроперит) – таблетки, содержащие комплекс мочевины с водорода пероксидом:
H2N − C − NH2 ´ H2O2


O
Токсическое действие озона, пероксида водорода
Озон.При большой концентрации озона в загрязненном выхлопными газами городов воздухе в организме человека возможна реакция озона с органическими веществами:
RH O3 = RO2 HO·
Эти радикалы инициируют радикально-цепные реакции с биоорганическими молекулами — липидами, белками, ДНК, что приводит к гибели клеток. На этой реакции основано применение озона для обеззараживания воды, озонирования воздуха.
Пероксид водорода. В организме человека пероксид водорода образуется в результате реакции:
2H O2 2e— = H2O2
Из Н2О2 возможно образование радикалов
Н2О2 = 2НО·
Радикал НО· реагирует с биоорганическими веществами — липидами клеточных мембран, ДНК, нарушая её репаративную функцию, что приводит к неконтролируемому делению клеток и возникновению опухолей. В здоровом организме срабатывают защитные механизмы – под действием фермента каталазы Н2О2 разлагается:
2Н2O2 ® 2Н2О О2
В старческом возрасте эти механизмы не срабатывают, в организме образуются радикалы, приводящие к массовой гибели клеток, старению организма и смерти.
Тема V. р-Элементы VI группы: сера, селен
Биологическая роль серы и селена
Сера. По содержанию в организме человека сера относится к макроэлементам (массовая доля 0,16%). Как и кислород, она жизненно необходима. Суточная потребность взрослого человека в сере около 4-5 г. Сера поступает в организм в виде неорганических и органических соединений, входящих в состав пищевых продуктов. Неорганические соединения серы (соли серной и сернистой кислот) не всасываются и выводятся из организма через кишечник. Органические соединения в организме расщепляются и всасываются в кишечнике. К элементам, способствующим усвоению серы, относятся F и Fe, а антагонистами серы являются As, Ba, Pb, Mo, Se.
Сера входит в состав многих биомолекул – белков, аминокислот (цистина, цистеина, метионина и др.), гормонов (например, инсулина), витаминов (например, витамина В1). Сера является компонентом структурного белка коллагена. Хондроитин-сульфат присутствует в коже, хрящах, ногтях, тканях миокарда. Серосодержащими метаболитами являются гемоглобин, эстрогены, фибриногены и др. Много серы содержится в структурных веществах волос, костях, нервной ткани.
Аминокислоты, содержащие серу, характеризуются наличием сульфгидрильных –SН-групп (например, цистеин) или наличием дисульфидных связей –S–S– (например, цистин). При окислении сульфгидрильных групп образуются дисульфидные связи и, наоборот, при восстановлении связей –S–S– образуются SН-группы, т.е. эти переходы обратимы:
R1–SH R2–SH « R1–S–S–R2
В некоторой степени этот обратимый переход защищает организм от радиационных поражений. Под влиянием ионизирующего облучения в результате радиолиза воды в организме образуются свободные радикалы, в том числе Н· и ·ОН, активизирующие процессы окисления. Сульфгидрильные группы вступают в реакции со свободными радикалами:
RSH ·ОН ® RS· H2О.
Образующиеся радикалы RS· малоактивны. Тем самым предотвращается воздействие активных радикалов (·ОН) на нуклеиновые кислоты.
В живых организмах сера, входящая в состав аминокислот, окисляется. Конечными продуктами этого процесса преимущественно являются сульфаты. Также образуются тиосульфаты, элементарная сера и политионовые кислоты:

Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений – фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. Кроме того, серная кислота связывает многие чужеродные для организма соединения (ксенобиотики) – лекарственные препараты и их метаболиты. Со всеми этими соединениями серная кислота образует относительно безвредные вещества – конъюгаты, в виде которых они и выводятся из организма. Например, с мочой человека выделяется конъюгат – калиевая соль сернокислого эфира фенола:

Практические данные о нарушениях, связанных с дефицитом серы в организме человека, немногочисленны. Экспериментально установлено, что недостаток метионина в пище тормозит рост молодых животных и снижает продуктивность взрослых животных. Поскольку метионин участвует в синтезе некоторых важных серосодержащих соединений (цистеина, глутатиона, биотина, тиамина, липоевой кислоты и др.), то проявления недостатка в организме этих веществ можно в определенной степени относить к симптомам дефицита серы.
Селен. По содержанию в организме селен относится к микроэлементам (массовая доля 10-5-10-7 %). Некоторые исследователи считают его жизненно необходимым элементом. Суточная потребность человека в селене составляет 20-100 мкг. Селен поступает в организм с пищей. Всасывание селена происходит в тонком кишечнике, где из растворимых соединений селена образуются соединения селена с метионином и цистеином. Усвоению селена способствует витамин Е. Накапливается селен в основном в печени и почках, а также в ногтях и волосах, костном мозге, сердечной мышце, поджелудочной железе, легких, коже. Концентрация селена в крови составляет 0,001-0,004 ммоль/л.
В живых организмах селен, как и сера, входит в состав биосубстратов в степени окисления -2. Вследствие близости химических свойств этих элементов, они могут замещать друг друга в соединениях. При этом селен может выступать как синергистом, так и антагонистом серы. При поступлении в организм в больших дозах селен в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты цистеин и метионин. Очевидно, что при этом селен, как аналог серы, замещает её в этих аминокислотах, превращая их в селеноцистеин и селенометионин. Установлено, что эти необычные аминокислоты входят в состав активных центров нескольких ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, обеспечивая их высокую ферментативную активность. В то же время замещение группы –SH на группу –SeH в ряде ферментов приводит к снижению их дегидрогеназной активности и ингибированию клеточного дыхания.
Селен является элементом, выполняющим многочисленные защитные функции в организме, усиливает иммунную защиту организма, способствует увеличению продолжительности жизни. Установлена зависимость между высоким содержанием селена в пище и низкой смертностью от рака.
Хорошо известна способность селена предохранять организм от отравления соединениями ртути и кадмия. Причем селен способствует связыванию катионов этих металлов не селенсодержащими группами метаболитов, а другими активными центрами, на которые их токсическое действие не оказывает влияния. При дефиците селена в организме происходит усиленное накопление ртути, кадмия и мышьяка.
Недостаток селена в организме приводит к нарушению целостности клеточных мембран, значительному снижению активности сгруппированных на них ферментов, накоплению кальция внутри клеток, нарушению метаболизма аминокислот, снижению энергопродуцирующих процессов.
§
В медицинской практике широко применяют как саму серу, так и многие её соединения.
Порошок «серы осажденной» применяют наружно в виде мазей и присыпок при лечении кожных заболеваний. В организме образуются продукты окисления серы – политионовые кислоты с общей формулой H2SXO6 (х = 3-6). Эти продукты обладают противомикробной и противопаразитарной активностью. На этом же основано применение «серы очищенной».
Тиосульфат натрия (Na2S2O3∙5H2O) применяют как детоксицирующее и противовоспалительное средство. Как детоксицирующее средство его используют при отравлениях соединениями ртути, свинца, синильной кислотой (HCN) и её солями, солями йода и брома. Механизм действия препарата, очевидно, связан с окислением тиосульфат-иона до сульфит-иона и элементарной серы:
S2O32- ® SO32- S0.
Ионы свинца и ртути, попадающие в организм с пищей или воздухом, образуют плохорастворимые нетоксичные сульфиты:
Pb2 SO32- ® PbSO3¯.
Цианид-ионы взаимодействуют с элементарной серой, образуя менее ядовитые тиоцианаты:
CN— S0 ® SCN—.
Применяют тиосульфат натрия и для лечения чесотки. После втирания в кожу 60% раствора Na2S2O3 делают повторные втирания 6%-ного раствора НС1. В результате реакции с НС1 тиосульфат натрия распадается на серу и оксид серы (IV):
Na2S2O3 2HCl ® 2NaCl SO2↑ S H2O,
которые и оказывают губительное действие на чесоточных клещей.
Слабительный эффект Na2SO4∙10H2O и MgSO4∙7H2O, так же как и других солевых слабительных, связан преимущественно с медленным всасыванием из кишечника и увеличением в полости кишечника осмотического давления: под влиянием препарата происходит накопление воды в кишечнике, содержимое его разжижается, перистальтика усиливается и каловые массы быстрее выводятся.
Применение неорганических соединений серы и селена
В медицине и фармации
Sulfur praecipitatum (сера осажденная) S. Применяют наружно в виде мазей (5-10-20%) и присыпок при лечении кожных заболеваний (себореи, сикоза, псориаза, чесотки и др.).
Sulfur depuratum (сера очищенная) S. Применяют внутрь в качестве противоглистного и легкого слабительного средства, а наружно в 5-10-20% мазях и присыпках при лечении кожных заболеваний (себореи, сикоза, псориаза, чесотки и др.). Входит в состав сложного порошка солодкового корня, применяемого в качестве легкого слабительного.
Natrii sulfas (натрия сульфат) Na2SO4∙10H2O. Назначают внутрь в качестве слабительного средства, показан при пищевых отравлениях, так как не только очищает кишечник, но и задерживает всасывание яда и поступление его в кровь.
Natrii thiosulfas (натрия тиосульфат) Na2S2O3∙5H2O. Применяют внутривенно в виде водного 30% раствора и внутрь в виде 10% раствора как противотоксическое, противовоспалительное средство, при аллергических заболеваниях, артритах, невралгиях. Наружно применяют для лечения больных чесоткой.
Magnesii sulfas (магния сульфат) MgSO4∙7H2O. Применяют в качестве успокаивающего, противосудорожного, спазмолитического, слабительного, желчегонного средства, при лечении гипертонической болезни, а также при отравлениях ртутью, мышьяком, тетраэтилсвинцом, солями бария. Назначают внутрь в виде водных растворов, внутримышечно и внутривенно (20% или 25% растворы).
В аналитической практике широко применяется метод йодиметрического титрования. Из неорганических веществ этим методом анализируют I2, KMnO4, Na3AsO4, HgCl2, CuSO4 и многие органические лекарственные препараты — формалин, акрихин, антипирин, анальгин, аскорбиновую кислоту и др. Применяют несколько вариантов метода. Основным веществом, используемым в качестве восстановителя в йодиметрии, является тиосульфат натрия, который реагирует с йодом по уравнению:
2Na2S2O3 I2 ® Na2S4O6 2NaI
Тиосульфат применяют для титрования избытка йода, добавляемого в процессе титрования некоторых восстановителей, или йода, образующегося при взаимодействии йодидов с окислителями, например:
Cl2 2I— ® 2Cl— I2
Реакции осаждения и растворения сульфидов и сульфатов катионов используются для обнаружения многих катионов. Сульфиды могут быть получены воздействием на соли металлов сероводорода или сульфидов щелочных металлов и аммония. Большинство сульфидов окрашено, например: РbS – черный; CdS – желтый; Ag2S – черный; MnS – телесный; Bi2S3 – черный; Sb2S3 – оранжевый. Катионы Ba2 , Сa2 , Sr2 осаждаются серной кислотой в виде сульфатов, нерастворимых в кислотах и щелочах.
В медицине селен в виде селенита и селената натрия, селенцистеина, селенсодержащих дрожжей применяют для профилактики и лечения различных заболеваний. Селен оказывает лечебный эффект при кардиопатиях различной этиологии, при гепатитах, панкреатитах, заболеваниях кожи, уха, горла и носа. Общеизвестна роль селена в профилактике и лечении злокачественных новообразований. Радиоактивные изотопы селена используются для диагностики болезней поджелудочной железы и др.
§
Очень ядовит сероводород (H2S), так как является ингибитором фермента цитохромоксидазы – переносчика электронов в дыхательной цепи. Он блокирует перенос электронов с цитохромоксидазы на кислород О2 за счет связывания атомов меди этого фермента. При вдыхании больших количеств сероводорода наступает обморочное состояние и даже смерть от паралича дыхания. Симптомами отравления сероводорода являются насморк, кашель, резь в глазах, головная боль, тошнота, рвота, возбуждение, а в тяжелых случаях – кома, судороги, отек легких. Смертельная концентрация сероводорода в воздухе – 1,2 мг/л.
Как раздражитель слизистой оболочки дыхательных путей действует оксид серы(IV) (SО2). Ежегодно в атмосферу выбрасывается 2,3 миллиарда тонн вредных примесей, из которых 14,9% приходится на долю SO2. При концентрации SO2 в воздухе 0,5 мг/м3 заболеваемость бронхитом у населения составит 6%, при концентрации 1,0 мг/м3 – 13,2%, при 5 мг/м3 – 71,2%, а при концентрации 6,8 мг/м3 все население заболеет бронхитом. Накопление SО2 в атмосфере сопровождается образованием сернистой и серной кислот за счет взаимодействия оксидов серы с парами воды и кислородом воздуха:
SO2 H2O Û H2SO3
SO2 O2 ® SO3 H2O ® H2SO4
H2SO3 и H2SO4 являются причиной кислотных дождей, наносящих огромный вред окружающей среде.
К источникам избыточного поступления серы в организм человека относятся серосодержащие соединения (сульфиты), которые добавляются во многие пищевые продукты и напитки в качестве консервантов. Токсичность соединений серы при попадании в желудочно-кишечный тракт связана с их превращением микрофлорой кишечника в сероводород.
Для качественного обнаружения сероводорода в растворе используют реакции образования малорастворимых сульфидов РbS (черного цвета), CdS (желтого цвета).
Для обнаружения SO2 в растворе используют реакции обесцвечивания растворов йода или перманганата калия:
SO2 I2 2H2O ® 2HI H2SO4
5SO2 2KMnO4 2H2O ® 2MnSO4 K2SO4 2H2SO4
Токсическая доза селена для человека составляет 5 мг. Соединения селена со степенью окисления 4 (селениты) более токсичны, чем цианиды. Распад соединений селена в организме приводит к выделению высокотоксичного диметилселена CH3-Se-CH3, имеющего чесночный запах.
Установлен механизм этой реакции. При взаимодействии селенистой кислоты H2SеO3 с тиолсодержащими белками (R−SH) происходит их превращение в белки, содержащие группы –S–Se–S–:
H2SеO3 4R–SH ® R−S−Se−S−R R–S–S–R 3Н2О
Наличие такой группы может привести к изменению третичной структуры белков и нарушению их биологической функции. Под действием ферментов соединения, содержащие группу –S–Se–S–, восстанавливаются до селеноводорода, который затем присоединяет метильные группы, образуя высокотоксичный диметилселен Н3С–Se–СН3.
Избыточное поступление селена и его соединений в организм отмечается у рабочих, занятых в электронной, литейной, медеплавильной, стекольной, лакокрасочной, нефтеперерабатывающей, химической (производство пестицидов) и фармацевтической (производство сульфида селена, селенита натрия) промышленностях.
Тема VI . р-Элементы VII группы: фтор, хлор, бром, йод
Биологическая роль фтора, хлора, брома и йода
По содержанию в организме человека хлор (0,15%) относится к макроэлементам, а остальные элементы этой группы (содержание 10-5%) являются микроэлементами. Хлор и йод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей.
В организме все галогены находятся в степени окисления -1, хлор и бром – в виде гидратированных ионов, а фтор и йод, главным образом, в связанной форме входят в состав некоторых биоорганических соединений. Вследствие уменьшения электроотрицательности в ряду F — С1 — Br — I связь углерода с йодом наименее полярна, поэтому йод находится в живых организмах в виде элементоорганических соединений (со связью С–I).
Фтор. В организме человека масса фтора составляет около 7 мг (10-5%). Соединения фтора концентрируются в костной ткани, ногтях, зубах.
Недостаток фтора в организме приводит к кариесу зубов. В состав эмали зубов входит труднорастворимый фторапатит Ca3(PO4)2∙CaF2. Минеральную основу дентина составляют гидроксоапатит 3Ca3(PO4)2∙Ca(OH)2, хлорапатит 3Ca3(PO4)2∙CaCl2 и фторапатит 3Ca3(PO4)2∙CaF2.
Фторид ионы способствуют осаждению фосфата кальция, образуя защитный слой на поверхности зубов.
Под действием кислот, вырабатываемых бактериями, происходит растворение одной из минеральных основ тканей зубов – гидроксоапатита:
3Ca3(PO4)2∙Ca(OH)2 10H ® 10Ca2 6H2PO4— 2H2O
Причем очень часто разрушению подвергается не внешняя поверхность зуба, покрытая слоем эмали, а внутренние участки дентина. Пока эмаль повреждена незначительно (имеются предположения), введение NаF способствует образованию фторапатита, который облегчает реминерализацию начавшегося повреждения.
Хлор. Хлорид-ионы играют важную биологическую роль. Они активируют некоторые ферменты, создают благоприятную среду для действия протеолитических ферментов желудочного сока. Для выработки соляной кислоты в желудке необходим NаСl. Помимо важной роли соляной кислоты в процессе пищеварения, NаС1 уничтожает различные болезнетворные бактерии (холеры, тифа). В форме соляной кислоты хлорид-ион является необходимым компонентом желудочного сока. Выделение соляной кислоты из клеток слизистой оболочки желудка можно описать следующим уравнением:
H2CO3(кровь) Cl— ® HCO3—(кровь) HCl(желудок)
Соляная кислота желудочного сока необходима для перехода фермента пепсина в активную форму. Пепсин обеспечивает переваривание белков путем гидролитического расщепления пептидных связей:
R–CO–NH–R1 H2O ® R–COOH R1–NH2
Хлорид-ионы, образуя ионные слои по обеим сторонам клеточных мембран, участвуют в создании электрического мембранного потенциала, который регулирует ионные потоки через клеточные мембраны, перенос неорганических и органических веществ сквозь мембраны, участвуют в поддержании осмотического равновесия. Имея оптимальный радиус для проникновения через мембрану клеток, хлорид-ионы совместно с ионами калия и натрия участвуют в создании определенного осмотического давления и регуляции водно-солевого обмена.
Бром локализуется преимущественно в железах внутренней секреции, в первую очередь в гипофизе. Биологическая роль соединений брома в нормальной жизнедеятельности организма еще недостаточно выяснена. Экспериментально установлено, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников.
Йод относится к числу незаменимых биогенных элементов, и его соединения играют важную роль в процессах обмена веществ. Он влияет на синтез некоторых белков, жиров, гормонов. В организме человека йода содержится 25 мг (4´10-5 %) и большая его половина находится в щитовидной железе (в виде гормонов). Щитовидная железа секретирует гормоны тироксин и трийодтиронин. Пониженная активность щитовидной железы (гипотиреоз) может быть связана с уменьшением её способности накапливать йодид-ионы, а также с недостатком в пище йода (эндемический зоб).
Таким образом, все р-элементы VII группы физиологически активны, хлор и йод незаменимы для нормальной жизнедеятельности организма. В организме галогены взаимозамещаемы, при этом наблюдаются как случаи синергизма, так и антагонизма. Антагонистами йода являются фтор и бром. Конкурируя с йодом, фтор может вытеснять его из йодорганических соединений и подавлять транспорт йода в организме. Поглощению йода щитовидной железой препятствует бром. К синергистам йода относится селен – при дефиците селена йод не усваивается.
§
Обогащение питьевой воды фтором, т.е. фторирование воды с целью доведения содержания в ней фтора до нормы (1 мг/л) приводит к значительному снижению заболеваемости населения кариесом зубов. Фторирование питьевой воды осуществляется добавлением к ней определенного количества фторида натрия.
В медицинской практике фторид натрия применяют в качестве местно действующего наружного средства. Его применение основано на образовании фторапатита в составе зубной пасты:
NaF 3Ca3(PO4)2∙Ca(OH)2 ® 3Ca3(PO4)2CaF2 NaOH
При этом происходит одновременно и подщелачивание среды ротовой полости, что способствует нейтрализации кислот, вырабатываемых бактериями.
Водные растворы натрия хлорида изотонический (0,9%) и гипертонические (3-5-10%) широко применяют в медицинской практике. Использование гипертонических растворов основано на законах осмоса. Изотонический раствор хлорида натрия изотоничен плазме крови человека; его часто называют «физиологическим». Раствор быстро выводится из сосудистой системы и лишь временно увеличивает объем жидкости, циркулирующей в сосудах, поэтому при кровопотерях и шоке он недостаточно эффективен. Основное применение изотонический раствор натрия хлорида имеет при обезвоживании организма и как дезинтоксикационное средство. Кроме того, его применяют для промывания ран, глаз, слизистой оболочки носа, а также для растворения различных лекарственных препаратов.
Компрессы, смоченные гипертоническим раствором в связи с его осмотическим влиянием, способствуют отделению гноя из раны. Гипертонические растворы (местно) оказывают также противомикробное действие. Хлорид натрия оказывает умеренное диуретическое действие.
Препараты брома обладают способностью концентрировать и усиливать процессы торможения в коре головного, мозга: по данным И.П. Павлова и его учеников, они могут восстанавливать равновесие между процессами возбуждения и торможения, особенно при повышенной возбудимости центральной нервной системы.
При эндемическом зобе назначают препараты иода: калия йодид КI или натрия йодид NаI в дозах, соответствующих суточной потребности человека в йоде (0,001 г йодида калия). В районах, где имеется дефицит йода, для профилактики эндемического зоба добавляют к поваренной соли NаI или КI. При повышенной активности щитовидной железы (гипертиреоз) вследствие избыточного синтеза тиреоидных гормонов наблюдается ненормально увеличенная скорость метаболических процессов. При эндемическом зобе йодид-ион используют для синтеза гормонов, в то время как при гипертиреозе йодид-ион тормозит йодирование тирозина.
При неэффективности препаратов для лечения гипертиреоза применяют препарат радиоактивного йода 131I, излучение которого разрушает фолликулы щитовидной железы и уменьшает тем самым избыточный синтез гормонов.
Препараты, содержащие йод, обладают различными свойствами. Элементарный йод оказывает противомикробное действие, его растворы широко применяют для обработки ран, подготовки операционного поля, при нанесении на кожу и слизистые оболочки оказывают раздражающее действие и могут вызвать рефлекторные изменения в деятельности организма. Всасываясь, йод оказывает активное влияние на обмен веществ, усиливает процессы диссимиляции. Особенно выражено его влияние на функцию щитовидной железы, так как он участвует в синтезе тироксина. Суточная потребность организма в йоде составляет около 200-220 мкг. При недостаточности йода происходит нарушение синтеза тироксина и угнетение функции щитовидной железы, введение йода усиливает в этих случаях синтез тироксина.
Малые дозы йода (Микройод) оказывают тормозящее влияние на образование тиреотропного гормона в передней доле гипофиза. Йод влияет на липидный и белковый обмен. При применении препарата йода у больных атеросклерозом наблюдается тенденция к снижению холестерина в крови, уменьшается содержание b-липопротеидов. Под влиянием препаратов йода несколько уменьшается свертываемость крови. Рефлекторным повышением секреции слизи железами дыхательных путей и протеолитическим действием объясняется применение препаратов йода в качестве отхаркивающих и муколитических средств.
§
В медицине и фармации
Из-за высокой токсичности соединения фтора в медицине не применяются. Однако имеются некоторые лекарственные препараты, в которых атомы фтора входят в состав радикалов.
Vitaftorum (витафтор). Применяют в комплексе лечебно-профилактических мероприятий у детей при кариесе зубов и для улучшения формирования тканей постоянных зубов. Назначают детям, проживающим в районах с недостаточным содержанием фтора (менее 1 мг/л) в питьевой воде. Аскорбиновая кислота предупреждает побочное влияние фтора. Препарат противопоказан при содержании фтора в питьевой воде свыше 1,5 мг/л и при явлениях А и D гипервитаминоза.
Acidum hydrochloricum (кислота соляная разведенная). Применяют внутрь в каплях и микстурах (часто вместе с пепсином) при недостаточной кислотности желудочного сока. При гипохромных анемиях вместе с препаратами железа обычно назначают разбавленную хлороводородную кислоту, она способствует улучшению всасывания и использования железа. Высшие дозы для взрослых внутрь: разовая 2 мл (40 капель), суточная 6 мл (120 капель).
Solutio Natrii chloridi isotonica (раствор натрия хлорида изотонический 0,9% для инъекций). Применяют при обезвоживании организма. Раствор вводят капельно до 3 л в сутки. Раствор натрия хлорида изотонический не оказывает раздражающего действия на ткани, его применяют для промывания ран, глаз, слизистой оболочки носа, а также для растворения различных лекарственных препаратов.
Гипертонические растворы натрия хлорида (3-5-10%) применяют наружно в виде компрессов и примочек при лечении гнойных ран. Гипертонический раствор вводят (медленно 10-20 мл 10% раствора) при легочных и кишечных кровотечениях, а также для усиления диуреза. В виде клизмы применяют 5% раствор натрия хлорида для вызывания дефекации, 2-5% раствор назначают внутрь и для промывания желудка при отравлениях нитратом серебра, который при этом превращается в нерастворимый и нетоксичный хлорид серебра. Введение гипертонических растворов натрия хлорида под кожу не допускается (некроз тканей).
Натрия хлорид применяют также для ванн, обтираний, полосканий (1-2% раствор) при заболеваниях верхних дыхательных путей.
Solutio Ringer Loche (Solutio Natrii chloridi composita) (раствор Рингера– Локка) имеет более «физиологический» состав, чем изотонический раствор натрия хлорида. Его применяют так же, как и изотонический раствор натрия хлорида.
Kalii chloridum (калия хлорид) КСl. Применяют при гипокалиемии, интоксикации наперстянкой, аритмиях различного происхождения. Принимают в виде 10% водного раствора или растворяют порошок или таблетки калия хлорида в 1/2 стакана воды или во фруктовом соке. Принимают препарат после еды.
Применение калия хлорида противопоказано при нарушении выделительной функции почек, в этом случае калий накапливается в плазме крови, что может привести к интоксикации.
Calcii chloridum (кальция хлорид). Применяют при различных патологических состояниях:
а) при недостаточной функции паращитовидных желез;
б) при усиленном выделении кальция из организма;
в) при аллергических заболеваниях (крапивнице сывороточной болезни, сенной лихорадке;
г) как средство, уменьшающее проницаемость сосудов, при пневмонии, плеврите, эндометрите;
д) при кожных заболеваниях (зуде, экземе, псориазе);
е) при нефрите, паренхиматозном гепатите, токсических поражениях печени.
Применяют как противоядие при отравлении солями магния, щавелевой кислотой и её растворимыми солями, а также растворимыми солями фтороводородной кислоты. CaCl2 назначают внутрь (5-10 % раствор) и внутривенно (10% раствор). Внутривенно препарат вводят очень медленно. Растворы CaCl2 нельзя вводить под кожу или внутримышечно, т.к. они вызывают сильное раздражение и некроз тканей.
Calcaria chlorata (хлорная известь) СаОСl2. Применяют как дезинфицирующее средство в сухом виде и в виде 0,2-5% растворов.
Natrii bromidum (натрия бромид) NaBr. Применяют при неврастении, истерии, неврозах, повышенной раздражительности, бессоннице, начальных формах гипертонической болезни, при эпилепсии и холере.
Натрия бромид назначают внутрь в микстурах, таблетках, вводят также внутривенно.
Kalii bromidum (калия бромид) KBr. Назначают только внутрь при тех же показаниях в тех же дозах, что и натрия бромид. Внутривенно не вводят из-за возможного угнетающего влияния ионов калия на проводимость и возбудимость сердечной мышцы. Часто назначают вместе с калия йодидом.
Solutio Iodi spirituosa 5% (раствор йода спиртовый). Применяют наружно как антисептическое, раздражающее и отвлекающее средство при воспалительных и других заболеваниях кожи и слизистых оболочек. Внутрь назначают для профилактики атеросклероза.
Solutio Lugoli (раствор Люголя). Применяют наружно главным образом для смазывания слизистой оболочки горла, гортани. Внутрь назначают по 5-10 капель 2 раза в день.
Kalii iodidum (калия йодид) КI. Применяют при эндемическом зобе, гипертиреозе, воспалительных заболеваниях дыхательных путей, глазных заболеваниях (катаракта и др.), бронхиальной астме.
Калия йодид – эффективное муколитическое средство, особенно у больных бронхиальной астмой. Применяют в виде 1-3% водного раствора, обильно запивая теплой водой.
Как вспомогательное средство КI назначают больным сифилисом. Препарат способствует рассасыванию инфильтрата, уменьшению болей.
Мазь, содержащая 15% калия йодида, предложена для эпиляции при грибковых поражениях кожи. Применяют также КI (внутрь) при лечении кандидозов.
Natrii iodidum (натрия йодид) NaI. Показания к применению и дозы такие же как для калия йодида.
Tabulettae «Antistruminum» (таблетки «Антиструмин»). Применяют для предупреждения эндемического зоба.
В химическом анализе широко применяется йодометрическое титрование. Из неорганических веществ этим методом анализируют KMnO4, Na3AsO4, Hg2Cl2, CuSO4 и многие органические лекарственные препараты – формалин, акрихин, анальгин, антипирин, аскорбиновую кислоту, пенициллин и др. В основе йодометрического титрования лежат реакции восстановления свободного йода до йодид ионов и окисления йодид ионов в свободный йод.
§
фармакопейная реакция с AgNO3
NaCl AgNO3 ® AgCl¯ NaNO3
белый
AgCl не растворяется в кислотах и щелочах, но растворяется в избытке раствора аммиака:
AgCl 2NH3 ® [Ag(NH3)2]Cl
хлорид диамминсеребра (I)
NaBr AgNO3 ® AgBr¯ NaNO3
светло- желтый
AgBr частично растворяется в избытке раствора аммиака:
NaI AgNO3 ® AgI¯ NaNO3
желтый
AgI нерастворим в растворе аммиака.
Окислители – KMnO4, MnO2, NaClO, хлорамин, хлорная вода – в кислой среде окисляют бромиды до свободного брома:
2KMnO4 16HCl 10KBr ® 12KCl 2MnCl2 5Br2 8H2O
Выделение свободного брома можно обнаружить несколькими способами:
1) В присутствии Br2 растворы буреют.
2) Органические растворители (хлороформ, бензол) окрашиваютcя Br2 в оранжевый цвет. При избытке хлорной воды окраска слоя органического растворителя становится лимонно-желтой вследствие образования бромхлорида BrCl.
3) При действии свободного брома на фуксинсернистую кислоту образуется бромпроизводное фуксинсернистой кислоты, имеющее красно-фиолетовый цвет.
Окислители окисляют йодиды до свободного йода. Чаще всего для окисления йодидов используют хлорную и бромную воду.
Если к испытуемому раствору в присутствии слоя хлороформа добавить хлорную воду небольшими порциями, то сначала происходит окисление I— до свободного йода и хлороформный слой окрашивается в фиолетовый цвет. При дальнейшем добавлении хлорной воды происходит окисление I2 до йодноватой кислоты HIO3 и фиолетовая окраска исчезает:
I2 5Cl2 6H2O ® 2HIO3 10HCl
Токсическое действие соединений фтора, хлора, брома и
Йода на живой организм
Вреден не только недостаток, но и избыток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (1,2 мг/л) зубная эмаль легко разрушается и появляются симптомы хронического отравления фтором — флуороз (фтороз) – повышение хрупкости костей, костные деформации и общее истощение организма.
Жизненно необходимые хлорид-ионы не обладают токсическим действием, в то время как молекулярный хлор – высокотоксичный газ, применявшийся в первую мировую войну в качестве отравляющего вещества. Газообразный хлор раздражает слизистые оболочки глаз, носа, гортани, вызывает тяжелое поражение легких. Предельно допустимая концентрация газообразного хлора в воздухе 0,001 мг/л.
Злоупотреблять препаратами брома опасно, т.к. накопление брома в организме вызывает отравление. Бромид-ионы легко всасываются в желудочно-кишечном тракте. Их токсичность невысока. Однако вследствие медленного выведения из организма они могут куммулировать, что приводит к развитию хронического отравления, которое называется «бромизмом». При появлении признаков хронического отравления бромом немедленно прекращают прием препаратов брома, вводят большое количество хлорида натрия, чтобы увеличить скорость выделения бромид-ионов и назначают обильное питье.
Большие дозы элементарного йода очень опасны: 2-3 г являются смертельными. Пары йода также ядовиты. Они вызывают сильное катаральное воспаление слизистой оболочки носа и глаз (йодный насморк).
Раздел III. Биогенные элементы d-семейства
Тема I. d-Элементы VI группы: хром, молибден, вольфрам
Биологическая роль хрома, молибдена, вольфрама
Хром относится к биогенным элементам. Общая масса хрома у взрослого человека равняется 6 мг. Как микроэлемент хром изучен еще недостаточно, но его существенная биогенная роль не вызывает сомнения. Установлено, что он играет важную роль в процессе метаболизма углеводов, осуществляя, по-видимому, связывание инсулина с рецепторами клеточных мембран. С этим согласуется тот факт, что обычное содержание хрома в сыворотке крови, которое составляет приблизительно 0,03 мМ, резко снижается при введении в кровь глюкозы. Хром потенцирует действие инсулина в периферических клетках, влияет на гомеостаз сывороточного холестерина.
Кроме того, хром входит в состав некоторых ферментов, осуществляющих окислительно-восстановительные реакции в клетках. Входит в состав пепсина, расщепляющего белки в пищеварительном тракте животных.
Молибден является эссенциальным (жизненно необходимым) микроэлементом. По содержанию в организме человека молибден относится к микроэлементам. Он входит во многие ферменты (ксантиндегидрогеназы, ксантиноксидазы, альдегидоксидазы, нитроредуктазы, сульфитоксидазы и др.), которые являются катализаторами окислительно-восстановительных процессов в растительных и животных организмах. Активные центры ферментов обычно содержат молибден, связанный с серой. Например, ксантиноксидаза – фермент, ускоряющий обмен сложных белков (в частности, пуриновый обмен):
ксантиноксидаза
ксантин О2 H2O  мочевая кислота H2O2
мочевая кислота H2O2
Если мочевая кислота не успевает выводиться из организма, то соли её скапливаются в суставах и мышечных сухожилиях, вызывая подагру. Как лекарственные препараты соединения молибдена в медицинской практике не применяются. Есть данные, что молибден играет важную роль в процессе включения фтора в зубную эмаль.
Вольфрам. В отличиеот молибдена вольфрам не относится к эссенциальным элементам. Однако, вольфрам способен замещать молибден и ингибировать молибдензависимые ферменты, например, ксантиноксидазу, что способствует снижению уровня мочевой кислоты и повышению уровня ксантина и гипоксантина. Есть данные, что вольфрам не обладает канцерогенными, тератогенными и метаболическими свойствами у человека и животных.
§
Проводятся исследования эффективности применения молибдата аммония для лечения новообразований головного мозга и мужского бесплодия.
Применение неорганических соединений хрома и молибдена
В медицине и фармации
В медицине в лечебных целях соединения хрома из-за высокой токсичности в настоящее время не используются. Для диагностики заболеваний крови и желудочно-кишечного тракта применяется pаствор Na2CrO4 меченый изотоп 51Сr для инъекций (Solutio Natrii chromatis chromo – 51 notati pro injectionibus).
Окислительные свойства хроматов и дихроматов широко используют в аналитической практике (хроматометрия). Метод основан на применении дихромата калия как сильного окислителя:
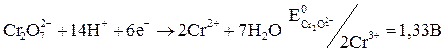
Хроматометрия используется для определения железа(II), урана(IV), меди(I), молибдена(III), некоторых органических веществ.
В санитарно-гигиенической практике применяют хроматометрию для анализа промышленных и сточных вод. В ходе анализа определяется так называемая окисляемость воды, которая характеризует общее содержание органических и неорганических восстановителей. В лабораторной практике для очистки химической посуды широко применяют хромовую смесь, состоящую из К2Сr2О7, Н20 и концентрированной Н2SО4 в соотношении 1:6:2 (по массе), которая обладает сильными окислительными свойствами.
Некоторые соединения молибдена применяются в анализе. Молибдат аммония (NH4)2MoO4∙4H2O используется как аналитический реактив на красный фосфор в присутствии концентрированной азотной кислоты, образуется осадок аммониевой соли гетерополифосформолибденовой кислоты: (NH4)3H4[P(Mo2O7)6].
4. Токсическое действие соединений хрома
Соединения хрома оказывают отрицательное воздействие на организм человека: общетоксическое, вызывают дерматиты и экземы при соприкосновении с кожей, аллергенное, канцерогенное. Причем соединения хрома(VI) значительно токсичнее, чем соединения хрома(III). Растворимые соединения хрома ядовиты: пары хромовой кислоты повреждают слизистые оболочки носа и дыхательных путей, хроматы и дихроматы разъедают кожу и вызывают экзему, а также повышают чувствительность к аллергенам. При приемах внутрь наблюдаются ожоги слизистой оболочки полости рта, ожоги пищевода и желудка, отечность. В литературных источниках имеются разноречивые данные о смертельной дозе хроматов 0,2-0,5-1 г и даже 8 г.
При содержании в водоемах соединения хрома(VI) могут вызвать поражение внутренних органов при потреблении с питьевой водой, а при купании – воспалительные изменения слизистых глаз, дерматиты и экземы, а также оказать канцерогенное действие. Предельно допустимая концентрация хрома в питьевой воде 0,05 мг/л. В аналитической практике используют способность ионов тяжелых металлов образовывать труднорастворимые хроматы:

кирпично-красный
Ag2CrO4 растворяется в растворе аммиака и азотной кислоте.
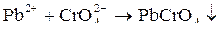
желтый
Реакцию проводят в уксуснокислой среде, в которой PbCrO4 нерастворим. В щелочной среде PbCrO4 растворяется с образованием плюмбитов:
PbCrO4 4OH— → PbO22- CrO42- 2H2O
Ba2 CrO42- → BaCrO4↓
желтый кристаллический
BaCrO4 растворяется в сильных кислотах. В присутствии Н2SO4 желтый BaCrO4 переходит в белый BaSO4.
2Ba2 Cr2O72- H2O → 2BaCrO4↓ 2H
желтый
§
1. Биологическая роль марганца
Марганец – один из десяти металлов жизни. Он является важным биогенным элементом, который необходим для нормального протекания процессов в организме. Марганец является эссенциальным элементом для человека и животных. Соединения марганца в основном поступают в организм с пищей. Всасывание марганца происходит в тонком кишечнике. Этому процессу способствуют витамины В1, Е, в умеренных количествах фосфор и кальций, а препятствует – избыточное поступление в организм фосфора и кальция. Среднесуточная потребность человека в марганце около 5 мг, она удовлетворяется той пищей, которую мы едим. Биоусвояемость марганца низкая и составляет всего 3-5%. В органах и тканях взрослого человека содержится около 12 мг марганца. Концентрируется он главным образом в костной ткани (до 43% от общего количества), печени, почках, поджелудочной железе.
В организме марганец образует комплексы с белками, нуклеиновыми кислотами (РНК и ДНК) и аминокислотами. Хотя эти комплексы из-за большого радиуса катиона Mn2 и его жесткости обычно мало устойчивы, но способствуют активации большого числа ферментов. Установлено, что биогенная роль ионов марганца (II) в организме разнообразна: они оказывают влияние на кроветворение, образование костей, минеральный обмен, процессы размножения и др. Так как ионные радиусы марганца и магния близки, они могут замещать друг друга в биохимических процессах. Марганец участвует в таком жизненно важном процессе, как аккумуляция и перенос энергии в организме, доказано его участие в синтезе витаминов группы В и С. В опытах на животных установлено влияние марганца на образование гемоглобина. Имеются данные, что это влияние марганца проявляется при некотором оптимальном соотношении марганца и железа. Таким образом, марганец – жизненно необходимый элемент.
Следует отметить, что в организме марганец находится в степени окисления 2, но его восстановительные свойства не выражены. Участвуя в биохимических процессах, марганец, как правило, не меняет своей степени окисления. Очевидно, это связано с тем, что в организме нет сильных окислителей, а также с тем, что органические лиганды стабилизируют состояние марганца(II).
Дефицит марганца является одним из распространенных отклонений в биоэлементном обмене современного человека. Это связано с повышенной психо-эмоциональной нагрузкой, за счет повышенного расходования марганца для обеспечения основных нейрохимических процессов, протекающих в центральной нервной системе.
2. Лечебное действие неорганических соединений марганца
Из соединений марганца в медицинской практике используют перманганат калия. Применяют растворы различных концентраций (в зависимости от заболевания). В целом растворы КМnO4 обладают антисептическими и прижигающими свойствами и используются для обработки поверхности кожи и слизистых оболочек, что обусловлено окислительным и коагулирующим действием его на белки. Лечебное действие KMnO4 основано на реакции:
4KMnO4 2H2O → 4MnO2↓ O2↑ 4KOH
Образующийся MnO2 оказывает вяжущее, раздражающее и прижигающее действие, а выделяющийся кислород обладает антимикробным и дезодорирующим действием. Кислород выделяется без образования пузырьков, поэтому растворы KMnO4 можно вводить в глубокие раны при анаэробной инфекции.
Перманганат калия является препаратом наружного действия. Иногда раствор КМnО4 применяют внутрь для окисления токсичных органических веществ, переводя их в менее токсичные формы. Например, морфин окисляется в мало токсичный оксиморфин.
Кроме того, в комплексе с другими компонентами используют сульфат и хлорид марганца(II) для лечения анемии. При больших кровопотерях также применяют соединения марганца в сочетании с солями меди(II) и кобальта(II).
3. Применение неорганических соединений марганца в медицине
и фармации
Kalii perm a nganas (калия перманганат) КМnO4. Применяют как антисептическое средство наружно в водных растворах для промывания ран (0,1-0,5%), для полоскания полости рта и горла (0,01-0,1%), для смазывания язвенных и ожоговых поверхностей (2-5%), для спринцеваний и промываний в гинекологической и урологической практике (0,02-0,1%). Растворы
(0,02-0,1%) применяют также для промывания желудка при отравлениях морфином, аконитином и другими алкалоидами, а также фосфором.
Для анализа ряда химических соединений и лекарственных препаратов, обладающих свойствами восстановителей, Н2О2, NaNО2, FеSО4 и др. применяют растворы перманганата калия, который и дал название методу – перманганатометрия. Определение проводят в кислой среде в присутствии серной кислоты:
MnO4– 8H 5e— → Mn2 4H2O
Используют также восстановление перманганат-ионов в нейтральной среде до МnО2 (бурого осадка) по полуреакции:
MnO4– 2H2O 3e— → MnO2¯ 4OН–
Перманганатометрию используют в клиническом и биохимическом анализе для определения некоторых ферментов, а также для определения мочевой кислоты в крови. В санитарно-гигиенической практике используют перманганат калия для определения окисляемости воды в промышленных и сточных водах.
4. Токсическое действие соединений марганца на живой организм
При действии на организм через органы дыхания соединения марганца приводят к тяжёлым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимая концентрация его соединений в воздухе равна 0,0003 мг/л в пересчёте на марганец. Описаны случаи острого отравления марганцевой пылью на производстве, с последующим быстрым развитием «марганцевого психоза» и других патологических проявлений.
Всемирная организация здравоохранения установила предельно допустимую концентрацию в питьевой воде марганца 0,5 мг/л и желательную – 0,1 мг/л.
При попадании в организм перманганаты токсичны из-за сильных окислительных свойств. При полосканиях, спринцеваниях концентрированными растворами перманганата калия наблюдается отёк слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма.
Независимо от способа введения марганец выводится из организма через желудочно-кишечный тракт и почки. Основным органом, задерживающим марганец, является печень.
Для лечения острых отравлений перманганатами используют 3%-й раствор пероксида водорода в уксуснокислой среде:
2KMnO4 5H2O2 6CH3COOH → 2Mn(CH3COO)2 2CH3COOK 8H2O 5O2↑
§
Биологическая роль железа, кобальта, никеля
Железо. По содержанию в организме человека железо относится к жизненно необходимым микроэлементам. Большая часть железа (”70%) сосредоточена в гемоглобине крови. Железо входит в состав ферментов, например, цитохромов, каталазы и др. В связанной форме железо находится в белках, которые выполняют роль переносчиков железа.
Комплексы железа:
а) Гемоглобин
Наиболее важным внутрикомплексным соединением железа является гемоглобин, который представляет собой белок, содержащий небелковую группу – гем. Гем – это бионеорганический комплекс железа (II) с органическим веществом – порфирином.
Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин условно обозначить HbFe2 , то реакцию обратимого присоединения кислорода можно выразить схемой:
дезоксигемоглобин оксигемоглобин
Гемоглобин, присоединивший кислород, называется оксигемоглобином, а без кислорода – дезоксигемоглобином. Гемоглобин взаимодействует также с оксидом углерода(II) (угарным газом). При этом образуется макроциклический комплекс с железом – карбоксигемоглобин:
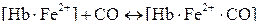
карбоксигемоглобин
Константа устойчивости этого комплекса приблизительно в 200 раз больше, чем оксигемоглобина. Поэтому при вдыхании оксида углерода(II) большая часть гемоглобина переходит в карбоксигемоглобин, что нарушает перенос кислорода от легких к тканям и вызывает отравление организма. При значительном увеличении парциального давления кислорода равновесие реакции может сместиться в сторону разрушения [Hb ∙ Fe2 ∙ CO] и частичного образования оксигемоглобина.
Серьезной причиной отравления оксидом углерода(II) является курение. Содержание карбоксигемоглобина в крови курильщика, выкуривающего пачку сигарет в день, составляет в среднем 4,7%, а у некурящих всего – 0,3-0,5%.
б) Миоглобин (Mb)
Комплексообразователем в миоглобине является ион Fe2 , который, предоставляя 6 свободных атомных орбиталей, образует 6 связей по донорно-акцепторному механизму. Из них 4 связи железо образует с порфириновым лигандом, пятая занята белком глобином, а шестая связь – молекулой воды, которая связана лабильно с комплексообразователем. Миоглобин связывает часть кислорода, поступающего в ткань, за счет замещения молекулы воды на молекулу кислорода, образуя оксигемоглобин [Mb ∙ Fe2 ∙ O2]:
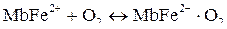
Миоглобин достаточно прочно удерживает кислород. Это позволяет тканям запасать кислород для его использования только при острой кислородной недостаточности.
в) Цитохромы – группа окислительно-восстановительных ферментов, представляющих собой гемсодержащий комплекс с белком. Функция комплекса заключается в переносе электрона за счет обратимого изменения степени окисления комплексообразователя:
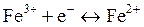
г) Каталазы и пероксидазы– группа железосодержащих ферментов, активные центры которых содержат Fe3 . Каталаза ускоряет разложение H2O2:
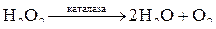
Пероксидаза ускоряет реакции окисления субстратов RH2 пероксидом водорода:
RH2 H2O2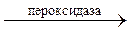 R∙ 2H2O
R∙ 2H2O
Таким образом, эти ферменты защищают клетку от Н2О2 — продукта свободного окисления.
д) Ферритин
В органах и тканях имеется депонированное (запасенное) железо, которое используется, если возникает дефицит железа. Депонируется оно с помощью белка – ферритина, который представляет собой биокластер с высокой молекулярной массой.
Кобальт относится кжизненно необходимым (эссенциальным) элементам. В организме содержится 1,2 мг кобальта в основном в составе витамина В12, центральным атомом которого является Со3 . Витамин В12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК.
Никель. В организме человека никель содержится в количестве 5-13,5 мг, около 49% микроэлемента в мышечной ткани, кроме того в лёгких, коже, печени. В организме человека он входит в состав ряда ферментов. Установлено, что никель пролонгирует действие инсулина, что увеличивает его гипогликемическую активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет процесс перехода сульфгидрильных групп в дисульфидные. Он угнетает действие адреналина и снижает артериальное давление.
2. Лечебное действие соединений железа и витамина В12
Соединения железа(II) используются при различных заболеваниях, сопровождающихся анемией. Механизм терапевтического действия соединений железа(II) связан с образованием гемоглобиновой буферной системы. Гемоглобиновая буферная система является буферной системой эритроцитов, которая включает в качестве донора протона две слабые кислоты: гемоглобин HHb (рКa=8,20) и оксигемоглобин HHbO2 (рКa=6,95). Роль акцепторов протона играют сопряженные этим кислотам основания, т.е. их анионы Hb– и HbO2–. Механизм буферного действия гемоглобиновой буферной системы основан на следующих реакциях. При добавлении кислоты:
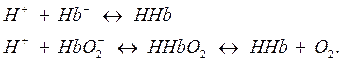
Поглощать ионы Н в первую очередь будут анионы гемоглобина, который имеет большое сродство к протону. При действии основания наибольшую активность будет проявлять оксигемоглобин по сравнению с гемоглобином:
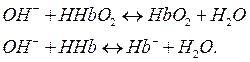
Таким образом, гемоглобиновая система крови играет очень значительную роль сразу в двух важнейших физиологических процессах – дыхании и поддержании постоянства рН внутри эритроцитов, а в конечном итоге – крови. Гемоглобиновая буферная система в организме эффективно функционирует только в сочетании с гидрокарбонатной системой.
Лечебное действие витамина В12 заключается в том, что некоторые его формы образуют в качестве кофермента соединения с витамином В6 или с некоторыми ферментами. В этих случаях он выполняет две основные функции: 1) роль метилирующего агента; 2) взаимный перенос атомов водорода и различных групп между соседними атомами углерода биосубстрата, при этом кобальт восстанавливается:
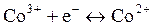
3. Применение соединений железа и кобальта в медицине и фармации
Ферковен Fercovenum (содержит железа сахарат, кобальта глюконат и раствор углеводов) – применяется при анемии.
Железа лактат (Ferri lactas) – применяется при гипохромных анемиях.
Железа закисного сульфат (Ferrosi sulfas) – применяется при анемии.
Ферроплекс (FeSO4 с аскорбиновой кислотой) (Ferroplex) – применяется при анемии.
Железа глицерофосфат (Ferri glycerophosphas) – применяется при анемии, астении.
Железа (III) хлорид (Ferri chloridum) – дезинфицирующее и кровоостанавливающее средство.
Железо восстановленное (Ferrum reductum) – при анемии.
Феррум Лек (Ferrum Lek) – применяется внутримышечно и внутривенно при лечении гипохромной анемии.
Радиоактивные изотопы железа (59Fe) – применяют при исследованиях обмена железа в организме.
Коамид Coamidum – содержит кобальт – применяется для лечения анемии.
Витамин В12 или цианокобаламин Cyanocobalaminum – применяется при лечении анемии, нервных заболеваний.
Изотоп радиоактивного кобальта 60Со – применяют для диагностики и лечения злокачественных опухолей.
§
На живой организм
Железо. Порог токсичности железа для человека составляет 200 мг/сутки. Летальная доза для человека: 7-35 г. Летальным исходом для ребенка может стать прием сульфата железа в дозе 3 г и выше. Недостаток содержания железа в организме является одной из самых распространенных причин возникновения анемии, обильных кровотечений, нарушения нервно-психических функций и снижения интеллекта у детей. Люди с избыточным содержанием железа страдают от физической слабости, теряют вес, чаще болеют. При этом избавиться от избытка железа намного труднее, чем устранить его дефицит. Необходимо помнить, что железо является окисляющим агентом (т.е. может явиться причиной возникновения свободных радикалов, способных разрушать ткани), поэтому не следует применять препараты железа в избыточных количествах.
Кобальт. Токсическая доза для человека 500 мг. Летальная доза для человека не определена. Летальная доза кобальта для животных составляет 25-30 мг/кг. Недостаток В12 в организме вызывает злокачественную анемию. Дефицит кобальта часто встречается у вегетарианцев, лиц с нарушениями функций органов желудочно-кишечного тракта, спортсменов, испытывающих повышенные физические нагрузки; а также при кровопотерях. Основные проявления дефицита кобальта выражаются в общей слабости, повышенной утомляемости, снижении памяти, вегетососудистых нарушениях, аритмии, замедленном развитии в детском возрасте, медленном выздоровлении после заболеваний.
Несмотря на то, что избыточное поступление кобальта в организм встречается довольно редко, этот процесс сопровождается различными нарушениями здоровья.Основные проявления избытка кобальта: поражение сердечной мышцы, аллергодерматиты (контактный дерматит), гиперплазия щитовидной железы, поражение слухового нерва, повышение артериального давления и уровня липидов в крови, повышение содержания эритроцитов в крови.
Никель. Металлический никель не опасен, а вот пыль и пары его соединений – токсичны. Никель способен накапливаться в роговице, поэтому отравление им может привести к значительному ухудшению зрения. Отравление никелем также негативно сказывается на пищеварительном тракте и на нервной системе. Никель – канцерогенное вещество. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил [Ni(CO)4]. Предельно допустимая концентрация никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений). Согласно ГОСТ 12.1.005-88 никель и его летучие соединения относятся к I классу опасных веществ.
Недостаточность никеля приводит к ингибированию нескольких печеночных энзимов, дезорганизует функционирование эндоплазматического ретикулума гепатоцитов, дыхательные процессы в митохондриях, изменяет содержание липидов в печени. Подобно кобальту, никель участвует в регуляции метаболизма гема в печени и почках, индуцируя активность гемоксигеназы. Повышенное содержание никеля в организме человека вызывает аллергические реакции (контактный дерматит).
Тема IV. d-элементы I, II группы: медь, серебро, цинк, ртуть
Биологическая роль меди, серебра, цинка, ртути
Медь. По содержанию в организме медь относится к микроэлементам, является металлом жизни и концентрируется в печени, головном мозге и в крови.
В настоящее время известно около 25 медьсодержащих белков и ферментов. Эти ферменты активируют молекулу кислорода, которая участвует в процессе окисления органических соединений. Они составляют группу так называемых оксигеназ и гидроксилаз. Имеется большая группа медьсодержащих белков, которые катализируют окислительно-восстановительные реакции с переносом протона или электронов от окисляемого вещества непосредственно на молекулярный кислород – это так называемые оксидазы. К оксидазам относится такой важнейший дыхательный фермент, как цитохромоксидаза (ЦХО), которая катализирует завершающий этап тканевого дыхания. Все ферменты тканевого дыхания связаны с внутренними мембранами митохондрий. В ходе каталитического процесса степень окисления меди цитохромоксидазы обратимо изменяется:
Окисленная форма цитохромоксидазы (Сu2 ) принимает электроны, переходя в восстановительную (Сu ) форму, окисляющуюся молекулярным кислородом, который сам при этом восстанавливается. Затем кислород присоединяет протоны из окружающей среды и превращается в воду. Механизм действия цитохромоксидазы не полностью расшифрован. Однако доказано, что на завершающем этапе тканевого дыхания ЦХО осуществляет перенос электронов на кислород.
Одним из медьсодержащих белков, обратимо присоединяющих молекулярный кислород, является гемоцианин (НС).
Медь вместе с железом участвует в кроветворении. Известно, что при дефиците меди в организме нарушается обмен железа между плазмой крови и эритроцитами, это может привести к разрушению эритроцитов. Потребность человека в меди 2-3 мг в сутки. Она полностью обеспечивается потребляемой пищей.
Серебро − примесный микроэлемент. В организме человека содержится приблизительно 7,3 ммоль серебра. Концентрируется серебро в печени, в гипофизе, эритроцитах, в пигментной оболочке глаза.
Цинк является микроэлементом и относится к металлам жизни. В организме концентрируется главным образом в мышцах, печени, поджелудочной железе, тестикулах.
Цинк входит в состав более 40 металлоферментов, которые катализируют гидролиз пептидов, белков, некоторых эфиров и альдегидов. По-видимому, эта роль в определенной степени обусловлена тем, что цинк не проявляет разных степеней окисления. Постоянная степень окисления определяет его участие в реакциях гидролиза, идущих без переноса электронов.
Одним из ранее открытых и наиболее изученных является цинксодержащий фермент – карбоангидраза. Этот фермент крови, содержащийся в эритроцитах, встречается в трех формах, которые отличаются активностью. Фермент состоит приблизительно из 260 аминокислотных остатков и представляет собой бионеорганический комплекс.
Цинк, расположенный в полости комплекса является важнейшим и незаменимым компонентом активного центра фермента. При удалении Zn фермент теряет каталитическую активность. Содержание цинка в ферменте порядка 0,33%. Хотя доля металла невелика, его роль трудно переоценить. Именно благодаря этому небольшому количеству цинка образующийся в тканях оксид СО2 превращается в кислоту Н2СО3. Затем в легких идет процесс дегидратации Н2СО3. Таким образом, эта обратимая реакция влияет на процесс дыхания, на его скорость, на газообмен в организме.
Существуют ферменты, которые участвуют в гидролизе дипептидов, они называются дипептидазами, в их состав обязательно входит цинк. Цинк входит в состав гормона инсулина, который влияет на содержание сахара в крови. Другими словами, цинк участвует в углеводном обмене.
Ртуть обнаруживается во всех органах и тканях организма человека. Биологическая роль ртути не ясна.
2. Лечебное действие неорганических соединений меди, серебра и ртути
Медь. Высокое сродство металлов I группы к сере определяют большую энергию связи Ме–S, а это, в свою очередь, обусловило определенный характер их поведения в биологических системах. Катионы этих металлов легко взаимодействуют с веществами, в состав которых входят группы, содержащие cеру. Например, ионы Cu2 реагируют с дитиоловыми ферментами микроорганизмов по схеме:
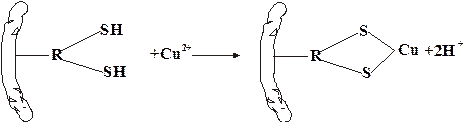
Включение ионов металлов в состав белка инактивирует ферменты, разрушает белки. Такой же механизм лежит и в основе действия лекарственных препаратов, содержащих медь и серебро, применяемых в дерматологии.
Серебро. Как и большинство тяжелых металлов, этот элемент не играет важной роли. Но как все тяжелые металлы, попадая в организм, оказывает токсическое действие, которое обусловлено тем, что, соединяясь с белками, содержащими серу, серебро инактивирует ферменты, разрушает и свертывает белки, образуя нерастворимые альбуминаты. Эта же способность серебра образовывать нерастворимые альбуминаты с белками определяет бактерицидные свойства серебра и его соединений. Уже при содержании серебра порядка 10-8 ммоль/л вода обладает бактерицидным действием. В настоящее время доказано, что бактерицидное действие ионов серебра выше таких известных дезинфицирующих средств, как карболовая кислота, хлор, хлорная известь.
Как правило, все используемые в медицине соединения серебра -препараты наружного действия. Их использование основано на вяжущих, прижигающих и бактерицидных свойствах этих соединений.
Некоторые соединения цинка и ртути в небольших концентрациях нашли применение в медицинской практике. Использование их основано на вяжущем, прижигающем и антисептическом действии. Так, цинка сульфат применяют для изготовления глазных капель (0,25%), цинка хлорид используют в стоматологической практике для прижигания папилом, для лечения воспаленных слизистых тканей. В стоматологической практике используют также цинка оксид и цинка сульфат.
3. Применение неорганических соединений меди, серебра, цинка и ртути в медицине и фармации
Cupri sulfas (меди II сульфат) CuSO4∙5H2O – антисептическое и вяжущее средство в виде 0,25% раствора при коньюнктивитах, для промывания мочевого пузыря, при уретритах и вагинитах.
Аrgenti nitras (серебра нитрат) AgNO3 – вяжущее, прижигающее и противовоспалительное средство. Назначают в виде водных растворов, мазей, а также в виде ляписных карандашей.
Stillius Lapidis (карандаш ляписный ) – для прижиганий.
Protargoli (протаргол) – вяжущее, антисептическое противовоспалительное средство для смазывания слизистых оболочек верхних дыхательных путей, для промывания мочеиспускательного канала и мочевого пузыря, в глазных каплях при коньюнктивите, блефарите.
Collargolum (колларгол) – коллоидный раствор серебра применяют в виде 0,2-1% раствора для промывания гнойных ран.
Zinci sulfas (цинка сульфат) ZnSO4∙7H2O – антисептическое и вяжущее средство при коньюнктивитах и хроническом катаральном ларингите, в редких случаях назначают внутрь как рвотное.
Zinci oxуdum (цинка оксид) ZnO – применяют наружно в виде присыпок, мазей, паст, как вяжущее, подсушивающее и дезинфицирующее средство при кожных заболеваниях.
Hydrargyri dichloridum (ртути II хлорид) HgCl2 − обладает антисептическим действием.
Hydrargyri amidochloridum (ртути амидхлорид) HgNH2Cl – обладает антисептическим действием.
В настоящее время лекарственные препараты ртути в виду токсичности не применяются.
5. Токсическое действие соединений меди, серебра и ртути
на живой организм
Медь. В больших концентрациях растворимые соли меди токсичны. Так например, сульфат меди массой до 2 г вызывает сильное отравление с возможным смертельным исходом. Токсическое действие меди объясняется тем, что медь образует с белками нерастворимые бионеорганические хелаты − альбуминаты, что приводит к коагуляции белков. Ионы меди образуют прочную связь с аминным азотом и с группой –SН белков, что приводит к инактивации тиоферментов.
Серебро, попадая в организм оказывает токсическое действие, обусловленное тем, что соединяясь с белками, содержащими серу, инактивирует, разрушает и коагулирует белки, образуя нерастворимые альбуминаты.
При попадании в организм больших доз растворимых солей серебра может наступить острое отравление, которое сопровождается отмиранием слизистой оболочки желудочно-кишечного тракта. Растворимые соединения цинка и ртути оказывают раздражающее действие на кожу, а при попадании внутрь организма вызывают отравление.
Ртуть является самым токсичным элементом Периодической системы. Отравления могут вызывать даже пары металлической ртути. Признаки отравления проявляются уже при содержании ртути в помещении в количестве 0,0002-0,0003 мг/л. Соединения ртути способны вступать во взаимодействие с сульфгидрильными группами белков, ферментов и некоторых аминокислот. При этом образуются нерастворимые соединения. Происходит подавление активности ферментов и свертывание белков.
Ионы ртути блокируют одновременно две SН–группы:
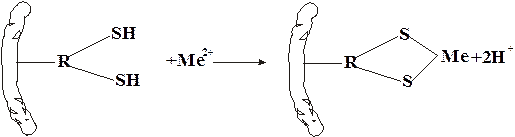
§
Тема I . s–Элементы I и II групп: литий, натрий, калий,
Магний, кальций, стронций, барий
1. Биологическая роль s-элементов I и II групп
По содержанию в организме человека Na, K, Mg, Ca относятся к макроэлементам, Li – к микроэлементам.
Литий. По содержанию в организме человека (10-4%) литий относится к микроэлементам. Он концентрируется в лимфоузлах, легких, печени, головном мозге, в мышцах. Биологическая роль лития выяснена недостаточно. Имеются сведения, что литий способствует высвобождению ионов магния и тормозит передачу нервных импульсов, снижая этим возбудимость центральной нервной системы. Установлено, что литий влияет на нейроэндокринные процессы, жировой и углеводный обмен. Синергистом лития является натрий.
Натрий. В организме человека содержится около 60 г (0,08%) натрия. Из этого количества 44% приходится во внеклеточной жидкости и 9% – во внутриклеточной. Остальное – в костной ткани, в сыворотке крови, спинно-мозговой, глазной жидкостях, пищеварительных соках, желчи, почках, легких, мозге.
Ионы натрия играют важную роль в обеспечении постоянства внутренней среды организма, участвуют в поддержании постоянного осмотического давления биожидкостей (осмотический гомеостаз).
Фосфатная буферная система (Nа2НРО4–NaH2PO4) обеспечивает кислотно-основное равновесие. Ионы Nа участвуют в регуляции водного обмена и влияют на работу ферментов. Вместе с ионами К , Mg2 и Са2 ионы Na участвуют в передаче нервных импульсов через мембраны нервных клеток и поддерживают нормальную возбудимость мышечных клеток. NаС1 – основной источник соляной кислоты для желудочного сока.
В организме натрий поступает в основном в виде поваренной соли, ежедневная потребность – 1 г, хотя среднее потребление достигает 4-7 г. Избыточное потребление NаС1 способствует появлению гипертонии.
Концентрация ионов Nа внутри клетки в 15 раз меньше, чем во внеклеточной жидкости, а концентрация ионов К в 35 раз выше внутри клетки, чем вне её.
Чтобы поддержать такое распределение, ионы Nа и К должны непрерывно перемещаться, что обеспечивается работой натрий-калиевых насосов. Эти насосы, обеспечивающие перенос ионов через плазматическую мембрану против градиента концентрации, требуют большой затраты энергии. Поэтому перенос ионов Nа и К через клеточные мембраны сопряжен с экзоэргонической реакцией гидролиза АТФ. Натрий-калиевый градиент обусловливает возникновение разности потенциалов на клеточной мембране.
Рис. 1. Схема действия ионов Na , K – АТФ-азы и возникновения разности потенциалов на клеточных мембранах
За счет энергии гидролиза одной молекулы АТФ три иона Nа выводятся из клетки, а два иона К поступают внутрь клетки (рисунок 2).
Такой дисбаланс электрических зарядов и служит причиной возникновения разности потенциалов на мембране, в частности, нервных волокнах.
Калий. В организме человека содержится 160 г (0,23%) калия. Калий –основной внутриклеточный катион (2/3 от общего количества активных клеточных катионов). Из общего количества калия – 98% находится внутри клеток; 2%– во внеклеточной жидкости. Его топография – печень, почки, сердце, костная ткань, мышцы, кровь, мозг и т.д.
Ионы К играют важную роль в физиологических процессах, сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях. Ионы калия – важные активаторы ферментов, находящихся внутри клеток. Ионы Nа и К принимают участие в биокатализе, образуя смешанные комплексы типа фермент–катион–субстрат. Калий образует комплексы с ферментами и субстратами, что играет важную роль в транспорте ионов. Как уже отмечалось, антибиотик валиномицин избирательно взаимодействует с ионом К , образуя прочный комплекс (с ионами натрия в очень незначительной степени). В связи с этим, валиномицин можно рассматривать как биологическую модель переносчика ионов К через плазматические мембраны в клетку.
С пищей обычно потребляется 2-3 г калия в сутки. При калиевом истощении применяют КСl.
Магний. В организме человека содержится около 20 г (0,027%) магния. В наибольшей степени магний концентрируется в дентине и эмали зубов, костной ткани, поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце. Концентрация ионов Мg2 внутри клеток в 2,5-3 раза выше, чем во внеклеточных жидкостях.
Имея меньший радиус иона и, соответственно, больший ионный потенциал, ион Мg2 образует более прочные связи с биолигандами, чем ион Са2 , поэтому является более активным катализатором ферментативных процессов. Ион Мg2 входит в состав различных ферментативных систем, являясь активатором и незаменимым компонентом (в карбоксипептидазу, холинэстеразу и др.) Только избыток ионов Мg2 может обеспечить гидролиз АТФ, сопряженный с рядом ферментативных реакций, образует гидрофостфат-ион HPO42- с выделением большого количества энергии.
Кальций. Общее содержание кальция в организме 1,4%. Основная масса кальция находится в костной и зубной тканях.
Ионы Са2 принимают участие в передаче нервных импульсов, сокращении мышц и регулировании работы сердечной мышцы. Кальций практически не используется внутри клетки, он выступает в качестве строительного материала в организме. В костях и зубах он находится в виде нерастворимого гидроксоапатита – Са5(РО4)3(ОН). Минеральную основу зубных тканей (дентина) составляют также фтор-апатит Са5(РО4)3F и хлорапатит Са5(РО4)3Cl.
Стронций. Общее содержание стронция в организме человека 10-3%. Находится он главным образом в костной ткани, частично замещая кальций. Играет важную роль в процессах остеогенеза.
Барий. По содержанию в организме человека (10-5%) относится к примесным элементам. Он накапливается преимущественно в сетчатке глаза. Барий является токсичным для организма. Он оказывает нейротоксическое, кардиотоксическое и гемотоксическое действие. Механизм токсического действия ионов бария заключается в том, что они, имея одинаковый радиус с ионами калия, конкурируют с ними в биохимических процессах и замещают их, что приводит к гипокалиемии.
§
В медицине и фармации
Litii с arbonas (лития карбонат) Li2CO3. Соли лития предложены давно для лечения подагры и растворения почечных камней. Установлено, что препараты лития обладают способностью купировать острое маниакальное возбуждение у психически больных. Дозы Li2CO3 устанавливаются индивидуально, постоянно проводя лабораторные исследования содержания лития в сыворотке крови. Во время лечения карбонатом лития возможно временное увеличение массы тела и формирование зоба, возможны нарушения функции почек, увеличение концентрации лития в крови. Выпускают Li2CO3 в форме таблеток, покрытых оболочкой по 0,3 г.
Natrii chloridum (натрия хлорид) NaCl. Натрия хлорид содержится в крови и в тканях, жидкостях организма. В крови массовая доля NaCl равна 0,5%, его содержанием обеспечивается постоянство осмотического давления крови. Изотонический (физиологический) раствор для инъекций – Solutio Natrii сhloridum isotonica pro injectionibus – водный раствор натрия хлорида 0,9%. Его вводят под кожу, внутривенно при больших потерях жидкостей и при интоксикациях. Условное название «физиологический» – он получил в связи с тем, что его раствор изотоничен плазме крови человека. Его применяют для растворения различных лекарственных препаратов и для капельных вливаний. Гипертонические растворы натрия хлорида (3-5-10%) – применяют наружно в виде компрессов и примочек при лечении гнойных ран. Введение этих растворов под кожу не допускается, т.к. вызывает некроз тканей.
Kalii chloridum (калия хлорид) KCl. Применяется как источник ионов калия при гипокалиемии и как антиаритмическое средство, оказывает умеренное диуретическое действие. Внутрь назначают по 1 г, или внутривенно 4% растворы.
Magnesii oxydum (магния окись) MgO. Применяется как антацидное средство, нейтрализует соляную кислоту желудочного сока:
MgO 2HC1 ® MgCl2 H2O
В отличие от NaHCO3 антацидное действие MgO не сопровождается вторичной гиперсекрецией. Образующийся MgCl2, переходя в кишечник, оказывает послабляющий эффект. Магния окись (MgO) входит в состав комбинированного препарата альмагель.
Magnesii sulfas (магния сульфат) MgSO4∙7Н2О. Магния сульфат при парентеральном применении оказывает успокаивающее действие на центральную нервную систему. В зависимости от дозы наблюдаются различные эффекты лечебного действия, такие как седативный, снотворный или наркотический. Магния сульфат как наркотическое средство не применяется, так как при малейшей передозировке легко вызывают паралич дыхательного центра. Он оказывает также желчегонное действие, что связано с рефлекторным раздражением нервных окончаний слизистой оболочки двенадцатиперстной кишки. Таким образом сульфат магния применяют в качестве противосудорожного, спазмолитического и слабительного средства.
Magnesii peroxydum (магния перекись) – смесь MgO (85%) и MgO2 (15%). Применяют при диспепсии, брожении в кишечнике, поносах. Лечебный эффект частично связан с действием MgO и частично – с образованием Н2О2 в желудке:
MgO2 2HCl ® MgCl2 H2O2
Magnesii subcarbonas (магния карбонат основной) Mg(OH)2∙4MgCO3∙H2O. Применяют наружно как присыпку, внутрь – при повышенной кислотности желудочного сока и как лёгкое слабительное. Входит в состав таблеток «Викалин» и «Викаир».
Calcii chloridum (кальция хлорид) СаС12∙6H2O. Применяют при различных патологических состояниях: при недостаточной функции паращитовидных желез, при усиленном выделении кальция из организма, при аллергических заболеваниях, как средство, уменьшающее проницаемость сосудов, при кожных заболеваниях (зуде, экземе, псориазе и др.), при токсических поражениях печени, как кровоостанавливающее средство, как противоядие при отравлении солями магния, щавелевой кислотой и солями фтороводородной кислоты.
Растворы кальция хлорида вводят внутривенно, так как они обладают сильным раздражающим действием и вызывают некроз тканей.
Calcii sulfas ustus (кальция сульфат жженый, гипс) CaSO4∙2H2O. Применяют в травматологии для наложения гипсовых повязок и стоматологической практике.
Barii sulfas pro roentgeno (бария сульфат для рентгеноскопии) BaSO4. Применяют внутрь в виде водной суспензии как контрастное средство при рентгенологическом исследовании пищевода, желудка и кишечника.
Некоторые соединения s-элементов I и II групп применяются в качестве реактивов при анализе лекарственных веществ в фармацевтическом анализе, а также при анализе лекарственного растительного сырья. Например: NaOH, KOH, Ca(OH)2 и др.
3. Токсическое действие соединений s-элементов на живой организм
Биогенные элементы в избытке могут оказывать токсическое действие, так как при этом нарушается химический гомеостаз. Например, избыток калия угнетающе действует на сердечную деятельность, поэтому прием препаратов калия строго дозируется. При повышенном содержании натрия в организме происходит нарушение функций нервной, сердечно-сосудистой и других систем, гладких и скелетных мышц.
Один из s-элементов бериллий не относится к биогенным элементам, но обладает высокой токсичностью.
Ионы бериллия подавляют активность многих ферментов, активируемых ионами Мg2 в результате замещения ионов Мg2 в его комплексах с ферментами. Это объясняется тем, что ион Ве2 , попадая в организм, образует более прочные комплексы чем ион Мg2 с кислородсодержащими и другими лигандами, которые присутствуют в живых организмах, оказывая тем самым токсическое действие. Высокопрочные комплексы бериллия с фосфат-ионами хорошо растворимы по сравнению с менее прочными комплексами магния. Поэтому, магний и бериллий являются антагонистами:
В результате попадания бериллия в организм возникает заболевание – «бериллиевый рахит».
Кальций близок по физико-химическим характеристикам к стронцию и барию, поэтому ионы Sr2 и Ba2 являются синергистами иона Са2 . При избытке ионов Sr2 возникает эндемическая уровская болезнь, которая была обнаружена у населения, проживающего у реки Уровы в Восточной Сибири. Анализ почвы этого района показал повышенное содержание в ней стронция. В костной ткани произошло вытеснение ионов Са2 ионами Sr2 , который не способен выполнять функции Са2 .
Избыток стронция вызывает размягчение и искривление костей, а также их ломкость – стронциевый рахит. Кроме того, избыток стронция вытесняет цинк из соединений с белками.
Соединения бария очень токсичны. Механизм токсического действия этих солей заключается в том, что ионы Ва2 , имея одинаковый радиус с ионом К , конкурируют с ним в биохимических процессах. В результате такой замены возникает гипокалиемия. Ионы Ba2 могут проникать и в костные ткани, замещая в ней ионы Са2 , вызывая эндемические заболевания. Такое замещение имеет место вследствие того, что растворимость фосфатов щелочно-земельных металлов уменьшается в ряду Са – Sr – Ва и равновесие смещается вправо:
3SrX2(p-р) Ca3(PO4)2(т) Û Sr3(PO4)2(т) 3CaX2(p-р)
где X = Cl—, HCO3— и др.
Образование очень прочного и малорастворимого фосфата бария – Ва3(РО4)2 в костной ткани, нервных клетках и мозговом веществе обусловливает токсичность иона Ва2 .

