- Краткое описание химических свойств и плотность кислорода
- В лаборатории
- В промышленности
- Геохимия водорода
- Изотопы
- Кислород плотность — справочник химика 21
- Меры предосторожности
- Относительная плотность газа
- Очистка
- Плотность — кислород
- Плотность газов при нормальных условиях – таблица
- Плотность кислорода жидкого — справочник химика 21
- Плотность кислорода и другие его физические свойства
- Свойства изотопов
- Таблица плотности веществ
- Таблица плотности газов
- Физика. таблица плотностей
- Химические свойства
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.
O2 2H2 = 2H2O (550oС, сгорание H2в O2);
O2 F2 = O2F2 (-183oС, электрический разряд);
O2 N2↔2NO (электрический разряд);
O2 S = SO2 (сгорание на воздухе);
5O2 4P = P4O10 (сгорание на воздухе);
O2 C = CO2 (600-700oС, сжигание на воздухе);
O2 2Na = Na2O2 (сжигание на воздухе);
O2 2Mg = 2MgO (сгорание на воздухе);
3O2 4Al = 2Al2O3 (сгорание на воздухе).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
В лаборатории
- Zn H2SO4 → ZnSO4 H2↑
- Ca 2H2O → Ca(OH)2 H2↑
- NaH H2O → NaOH H2↑
- 2Al 2NaOH 6H2O → 2Na[Al(OH)4] 3H2↑
- Zn 2KOH 2H2O → K2[Zn(OH)4] H2↑
- 2H3O 2e− → 2H2O H2↑
В промышленности
На 2022 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа. Почти все остальное получают из угля.
- CH4 H2O ⇄ CO 3H2
- H2O C ⇄ CO↑ H2↑
- 2NaCl 2H2O → 2NaOH Cl2↑ H2↑
- 2H2O →4e− 2H2↑ O2↑
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной.
- 2CH4 O2 ⇄ 2CO 4H2
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3−22 гигатонн/год).
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду.
Изотопы
Основная статья: Изотопы водорода
Наиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2H (ядро состоит из одного протона и одного нейтрона) и тритий 3H (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3.
Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с.
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Кислород плотность — справочник химика 21
Установите молекулярную формулу вещества, содержащего 81,6% хлора и 18,4 % кислорода. Плотность этого вещества по водороду 43,5.
[c.142]
Соединение содержит 39,14% углерода, 8,7% водорода, 52,16% кислорода. Плотность паров по водороду равна 46. Определить истинную формулу соединения. [c.16]
Пример. Анализ уксусной кислоты показывает, что в ней на 2,1 весовой части углерода приходится 0,35 весовой части водорода и 2,8 весовой части кислорода. Плотность пара уксусной кислоты по водороду равна [c.46]
Один из оксидов хлора содержит 47,4% кислорода. Плотность по водороду этого оксида в газообразном состоянии равна 33,75. Установите формулу оксида.
[c.219]
Содержание кислорода, % Плотность при 20 °С, г/см з [c.540]
Электрофлотационный способ является одним из наиболее эффективных при очистке воды нефтепродуктов, тонкодисперсных частиц, растворенных органических соединений. Наиболее высокая степень очистки сточных вод достигается в электрофлотационных аппаратах, имеющих наряду с флотационной камерой и камеру электрокоагуляции.
В этом случае сточные воды предварительно подвергаются воздействию как электрического поля, так и образующихся при электрокоагуляции оксидов металлов — продуктов растворения анодных электродных пластин. В качестве таких пластин используют сталь Ст.З.
В камере электрокоагуляции в результате адсорбции загрязнений на хлопьях гидрооксида железа образуются агрегаты, которые включают также пузырьки выделяющихся при электролизе водорода и кислорода. Плотность этих агрегатов меньше, чем плотность воды. Однако скорость их флотационного отделения от воды невелика.
Для интенсификации отделения этих агрегатов от воды и доочистки осветленной жидкости используют электрофлотацию с применением нерастворимого анода. Как показали экспериментальные исследования, продолжительность электрокоагуляции и флотации сточных вод должна быть одинаковой.
Кислород малорастворим в воде (5 объемов в 100 объемах воды), ко все же лучше, чем другие газы атмосферы, поэтому вода обогащается кислородом. Плотность кислорода при нормальных условиях р = 1,429 г/л. При —183 °С кислород конденсируется в бледно-голубую жидкость (р = 1,13 г/см ), а при —218,7 С образует синие кристаллы. [c.111]
Кислород — наиболее распространенный элемент земной коры. Он составляет 89% массы воды, 23% массы воздуха (21% по объему) и почти 50% массы обычных минералов (силикатов). В элементном состоянии кислород состоит из двухатомных молекул, строение которых описано ниже.
Зто бесцветный газ, не имеющий запаха и слабо растворимый в воде 1 л еоды при 0°С и 1 атм растворяет 48,9 мл газообразного кислорода. Плотность кислорода при 0°С и 1 атм равна 1,429 Г-Л-. Кислород конденсируется в бледно-голубую жидкость при температуре кипения —183,0 °С и при дальнейшем охлаждении отвердевает при —218,4 °С, образуя бледно-голубое кристаллическое вещество. [c.178]
Имеется смесь метана и кислорода плотностью [c.10]
В эвдиометре сожгли 20 мл газовой смеси, состоящей из азота, водорода и кислорода. Плотность смеси по водороду равна 14,0. После конденсации воды и приведения газовой смеси к начальным условиям объем ее был равен 17 мл. К образовавшейся смеси прибавили 50 мл воздуха и снова сожгли. Объем смеси не изменился. Определить процентный состав взятой газовой смеси. [c.11]
Определить формулу соединения, содержащего 39,14% углерода, 8,7% водорода и 52,16% кислорода. Плотность пара этого вещества по водороду равна 46. [c.64]
Задача 5. Анализ показал, что соединение состоит из 30,43% азота и69,57% кислорода. Плотность этого вещества по водороду равна 46. Определить его молекулярный вес и формулу. [c.56]
В обоих случаях защищаемая конструкция подвергается катодной поляризации, которая смещает ее потенциал к отрицательным значениям, а pH электролита, контактирующего непосредственно с металлом, сдвигается в щелочную область. Благодаря высокому pH на поверхности металла осаждаются гидроокись магния, карбонаты кальция и магния, образуя пленку подобно накипи.
Вывести истинную формулу кислоты, в составе которой на 2,1 в. ч. углерода приходится 0,35 в. ч. водорода и 2,8 в. ч. кислорода. Плотность пара кислоты по водороду Вп = 30. [c.35]
Составьте уравнение реакции получения кислорода из перманганата калия (КМпО ) и вычислите массу перманганата калия, необходимого для получения 10 л (при н.у.) кислорода (плотность кислорода 1,43 г/л). [c.36]
Для цинкования берут железный гвоздь или стальную пластинку. Работу проводят, как и в предыдуш,ем опыте. На катоде выделяется цинк и водород, на аноде — кислород. Плотность тока около [c.254]
Пример 3. Вывести молекулярную формулу вещества, содержащего 40,00% углерода, 6,70% водорода и 53,30%о кислорода. Плотность пара по водороду равна 30. [c.6]
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильней катион, тем сильнее основание. Стабильность катиона определяется суммой тех же факторов, что и стабильность аниона, с той лишь разницей, что влияние этих факторов на основность противоположно тому влиянию, которое они оказывали на кислотность.
Например, наличие в углеводородном радикале электронодонорных заместителей будет способствовать стабилизации катиона и, следовательно, повышать силу основания. Напротив, электроноакцетхзрные заместители будут дестабилизировать катион и уменьшать основность соединения.
Исходя из природы атомов кислорода, азота и серы, можно сделать вывод, что наиболее электроотрицательный атом кислорода за счет более прочного удерживания неподеленной пары электронов менее склонен присоединять протон по сравнению, например, с атомом азота.
Действительно, амины обычно более сильные основания, чем спирты. Электроны атомов азота и серы менее прочно удерживаются ядром и более доступны для связи с протоном. Однако у атома серы электронная плотность рассредоточена в большем объеме по сравнению с атомом азота и кислорода.
www.chem21.info
Меры предосторожности
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки.
Относительная плотность газа
Обозначим относительную плотность газа m1 / m2 буквой D. Тогда
D = M1 / M2,
откуда
M1 = D×M2.
Следовательно, молярная масса газа равна его плотности по отношению у другому газа, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид:
M = 2,0158 ×D
или, если округлить молярную массу водорода до 2:
M = 2 ×D.
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше равна 22, находим:
M(CO2) = 2 × 22 = 44 г/моль.
Плотность газа в лабораторных условиях самостоятельно можно определить следующим образом: необходимо взять стеклянную колбу с краном и взвесить её на аналитических весах. Первоначальный вес – вес колбы, из которой откачали весь воздух, конечный – вес колбы, наполненной до конкретного давления исследуемым газом. Разность полученных масс следует разделить на объем колбы. Вычисленное значение и есть плотность газа в данных условиях.
Чтобы рассчитать плотность газа при н.у. нужно воспользоваться уравнением состояния идеального газа:
p2 = pN;
V2 = VN;
T2 = TN.
p1/pN×V1/m×m/VN = T1/TN;
т.к. m/V1 = r1 и m/VN = rN, получаем, что
rN = r1×pN/p1×T1/TN.
В таблице ниже приведены значения плотностей некоторых газов.
Таблица 1. Плотность газов при нормальных условиях.
Газ | Плотность, кг/м3 | Dair | DH2 |
Воздух | 1,293 | 1 | 14,5 |
Водород | 0,0899 | 0,00695 | 1 |
Азот | 1,25 | 0,967 | 14 |
Кислород | 1,43 | 1,11 | 16 |
Диоксид углерода | 1,997 | 1,53 | 22 |
Гелий | 0,179 | 0,139 | 2 |
Очистка
В промышленности реализованы несколько способов очистки водорода из углерод-содержащего сырья (т. н. водородсодержащий газ — ВСГ).
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: Настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80-85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 H2/сут. Образуется водород высокой чистоты 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95-96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Плотность — кислород
Cтраница 2
Какой объем озона следует добавить к 1 л воздуха, чтобы получить газовую смесь, плотность которой равна плотности кислорода при той же температуре.
[16]
Для отделения азота от кислорода нельзя воспользоваться различием в плотностях обоих газов, потому что они очень близки: плотность кислорода в 16, азота в 14 раз более плотности водорода, а потому здесь нельзя употребить пористых сосудов; разность во времени просачивания для обоих газов будет ничтожною.
[17]
К — температура газа, / 71 6 — 105 н / м2 — давление газа, ро1 43 кг / м3 — плотность кислорода при нормальных условиях, ро 1 013 — 105 н / м2 — нормальное атмосферное давление, i 32 кг / кмоль — масса киломоля кислорода, R 8314 дж / кмоль-град — универсальная газовая постоянная.
[18]
Статья Рэлея, написанная в марте 1893 г. [18], свидетельствует о новом подходе к исследованию плотности газа, а именно вместо измерений отношения плотностей кислорода и водорода на первый план выступило измерение отношения плотностей кислорода и азота.
[19]
Далее, Беккером, применившим для исследования эмиссионный микроскоп-проектор [18], было опубликовано доказательство существования на поверхности вольфрама адсорбционных центров двух видов, различающихся по плотности кислорода. Эти два вида центров характеризуются различными энергиями связи, причем одна из них соответствует теплоте адсорбции 4 эв, а вторая — 2 эв.
Подобное доказательство можно вывести из данных по адсорбции азота, полученных Гринхальфом и сотрудниками [19], которые показали, что на некоторых металлах наблюдается необратимый и обратимый тип хемосорб-ции, особенности которой зависят от рода металла и адсорбата.
Дано: У 200 0 м8 — объем газа, Г300 К — температура газа, р1 6 105 Па — давление газа, р01 43 кг / м3 — плотность кислорода при нормальных условиях, р0 1 013 — 105 Па — нормальное атмосферное давление, М 32 — 10 3 кг / моль — молярная масса кислорода, R 8 314 Дж / ( моль — К) — газовая постоянная.
[21]
Дано: У200 0м3 — объем газа, Г300 К — температура газа, р1, 6 — 105 Па — давление газа, р 1 43 кг / м3 — плотность кислорода при нормальных условиях, р0 1 013 — 105 Па — нормальное атмосферное давление, р32 — 10 3 кг / моль — молярная масса кислорода, 8 314 Дж / ( моль — К) — молярная газовая постоянная.
[22]
Дано: V200 0 м3 — объем газа, Г300 К — температура газа, р1 6 — 105 Па — давление газа, р 1 43 кг / м3 — плотность кислорода при нормальных условиях, рв1 013 — 105 Па — нормальное атмосферное давление, ц32 — 10 — 3 кг / моль — молярная масса кислорода, Я8 314 Дж / ( моль — К) — молярная газовая постоянная.
[23]
Статья Рэлея, написанная в марте 1893 г. [18], свидетельствует о новом подходе к исследованию плотности газа, а именно вместо измерений отношения плотностей кислорода и водорода на первый план выступило измерение отношения плотностей кислорода и азота.
[24]
Дано: V-50 л5 0 — 10-а м — 8 — объем выделенного кислорода, Т300 К — температура кислорода, р0Ю1 3 кПа — нормальное атмосферное давление, р01 43 кг / м3 — плотность кислорода при нормальных условиях, 8 29 — 10 — 8 кг / Кл — электрохимический эквивалент кислорода.
[25]
Дано: V5 л5 — 10 — 3 м — 3 — объем выделенного кислорода, Т300 К — температура кислорода, ра 101 3 кПа — нормальное атмосферное давление, р01 43 кг / м3 — плотность кислорода при нормальных условиях, / г — 8 29 X X 10 — 8 кг / Кл — электрохимический эквивалент кислорода.
[26]
Дано: V 5 0 л — 5 0 — 10 — 3 м — объем выделенного кислорода, / 27 С; Т 300 К — температура кислорода, ро 760 мм рт. ст. — нормальное атмосферное давление, ро 1 43 кг / л3 — плотность кислорода при нормальных условиях, Дг 8 29 — 10 — кг / к — электрохимический эквивалент кислорода.
[27]
При температуре 20 С в одном литре воды растворяется 28 см3 кислорода. Какова плотность кислорода в воде, свободная поверхность которой граничит с атмосферным воздухом, при нормальном давлении. Принять, что масса кислорода составляет 23 % массы воздуха.
[28]
Кислород ( как и любой из газов) в зависимости от условий может находиться в газообразном, жидком или твердом состоянии. В каком из состояний плотность кислорода наибольшая; наименьшая.
[29]
Одновременно он указал на возможность использования ее для установления атомного состава сложных газообразных веществ и дал новый метод определения атомных и молекулярных весов: Исходя из этой гипотезы, видно, что мы имеем средство легко определять относительные массы молекул для тех веществ, которые можно перевести в газообразное состояние, а также относительное число молекул в соединениях, потому что отношения молекулярных масс те же самые, что и отношения плотностей различных газов, при одинаковой температуре и давлении, а относительное число молекул в соединении дано непосредственно отношением объемов тех газов, которые образуют данное соединение.
Например, числа 1 10359 и 0 07321 выражают плотности кислорода и водорода, если принять плотность воздуха равной единице; отношение же этих двух чисел показывает, следовательно, отношение между массами двух равных объемов данных газов; это же самое отношение выразит, согласно Предложенной гипотезе, отношение масс их молекул.
Так, масса молекулы кислорода будет приблизительно в 15 раз больше массы молекулы водорода [ 20, стр. С другой стороны, так как мы знаем, что отношение объемов водорода и кислорода при образовании воды равняется 2: 1, то отсюда следует, что вода образуется путем соединения одной молекулы кислорода с двумя молекулами водорода.
Таким же образом — согласно объемным отношениям, установленным Гей-Люссаком для элементов, составляющих аммиак, окись азота, селитряный газ и азотную кислоту — аммиак должен образовываться путем соединения одной молекулы азота с тремя молекулами водорода, закись азота — из одной молекулы кислорода и двух молекул азота, селитряный газ — из одной молекулы азота и одной молекулы кислорода…
[30]
Страницы:
1
2
3
Плотность газов при нормальных условиях – таблица
| Газ (газовая фаза) | Хим. формула | Плотность | ||
| г/см3 | г/л | кг/м3 | ||
| Азот | N2 | 1.251⋅10−3 | 1.251 | 1.251 |
| Аммиак | NH3 | 7,723⋅10−4 | 0,7723 | 0,7723 |
| Аргон | Ar | 1,784⋅10−3 | 1,784 | 1,784 |
| Арсин (мышьяковистый водород) | H3As | 3,48⋅10−3 | 3,48 | 3,48 |
| Ацетилен | C2H2 | 1,16⋅10−3 | 1,16 | 1,16 |
| Бромоводород (бромистый водород) | HBr | 3.664⋅10−3 | 3.664 | 3.664 |
| Бутан | C4H10 | 2,7⋅10−3 | 2,7 | 2,703 |
| Водород | H2 | 8,987⋅10−5 | 0.08987 | 0.08987 |
| Гелий | He | 1,785⋅10−4 | 0,1785 | 0,1785 |
| Герман (германия тетрагидрид) | GeH4 | 3,42⋅10−3 | 3,42 | 3,420 |
| Диметиламин | (CH3)2NH | 2,0125⋅10−3 | 2,0125 | 2,0125 |
| Диметиловый эфир (метиловый эфир, метоксиметан, древесный эфир) | C2H6O | 2,1098⋅10−3 | 2,1098 | 2,1098 |
| Диоксид углерода (двуокись углерода, углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) | CO2 | 1,9768⋅10−3 | 1,9768 | 1,9768 |
| Диоксид хлора (двуокись хлора) | ClO2 | 3,01⋅10−3 | 3,01 | 3,01 |
| Дифтордихлорметан (дихлордифторметан, Фреон R 12, Фреон-12, Хладон-12, CFC-12, R-12) | CF2Cl2 | 5,51⋅10−3 | 5,51 | 5,510 |
| Закись азота (оксид диазота, оксид азота(I), веселящий газ) | N2O | 1,978⋅10−3 | 1,978 | 1,978 |
| Изобутан | C4H10 | 2,673⋅10−3 | 2,673 | 2,673 |
| Иодоводород (водород иодистый) | HI | 5,789⋅10−3 | 5,789 | 5,789 |
| Кислород | O2 | 1,429⋅10−3 | 1,429 | 1,429 |
| Кремния гексагидрид | Si2H6 | 2,85⋅10−3 | 2,85 | 2,85 |
| Криптон | Kr | 3,74⋅10−3 | 3,74 | 3,74 |
| Ксенон | Xe | 5,89⋅10−3 | 5,89 | 5,89 |
| Метан | CH4 | 7,168⋅10−4 | 0,7168 | 0,7168 |
| Метиламин | CH5N | 1,388⋅10−3 | 1,388 | 1,388 |
| Метилфторид | CH3F | 1,545⋅10−3 | 1,545 | 1,545 |
| Монооксид углерода (угарный газ, окись углерода, оксид углерода(II)) | CO | 1,25⋅10−3 | 1,25 | 1,25 |
| Моносилан (тетрагидрид кремния) | SiH4 | 1,44⋅10−3 | 1,44 | 1,44 |
| Неон | Ne | 0,9⋅10−3 | 0,9 | 0,900 |
| Озон | O3 | 2,14⋅10−3 | 2,14 | 2,14 |
| Оксид азота(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) | NO | 1,3402⋅10−3 | 1,3402 | 1,3402 |
| Оксид серы(IV) (диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид) | SO2 | 2,9263⋅10−3 | 2,9263 | 2,9263 |
| Оксид хлора(I) (окись хлора) | Cl2O | 3,88⋅10−3 | 3,88 | 3,88 |
| Оксифторид фосфора | POF3 | 4,8⋅10−3 | 4,8 | 4,8 |
| Пропан | C3H8 | 2,0037⋅10−3 | 2,0037 | 2,0037 |
| Пропилен | C3H6 | 1,915⋅10−3 | 1,915 | 1,915 |
| Радон | Rn | 9,81⋅10−3 | 9,81 | 9,81 |
| Селеноводород | H2Se | 3,6643⋅10−3 | 3,6643 | 3,6643 |
| Сероводород (сернистый водород) | H2S | 1,5206⋅10−3 | 1,5206 | 1,5206 |
| Сероокись углерода (карбонилсульфид) | COS | 2,72⋅10−3 | 2,72 | 2,72 |
| Стибин (сурьмянистый водород) | H3Sb | 5,48⋅10−3 | 5,48 | 5,48 |
| Теллуроводород (теллуран) | H2Te | 5,81⋅10−3 | 5,81 | 5,81 |
| Тетрафторид кремния | SiF4 | 4,96⋅10−3 | 4,96 | 4,96 |
| Триметиламин | C3H9N | 2,64⋅10−3 | 2,64 | 2,64 |
| Триметилбор | C3H9B | 2,52⋅10−3 | 2,52 | 2,52 |
| Трифторид мышьяка (мышьяк фтористый) | AsF5 | 7,71⋅10−3 | 7,71 | 7,71 |
| Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора) | PH3 | 1,53⋅10−3 | 1,53 | 1,53 |
| Фтор | F2 | 1,695⋅10−3 | 1,695 | 1,695 |
| Фторид бора (III), (трифторид бора, бор трехфтористый) | BF3 | 3,028⋅10−3 | 3,028 | 3,028 |
| Фторид нитрила (фторокись азота) | (NO2)F | 2,9⋅10−3 | 2,90 | 2,90 |
| Фторид нитрозила (нитрозил фтористый) | (NO)F | 2,1875⋅10−3 | 2,1875 | 2,1875 |
| Фторид серы(VI) (Гексафторид серы, элегаз, шестифтористая сера) | SF6 | 6,56⋅10−3 | 6,56 | 6,56 |
| Фторид фосфора(III) | PF3 | 3,91⋅10−3 | 3,91 | 3,91 |
| Фторид фосфора(V) (пентафторид фосфора) | PF5 | 5,81⋅10−3 | 5,81 | 5,81 |
| Хлор | Cl2 | 3,22⋅10−3 | 3,22 | 3,22 |
| Хлорид нитрозила (нитрозилхлорид, хлористый нитрозил, оксид-хлорид азота) | NOCl | 2,992⋅10−3 | 2,992 | 2,992 |
| Хлорметан (метилхлорид) | CH3Cl | 2,307⋅10−3 | 2,307 | 2,307 |
| Хлороводород (хлористый водород) | HCl | 1,6391⋅10−3 | 1,6391 | 1,6391 |
| Хлорокись азота | NO2Cl | 2,57⋅10−3 | 2,57 | 2,57 |
| Циан (дициан) | C2N2 | 2,38⋅10−4 | 0,238 | 0,238 |
| Этан | C2H6 | 1,356⋅10−3 | 1,356 | 1,356 |
| Этилен | C2H4 | 1,26⋅10−3 | 1,26 | 1,2605 |
В различных источниках информация может немного различаться.
Нормальные условия (н. у.) — физические условия, определяемые давление p=0,1013 МПа = 760 мм рт. ст. (нормальная атмосфера) и температурой 273,15 К (0 °С).
Плотность кислорода жидкого — справочник химика 21
Кислород жидкий — прозрачная легкоподвижная жидкость голубоватого цвета, быстро испаряющаяся при обычных т-рах. Кипит при —183° С имеет плотность 1,13.
[c.274]
Плотность жидкого кислорода при—183°С 1,14 г/см . Во сколько раз увеличится объем кислорода при переходе его из жидкого в газообразное состояние при нормальных условиях [c.28]
Метод пьезометра постоянного объема был использован при исследовании плотности жидкого кислорода при низких температурах [17]. Количество вещества, выпускаемого из пьезометра, измерялось в специальном термостатированном устройстве (газометре) следующим образом.
Предварительно точно устанавливался объем газометра. Измерялось давление кислорода, заполнившего газометр. После установления равновесия массу вещества в газометре определяли по известной плотности кислорода при низком давлении и температуре термостата.
[c.438]
Озон — один из наиболее сильных окислителей. Он является аллотропическим видоизменением кислорода. Молекула его содержит три атома кислорода. Жидкий озон имеет темно-синий цвет, кипит при температуре —112 и замерзает при температуре —251° С, плотность его равна 1,46. [c.125]
Для выявления условий накопления опасных примесей В воздухоразделительных аппаратах немаловажную роль играют данные по их плотности в жидком кислороде. [c.95]
Так, плотность кислорода в жидком состоянии при температуре кипения равна 1,14, а жидкого фтора — 1,51. Этим отчасти и объясняется большая эффективность фтора как окислителя по сравнению с кислородом.
[c.225]
Помимо удельной тяги, на скорость и дальность полета ракеты в значительной степени влияет плотность топлива, определяющаяся плотностью его компонентов. Плотность фтора в жидком состоянии при температуре кипения 1,51, а соответствующая плотность кислорода 1,14. Этим отчасти объясняется большая эффективность фтора как окислителя по сравнению с кислородом. [c.36]
Эти свойства кислорода требуют применения специальных материалов для изготовления сосудов, трубопроводов, арматуры и деталей, соприкасающихся с кислородом. Кроме того, при работе с жидким и газообразным кислородом в помещениях, в которых производится, хранится и газифицируется кислород, а также там, где проходят кислородопроводы, требуется соблюдать специальные меры предосторожности.
Следует иметь в виду во всех случаях, что плотность кислорода больше, чем воздуха (плотность кислорода по отношению к воздуху составляет 1,1). При утечках кислород вытесняет воздух и смешивается с ним, создавая опасность взрыва, особенно в нижней части помещений, в траншеях и углублениях, где может оставаться долгое время. [c.369]
На рис. 14 представлены кривые распределения средней плотности пропитанного жидким кислородом [c.33]
Кремнийорганическими соединениями называют большую группу веществ, представляющих собой соединения кремния с водородом или кислородом и различными органическими радикалами. Кремнийорганические соединения являются продуктами различной плотности —от жидких до твердых.
Этот же метод позволяет проверить, в какой степени различные исследуемые парафиновые углеводороды — метан, этан, пропан и бутан — смешиваются между собой в пределах изучаемой температуры. Из соображений удобства опыты проводились при температуре кипения сжиженного кислорода (—183° С) и сжиженного метана (—161° С).
Чистота всех изучаемых газов находилась в пределах 99—99,9%. Полученные значения плотности наносились на график (рис. 10), где одновременно представлены взятые из литературы плотности в жидком состоянии чистых метана, этана, пропана и бутана при различных температурах. Плотность чистого бутана, [c.44]
Плотность растворов кислорода во фторе найдена при допущении, что растворы являются идеальными. При этом плотность жидкого фтора принята согласно работе Джерри и Миллера [47], а плотность кислорода взята из справочника Варгафтика [14]. [c.20]
На рис. V. 9 показан общий вид контактного трехзажимного (трехэлектродного) коаксиального преобразователя для опреде-j ления диэлектрической проницаемости криогенных жидкостей и газов в широком диапазоне температур и давлений [137] на осно- вании отношения измеренной емкости преобразователя с веществом к емкости с вакуумом (и
www.chem21.info
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oC растворяют 4,9, а при 20oC – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже:
Таблица 1. Физические свойства и плотность кислорода.
Плотность, кг/м3 | 1,42987 – газ 1141 – жидкость |
Температура плавления, oС | -218,35 |
Температура кипения, oС | -182,96 |
Энергия ионизации атома, эВ | 9,32 |
Относительная электроотрицательность | 1,51 |
Радиус атома, нм | 112 |
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500oC она становится заметной.
Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
Свойства изотопов
Свойства изотопов водорода представлены в таблице.
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2 | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1 | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2 | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1⋅10−22 с | (1⁄2 ) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10−23 с | 1⁄2 | -nn | 23,03(101) МэВ | |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Таблица плотности веществ
Плотность — физическая величина, которая равна отношению массы тела к его объему:
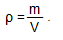 Плотности некоторых твердых тел
Плотности некоторых твердых тел
(при норм. атм. давл., t = 20ºC)
| Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 | Твердое тело | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Осмий | 22 600 | 22,6 | Мрамор | 2700 | 2,7 |
| Иридий | 22 400 | 22,4 | Стекло оконное | 2 500 | 2,5 |
| Платина | 21 500 | 21,5 | Фарфор | 2 300 | 2,3 |
| Золото | 19 300 | 19,3 | Бетон | 2 300 | 2,3 |
| Свинец | 11 300 | 11,3 | Кирпич | 1 800 | 1,8 |
| Серебро | 10 500 | 10,5 | Сахар-рафинад | 1 600 | 1,6 |
| Медь | 8 900 | 8,9 | Оргстекло | 1 200 | 1,2 |
| Латунь | 8 500 | 8,5 | Капрон | 1 100 | 1,1 |
| Сталь, железо | 7 800 | 7,8 | Полиэтилен | 920 | 0,92 |
| Олово | 7 300 | 7,3 | Парафин | 900 | 0,90 |
| Цинк | 7 100 | 7,1 | Лёд | 900 | 0,90 |
| Чугун | 7 000 | 7,0 | Дуб (сухой) | 700 | 0,70 |
| Корунд | 4 000 | 4,0 | Сосна (сухая) | 400 | 0,40 |
| Алюминий | 2 700 | 2,7 | Пробка | 240 | 0,24 |
Плотности некоторых жидкостей
(при норм. атм. давл., t = 20ºC)
| Жидкость | ρ, кг / м 3 | ρ, г / cм 3 | Жидкость | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Ртуть | 13 600 | 13,60 | Керосин | 800 | 0,80 |
| Серная кислота | 1 800 | 1,80 | Спирт | 800 | 0,80 |
| Мёд | 1 350 | 1,35 | Нефть | 800 | 0,80 |
| Вода морская | 1 030 | 1,03 | Ацетон | 790 | 0,79 |
| Молоко цельное | 1 030 | 1,03 | Эфир | 710 | 0,71 |
| Вода чистая | 1000 | 1,00 | Бензин | 710 | 0,71 |
| Масло подсолнечное | 930 | 0,93 | Жидкое олово(при t = 400ºC) | 6 800 | 6,80 |
| Масло машинное | 900 | 0,90 | Жидкий воздух(при t = -194ºC) | 860 | 0,86 |
Плотности некоторых газов
(при норм. атм. давл., t = 20ºC)
| Газ | ρ, кг / м 3 | ρ, г / cм 3 | Газ | ρ, кг / м 3 | ρ, г / cм 3 |
|---|---|---|---|---|---|
| Хлор | 3,210 | 0,00321 | Оксид углерода (II)(угарный газ) | 1,250 | 0,00125 |
| Оксид углерода (IV)(углекислый газ) | 1,980 | 0,00198 | Природный газ | 0,800 | 0,0008 |
| Кислород | 1,430 | 0,00143 | Водяной пар (приt = 100ºC) | 0,590 | 0,00059 |
| Воздух (при 0ºC) | 1,290 | 0,00129 | Гелий | 0,180 | 0,00018 |
| Азот | 1,250 | 0,00125 | Водород | 0,090 | 0,00009 |
Другие заметки по химии
Таблица плотности газов
| Газы | Формула | Плотность при нормальных условиях ρ, кг/м3 |
| Азот | N2 | 1,2505 |
| Аммиак | NH3 | 0,7714 |
| Аргон | Ar | 1,7839 |
| Ацетилен | C2H2 | 1,1709 |
| Ацетон | C3H6O | 2,595 |
| Бор фтористый | BF3 | 2,99 |
| Бромистый водород | HBr | 3,664 |
| Н-бутан | C4H10 | 2,703 |
| Изо-бутан | C4H10 | 2,668 |
| Н-бутиловый спирт | C4H10O | 3,244 |
| Вода | H2O | 0,768 |
| Водород | H2 | 0,08987 |
| Воздух (сухой) | — | 1,2928 |
| Н-гексан | C6H14 | 3,845 |
| Гелий | He | 0,1785 |
| Н-гептан | C7H16 | 4,459 |
| Германия тетрагидрид | GeH4 | 3,42 |
| Двуокись углерода | CO2 | 1,9768 |
| Н-декан | C10H22 | 6,35 |
| Диметиламин | (CH3)2NH | 1,966* |
| Дифтордихлорметан | CF2Cl2 | 5,51 |
| Дифенил | C12H10 | 6,89 |
| Дифениловый эфир | C12H10O | 7,54 |
| Дихлорметан | CH2Cl2 | 3,79 |
| Диэтиловый эфир | C4H10O | 3,30 |
| Закись азота | N2O | 1,978 |
| Йодистый водород | HI | 5,789 |
| Кислород | O2 | 1,42895 |
| Кремний фтористый | SiF4 | 4,9605 |
| Кремний гексагидрид | Si2H5 | 2,85 |
| Кремний тетрагидрид | SiH4 | 1,44 |
| Криптон | Kr | 3,74 |
| Ксенон | Xe | 5,89 |
| Метан | CH4 | 0,7168 |
| Метиламин | CH5N | 1,388 |
| Метиловый спирт | CH4O | 1,426 |
| Мышьяк фтористый | AsF5 | 7,71 |
| Неон | Ne | 0,8999 |
| Нитрозилфторид | NOF | 2,176* |
| Нитрозилхлорид | NOCl | 2,9919 |
| Озон | O3 | 2,22 |
| Окись азота | NO | 1,3402 |
| Окись углерода | CO | 1,25 |
| Н-октан | C8H18 | 5,03 |
| Н-пентан | C5H12 (CH3(CH2)3СН3) | 3,457 |
| Изо-пентан | C5H12 (СН3)2СНСН2СН3 | 3,22 |
| Пропан | C3H8 | 2,0037 |
| Пропилен | C3H6 | 1,915 |
| Радон | Rn | 9,73 |
| Силан диметил | SiH2(CH3)2 | 2,73 |
| Силан метил | SiH3CH3 | 2,08 |
| Силан хлористый | SiH3Cl | 3,03 |
| Cилан трифтористый | SiHF3 | 3,89 |
| Стибин (15°С, 754 мм.рт.ст.) | SbH3 | 5,30 |
| Селеновая кислота | H2Se | 3,6643 |
| Сернистый газ | SO2 | 2,9263 |
| Сернистый ангидрид | SO3 | 3,575 |
| Сероводород | H2S | 1,5392 |
| Сероокись углерода | COS | 2,72 |
| Сульфурил фтористый | SO2F2 | 3,72* |
| Триметиламин | (CH3)3N | 2,58* |
| Триметилбор | (CH3)3B | 2,52 |
| Фосфористый водород | PH3 | 1,53 |
| Фосфор фтористый | PF3 | 3,907* |
| Фосфор оксифторид | POF3 | 4,8 |
| Фосфор пентафторид | PF5 | 5,81 |
| Фреон-11 | CF3CI | 6,13 |
| Фреон-12 (дифтордихлорметан) | CF2CI2 | 5,51 |
| Фреон-13 | CFCI3 | 5,11 |
| Фтор | F2 | 1,695 |
| Фтористый кремний | SiF4 | 4,6905 |
| Фтористый метил | CH3F | 1,545 |
| Фторокись азота | NO2F | 2,9 |
| Хлор | Cl2 | 3,22 |
| Хлор двуокись | ClO2 | 3,09* |
| Хлор окись | Cl2O | 3,89* |
| Хлористый водород | HCl | 1,6391 |
| Хлористый метил (метилхлорид) | CH3Cl | 2,307 |
| Хлористый этил | C2H5Cl | 2,88 |
| Хлороформ | CHCl3 | 5,283 |
| Хлорокись азота | NO2Cl | 2,57 |
| Циан, дициан | C2N2 | 2,765 (2,335*) |
| Цианистая кислота | HCN | 1,205 |
| Этан | C2H6 | 1,356 |
| Этиламин | C2H7N | 2,0141 |
| Этилен | C2H4 | 1,2605 |
| Этиловый спирт | C2H6O | 2,043 |
Физика. таблица плотностей
Плотность — это скалярная физическая величина, которая определяется как отношение массы тела к занимаемому этим теломобъёму или площади (поверхностная плотность). Для обозначения плотности обычно используется символ  .
.
| Наименование | Плотность, кг/м3 |
| Алюминий | 2,7·103 |
| Барий | 3,5·103 |
| Бензин | 0.750 · 103 |
| Ванадий | 6,0·103 |
| Вольфрам | 19,1 ·103 |
| Вода дистилированая | 0.998 · 103 |
| Вода морская | 1.020 · 103 |
| Висмут | 9,8·103 |
| Дизельное топливо | 0.850 · 103 |
| Железо | 7,8·103 |
| Литий | 0,53·103 |
| Медь | 8,9·103 |
| Никель | 8,9·103 |
| Свинец | 11,3·103 |
| Серебро | 10,5·103 |
| Цезий | 1,9·103 |
| Цинк | 7,1·103 |
| Вода (при 40С) | 1,00·103 |
| Глицерин | 1,26·103 |
| Гранит | 2600 |
| Дерево (Дуб) | 810 |
| Ртуть | 13,6·103 |
| Спирт | 0,80·103 |
| Сероуглерод | 1,26·103 |
| Водород | 0,09 |
| Воздух | 1,29 |
| Гелий | 0,18 |
| Кислород | 1,43 |
| Керосин | 800 |
| Эфир | 0.720 · 103 |
| Нефть | изменяемая 730—1040 |
| Мрамор | 2700 |
| Керосин | 0.800 · 103 |
| Серная кислота | 1.830 · 103 |
| Сера | 2070 кг/м³ |
| Золото | 19320 |
| Гипс | 1500 |
| Бетон | 2000 |
| Молоко | 1050 |
| Стекло | 2500 |
| Чугун | 7000 |
Химические свойства
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- H2 → 2H− 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
- Ca H2 → CaH2
и с единственным неметаллом — фтором, образуя фтороводород:
- F2 H2 → 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
- O2 2H2 → 2H2O
Записанное уравнение отражает восстановительные свойства водорода.
- CuO H2 → H2O Cu
С галогенами образует галогеноводороды:
- H2 F2 → 2HF , реакция протекает со взрывом в темноте и при любой температуре,
- H2 Cl2 → 2HCl , реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
- C 2H2 → CH4

