- История
- Общие сведения:
- Понятие валентности. связь валентности со строением атома. конспект химия
- Применение теллура:
- Свойства атома кобальта :
- Свойства металла
- Свойства атома
- Химические свойства
- Термодинамические свойства простого вещества
- Кристаллическая решётка простого вещества
- Прочие характеристики
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Физические свойства теллура:
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались всё новые порции бурых оксидов азота, которые исследователь периодически растворял в щёлочи.
Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырёк газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры)
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошёл своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр.
Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий.
Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %).
Слишком невероятен был тот факт, что несколько поколений учёных не заметили составной части воздуха, да ещё и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Общие сведения:
| 101 | Название | Теллур |
| 102 | Прежнее название | |
| 103 | Латинское название | Tellurium |
| 104 | Английское название | Tellurium |
| 105 | Символ | Te |
| 106 | Атомный номер (номер в таблице) | 52 |
| 107 | Тип | Неметалл |
| 108 | Группа | Полуметалл, халькоген |
| 109 | Открыт | Франц Йозеф Мюллер, Австрия, 1782 г. |
| 110 | Год открытия | 1782 г. |
| 111 | Внешний вид и пр. | Хрупкое, серебристо-белое вещество с металлическим блеском |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации теллура: — α-теллур (кристаллический, металлический теллур) с гексагональной кристаллической решёткой, — аморфный теллур в виде чёрно-коричневого порошка |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 9,9·10-8 % |
| 120 | Содержание в морях и океанах (по массе) | |
| 121 | Содержание во Вселенной и космосе (по массе) | 9,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,00021 % |
| 124 | Содержание в организме человека (по массе) |
Понятие валентности. связь валентности со строением атома. конспект химия
Валентность — количество химических связей, которые может образовывать атом элемента с другими атомами за счет объединения неспаренных электронов в общую электронную пару (не зря ковалентная связь так названа). Валентность обозначают римской цифрой.
Валентность часто равна количеству неспаренных электронов у атома. Для элементов IV – VII А — групп валентность определить легко, задав вопрос: «Сколько электронов нужно данному элементу до завершения внешнего энергетического уровня?» или по формуле: 8 — № группы (действует только для элементов главных подгрупп IV – VII групп). Но не стоит забывать, что многие элементы в процессе возбуждения могут распаривать электроны, в таком состоянии валентность может достигать номера группы (это характерно для всех элементов, кроме азота, кислорода и фтора). Рассмотрим примеры.
Валентность азота и фосфора
Азот и фосфор, находящиеся в одной группе. Для них по формуле 8 – 5 = 3 мы можем найти низшую валентность (количество неспаренных электронов в основном состоянии), равную трем (III).
В таком случае азот образует аммиак (NH3) и оксид азота III (N2O3), а фосфор – фосфин (PH3) или оксид фосфора III (P2O3).
Но вспомним про возможность образовывать донорно-акцепторные связи некоторыми атомами. И азот, и фосфор имею такую возможность, поэтому кроме трех обычных ковалентных связей, они могут образовать дополнительную донорно-акцепторную. В таком случае, в основном состоянии оба могут иметь валентность IV, что соответствует катиону аммония и катиону фосфония (NH4 и PH4 ). Ковалентные связи обозначают черточкой («‒»).
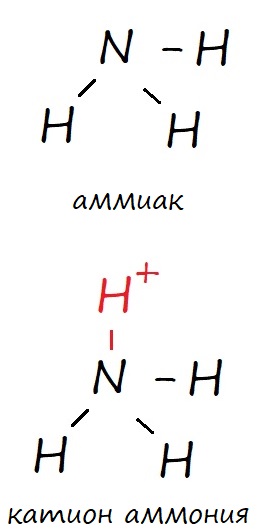
Рис. Образование ковалентных и донорно-акцепторных (выделено красным) связей атомом азота.
У фосфора, в отличие от азота, на внешнем уровне есть незаполненная d-орбиталь, на которую могут переходить электроны при возбуждении.
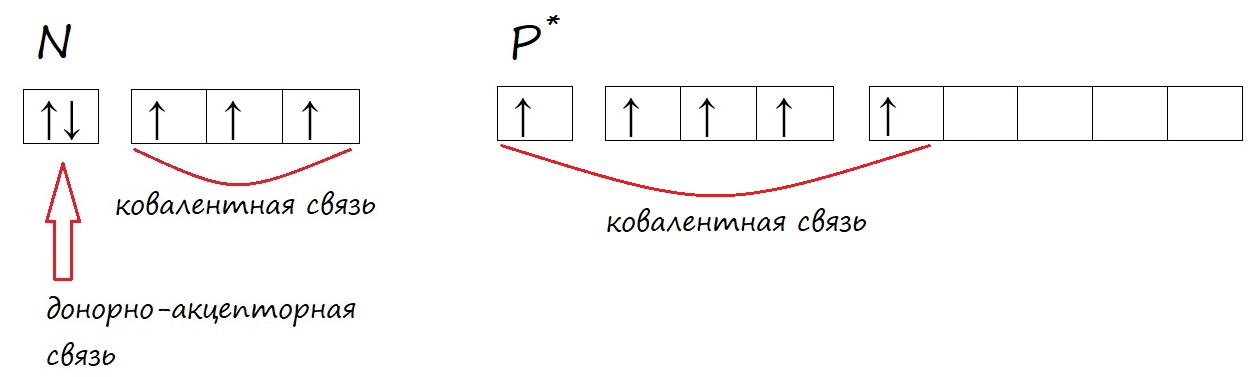
У фосфора в возбужденном состоянии появляется пять неспаренных электронов, поэтому он способен образовывать пять ковалентных связей, соответственно проявлять валентность V, например в ортофосфорной кислоте (H3PO4).
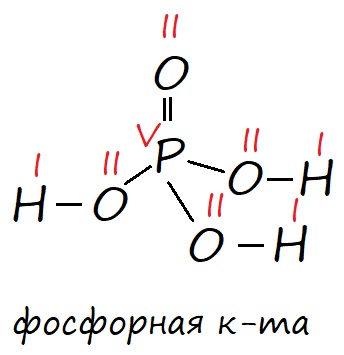
Рис. Строение фосфорной кислоты в соответствии с валентными состояниями атомов: фосфор в возбужденном состоянии имеет пять неспаренных электронов, его валентность равна V; кислород имеет два неспаренных электрона, поэтому его валентность равна II и он может образовывать две ковалентные связи; водород имеет один неспаренных электрон и его валентность равна I. Валентность обозначена красными римскими цифрами.
У азота нет свободной d-орбитали (она появляется с третьего энергетического уровня, а у азота всего два уровня), поэтому распарить электроны не может и высшую валентность, равную номеру группы, проявлять он не способен.
Валентность кислорода и серы
Аналогичную ситуацию можно наблюдать у атомов кислорода и серы. Кислород, находясь во втором периоде может иметь только два энергетических уровня, поэтому d-орбитали, появляющейся с третьего уровня, у него нет. Тогда как у серы три энергетических уровня, на внешнем уровне есть d-орбиталь и возможность распаривать на нее электроны в процессе возбуждения.
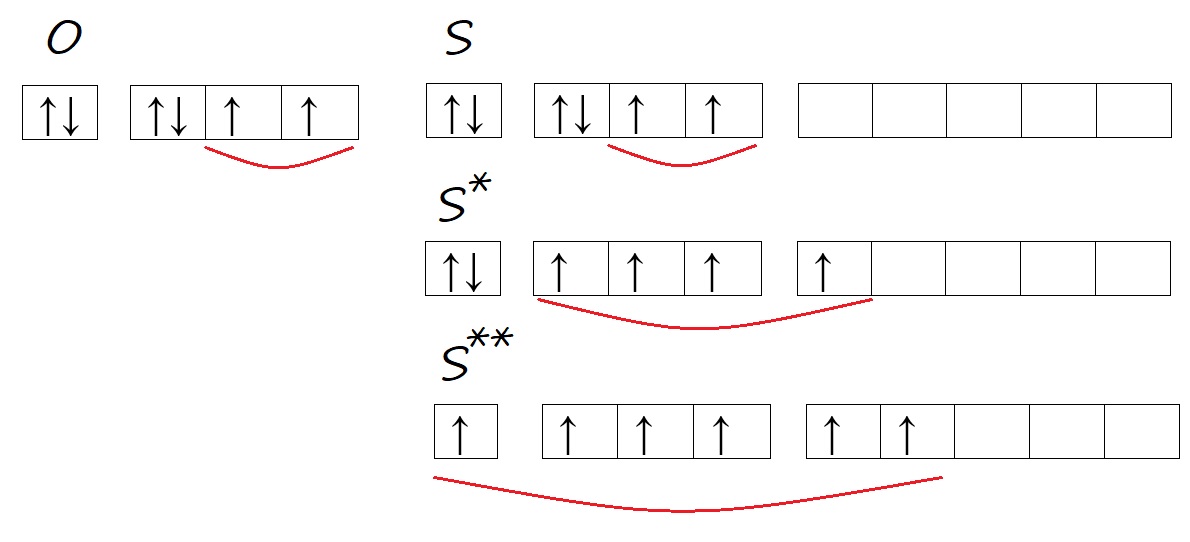
Рис. Количество неспаренных электронов у кислорода и серы в основном и возбужденном состоянии.
Таким образом, кислород способен проявлять валентность II, а сера – валентность II, IV, VI, например, в сероводороде (H2S) валентность равна двум; в сернистом газе и сернистой кислоте (SO2 и H2SO3) валентность равна четырём; в серном ангидриде и серной кислоте (SO3 и H2SO4) – шести.
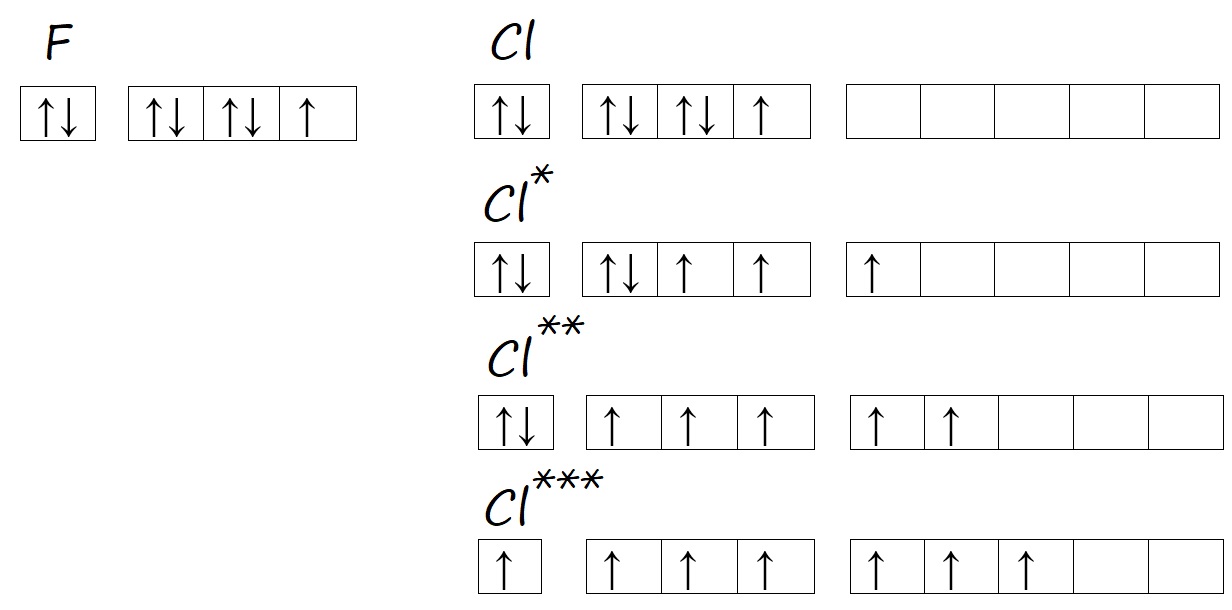
Валентность фтора и хлора
По причинам, описанным выше, фтор так же не способен распаривать свои электроны и переходить в возбужденное состояние, а хлор может. Поэтому у фтора есть одно валентное состояние (I), например, в HF (H ‒ F) и OF2 (F ‒ O ‒ F).
Хлор, как и другие нижестоящие галогены (элементы VIIА-подгруппы), может образовывать несколько возбужденных состояний, поэтому в разных соединениях имеет разную валентность. Например, валентность I хлор проявляет в хлороводороде HCl. Валентность III в хлористой кислоте HClO2. Валентность равную V – в хлорноватой кислоте HClO3. Равную VII – в хлорной кислоте HClO4.
Постоянная и непостоянная валентность
Как уже можно было заметить, некоторые элементы способны проявлять только одну валентность, тогда как другие могут иметь множество валентностей. По этой черте все элементы можно разделить на две группы: элементы с постоянной и непостоянной валентностью.
Таб. Классификация элементов по валентности
С постоянной валентностью | С непостоянной валентностью |
I: H и F II: O | Все остальные неметаллы. |
Иногда валентность определяют и у металлов, хотя для них характерна ионная, а не ковалентная связь, в таком случае таблица будет выглядеть следующим образом:
С постоянной валентностью | С непостоянной валентностью |
I: H, F, все металлы IА-подгруппы (Li, Na…). II: O и все металлы IIА-подгруппы, а также цинк. III: элементы IIIА-подгруппы. | Все остальные неметаллы и металлы. |
Низшая и высшая валентность
Высшая валентность равна номеру группы, в которой находится элемент (исключения: кислород, азот и фтор, как и было описано выше). Так, для брома высшей валентностью будет VII, для теллура – VI, для мышьяка V. Низшая валентность возможна для элементов четвёртой группы, она равна двум. Для элементов V – VII групп она определяется по описанной выше формуле (8 — №группы элемента). Поэтому у брома низшей валентностью будет I, у теллура II, а у мышьяка III.
Применение теллура:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Свойства атома кобальта :
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 58,933194(4) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d7 4s2 |
| 203 | Электронная оболочка | K2 L8 M15 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 152 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 126 пм – low-spin, 150 пм – high-spin |
| 207 | Радиус иона (кристаллический) | Co2 low spin 79 (6) пм, Co3 low spin 68,5 (6) пм, Co2 high spin 88,5 (6) пм, Co3 high spin 75 (6) пм, Co4 high spin 67 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 27 электронов, 27 протонов, 32 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 9-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Свойства металла
Кобальт — элемент периодической таблицы Менделеева под номером 27. Его относят к металлам, он имеет белый или желтоватый серебристый цвет. Имеет синеватый или розоватый отлив.
Физические свойства металла:
- плотность 8,9 г/см³;
- температура плавления 1495°С;
- кипит при 2870 градусах Цельсия;
Кобальт ферромагнетик, как и два его соседа по таблице Менделеева — железо и никель.
Рекомендуем: ЛИТИЙ — в космосе, на земле, под водой
Химические свойства металла обусловлены его степенями окисления — 2, 3, 0.
Холодная концентрированная азотная кислота пассивирует Co.
Щелочи реагируют с водными растворами солей, при этом образуется гидроксид Со(ОН)2.
Свойства атомаКобальт / Cobaltum (Co), 27 — Название, символ, номер |
| 58,933194(4) а. е. м. (г/моль) — Атомная масса(молярная масса) |
| [Ar] 3d7 4s2 — Электронная конфигурация |
| 125 пм — Радиус атома |
Химические свойства116 пм — Ковалентный радиус |
| ( 3e) 63 ( 2e) 72 пм — Радиус иона |
| 1,88 (шкала Полинга) — Электроотрицательность |
| E0(Co2 /Co) = −0,277 В — Электродный потенциал |
| 3, 2, 0, −1 — Степени окисления |
| 758,1 (7,86) кДж/моль (эВ) — Энергия ионизации (первый электрон) |
Термодинамические свойства простого вещества8,9 г/см³ — Плотность (при н. у.) |
| 1768 K — Температура плавления |
| 3143 K — Температура кипения |
| 15,48 кДж/моль — Уд. теплота плавления |
| 389,1 кДж/моль — Уд. теплота испарения |
| 24,8[1] Дж/(K·моль) — Молярная теплоёмкость |
| 6,7 см³/моль — Молярный объём |
Кристаллическая решётка простого веществагексагональная — Структура решётки |
| a=2,505 c=4,089 Å — Параметры решётки |
| 1,632 — Отношение c/a |
| 385 K — Температура Дебая |
Прочие характеристики(300 K) 100 Вт/(м·К) — Теплопроводность |
| 7440-48-4 — Номер CAS |
Водорастворимые соли кобальта дарят воде розовый цвет. Растворенные в ацетоне, эти соли окрашивают раствор в синий цвет.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 698
Физические свойства теллура:
| 400 | Физические свойства | |
| 401 | Плотность* | 6,24 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 5,70 г/см3 (при температуре плавления 449,51 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 449,51 °C (722,66 K, 841,12 °F) |
| 403 | Температура кипения* | 988 °C (1261 K, 1810 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 17,49 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 114,1 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,202 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,73 Дж/(K·моль) |
| 411 | Молярный объём | 20,4487 см³/моль |
| 412 | Теплопроводность | 1,97-3,38 Вт/(м·К) (при стандартных условиях) |
| 413 | Коэффициент теплового расширения | 18 мкм/(М·К) (при 20 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |


