Кислород
Электронная конфигурация невозбужденного атома кислорода 1s22s22р4:
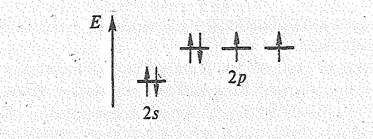
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений равна —2. Кроме того, кислород проявляет степени окисления 2 и 4, а также 1 и –1 в соединениях со связью О—О.
Кислород — самый распространенный элемент (58,0 мол. доли) на Земле. Состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18O (0,204%). Искусственно получены также изотопы 14O, 15O и 19О, период полураспада которых исчисляется десятками секунд. Вследствие количественного преобладания и большой окислительной активности кислород предопределяет форму существования на Земле всех остальных элементов. Его значение было особенно велико в период образования земной коры. Предполагается, что наличие кислорода в атмосфере обусловлено вторичными процессами деятельностью зеленых растений.
Простые вещества. Наиболее устойчива двухатомная молекула кислорода О2. Как показывают магнитные исследования, она парамагнитна. При этом величина ее парамагнетизма отвечает наличию двух непарных электронов:
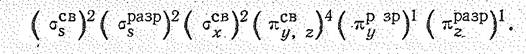

В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать структурными формулами[1]:

Вследствие кратности связи межатомное расстояние в О2 (0,1207 нм) меньше длины одинарной связи 0—О (0,148 нм). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кДж/моль, в то время как энергия одинарной связи О–О всего 210 кДж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С; она имеет место также при поглощении ультрафиолетового излучения (фотолиз).
Температуры плавления (—218,9 °С) и кипения (—183 °С) кислорода очень низкие. Он плохо растворяется в воде (5 объемов О2 в 100 объемах Н2О при 0 °С). Жидкий и твёрдый кислород притягивается магнитом.
Аллотропическую модификацию кислорода озон О3 можно рассматривать как соединение О (IV).
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора; с большинством простых веществ он взаимодействует непосредственно, образуя оксиды; лишь по отношению к фтору проявляет восстановительные свойства.
Кислород получают ректификацией жидкого воздуха, а также как побочный продукт при электролизе воды. В лаборатории для его получения используют термическое разложение богатых кислородом соединений (КМnО4, КСlO3 и др.).
Соединения со степенью окисления кислорода —2. Как уже указывалось, образование двух- и многозарядных одноатомных анионов Эn— энергетически невыгодно. Поэтому не существует соединений, содержащих ион О2-. Даже в кристаллических оксидах наиболее активных металлических элементов типа Nа2O и СаО эффективный заряд атома кислорода составляет всего около 1—.
Как и для других р-элементов 2-го периода, максимальная валентность (число двухэлектронных двухцентровых связей) кислорода равна четырем. При этом атомы кислорода могут находиться в состоянии sр3-, sр2— и sр-гибридизации, что соответствует тетраэдрическому, треугольному и линейному расположению s–связей. В качестве примера соединений, в которых проявляются эти гибридные состояния орбиталей кислорода, можно указать соответственно кристаллические ВeО, ТiO2 и SiO2.
Весьма разнообразны также оксиды, в которых координационное число кислорода превышает значение его максимальной валентности, т. е. больше четырех. Например, в кристалле МgO координационное число кислорода равно шести, а в кристалле Nа2O восьми. Согласно теории молекулярных орбиталей это обусловлено тем, что в кристалле MgO (структурный тип NаСI) каждый атом О (за счет 2pх-, 2рy— и 2рz-орбиталей) объединяется с шестью соседними атонами Мg посредством трех трехцентровых связей. Аналогично построены кристаллические МnО, FеО, СоО, NiO и другие оксиды со структурой типа NаСI.
В оксидах типа Nа2O (К2O, Rb2O, Li2O) атомы кислорода (за счет 2s, 2рx-, 2pу— и 2рz-орбиталей) с восемью соседними атомами металла объединяются посредством четырех трехцентровых связей.
Состав кристаллических оксидов (в особенности d-элементов) в большей или меньшей степени переменный. Так, для МnО он изменяется в пределах от МnО до МnО1.5, а для МnО2 — от МnO1,5 до МnО2,6. Если в оксидах содержание кислорода выше стехиометрического, они проявляют дырочную проводимость, а если содержание металла выше стехиометрического, то электронную. Полупроводниками с дырочной проводимостью являются МnО, Сu2О, FеО н др. Ряд оксидов, состав которых не подчиняется обычным правилам степеней окисления (например, Сr3О, Тi6О, Тi3О), — металлические соединения.
Важнейшим из оксидов является оксид водорода — вода. Достаточно сказать, что она составляет 50—99% массы любого живого существа. Кровь человека содержит более 4/5 воды, мускулы — 35% воды. При средней продолжительности жизни (70 лет) человек выпивает около 25 т воды.
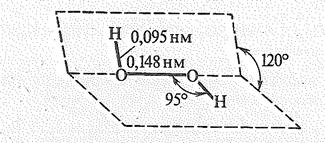
Молекула воды имеет угловую форму, что согласно теории валентных связей соответствует sр3-гибридвому состоянию атома кислорода. В молекуле Н2O две sр3-гибридные орбитали атома кислорода участвуют в образовании двух связей О—Н. На двух других sр3-гибридных орбиталях расположены две несвязывающие электронные пары. Валентный угол в молекуле воды НOН составляет 104,5о.
В рамках теории молекулярных орбиталей модель молекулы воды соответствует распределению восьми валентных электронов по двум связывающим и двум несвязывающим молекулярным орбиталям
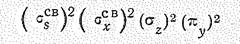
и наличию двух свободных разрыхляющих орбиталей (рис. 1). Такое объяснение подтверждается наличием у молекулы Н2О четырех первых потенциалов ионизации (27,3; 16,2; 14,5 и 12,6 эВ).
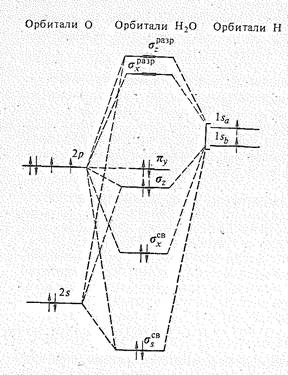 С позиций теории молекулярных орбиталей строение молекулы Н2О можно объяснить следующим образом. Взаимное расположение атомов водорода и кислорода в молекуле воды можно представить схемой:
С позиций теории молекулярных орбиталей строение молекулы Н2О можно объяснить следующим образом. Взаимное расположение атомов водорода и кислорода в молекуле воды можно представить схемой:
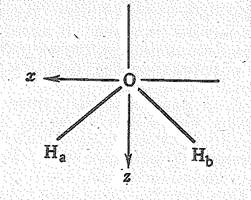
Рис 1. Энергетическая Молекулярные орбитали Н2О образуются за счет 2s-,
диаграмма орбиталей и 2р-орбиталей атома кислорода и 1s-орбиталей
молекулы Н2О двух атомов водорода. Характер перекрывания этих
орбиталей показан на рис. 2.
Перекрывание 2рx-орбитали атома кислорода и 1s-орбиталей двух атомов водорода приводит к возникновению молекулярных sxсв.— и sхразр.-орбиталей, Как видно из рис. 2, характер перекрывания 2s— и 2рz-орбиталей кислорода одинаков. В результате образуются три молекулярные орбитали: связывающая ssсв., почти несвязывающая sz и разрыхляющая szразр.. Орбиталь 2рy, расположенная перпендикулярно плоскости расположения атомов Н и О, с 1s-орбиталями атомов Н не перекрывается и в молекуле Н2O играет роль не-связывающей молекулярной py -орбитали.
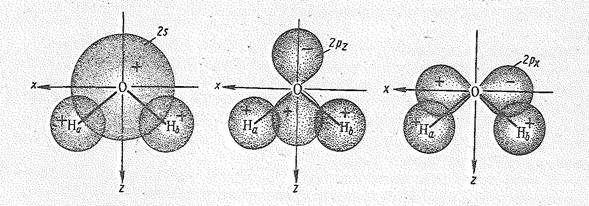
Рис. 2. Перекрывание 2s-, 2рz— и 2рx-орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Таким образом, комбинация исходных четырех атомных орбиталей кислорода и двух орбиталей атомов водорода приводит к образованию двух связыазющнх (ssсв. и sxсв.), двух несвязывающих (sz и py) и двух разрыхляющих (sxразр. И szразр.) молекулярных орбиталей (см. рис. 1).
В соответствии с природой элемента в положительной степени окисления характер оксидов в периодах и группах периодической системы закономерно изменяется. В периодах уменьшается отрицательный эффективный заряд на атомах кислорода dо и осуществляется постепенный переход от основных через амфотерные оксиды к кислотным, например:
 Различие в свойствах оксидов разного типа проявляется при их взаимодействии с водой:
Различие в свойствах оксидов разного типа проявляется при их взаимодействии с водой:

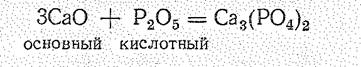 а также при взаимодействии оксидов разного типа друг с другом:
а также при взаимодействии оксидов разного типа друг с другом:
Амфотерные оксиды с водой не взаимодействуют, но могут реагировать и с кислотами, и с щелочами:
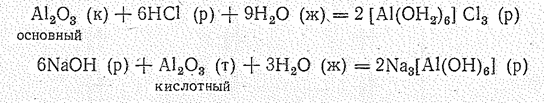
а при сплавлении — с основными и кислотными оксидами.
Сравнительную количественную оценку основно-кислотной активности оксидов можно дать на основании значений DG соответствующих однотипных реакций. Уменьшение отрицательного значения DGо298 в реакциях

свидетельствует об ослаблении в ряду Nа2О – МgО —Al2O3 их основных свойств, а также об их способности взаимодействовать с водой. В ряду Р2О5—SO3—Сl2О7
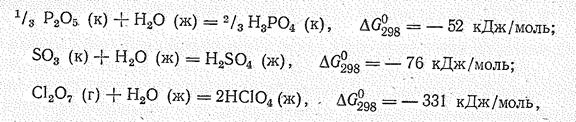
наоборот, наблюдается увеличение отрицательного значения DGо298, что свидетельствует об усилении у оксидов кислотных свойств.
Соединения перекисного типа. Сродство к электрону молекулы O2 составляет 0,8 эВ, а ее энергия ионизации 12,08 эВ. При химических превращениях молекула O2 может присоединять или терять электроны с образованием молекулярных ионов типа O22-, O2— и O2 (табл. 1).
Таблица 1.
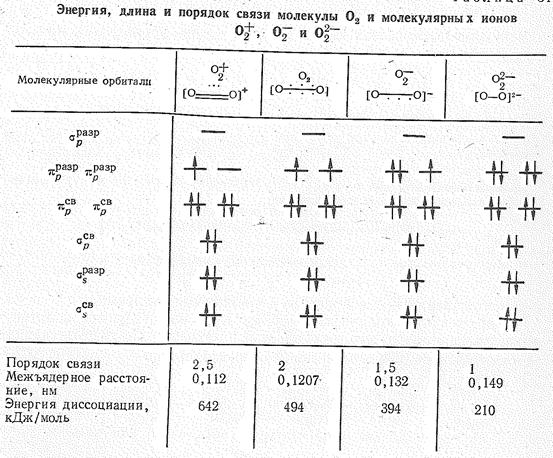
Как видно из табл. 1, удаление электрона с pразр. -орбитали молекулы О2 соответствует повышению порядка связи в О2 , а появление электронов на pразр -орбитали приводит, наоборот, к уменьшению порядка связи в молекулярных нонах О22- и О2—. В соответствии с этим в ряду О2 – О2 — О2— — О22- расстояние между атомами кислорода увеличивается, а средняя энергия связи уменьшается.
Присоединение одного электрона к молекуле О2 вызывает образование надпероксид— нона О2— :
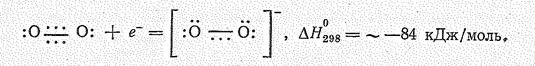
Производные радикала О2— называются надпероксидами; они известны для наиболее активных щелочных металлов (К, Rb, Сs). Надпероксиды образуются при прямом взаимодействии простых веществ:
К O2 = КO2.
Непарный электрон нона О2— обусловливает парамагнетизм надпероксидов и наличие у них окраски. Надпероксиды — очень сильные окислители. Oни бурно реагируют с водой с выделением кислорода.
Присоединяя два электрона, молекула О2 превращается в пероксид-ион О22-, в котором атомы связаны одной двухэлектронной связью, и поэтому он диамагнитен:

Это также согласуется с отсутствием окраски у пероксидов,
Пероксиды образуются при окислении ряда металлов, например:
Ва О2 = ВаО2
Наибольшее практическое значение имеет пероксид (перекись) водорода Н2О2. Строение молекулы показано ниже:
Энергия связи О — О (210 кДж/моль) почти в два раза меньше энергии связи О — Н (468 кДж/моль).
Из-за несимметричного распределения связей Н – О молекула Н2О2 сильно полярна ( = 0,7. 10-29 Кл×м). Между молекулами Н2О2 возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода — сиропообразная жидкость (пл. 1,44) с довольно высокой температурой кипения (т. кип. 150,2 °С, т. пл. 0,41 °С). Она имеет бледно-голубую окраску. Пероксид водорода — хороший. ионизирующий растворитель. С водой смешивается в любых отношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата Н2О2×2Н2О (т. пл. —52,0 °С). В лаборатории обычно используются 3%-ные и 30%-ные растворы Н2О2 (последний называют пергидролем).
В водных растворах пероксид водорода — слабая кислота (Киониз = 2,24×10-12):

В химических реакциях пероксид-радикал может, не изменяясь, переходить в другие соединения, например:
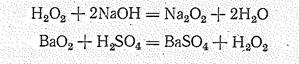
Последняя реакция используется для получения перекиси водорода.
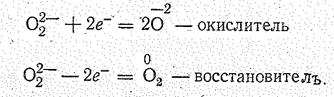 Чаще, однако, протекают реакции, сопровождающиеся разрушением связи О — О или изменением заряда иона О22-. Можно считать, что ион О присоединяет или теряет электроны:
Чаще, однако, протекают реакции, сопровождающиеся разрушением связи О — О или изменением заряда иона О22-. Можно считать, что ион О присоединяет или теряет электроны:
Окислительные свойства пероксидов выражены сильнее, чем восстановительные:
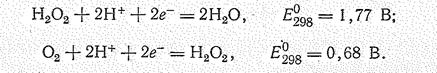
Так, при действии концентрированных растворов Н2О2 на бумагу, опилки или другие горючие вещества происходит их самовоспламенение. Восстановительные свойства перекись водорода проявляет только по отношению к таким сильным окислителям, как ионы МnО4—.
Для пероксида водорода характерен также распад по типу диспропорционирования:
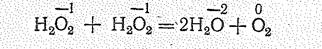
Этот распад ускоряется в присутствии примесей, при освещении, нагревании и может протекать со взрывом. Довольно устойчивы только очень чистая Н2О2 и ее 30—65%-ные растворы. Пероксид водорода и его растворы обычно хранят в темной посуде и на холоде; для стабилизации добавляют ингибиторы.
Водные растворы пероксида водорода широко используются для отбелки различных материалов, для обеззараживания сточных вод. Пероксид водорода применяют как окислитель ракетного топлива.
В последнее время удалось синтезировать Н2О3 и Н2О4. Эти соединения весьма неустойчивы. При обычных температурах они разлагаются за доли секунды. Однако при низких температурах порядка —70°С они существуют часами. Спектроскопическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру:

Молекулы Н2О2, как и Н2О, могут выступать в качестве нейтральных лигандов, например [Fе(ОН2)5(О2Н2)]3 , и давать аналогичные кристаллогидратам пероксогидраты: К2СО3 ×3Н2O2, СаО2×2Н2O2, ВаO2×2Н2О×2Н2О2 и др. Роль лиганда может играть и пероксидион, например в комплексе [V(О2)4]3-:
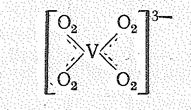
Кислоты, в которых имеется группировка О22-, называют пероксокислотами:
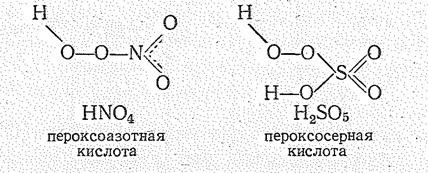
При гидролизе пероксокислот образуется пероксид водорода, что используется для его получения в промышленности.
Характерным свойством пероксидных соединений, как простых, так и комплексных, является способность образовывать пероксид водорода при взаимодействии с разбавленными растворами кислот, а также выделять кислород при термическом разложении или действии воды и других химических агентов. Другие неорганические соединения, которые могут быть источником кислорода, как, например, нитраты, хлораты, перхлораты, перманганаты и некоторые оксиды, не выделяют пероксид водорода при действии воды. Кислород они выделяют только при нагревании и в присутствии катализаторов.
Соединения кислорода (II) и кислорода (I). Можно считать, что электроположительная поляризация атомов кислорода проявляется в соединениях с фтором, а также в ионе О2 . Некоторые примеры фторопроизводных кислородных соединений приведены в табл. 2.
Простейший представитель такого рода соединений — дифторид кислорода ОF2: его получают при быстром пропускании фтора через 2%-ный раствор щелочи:
2F2 2NaOH = OF2 2NaF H2O
Таблица 2.
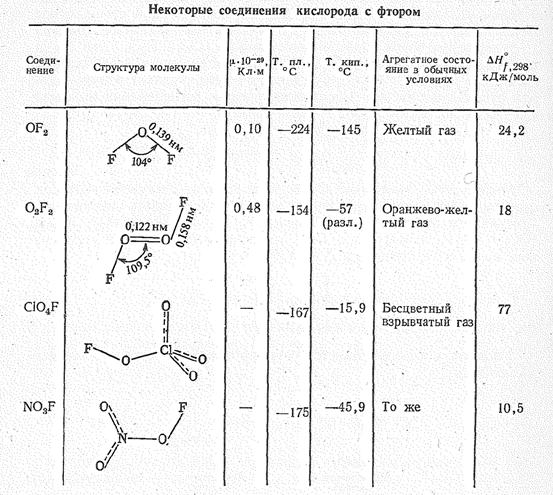
Молекула ОF2 имеет угловую форму (dOF = 0,139 нм, ÐFОF = 104° 16’, m= 0,1 × 10-29 Кл×м.) Дифторид кислорода ядовитый газ бледно-желтого цвета, термически устойчив до 200—250 °С, сильный окислитель, эффективный фторирующий агент.
В диоксидифториде О2F2 радикал О22 ковалентно связан с атомами фтора. Молекула О2F2 диамагнитна. Это соединение образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). Согласно спектроскопическим данным молекула О2F2 (m = 0,48×10-29 Кл×м) по структуре аналогична Н2О2:
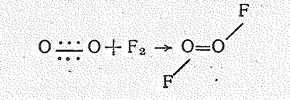
Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).
Получены также полиоксидифториды типа О4F2, О5F2 и О6F2, существующие лишь при низкой температуре (—190 °с). Предполагают, что их молекулы имеют цепное строение, например F—О—О—О—О—F. Термическая устойчивость полиоксидифторидов уменьшается с увеличением числа атомов в молекуле ОnF2 (n = 2 – 6).
Энергия ионизации молекулы О2 довольно значительная (12,08 эВ), однако при взаимодействии О2 с сильнейшим окислителем РtF6 образуется солеподобное вещество О2 [РF6]—
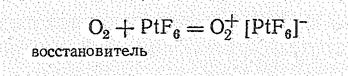
в котором роль катиона играет молекулярный ион О2 (диоксигенил):

Гексафтороплатинат (V) диоксигенила О2[РtF6] – парамагнитное вещество красного цвета, плавится с разложением при 219 °С. Синтез этого соединения канадским ученым Н. Бартлетом в 1962 г. послужил толчком к синтезу соединений ксенона, энергия ионизации которого близка к таковой молекулы кислорода.
Производные О2 получены также при взаимодействии O2F2 и O4F2 с резко кислотными фторидами типа ВF3, РF5, AsF5, SbF5, ВrF5:
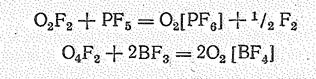
Синтез диоксигенильных солей можно осуществлять нагреванием в автоклаве (в течение 10—20 ч) при 150—500 °С смеси кислорода, фтора и порошка соответствующего металла:
О2 3 F2 Э = O2[ЭF6]
где Э – As, Sb, Bi, Nb, Au, Ru, Rh.
Частота валентных колебаний О2 в диоксигенильных соединениях близка к таковой для свободного иона, что подтверждает существование иона О2 в указанных солях. Межъядерное расстояние в катионе О2 , известное из спектроскопических данных (0,112 нм), как и следовало ожидать, короче, чем в О2 0,1207 нм). Ион О2 имеет один непарный электрон (см. табл. 1). Энергия диссоциации О2F2, ОF2 (~70 кДж/моль) меньше, чем у F2 (159 кДж/моль). Они — удобная форма хранения фтора, который выделяется при распаде этих фторидов уже при обычных температурах.
В соединениях типа СlО4F, NO3F мостиковый атом кислорода относительно центрального атома (Сl, N) поляризован отрицательно, а относительно атома фтора — положительно. Рассматриваемые соединения можно получить при взаимодействии с фтором концентрированных растворов НСlО4 и НNO3 или твердых солей КСlО4 и KNO3
HClO4 F2 = ClO4F HF
KNO3 F2 = NO3F KF
В воде эти соединения разлагаются, выделяя кислород:
ClO4F 2Н2О = HClO4 O2 2HF
Производные положительной степени окисления кислорода являются сильнейшими энергоемкими окислителями, способными выделять запасенную в них химическую энергию в определенных условиях. Их можно использовать как эффективные окислители ракетного топлива.
Соединения кислорода (IV). В качестве производного, в котором кислород проявляет степень окисления 4, можно рассматривать аллотропическую модификацию кислорода озон O3 – (О 4O2).
Молекула O3 диамагнитна, имеет угловую форму (ÐООО = 116,5°) и обладает некоторой полярностью (m = 0,17 × 10-29 Кл × м). Длина связи dOO ( 0,128 нм) является промежуточной между длиной одинарной (0,149 нм) и двойной связи (0,1207 нм). Поэтому считают, что в молекуле О3 порядок связи 1,5. Строение молекулы О3 можно передать следующей структурной формулой:
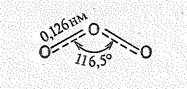
Исходя из приведенных данных, строение молекулы О3 можно объяснить следующим образом. Центральный атом кислорода молекулы О3 находится в состоянии sр2-гибридизации (за счет 2s-, 2pх н 2рy,-орбиталей). Две из гибридных sр2-орбиталей центрального атома участвуют в образовании двух s-связей О—О (двух молекулярных sсв.-орбиталей). Третья sр2-гибридная орбиталь (молекулярная s-орбиталь) содержит неподеленную электронную пару. 2рz -орбиталъ центрального атома (расположенная перпендикулярно плоскости расположения атомов) и 2рz-орбитали крайних атомов участвуют в образовании нелокализованной p-связи (молекулярная pсв.-орбиталь). Таким образом, невозбужденное состояние молекулы О3 отвечает следующему заполнению молекулярных орбиталей: (sсв.)4(pсв.)2(s)2.
Остальные электроны заполняют несвязывающие орбитали, локализованные у периферических атомов.
Шести электронам, связывающим три атома кислорода, соответствует порядок связи 1,5.
Озон газ синего цвета с резким раздражающим запахом, очень токсичен. Жидкий озон — темно-синяя жидкость, твердый – темно- фиолетовые кристаллы (т. пл. —192,7 °С). Поскольку молекула О3 обладает большей полярностью и поляризуемостью, озон имеет более высокую температуру кипения (—111,9 °С), чем кислород. Этим же объясняется большая интенсивность окраски озона и лучшая его растворимость в воде.
Озон образуется в процессах, сопровождающихся выделением атомарного кислорода (радиолиз воды, разложение перекисей и др.), а также при действии на молекулярный кислород потока электронов, протонов, коротковолнового излучения, т. е. за счет радиохимических
и фотохимических реакций. Цепную реакцию образования озона из кислорода можно представить схемой
О2 hn ® O2·
O2· O2 = O3 ·O·
·O· O2 = O3
или суммарно 3О2 = 2О3 DGо298 = 326 кДж/моль.
В естественных условиях озон образуется из атмосферного кислорода при грозовых разрядах, а на высоте 10—30 км — под действием ультрафиолетовых солнечных лучей. Озон задерживает вредное для жизни ультрафиолетовое излучение Солнца и поглощает инфракрасное излучение Земли, препятствуя ее охлаждению. Следовательно, «озонный пояс» играет большую роль в обеспечении жизни на Земле.
В технике озон получают в озонаторах действием тихого электрического разряда на кислород.
Озон — вещество эндотермическое (DНof,298 = 142,3 кДж/моль, DGof,298 = 162,7 кДж/моль). Но тем не менее в отсутствие катализаторов или без ультрафиолетового облучения газообразный озон разлагается довольно медленно даже при 250 °С. Жидкий озон и его концентрированные смеси (70% 0) взрывчаты.
Окислительная активность озона заметно выше, чем О2. Например, уже при обычных условиях он окисляет многие малоактивные простые вещества (Аg, Нg и пр.):
8Аg 2O3 = 4Аg2О O2
О более высокой химической активности О3, чем O2, свидетельствует также сравнение их окислительно-восстановительных потенциалов для водных растворов, например:
О3 (г) Н2О (ж) 2е— = О2 (г) 2ОН— (р), Ео298 = 1,24 В;
О2 (г) 2Н2О (ж) 4е— = 4ОН— (р), Ео298 = 0,401 В.
Для количественного определения озона можно использовать его взаимодействие с раствором КI:
2I— (р) O3 (г) Н2O (ж) = I2 (т) 2ОН— (р) О2 (г)
Сродство к электрону озона около 180 кДж/моль, поэтому он может переходить в озонид-ион О3—. В частности, при действии озона на щелочные металлы образуются озониды: К О3 = КО3
Озониды — это соединения состоящие из положительных ионов металла и отрицательных ионов О3— (dOO = 0,134 нм). Наличие в ионе О3— непарного электрона обусловливает парамагнетизм и наличие окраски у озонидов, Обычно они окрашены в красный цвет.
Как сильный окислитель озон используется для очистки питьевой воды, для дезинфекции воздуха, в различных химических синтезах.
[1] Тремя точками обозначены связи, обусловленные двумя pсв. и одним pразр. электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают pразр.-электроны, При возбуждении молекул О2 становится диамагнитной. Этому состоянию отвечает структурная формула .
§
Т 4 Л 10 Подгруппа мышьяка
Мышьяк Аs, сурьма Sb и висмут Вi — полные электронные аналоги с конфигурацией s2р3. По мере увеличения размеров атомов в ряду Аs — Sb — Вi значения устойчивых координационных чисел возрастают. Степени окисления мышьяка, сурьмы и висмута равны —3, 3 и 5. Вследствие особой устойчивости конфигурации 6s2 для висмута наиболее характерна степень окисления 3.
Содержание в земной коре мышьяка, сурьмы и висмута сравнительно невелико. Они обычно встречаются в виде сульфидных минералов:
Простые вещества. В ряду N—Р—Аs—Sb—Вi отчетливо наблюдается усиление металлических признаков простых веществ.
В частности, в этом ряду устойчивость неметаллических модификаций падает, а металлических возрастает. Мышьяк, как и фосфор, имеет несколько аллотропных форм. При быстром охлаждении пара (состоящего из молекул As4) образуется неметаллическая модификация — желтый мышьяк (пл. 2,0 г/см3), изоморфный белому фосфору и подобно ему растворимый в сероуглероде. Эта модификация менее устойчива, чем белый фосфор, и при действии света или при слабом нагревании легко переходит в металлическую модификацию — серый мышьяк. Неметаллическая модификация сурьмы (желтая сурьма) еще менее устойчива, чем желтый мышьяк. У висмута же неметаллическая модификация неизвестна вообще.
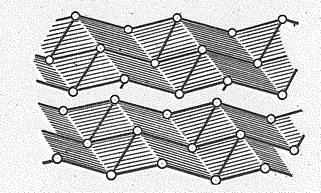
Устойчивые в обычных условиях модификации — серый мышьяк, серая сурьма и висмут — имеют металлический вид, электропроводны, но хрупки. Они изоморфны, имеют слоистую структуру типа черного фосфора. Каждый из атомов пирамидально связан с тремя соседними по слою и имеет трех ближайших соседей в другом слое. В ряду As—Sb—Вi различие межъядерных расстояний внутри и между слоями уменьшается (0,063—0,050—0,0З7 нм), т. е. происходит постепенно приближение к характерному для металлических структур равенству межъядерных расстояний. Благодаря близости параметров кристаллических решеток сурьма образует твердые растворы с мышьяком и висмутом, но последние друг с другом их не образуют.
Некоторые сведения о простых веществах р-элементов V группы приведены ниже: ( в твердом состоянии; При 1,8×109 Па; При 3,6×106 Па.)

В обычных условиях металлические модификации устойчивы по отношению к воздуху и воде. В ряду напряжений они располагаются после водорода. При взаимодействии с концентрированной НNО3 мышьяк переходит в мышьяковую кислоту:
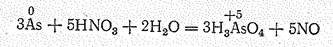
Сурьма в этих же условиях образует b-сурьмяную кислоту НSbO3 (Sb2О5× nН2О):
3Sbo 5HNO3 = 3НSb 5O3 5NO Н2О
Висмут же в концентрированной НNО3 пассивируется, а с разбавленной дает нитрат, т. е. ведет себя как металл:
Вio 4HNO3 = Вi 3(NO3)3 NО 2Н2О
Для получения мышьяка, сурьмы и висмута их природные сульфиды обжигают; образующиеся при этом оксиды восстанавливают углем:
2Э2S3 9O2 = 6SO2 2Э2O3
Э2O3 3С = 2Э 3СО
Мышьяк, сурьма и висмут существенно отличаются по структуре от типичных металлов и поэтому с металлами твердые растворы обычно не образуют. Более характерно возникновение эвтектических смесей. Так, сплав состава 60% Вi и 40% Сd плавится при 144 °С. Широко применяемый сплав Вуда, температура плавления которого 65 – 70 °С, т. е. ниже точки кипения воды, содержит 50 % Вi, 25 % Рb, 12,5 % Sn и 12,5 % Сd. Сплав состава 41 % Вi, 22 % Рb, 11 % Sn, 8 % Сd и I8 % In плавится лишь при 47 °С. Сплавы висмута эвтектического состава применяются в автоматических огнетушителях и в качестве припоев.
Мышьяк и сурьма используются главным образом в качестве добавки к свинцу для придания ему повышенной твердости. Важное значение имеет типографский сплав, содержащий 25 % Sb, 60% Рb и 15% Sn.
Соединения со степенью окисления мышьяка, сурьмы и висмута—3. В качестве солеподобных соединений, в которых мышьяк, сурьма и висмут проявляют степень окисления —3, можно рассматривать арсениды, стибиды (антимониды) и висмутиды s-элементов I и II групп (К3Э, Са3Э2, Мg3Э2 и др.). В большинстве же других случаев при взаимодействии металлов с мышьяком, сурьмой и висмутом образуются соединения металлического типа. Стибиды и арсениды р-элементов и элементов подгруппы цинка — полупроводники. В ряду однотипных нитридов, фосфидов, арсенидов, стибидов и висмутидов ширина запрещенной зоны уменьшается, что свидетельствует об увеличении доли нелокализованной связи. Например:
АlN АlР АlAs АlSb
DЕ, эВ ……………3,8 3,0 2,16 1,6
Большинство арсенидов, стибидов и висмутидов довольно легко разлагается кислотами.
Ослабление признаков неметаллических элементов в ряду Аs—Sb—Вi проявляется также в их соединениях с водородом Н3Э. Строение молекул Н3Э аналогично строению Н3N и H3Р. Но по мере увеличения размеров электронных облаков в ряду N—Р—As—Sb—Вi полярность и прочность связи Э — Н уменьшается. По этой же причине несвязывающее двухэлектронное облако становится пространственно менее направленным, значение валентного угла — ÐНЭН приближается к 90о и наблюдается уменьшение электрического момента диполя молекул. В обычных условиях Н3Аs (арсин), Н3Sb (стибин) и ВiН3 (висмутин) — газообразные вещества с резким запахом. Арсин, стибин и особенно висмутин сильно эндотермичны. При нагревании они довольно легко распадаются с образованием на стенках сосуда черного осадка с металлическим блеском (простые вещества Аs, Sb, Вi). В ряду Н3Аs—Н3Sb—ВiН3 устойчивость падает, вследствие чего висмутин недостаточно изучен. Все они сильные восстановители.
Образуются Н3Э действием разбавленных кислот на арсениды, стибиды и висмутиды:
Мg3Э2 6НСl = 3МgСl2 2Н3Э
а также действием цинка на подкисленные растворы соединений:
Аs2O3 6Zn I2НСl = 2Н3Аs 6ZnСl2 3Н2O
Арсин (в меньшей степени стибин и висмутин) очень токсичен. Поскольку цинк почти всегда содержит небольшие количества мышьяка, опасно вдыхать водород, выделяющийся при действии кислот на цинк.
В ряду Н3N—Н3Р—Н3Аs—Н3Sb—ВiН3 электронодонорные свойства молекул ослабевают. Так, если производные аммония вполне устойчивы, то арсоний-ион АsН5 обнаружен лишь с помощью ИК-спектра (в смеси Н3Аs и НI при низкой температуре). Ионы SbH4 и ВiН4 вообще не обнаружены.
В молекулах арсина и стибина связь почти неполярна и в зависимости от условий характер поляризации атомов Аs и Sb может изменяться. Поэтому для Н3Аs и Н3Sb характерен ряд свойств гидридов, т. е. производных Аs (III) и Sb (III). В частности, при взаимодействии арсина с растворами щелочей выделяется водород.
Соединении мышьяка (III), сурьмы (III) и висмута (III). В степени окисления 3 атомы Аs, Sb и Вi сохраняют несвязывающую электронную пару; имеют координационные числа 3, 4, 5 и 6. Этим координационным числам отвечают структурные единицы в виде тригональной пирамиды искаженного тетраэдра, тетрагональной пирамиды, искаженного октаэдра соответственно.
Степень окисления 3 у мышьяка и его аналогов проявляется в галогенидах ЭНаl3, оксидах Э2О3, сульфидах Э2S3. Бинарные соединения и гидроксиды Э(III) амфотерны.
В ряду однотипных соединений Аs (III) — Sb (III) — Вi (III) кислотные признаки ослабевают и нарастают основные.
Оксиды Э2О3 получают прямым взаимодействием простых веществ, Sb2О3 также окислением сурьмы разбавленной НNО3, а Вi2О3 — термическим разложением Вi(NO3)3.
Структура оксидов в при переходе от Аs (III) к Вi (III) существенно изменяется. Кристаллы низкотемпературных модификаций Аs2О3 и Sb2O3 имеют, как и Р2O3, молекулярную решетку, построенную из молекул Э4O6. Последние состоят из четырех объединенных друг с другом пирамид ЭO3. В высокотемпературной модификации Sb2O3 пирамиды SbO3 связаны в бесконечные сдвоенные цепи:
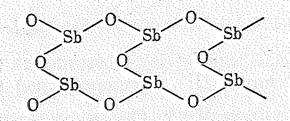
Оксид висмута (III) Вi2O3 имеет координационную решетку с искаженной октаэдро-тетраэдрической координацией атомов. Различие в структуре, естественно, сказывается на свойствах оксидов.
Аs2O3 (белый мышьяк) — преимущественно кислотный оксид. Он растворяется в воде и щелочах, но в отличие от Р2О3 взаимодействует также с галогеноводородными кислотами:
Аs2O3 Н2О = 2Н3АsO3
Аs2O3 8НCl = 2HAsCl4 H2O
Sb2O3 в воде практически не растворяется, но взаимодействует со щелочами, а также с соляной кислотой.
Взаимодействие Аs2O3 с растворами щелочей приводит к образованию соответственно гидроксоарсенатов (III) (гидроксоарсенитов) и гидроксостибатов (III) (гидроксоантимонитов):
Э2О3 2КОН 3Н2О = 2К[Э(ОН)4]
Наоборот, Вi2О3 легко взаимодействует с кислотами, образуя разнообразные соли Вi (III), в воде не растворяется, со щелочами практически не реагирует.
Аналогично изменяются свойства и в ряду гидроксидов. В отличие от Н3РО3 гидроксиды Аs(ОН)3 и Sb(ОН)3 амфотерны: у первого преобладают кислотные свойства, у второго — основные. При этом и кислотная, и основная ионизации Э(ОН)3 в растворе выражены слабо.
В свободном состоянии Аs(ОН)3 не выделен, в водном растворе ведет себя как слабая кислота Н3АsО3, называемая мышьяковистой.
Гидроксиды Sb (III) и Вi (III) в воде практически не растворяются. Они получаются в виде белых осадков переменного состава Э2O3×nН2О при действии щелочей на катионные производные Э (III):
Bi(NO3)3 3KOH = Bi(OH)3¯ 3KNO3
или кислот на анионные производные Э (III):
Nа[Sb(ОН)4] НСl = NаСI Sb(ОН)3¯ Н2О
При сплавлении Э2O3 или Э(ОН)3 со щелочами обычно образуются полимерные метаарсенаты (III) (метаарсениты) и метастибаты (III) (метаантимониты) состава М 1ЭО2.
Оксовисмутаты (III) неустойчивы.
Ослабление кислотных признаков проявляется также в ряду сульфидов Э2S3. Желтый Аs2S3, оранжевый Sb2S3 и черно-бурый Вi2S3 твердые вещества, нерастворимые в воде.
Сульфиды образуются непосредственным взаимодействием простых веществ или действием сероводорода на растворимые соединения Э (III) в кислой среде:
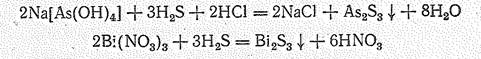
Сульфиды Аs (III) и Sb (III) — преимущественно кислотные соединения. Они легко растворяются в присутствии основных сульфидов с образованием сульфидоарсенатов (III) и сульфидостибатов (III) типа М 1ЭS2 и М 13ЭS3:
Э2S3 (NH4)2S = 2NH4ЭS2
Растворяются As2S3 и Sb2S3 и в щелочах.
Сульфид висмута (III) Вi2S3 кислотные свойства в растворах не проявляет, с основными сульфидами взаимодействует лишь при сплавлении.
Соединения Э2S3 характеризуются сравнительно небольшими значениями энергий Гиббса образования; довольно легко переходят в Э2О3, ЭF3 и ЭСl3 при окислении кислородом, фтором и хлором, например:
2Sb2S3 9O2 = 2Sb2O3 6SO2
В отличие от Аs2S3 сульфиды Sb (III) и Вi (III) растворяются в концентрированной соляной кислоте:
Sb2S3 8НСI « 2НSbСl4 3Н2S
Тригалогениды элементов подгруппы мышьяка ЭНаl3 получают взаимодействием простых веществ при недостатке галогена. У большинства тригалидов элементов подгруппы мышьяка кристаллические решетки молекулярны. Температура плавления трифторида висмута, имеющего координационную решетку, наиболее высокая (730 °С).
Подобно Э2О3 и Э2S3, галогениды Аs (III) — кислотные соединения, галогениды Sb (III) и Вi (III) проявляют также свойства солей.
При гидролизе АsНаl3 образуются кислоты. Однако в отличие от РНаl3 гидролиз АsНаl3 обратим:
АsСl3 4Н2O = Н[Аs(ОН)4] 3НСl
Гидролитическое разложение галогенидов Sb (III) и Вi (III) также преобладает над их электролитической диссоциацией. Гидролиз протекает энергично до оксогалогенидов, например:
SbСl3 Н2O « SbОСl 2НСl
Оксогалогениды Sb (III) и Вi (III) состава ЭОНаl в обычных условиях – твердые, нерастворимые в воде вещества с координационнослоистой решеткой, структурно совершенно отличные от аналогичных соединений фосфора (III) и мышьяка (III).
Ослабление неметаллических свойств в ряду Аs – Sb – Вi проявляется также в изменении устойчивости солей и солеподобных соединений Э (III). Последние для Аs (III) неустойчивы и в свободном состоянии не выделены, а для Sb (III) известны сульфат Sb2(SO4)3, нитрат Sb(NО3)3 и некоторые другие. В воде эти соединения энергично разлагаются. Относительно устойчивы комплексные стибаты (III) s-элементов I группы, например сульфатостибаты (III) М 1[Sb(SO4)2].
Соли Вi (I1I) весьма разнообразны и устойчивы. Кислотные признаки у них проявляются в характере гидролиза (который у них преобладает над электролитической диссоциацией)
Вi(NО3)3 Н2O « ВiОNО3 2НNO3
и в способности образовывать производные типа M 1[Вi(SО4)2], М 1[Вi(NО3)4].
Соединения Аs (IП) довольно легко окисляются. Так, Аs2S3 окисляется персульфидом аммония:
Аs2S3 2(NН4)2S2 = 2NН4ЭS2
а Аs2О3 – азотной кислотой:
Аs2O3 4HNO3 7H2O = 6H3AsO4 4NO
У производных Sb (III) восстановительная активность проявляется в меньшей степени, однако Sb2S3 также окисляется персульфидом аммония. Окисление же соединений Вi (ПI) возможно лишь наиболее сильными окислителями в сильнощелочной среде, например:
ВiСl3 Сl2 6КОН = КВiО3 5КСl 3Н2O
Соединения мышьяка (V), сурьмы (V) и висмута (V). В ряду Аs (V) – Sb (V) – Вi (V) устойчивость соединений в целом падает. При рассмотрении подгрупп брома и селена было показано, что высшая степень окисления в этих подгруппах наиболее характерна для р-элементов 5-го периода, т. е. для I и Те. Наименее устойчива высшая степень окисления для р-элементов 6-го периода, т. е. для Аt и Ро. Подобная закономерность, хотя и выраженная — менее отчетливо, проявляется и в подгруппе мышьяка; степень окисления 5 наиболее характерна для Sb, менее характерна для Аs и неустойчива у Вi.
Для висмута (V) получен лишь фторид ВiF5, для мышьяка (V) и сурьмы (V), кроме того, известны оксиды Э2О5, сульфиды Э2S5, а для сурьмы (V) — еще и хлорид SbСl5:
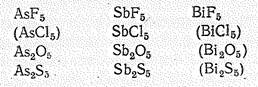
По химической природе бинарные соединения мышьяка (V) и его аналогов кислотные. Им соответствуют анионные комплексы, простейшие из которых ЭНаl6—, ЭО43-, Э(ОН)6—.
Оксиды Э2O5 в обычных условиях твердые вещества. По структуре и свойствам Аs2O5 напоминает Р2O5, довольно хорошо растворяется в воде:
Аs2O5 3Н2O = 2Н3АsО4
Sb2O5 (желтого цвета) в воде растворим мало, лучше в щелочных растворах:
Sb2O5 2КОН 5Н2О = 2К[Sb (ОН)6]
Оксоарсенаты (V) и оксостибаты (V), образующиеся при сплавлении Аs2O5 и Sb2О5 со щелочами и оксидами металлов, в большинстве полимерны.
Структура оксоарсенатов обычно подобна структуре оксофосфатов (V).
Чаще всего полимерные висмутаты отвечают составу М 1ВiО3.
Из растворов обычно выделяются тетраоксоарсенаты типа М 13АsО4 и гексагидроксостибаты типа М 1[Sb(ОН)6]. Подобно фосфатам арсенаты, стибаты и висмутаты, как правило, трудно растворимы в воде.
Из соответствующих соединений водорода в свободном состоянии получен лишь оксоарсенат (V) водорода Н3АsО4 (мышьяковая кислота) — твердое, растворимое в воде вещество, Н3АsО4 получают окислением Аs или Аs2О3 азотной кислотой. Мышьяковая кислота (К1 = 6×10-3) слабее фосфорной. При попытке получения сурьмяных кислот образуется осадок неопределенного состава Sb2O5×nН2О. Не выделены в свободном состоянии и висмутовые кислоты.
Сульфиды Э2S5 во многом напоминают оксиды Э2O3. Желтый Аs2S5 и оранжевый Sb2S5 с водой не взаимодействуют; будучи кислотными соединениями, они растворяются в присутствии основных сульфидов и при действии щелочей:
Э2S5 3Nа2S = 2Nа3ЭS4
Сульфиды Э2S5 можно получить либо взаимодействием простых веществ, либо осаждением при действии Н2S на производные Э(V) в кислой среде:
2Nа3АsО4 (р) 5Н2S (р) 6НСl (р) = Аs2S5 (т) 6NаС1 (р) 8Н2O (ж)
Соответствующие сульфидоарсенаты (V) и сульфидостибаты (V) (тиоанатимонаты) водорода в свободном состоянии неустойчивы.
Молекулы пентагалогенидов ЭНаl5, как и РНаl5, имеют форму тригональной бипирамиды.
В обычных условиях АsF5 — газ (Тпл. —80 °С, Ткип. —53 °С), а SbF5 (Тпл. 8 °С, Ткип. 142 °С) и SbСl (Тпл. 30 oС, Ткип. 140 оС) – жидкости; ВiF5 — твердое вещество (Тпл. 151 oС, Ткип. 230 °С). Резкое повышение точек плавления и кипения при переходе от АsF5 и SbF5 обусловливается ассоциацией молекул SbF5 в полимерные цепи, образованные октаэдрическими структурными единицами SbF6 (—SbF4 — F — SbF4 — F —). Пентагалиды типичные кислотные соединения. При взаимодействии с водой ЭНаl5 дают кислоты, с основными галогенидами образуют галогеноарсенаты (V) и галогеностибаты (V):
КF ЭF5 = К[ЭF6]
Пентафториды ЭF5—очень сильные акцепторы фторид-иона; при взаимодействии с ЭF5 основные свойства проявляют даже такие соединения, как НF, O2F2, N2F4, СlF5.
Производные типа М[ЭOF4] образованы полимерными анионами в виде цепи октаэдрических структурных единиц:
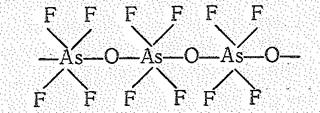
Соединения висмута (V) сильные окислители. Они, например, переводят Мn (II) в Мn (VII):
2Мn2 5ВiО3— 14Н = 5Вi3 2МnО4— 7Н2O
Производные сурьмы (V) окислительные свойства проявляют в меньшей степени, однако Sb2O5 может окислять концентрированную соляную кислоту по обратимой реакции:
Sb2O5 I0НСl « 2SbСl3 2Сl2 5Н2O
Применение соединений мышьяка, сурьмы и висмута весьма разнообразно. Так, производные Аs в сельском хозяйстве служат одним из основных средств борьбы с вредителями культурных растений. Например, Nа3АsО4, Са3(АsО4)2, Са(AsO2)2, и другие применяются как инсектициды. Важное применение соединения мышьяка (Аs2O3, КАsО2, органические производные) находят в медицине. Лекарства на их основе рекомендуют при малокровии, истощении, используют в стоматологической практике. Производные Аs, Sb и Bi нашли применение также в производстве керамики и в других областях.
Соединения сурьмы, висмута и в особенности мышьяка ядовиты.
Таблица степеней окисления химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Степень окисления |
| 1 | Водород | H | 1, 0, -1 |
| 2 | Гелий | He | 0 |
| 3 | Литий | Li | 1 |
| 4 | Бериллий | Be | 0, 1, 2 |
| 5 | Бор | B | -1, 0, 1, 2, 3 |
| 6 | Углерод | C | -4 , -3 , -2 , -1 , 0 , 1, 2, 3, 4 |
| 7 | Азот | N | -3 , -2, -1, 0, 1, 2, 3 , 4, 5 |
| 8 | Кислород | O | -2, -1, -0,5, 0, 1, 2 |
| 9 | Фтор | F | -1, 0 |
| 10 | Неон | Ne | 0 |
| 11 | Натрий | Na | -1, 0, 1 |
| 12 | Магний | Mg | 0, 2 |
| 13 | Алюминий | Al | 0, 1, 2, 3 |
| 14 | Кремний | Si | -4 , -3, -2, -1, 0, 1, 2, 3, 4 |
| 15 | Фосфор | P | -3 , -2, -1, 0, 1, 2, 3 , 4, 5 |
| 16 | Сера | S | -2 , -1, 0 , 1 , 2 , 3, 4 , 5, 6 |
| 17 | Хлор | Cl | -1 , 0, 1 , 2, 3 , 4, 5 , 6, 7 |
| 18 | Аргон | Ar | 0 |
| 19 | Калий | K | 0, 1 |
| 20 | Кальций | Ca | 0, 2 |
| 21 | Скандий | Sc | 0, 1, 2, 3 |
| 22 | Титан | Ti | -2, -1, 0, 1, 2, 3, 4 |
| 23 | Ванадий | V | -3, -1, 0, 1, 2, 3, 4, 5 |
| 24 | Хром | Cr | -4, -2, -1, 0, 1, 2 , 3 , 4, 5, 6 |
| 25 | Марганец | Mn | -3, -2, -1, 0, 1, 2 , 3, 4 , 5, 6, 7 |
| 26 | Железо | Fe | -4, -2, -1, 0, 1, 2 , 3 , 4, 5, 6 , 7 |
| 27 | Кобальт | Co | -3, -1, 0, 1, 2 , 3 , 4, 5 |
| 28 | Никель | Ni | -2, -1, 0, 1, 2 , 3, 4 |
| 29 | Медь | Cu | -2, 0, 1, 2 , 3, 4 |
| 30 | Цинк | Zn | -2, 0, 1, 2 |
| 31 | Галлий | Ga | -5, -4, -3, -2, -1, 1, 2, 3 |
| 32 | Германий | Ge | -4 -3, -2, -1, 0, 1, 2 , 3, 4 |
| 33 | Мышьяк | As | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
| 34 | Селен | Se | -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 35 | Бром | Br | -1, 0, 1, 3, 4, 5, 7 |
Таблица степеней окисления химических элементов (2 часть):
| 36 | Криптон | Kr | 0, 1, 2 |
| 37 | Рубидий | Rb | -1, 0, 1 |
| 38 | Стронций | Sr | 0, 1, 2 |
| 39 | Иттрий | Y | 0, 1, 2, 3 |
| 40 | Цирконий | Zr | -2, 0, 1, 2, 3, 4 |
| 41 | Ниобий | Nb | -3, -1, 0, 1, 2, 3, 4, 5 |
| 42 | Молибден | Mo | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 43 | Технеций | Tc | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 44 | Рутений | Ru | -4, -2, 0, 1, 2, 3, 4, 5, 6, 7, 8 |
| 45 | Родий | Rh | -3, -1, 0, 1, 2, 3, 4, 5, 6 |
| 46 | Палладий | Pd | 0, 1, 2, 3, 4, 5, 6 |
| 47 | Серебро | Ag | -2, -1, 1, 2, 3 |
| 48 | Кадмий | Cd | -2, 1, 2 |
| 49 | Индий | In | -5, -2, -1, 1, 2, 3 |
| 50 | Олово | Sn | -4, -3, -2, -1, 0, 1, 2, 3, 4 |
| 51 | Сурьма | Sb | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
| 52 | Теллур | Te | 2, -1, 1, 2, 3, 4, 5, 6 |
| 53 | Йод | I | -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 54 | Ксенон | Xe | 0, 1, 2, 4, 6, 8 |
| 55 | Цезий | Cs | -1, 1 |
| 56 | Барий | Ba | 1, 2 |
| 57 | Лантан | La | 0, 1, 2, 3 |
| 58 | Церий | Ce | 1, 2, 3, 4 |
| 59 | Празеодим | Pr | 0, 1, 2, 3, 4, 5 |
| 60 | Неодим | Nd | 0, 2, 3, 4 |
| 61 | Прометий | Pm | 2, 3 |
| 62 | Самарий | Sm | 0, 2, 3 |
| 63 | Европий | Eu | 1, 2, 3 |
| 64 | Гадолиний | Gd | 0, 1, 2, 3 |
| 65 | Тербий | Tb | 0, 1, 2, 3, 4 |
| 66 | Диспрозий | Dy | 0, 1, 2, 3, 4 |
| 67 | Гольмий | Ho | 0, 1, 2, 3 |
| 68 | Эрбий | Er | 0, 1, 2, 3 |
| 69 | Тулий | Tm | 2, 3 |
| 70 | Иттербий | Yb | 1, 2, 3 |
Таблица степеней окисления химических элементов (3 часть):
| 71 | Лютеций | Lu | 0, 1, 2, 3 |
| 72 | Гафний | Hf | -2, 0, 1, 2, 3, 4 |
| 73 | Тантал | Ta | -3, -1, 1, 2, 3, 4, 5 |
| 74 | Вольфрам | W | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 75 | Рений | Re | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 76 | Осмий | Os | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6, 7, 8 |
| 77 | Иридий | Ir | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 |
| 78 | Платина | Pt | -3, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 79 | Золото | Au | -3, -2, -1, 0, 1, 2, 3, 5 |
| 80 | Ртуть | Hg | -2, 1, 2 |
| 81 | Таллий | Tl | -5, -2, -1, 1, 2, 3 |
| 82 | Свинец | Pb | -4, -2, -1, 0, 1, 2, 3, 4-4, -2, -1, 0, 1, 2, 3, 4 |
| 83 | Висмут | Bi | -3, -2, -1, 1, 2, 3, 4, 5 |
| 84 | Полоний | Po | -2, 2, 4, 5, 6 |
| 85 | Астат | At | -1, 1, 3, 5, 7 |
| 86 | Радон | Rn | 0, 2, 6, 8 |
| 87 | Франций | Fr | 0, 1 |
| 88 | Радий | Ra | 2 |
| 89 | Актиний | Ac | 3 |
| 90 | Торий | Th | 1, 2, 3, 4 |
| 91 | Протактиний | Pa | 2, 3, 4, 5 |
| 92 | Уран | U | 1, 2, 3, 4, 5, 6 |
| 93 | Нептуний | Np | 2, 3, 4, 5, 6, 7 |
| 94 | Плутоний | Pu | 2, 3, 4, 5, 6, 7 |
| 95 | Америций | Am | 2, 3, 4, 5, 6, 7 |
| 96 | Кюрий | Cm | 3, 4, 5, 6 |
| 97 | Берклий | Bk | 2, 3, 4, 5 |
| 98 | Калифорний | Cf | 2, 3, 4, 5 |
| 99 | Эйнштейний | Es | 2, 3, 4 |
| 100 | Фермий | Fm | 2, 3 |
| 101 | Менделевий | Md | 2, 3 |
| 102 | Нобелий | No | 2, 3 |
| 103 | Лоуренсий | Lr | 3 |
| 104 | Резерфордий (Курчатовий) | Rf | 2, 3, 4 – предположительно |
| 105 | Дубний (Нильсборий) | Db | 3, 4, 5 – предположительно |
| 106 | Сиборгий | Sg | 0, 3, 4, 5, 6 – предположительно |
| 107 | Борий | Bh | 3, 4, 5, 7 – предположительно |
| 108 | Хассий | Hs | 2, 3, 4, 6, 8 – предположительно |
| 109 | Мейтнерий | Mt | 1, 3, 4, 6, 8, 9 – предположительно |
| 110 | Дармштадтий | Ds | 0, 2, 4, 6, 8 – предположительно |
Коэффициент востребованности 2 898
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na 1I-1, Mg 2Cl-12, Al 3F-13, Zr 4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно ( 1) и ( 2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, ( 2), ( 4), ( 6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
1 | Водород / Hydrogen | H | ( 1), (-1) |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | ( 1) |
4 | Бериллий / Beryllium | Be | ( 2) |
5 | Бор / Boron | B | (-1), 0, ( 1), ( 2), ( 3) |
6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, ( 2), ( 4) |
7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, ( 1), ( 2), ( 3), ( 4), ( 5) |
8 | Кислород / Oxygen | O | (-2), (-1), 0, ( 1), ( 2) |
9 | Фтор / Fluorine | F | (-1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | ( 1) |
12 | Магний / Magnesium | Mg | ( 2) |
13 | Алюминий / Aluminum | Al | ( 3) |
14 | Кремний / Silicon | Si | (-4), 0, ( 2), ( 4) |
15 | Фосфор / Phosphorus | P | (-3), 0, ( 3), ( 5) |
16 | Сера / Sulfur | S | (-2), 0, ( 4), ( 6) |
17 | Хлор / Chlorine | Cl | (-1), 0, ( 1), ( 3), ( 5), ( 7), редко ( 2) и ( 4) |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | ( 1) |
20 | Кальций / Calcium | Ca | ( 2) |
21 | Скандий / Scandium | Sc | ( 3) |
22 | Титан / Titanium | Ti | ( 2), ( 3), ( 4) |
23 | Ванадий / Vanadium | V | ( 2), ( 3), ( 4), ( 5) |
24 | Хром / Chromium | Cr | ( 2), ( 3), ( 6) |
25 | Марганец / Manganese | Mn | ( 2), ( 3), ( 4), ( 6), ( 7) |
26 | Железо / Iron | Fe | ( 2), ( 3), редко ( 4) и ( 6) |
27 | Кобальт / Cobalt | Co | ( 2), ( 3), редко ( 4) |
28 | Никель / Nickel | Ni | ( 2), редко ( 1), ( 3) и ( 4) |
29 | Медь / Copper | Cu | 1, 2, редко ( 3) |
30 | Цинк / Zinc | Zn | ( 2) |
31 | Галлий / Gallium | Ga | ( 3), редко ( 2) |
32 | Германий / Germanium | Ge | (-4), ( 2), ( 4) |
33 | Мышьяк / Arsenic | As | (-3), ( 3), ( 5), редко ( 2) |
34 | Селен / Selenium | Se | (-2), ( 4), ( 6), редко ( 2) |
35 | Бром / Bromine | Br | (-1), ( 1), ( 5), редко ( 3), ( 4) |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | ( 1) |
38 | Стронций / Strontium | Sr | ( 2) |
39 | Иттрий / Yttrium | Y | ( 3) |
40 | Цирконий / Zirconium | Zr | ( 4), редко ( 2) и ( 3) |
41 | Ниобий / Niobium | Nb | ( 3), ( 5), редко ( 2) и ( 4) |
42 | Молибден / Molybdenum | Mo | ( 3), ( 6), редко ( 2), ( 3) и ( 5) |
43 | Технеций / Technetium | Tc | ( 6) |
44 | Рутений / Ruthenium | Ru | ( 3), ( 4), ( 8), редко ( 2), ( 6) и ( 7) |
45 | Родий / Rhodium | Rh | ( 4), редко ( 2), ( 3) и ( 6) |
46 | Палладий / Palladium | Pd | ( 2), ( 4), редко ( 6) |
47 | Серебро / Silver | Ag | ( 1), редко ( 2) и ( 3) |
48 | Кадмий / Cadmium | Cd | ( 2), редко ( 1) |
49 | Индий / Indium | In | ( 3), редко ( 1) и ( 2) |
50 | Олово / Tin | Sn | ( 2), ( 4) |
51 | Сурьма / Antimony | Sb | (-3), ( 3), ( 5), редко ( 4) |
52 | Теллур / Tellurium | Te | (-2), ( 4), ( 6), редко ( 2) |
53 | Иод / Iodine | I | (-1), ( 1), ( 5), ( 7), редко ( 3), ( 4) |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | ( 1) |
56 | Барий / Barium | BA | ( 2) |
57 | Лантан / Lanthanum | La | ( 3) |
58 | Церий / Cerium | Ce | ( 3), ( 4) |
59 | Празеодим / Praseodymium | Pr | ( 3) |
60 | Неодим / Neodymium | Nd | ( 3), ( 4) |
61 | Прометий / Promethium | Pm | ( 3) |
62 | Самарий / Samarium | Sm | ( 3), редко ( 2) |
63 | Европий / Europium | Eu | ( 3), редко ( 2) |
64 | Гадолиний / Gadolinium | Gd | ( 3) |
65 | Тербий / Terbium | Tb | ( 3), ( 4) |
66 | Диспрозий / Dysprosium | Dy | ( 3) |
67 | Гольмий / Holmium | Ho | ( 3) |
68 | Эрбий / Erbium | Er | ( 3) |
69 | Тулий / Thulium | Tm | ( 3), редко ( 2) |
70 | Иттербий / Ytterbium | Ib | ( 3), редко ( 2) |
71 | Лютеций / Lutetium | Lu | ( 3) |
72 | Гафний / Hafnium | Hf | ( 4) |
73 | Тантал / Tantalum | Ta | ( 5), редко ( 3), ( 4) |
74 | Вольфрам / Tungsten | W | ( 6), редко ( 2), ( 3), ( 4) и ( 5) |
75 | Рений / Rhenium | Re | ( 2), ( 4), ( 6), ( 7), редко (-1), ( 1), ( 3), ( 5) |
76 | Осмий / Osmium | Os | ( 3), ( 4), ( 6), ( 8), редко ( 2) |
77 | Иридий / Iridium | Ir | ( 3), ( 4), ( 6), редко ( 1) и ( 2) |
78 | Платина / Platinum | Pt | ( 2), ( 4), ( 6), редко ( 1) и ( 3) |
79 | Золото / Gold | Au | ( 1), ( 3), редко ( 2) |
80 | Ртуть / Mercury | Hg | ( 1), ( 2) |
81 | Талий / Thallium | Tl | ( 1), ( 3), редко ( 2) |
82 | Свинец / Lead | Pb | ( 2), ( 4) |
83 | Висмут / Bismuth | Bi | ( 3), редко ( 3), ( 2), ( 4) и ( 5) |
84 | Полоний / Polonium | Po | ( 2), ( 4), редко (-2) и ( 6) |
85 | Астат / Astatine | At | — |
86 | Радон / Radon | Ra | 0 |
87 | Франций / Francium | Fr | — |
88 | Радий / Radium | Ra | ( 2) |
89 | Актиний / Actinium | Ac | ( 3) |
90 | Торий / Thorium | Th | ( 4) |
91 | Проактиний / Protactinium | Pa | ( 5) |
92 | Уран / Uranium | U | ( 3), ( 4), ( 6), редко ( 2) и ( 5) |

