Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 8KClO3 6NaOH = 6NaNO3 8KCl 12H2O
10NH3 6KMnO4 9H2SO4 = 5N2 6MnSO4 3K2SO4 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
NH3 HCl = NH4Cl
NH3 H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
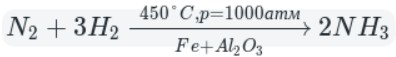
Лабораторный способ:
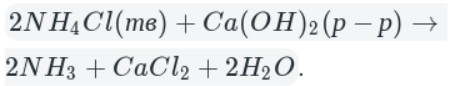
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Аммиак (нитрид водорода)
В случае возгорания в окрестностях разрешены все средства пожаротушения.Провести эвакуацию из опасной зоны!
В случае пожара: охлаждать баллоны, обливая их водой.
НИКОГДА не направлять струю воды на жидкость. Проконсультироваться со специалистом! Вентиляция. Удалить газ, используя мелкие брызги воды. Держаться с наветренной стороны. Пары осаждать тонкораспыленной водой. Не прекращать горения при наличии утечки.
Непосредственно на месте аварии и вблизи источника заражения работы проводят в изолирующих противогазах ИП-4М, ИП-5 (на химически связанном кислороде) или дыхательных аппаратах АСВ-2, ДАСВ (на сжатом воздухе), КИП-8, КИП-9 (на сжатом кислороде) и средствах защиты кожи (Л-1, КИХ-4, КИХ-5 и др.).На расстоянии более 250 метров от очага средства защиты кожи можно не использовать, а для защиты органов дыхания используют промышленные противогазы с коробками марок КД, Г, М, ВК, а также гражданские противогазы ГП-5, ГП-7, ПДФ-2Д, ПДФ-2Ш в комплекте с дополнительным патроном ДПГ-3. При концентрациях менее 20 мг/м3 можно использовать респиратор РПГ-67 с патронами КД или ВК.
Нейтрализуют аммиак следующими растворами:
– 10%-ным раствором соляной или серной кислоты, для чего 1 часть концентрированной кислоты смешивают с 9 частями воды (например, 10 литров кислоты 90 литров воды);
– 2%-ным раствором сернокислого аммония, для чего 2 части сернокислого аммония разводят в 98 частях воды (например, 2 кг сернокислого аммония 98 литров воды).
При утечке газообразного аммиака для погашения паров распыляют воду. Норма расхода воды не нормируется.
При разливе жидкого аммиака место разлива ограждают земляным валом, заливают раствором соляной или серной кислоты, либо водой. Для обезвреживания 1 тонны жидкого аммиака необходимо 10-15 тонн раствора соляной (серной) кислоты или 18-20 тонн воды. Для нейтрализации 1 тонны жидкого аммиака необходимо 20-30 тонн раствора соляной (серной) кислоты. Нейтрализацию жидкого аммиака водой желательно не проводить, потому что в воздухе могут образовываться высокие концентрации аммиака, что небезопасно, так как 15-28 объёмных процентов аммиака с воздухом образует взрывоопасные смеси.
Для распыления воды или растворов применяют поливомоечные и пожарные машины, авторазливочные станции (АЦ, ПМ-130, АРС-14, АРС-15), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
Аммиак, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Необычные свойства жидкого аммиака
И внешне жидкий аммиак похож на простую воду. Сходство этим не ограничивается. Практически важно, что, как и вода, аммиак — прекрасный растворитель многих неорганических и органических соединений. В нем, в частности, легко растворяются многие соли, и как в водных растворах, растворяясь, диссоциируют на ионы. Конечно, катионы металлов в таких растворах сольватированы молекулами аммиака.
В то же время многие реакции с участием солей идут в жидком аммиаке совсем не так, как в воде. Прежде всего, потому, что разные соли по-разному растворяются в аммиаке и в воде (см. таблицу):

Из этих данных следует, например, что в жидком аммиаке ничего не стоит провести некоторые обменные реакции, немыслимые в водных растворах:
Ba(NO3)2 2AgCl = BaCl2 2AgNO3.
Молекула NH3 — сильный акцептор протонов. Поэтому, если растворить в аммиаке уксусную кислоту, то эта обычно слабая кислота продиссоциирует нацело, проявив тем самым свойства кислоты сильной. В жидком аммиаке по сравнению с водными растворами значительно усиливаются и кислотные свойства солей аммония. Здесь легко идут такие, к примеру, реакции
2NH4NO3 Mg = Mg(NO3)2 2NH3 H2 или Na2O2 2NH4NO3 = 2NaNO3 H2O2 2NH3.
Из растворов различных веществ в жидком аммиаке наиболее интересны, без сомнения растворы щелочных металлов. Впервые аммиачные растворы натрия и калия были приготовлены больше века назад (в 1864 г.) и сразу же обратили на себя внимание химиков. Они прежде всего установили, что если дать аммиаку спокойно испариться, в осадке останется чистый металл, как это бывает с растворами солей в воде. Однако эта аналогия не совсем точна: щелочные металлы, хотя и медленно, с аммиаком все же реагируют с выделением водорода и образованием солеобразных амидов:
2К 2NH3 = 2KNH2 H2.
Амиды — вполне устойчивые соединения, но водой немедленно разлагаются:
KNH2 H2O= NH3 KOH.
Тогда же выяснилось, что при растворении металла в жидком аммиаке объем раствора увеличивается. При этом с ростом концентрации металла непрерывно снижается плотность раствора, чего не бывает у водных растворов твердых веществ. Концентрированный раствор лития в жидком аммиаке — вообще самая легкая при обычных условиях жидкость: ее плотность при 20°С составляет всего 0,48 г/см3; она вдвое легче воды, легче спирта, бензина, эфира…
Вообще свойства растворов щелочных металлов в жидком аммиаке сильно зависят от концентрации. В разбавленных растворах находятся катионы металла и самые легкие анионы — электроны, которые, однако, не могут свободно передвигаться, так как они связаны с молекулами аммиака. Именно такие связанные (сольватированные) электроны придают растворам щелочных металлов в жидком аммиаке красивый синий цвет. Сольватированные электроны можно получить и в водном растворе, но при обычных условиях время их жизни в воде чрезвычайно мало. В аммиаке — куда больше.
Сильно разбавленные аммиачные растворы плохо проводят электрический ток. Но с ростом концентрации растворенного металла несвязанных электронов становится в растворе все больше — электропроводность очень сильно повышается, иногда в триллионы раз, от 10-8 (что типично для диэлектриков) до 104 Ом-1см-1 (что приближается уже к электропроводности металлов). Вообще разбавленные растворы щелочных металлов в жидком аммиаке настолько отличаются от концентрированных, что трудно поверить, что это раствор одного и того же вещества в одном и том же растворителе. Разбавленный и концентрированный растворы одного и того же щелочного металла в жидком аммиаке не смешиваются друг с другом! Для водных растворов это — редкое явление.
Растворы с концентрацией более 3 моль/л называют иногда жидкими металлами, поскольку им присущ отчетливый металлический блеск с золотисто-бронзовым отливом. Это свойство сохраняется и когда раствор замораживают. Кстати, и здесь литию принадлежит своеобразный рекорд: его концентрированный раствор в жидком аммиаке — самый легкоплавкий «жидкий металл», он замерзает лишь при температуре ожижения кислорода -183°С.
Много ли металла может растворить жидкий аммиак? Это зависит в основном от температуры. При температуре кипения моль аммиака способен растворить примерно 0,15 моль щелочного металла. С ростом температуры растворимость быстро увеличивается и становится бесконечно большой при температуре плавления металла (для цезия это происходит уже при 28°С). Аммиак из таких растворов испаряется слабо, так как давление его насыщенных паров над раствором при увеличении концентрации металла стремится к нулю. Общепринятой теории, которая объясняла бы все особенности поведения растворов металлов в жидком аммиаке, пока нет. Экспериментаторы же обнаруживают все новые факты. Оказалось, например, что сопротивление замороженного раствора натрия в жидком аммиаке крайне мало. Растворы металлов в аммиаке использовали для получения сверхпроводящих систем. Не удивительно поэтому, что и в наши дни растворами металлов в аммиаке с большим интересом занимаются как химики, так и физики. И те и другие находят в аммиаке и его растворах предмет для размышлений и приложения рук.
Пожаро- и взрывоопасность производственных помещений и наружных установок
Из характеристики аммиака следует, что в зависимости от условий хранения он может находиться в газообразном или жидком состоянии. При этом физическое состояние аммиака оказывает влияние на его пожаро- и взрывоопасные свойства, соответственно, — на выявление категории помещений, зданий и наружных установок.
Газообразный аммиак при концентрациях аммиачно-воздушной смеси 15-33,6 % взрывоопасен. Однако он относится к слабочувствительным веществам с низкой способностью к образованию взрывоопасных смесей и к протеканию детонационного горения даже для стехиометрической смеси.
Детонационная ячейка аммиака — более 40 см, тогда как у ацетилена, водорода, особо чувствительных к образованию взрывоопасных смесей, — менее 1 см. Энергия воспламенения аммиака в сотни раз превосходит энергию воспламенения метана и в тысячи раз — водорода.
Скорость роста давления для стехиометрической смеси в замкнутом объеме составляет 6 МПа/с, что значительно ниже, чем у водорода, ацетилена, в 3 раза ниже, чем у метана. Кроме того, для аммиака характерны высокий нижний концентрационный предел воспламенения (НКПВ)
— 15 % с узкой зоной возможного горения аммиачно-воздушной смеси и высокая температура воспламенения, при этом требуется значительная энергия зажигания. Малая удельная теплота сгорания (18 688 кДж/кг) и, следовательно, низкая адиабатическая температура горения (1777 К) не обеспечивают самоподдерживающее даже диффузионное горение для стехиометрической смеси. Поэтому при сгорании неограниченного облака, т.е. на наружных установках, взрывная волна не образуется.
Взрывные явления аммиачно-воздушных смесей в промышленных условиях отмечены лишь в замкнутых системах при высоких температуре и давлении. Все известные случаи взрывов происходили в замкнутых объемах, где образовывались взрывоопасные смеси и находился источник воспламенения не менее 680 мДж с температурой не ниже 650 °С.
Используя нормативную методику, определяют категорию помещения. Когда давление ударной волны при взрыве > 5 кПа, то, согласно нормативной методике, производственные помещения должны отвечать требованиям категории А — повышенной взрывопожарной опасности.
В случае если расчетное избыточное давление взрыва в помещении не превышает 5 кПа, то, согласно требованиям, производственные помещения не могут быть отнесены к категориям А и Б. Использование категории В также исключается, так как категории В1-В4 требуют знания удельной пожарной нагрузки, т.е. наличия площади горения вещества, тогда как горение (взрыв) газообразного аммиака протекает в объеме помещения. В этом случае помещение должно соответствовать категории Д.
В мировой практике не зафиксированы взрывы аммиачно-воздушных смесей в открытом пространстве.
Сжиженный аммиак — это трудногорючая жидкость. При аварийных выбросах сжиженного аммиака в помещении или на открытой площадке происходит его вскипание за счет внутренней энергии перегрева с образованием аэрозольного облака паров и капель, равных по массе.
Аэрозольное облако активно поглощает влагу атмосферного воздуха с образованием аммиачной воды. Поверхностный слой облака становится негорючим, препятствует возгоранию. Капли аммиака делают аэрозольное облако непожаро- и невзрывоопасным. Это и объясняет отсутствие взрывов аммиачно-воздушных смесей на открытых площадках и в помещениях.
В то же время трудногорючая жидкость сжиженного аммиака с температурой кипения -33,4 °С за счет тепла подстилающей поверхности поддона (грунта) начинает испаряться. При наличии постоянного источника воспламенения в период ее бурного испарения (кипения) сразу после пролива горение паров происходит лишь в виде периодических вспышек.
По мере снижения интенсивности теплового потока от подстилающей поверхности поддона кипение затухает. С окончанием кипения жидкого аммиака прекращаются и периодические вспышки. Расчетные и экспериментальные данные показывают, что опасность взрывов паров аммиака в воздухе отсутствует. В также подтверждается этот факт.
При авариях с выбросом сжиженного аммиака заражается атмосферный воздух. Производственные помещения и наружные установки, согласно требованиям нормативной методики, должны отвечать категориям Д и Дн.
При сгорании аммиачно-воздушных смесей в открытом пространстве ударные волны не образуются и наружные установки могут быть отнесены к категории Вн или Дн в зависимости от удельной тепловой нагрузки сгорания огненного шара.
Согласно помещения распределительных устройств, камер непосредственного охлаждения холодильных установок относят к категории Д, если концентрация аммиака не превышает нижнего Предела взрываемое.
Производственные помещения должны оснащаться приточно-вытяжной вентиляцией. При работе с аммиаком используют фильтрующий противогаз марки «М» или «КД». При выбросах газообразного или сжиженного аммиака необходима постановка водяных завес на открытых площадках.
Противопожарная защита аммиачных помещений
Производственные помещения категории А, согласно требованиям, в зависимости от размеров производственной площадки оснащаются автоматическими установками пожаротушения (АУПТ) и пожарной сигнализации (АУПС). Опираясь на, не учитывая специфические свойства аммиака, контролирующие органы механически эти требования переносят на аммиачные объекты. Необходимость обеспечения противопожарной защиты потенциально опасных аммиачных объектов требует детальной проработки.
Аммиак — это не только горючий, взрывоопасный, но еще и токсичный газ. При появлении газообразного аммиака или паров в атмосфере проявляются прежде всего его токсические свойства, а затем при объемной доле 15-33,6 % — взрывоопасные. На аммиачных установках, согласно, предусматриваются автоматические системы контроля загазованности и оповещения об аварийных выбросах аммиака, которые имеют два уровня контроля.
В случае достижения ПД Кр з = 20 мг/м3 (0,0028 %) включаются предупредительная световая и звуковая сигнализация, а также общеобменная вентиляция.
При ПДК з = 500 мг/м3 и более включаются аварийная вентиляция, световая и звуковая сигнализация «Авария», технические средства локализацииаварийной ситуации, отключается аварийный блок, реализуются мероприятия по ликвидации аварии.
Наличие автоматической системы контроля за загазованностью позволяет зафиксировать и оповестить производственный персонал о возникновении аварийной ситуации, а затем начать ее локализацию на ранней стадии. Следовательно, данная система начинает выполнять функции АУПТ и АУПС уже при превышении аммиаком.. ПДКрз. Учитывая токсичность аммиака, разработка АУПТ и АУПС не потребуется.
При истечении жидкого аммиака под давлением в атмосферу, как отмечалось ранее, образуется не пожаро- и взрывоопасное, а токсичное аэрозольное облако. Горение паров жидкой фазы не наблюдается. Из-за малой нормальной скорости пламени аммиачно-воздушной смеси, удельного тепловыделения при горении, которое для стехио-метрической смеси — 2,38 МДж/м3, даже в момент бурного испарения при поджигании наблюдаются неустойчивые вспышки. Будет иметь место токсическое заражение.
Согласно, если производственные помещения относятся к категории А по взрывопожарной опасности х; обращением легковоспламеняющихся и горючих жидкостей, сжиженных горючих газов, горючих пылей и волокон, то необходимо иметь АУПТ при площади помещения 300 м2 и более, в остальных случаях — АУПС.
Это справедливо для сжиженных горючих газов, у которых после взрыва или «хлопка» наблюдается горение паров испаряющейся жидкой фазы, при проливе они обладают свойствами горючей жидкости. Оказывается, что нормативные документы содержат разные требования к составу пожаро- и взрывоопасных веществ при категорировании и оснащении автоматическими системами тушения и сигнализации о пожаре помещений категории А.
Газообразный горючий или сжиженный аммиак (трудногорючая жидкость) отсутствует в составе требований, поэтому необходимость оснащать аммиачные помещения АУПТ и АУПС отпадает. Следовательно, помещения, в которых функционирует сжиженный аммиак, следует относить к категории Д.
Кроме того, у аммиака НКПВ = 15 % (10500мг/м3), что значительно превышает порог его ощутимого раздражения 55 мг/м3. Даже люди, не чувствующие запаха, ощущают его болевое воздействие на слизистые оболочки и влажные участки кожи при незначительных концентрациях (до 100 мг/м3), которые не вызывают последствий после пребывания до полутора часов. Малые утечки могут быть немедленно обнаружены и устранены.
Свойства и способы получения соединений цезия
Цезий химически очень активен, стандартный электродный потенциал составляет 2,923 В. на воздухе мгновенно окисляется с воспламенением, образуя надпероксид Сs02с примесью пероксида Сs202. При ограниченном доступеO2 Окисляется до оксида цезия Cs20; Сs02 переходит в озонид Cs03 в токе озонированного O2 при 40 °С. С водой цезий реагирует со взрывом с образованием гидроксида CsОН и выделением Н2. Взаимодействует с сухим Н2 при 200-350 °С под давлением 5-10 МПа или в присутствии катализатора с образованием гидрида СsН. Все многочисленные соединения цезия можно подразделить на две группы: простые и комплексные. Простые соединения. Оксид цезия Сs2О, кристаллы, расплывающиеся на воздухе; в вакууме (10-3 Па) возгоняется при 350-450 °С, при 500 °С разлагается: 2Cs20 >Сs202 2Cs; энергично реагирует с водой, давая CsОН, с влажным СО2, при 150-200 °С — с Н2, Р2, С12, а также с расплавленной серой; разлагается на свету; получают медленным окислением Cs кислородом (2/3 стехиометрического колличества), остаток Cs отгоняют в вакууме при 180-200 °С. При окислении Cs кислородом получают также его пероксид и надперокид. Таблица 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пероксид Сs202 — гигроскопичные кристаллы, выше 650 °С разлагается с выделением атомарного кислорода и активно окисляет Ni, Аg, Рt, Аu; давление диссоциации 2261 Па (1103 °С); растворяется в ледяной воде без разложения, при температуре выше 25° С протекает реакция с образованием гидроокисей:
2Ме202 2Н20 = MеОН О2,
а в кислоте происходит выделение перекиси водорода:
Ме202 Н2S04 = Ме2S04 Н202.
Гидриды цезия (СsН) — твердые кристаллические вещества, имеют кубическую гранецентрированную решетку типа хлорида натрия, СsН 3,4 г/см3. Они относятся к солеобразным соединениям, в которых анион Н~ по физическим свойствам близок к ионам галогенида.
Гидриды воспламеняются на воздухе, содержащем следы влаги, самовоспламеняются в атмосфере хлора и фгора; бурно реагируют с водой, выделяя водород:
СsН Н20= СsОН Н2
Гидриды получаются путем гидрирования чистых металлов водородом.
Цезий очень энергично соединяеся с кислородом. Все соединения цезия, содержащие кислород, активно взаимодействуют с влагой и двуокисью углерода воздуха.
Из соединений цезия с более высоким содержанием кислорода известны четыре типа: перекиси (Ме20.2), триокиси [Ме± (02)3], надперекиси (Ме02) и озониды (Ме03).
Окиси цезия представляют собой прозрачные иглы, расплывающиеся на воздухе. Под действием света окиси разлагаются, давая металл. В вакууме окись цезия возгоняется при температуре (350-450° С), а уже при 500° С образуется 0>202, которая полностью сублимирует. Окиси цезия бурно реагируют с расплавленной серой по реакции:
4Ме20 7S = Мe2S04 6Mе.
Безводные гидроокиси цезия представляют собой кристаллические, очень гигроскопичные вещества, переходящие вследствие взаимодействия с Н20 и СО в карбонаты. Известно пять кристаллогидратов гидроокисей: МеОН-Н20; МеОН-2НаО; МeOН-ЗН, 0; МeOН-4Н20 и ЗМеОН-Н20. Отмечается, что кристаллизационная вода остается в образцах при температурах, значительно превышающих их температуры плавления.
Растворимость гидроокисей уменьшается с повышением температуры и составляет при 15° С 79,41% (по массе) CsОН. Гидроокиси хорошо растворяются в этаноле, жидком аммиаке и этиловом спирте. На воздухе они расплываются и постепенно переходят в карбонаты, а при 400 — 500° С образуют перекиси.
Расплавленные гидроокиси очень агрессивны: они взаимодействуют с железом, кобальтом, никелем, платиной, разрушают изделия из корунда и двуокиси циркония, растворяют серебро и золото.
Цезий горит в атмосфере галогенов, давая галогениды цезия. Галогениды цезия СsХ, где X = F, С1, Вr, I, — бесцветные кристаллы. Плавятся без разложения, выше температуры плавления летучи, давление пара повышается, а термическая устойчивость понижается при переходе от СsF к CsI; CsВr и CsI в парах частично разлагаются с выделением соответственно Вг2 и I2. СsI легко окисляется при обычной температуре, на свету его водные растворы желтеют вследствие выделения I2. Растворимость галогенидов цезия в воде (г в 100 г.): CsР — 530 (25 °С), 608 (50 °С); CsС1 — 162,3 (0,7 °С), 191,8 (25 °С), 229,4 (50 *С); СsВr — 123,5 (25 °С); СU — 43,1 (0 °С), 85,6 (25 °С), 160 (61 °С), Из водных растворов кристаллизуются безводные СsСl, CsВr, CsI, кристаллогидраты СsF·nН20, где n = 1, 1,5, 3.
Галогениды цезия хорошо растворимы в метаноле, этаноле, муравьиной кислоте, гидразине, плохо — в ацетоне, эфирах, пиридине, ацетонитриле, нитробензоле.
Таблица 3. Растворимость в галогеноводородных кислотах НХ:
Вещество | Концетрация в растворе HX и CsX, % по массе (25?С) | ||||
HBr | 5,0 | 10,0 | 15,0 | 20,0 | 25,0 |
CsBr | 49,0 | 40,6 | 33,3 | 27,9 | 23,4 |
HCl | 4,2 | 11,0 | 15,4 | 20,2 | 22,4 |
CsCl | 57,9 | 49,1 | 45,5 | 43,1 | 42,4 |
Растворы CsС1 в соляной кислоте используют для его первичного отделения от NaС1 и КС1.
Безводный CsF гигроскопичен, его водные растворы имеют щелочную среду: 2CsР Н20 CsНF2 CsОН. Фторид образует гидрофториды: CsF·nНF, где n=1, 2, 3, 6, — бесцветные кристаллы, при п > 2 легко расплываются и разлагаются на воздухе; CsНF2 термически устойчив, отщепляет НF при 500-600 °С; хорошо растворим в воде.
Галогениды цезия образуют с соответствующими КХ и RbХ твердые раствворы, с NаХ — эвтектические смеси, с LiХ — аддукты, например LiCl·2CsС1. Комплексы CsХ с галогенидами многих элементов, например Cs3[Sb2С19], используют для выделения и определения цезия.
Получают CsХ нейтрализацией Сs2С03 соответствующей кислотой НХ либо взаимодействием СsSО4 с ВаХ2 в растворе. CsВr и CsI получают в горячем растворе по реакции:
6СsОН ЗХ2>5CsХ СsХ03 ЗН20
Далее в раствор добавляют активированный уголь, упаривают досуха и прокаливают при 300-450 °С. СsВг и СsI можно получить из Сs2СО3 или СsНС03 в присутствии восстановителей:
2Сs2С03 2Х2 N2H 4>4СsХ N2 2Н20 2С02
Галогениды CsВr и Cs1 обладают оптической прозрачностью в интервале длин волн от 500 до 6 * 104 нм, их используют для изготовления призм в ИК спектроскопии; пары CsВг — рабочее тело в плазменных СВЧ установках; монокристаллы Cs1, активированные Т1, используют в сцинтилляционных счетчиках. СsХ — компоненты люминофоров для флуоресцирующих экранов. СsF применяют при получении пьезоэлектрической. керамики, как компонент специальных стекол и эвтектических, композиций для аккумуляторов тепла, CsС1 — электролит в топливных элементах, флюс при сварке Мо.
Таблица 4
Свойства галогенидов цезия | ||||||||||
Показатель | CsF | CsHF2 | CsCl | CsBr | Csl | |||||
Сингония | Кубическая | Тетрагоническая | Кубическая | Кубическая | Кубическая | Кубическая | Кубическая | Кубическая | Кубическая | Кубическая |
Параметр кристалической решетки a, нм | 0,601 | 0,6146 | 0,412 | — | 0,411 | 0,694 | 0,429 | 0,723 | 0,457 | 0,766 |
Число формульных единиц в ячейке | 4 | — | 1 | — | 1 | 4 | 1 | 4 | 1 | 4 |
Пространственная группа | Fm3m | 14/mcm | Pm3m | — | Pm3m | Fm3m | Pm3m | Fm3m | Pm3m | Fm3m |
Температура плавления,?С | 703? | 58? | 177? | 180? | 470? | 646? | — | 637? | — | 632? |
Температура кипения,?С | 1253? | — | — | — | — | 1295? | — | 1297? | — | 1280? |
Плотность (25?С), г/см3 | 3,59 | 3,68 | 3,81 | — | 3,983 | — | 4,43 | 4,509 | — | |
С?р, Дж/(моль·К) | 51,09 | 87,34 | — | — | 52,47 | — | 52,93 | — | 52,47 | — |
?Н?обр, кДж/ моль | -557,1? | -973,2? | 4,15? | — | -442,3? | 2,93? | -405,6? | — | -348,1? | |
?Н?пл, кДж/моль | 21,7? | 2,43? | — | 2,76? | — | 20,38? | — | 23,6? | — | 25,65? |
S?298, Дж/(моль·К) | 92,96 | 135,3 | — | — | 101,17 | — | 112,94 | — | 122,20 | — |
Показатель преломления прн 20?С (? 589 нм) | 1,480 | — | — | — | 1,6397 | — | 1,6984 | — | 1,7876 | — |
Фториды цезия выделяются из водных растворов в виде кристаллогидратов. Они довольно устойчивы; заметно возгоняются при температуре выше 800-900 °С. Фториды хорошо растворяются в воде; их получают нейтрализацией карбонатов цезия избытком плавиковой кислоты с последующим упариванием раствора досуха.
Хлориды цезия выделяются из водных растворов в виде негигроскопичных безводных кристаллов ромбической формы.
Хлориды цезия термически устойчивые соединения, плавящиеся без разложения; они хорошо растворяются в воде и в муравьиной кислоте. В соляной кислоте растворимость хлоридов уменьшается с повышением концентрации НС1. Это свойство широко используется в промышленности.
Бромиды цезия кристаллизуются в виде негигроскопичных безводных кубиков или ромбических додекаэдров. Термически это довольно устойчивые соединения. При нагревании выше температур плавления (682° С для КЬВг; 627° С для ОзВг) они частично разлагаются с выделением брома или бромистово-дородной кислоты.
Бромиды получают взаимодействием нагретого водного раствора гидроокиси цезия и брома:
6CsОН ЗВг2 = 5СsВг СsВrOз ЗН20.
После окончания реакции в раствор вводят порошок активированного угля, смесь упаривают досуха, и остаток осторожно прокаливают с углеродом при 300-450° С:
2СsВr03 ЗС= 2СsВг ЗС02.
Иодиды цезия выделяются из водных растворов в виде безводных хорошо выраженных кубических кристаллов, стабильных при нормальной температуре и ‘хорошо растворимых в абсолютном спирте и эфире. Сг13 стабилен при нормальной температуре и начинает разлагаться с отделением при 115° С. С повышением температуры растворимость иодидов, как и бромидов цезия, возрастает.
Возгонка иодидов цезия на воздухе сопровождается их частичной диссоциацией с выделением элементарного йода. Иодиды цезия отличаются от других галогенидов повышенной окисляемостью и способностью к образованию продуктов типа MeI * 4S02. Под действием окислителей иод легко выделяется из разбавленных растворов иодидов рубидия и цезия.
Иодиды цезия можно получить при взаимодействии либо гидроохиси с иодом при нагревании, либо карбонатов с иодом в присутствии восстановителя. В обоих случаях сухой остаток после выпаривания раствора прокаливают и выщелачивают водой. Для очистки иодидов цезияот калия кристаллизацию проводят в присутствии иодистоводородной кислоты при 30° С. При этом содержание примеси калия понижается до 1-10-30% (по массе). Кристаллы иодидов промывают холодным сухим ацетоном и высушивают в вакууме при 75С.
Сульфиды СsSn, (n=1-6) получают взаимодействием металла с S в жидком NН3.
Сульфаты цезия изоморфны и кристаллизуются в виде бесцветных ромбических кристаллов. Сульфаты и цезия характеризуются сравнительно высокими температурами плавления и летучестью (температура плавления сульфата цезия 1019 °С). Заметное улетучивание сульфатов происходит выше 1400 °С без изменения состава.
При прокаливании в токе водорода или аммиака сульфаты цезия (620-770° С) переходят в сравнительно легкоиспаряющиеся сульфиды. Сульфаты цезия хорошо растворимы в воде, во много раз: лучше, чем сульфат калия. Ниже приведены растворимости сульфатов в воде в зависимости от температуры:
Таблица 5
Температура, ?С | 0 | 20 | 40 | 60 | 80 | 100 |
Растворимость, г/100 г. воды | ||||||
K2SO4 | 7,33 | 11,15 | 14,79 | 18,2 | 21,29 | 24,1 |
Rb2SO4 | 36,4 | 48,2 | 58,5 | 67,4 | 75 | 81,8 |
Cs2SO4 | 167,1 | 178,7 | 189,9 | 199,9 | 210,3 | 220,3 |
Сульфаты легко получают взаимодействием серной кислоты с карбонатами цезия или их хлоридами, а также из квасцов, осаждая алюминий квасцов избытком аммиака.
Известны также гидросульфаты (МеНS04), дисульфаты (Ме2S2О7), пероксосульфаты (Ме2S2О8) цезия. Для получения гидросульфатов сульфаты, карбонаты или хлориды нагревают с избытком серной кислоты при 400-500° С до получения сухого остатка, который растворяют в минимальном количестве воды; раствор упаривают досуха, остаток промывают абсолютным этанолом, затем эфиром.
Шениты цезия Ме2SO4·Ме’SO4·6Н20, где Ме-Сз, а Ме’ — Сu, Со, Мg, Мn, Сd, Ni, образуют изоморфные бесцветные или ярко окрашенные кристаллы моноклинной сингонии. При нагревании шениты сначала переходят в дигидраты (70-100° С), а затем полностью обезвоживаются (140 — 200° С). Безводные соли не разлагаются даже при нагревании до 1000° С. В ряду шенитов рубидиевые соли обладают наименьшей растворимостью, что благоприятно при получении чистых препаратов рубидия методом фракционной кристаллизации.
Цезиевыми квасцами называют соединения, общая формула которых Ме-Э (S04)· 12НаО, где Ме — Cs, а Э — один из следующих трехвалентных катионов: А1, Сr, Fе, Тi, V, Мn, Gа, In, Со. Наибольшее значение в технологии цезия имеют алюмоцезиевые квасцы кристаллизующиеся в виде больших блестящих и прозрачных изотропных октаэдрическнх кристаллов, имеющих кубическую гранецентрировакную решетку типа NaCl.
В ряду щелочных металлов: Na К, Rb и Cs растворимость квасцов понижается с увеличением атомной массы. Например, растворимость разных квасцов в пересчете на безводную соль при 15° С такова, %:
Натриевые 27,9
Калиевые 4,8
Рубидиевые 0,25
Цезиевые 0,35
На рис. 1, где показано влияние температуры на растворимость различных квасцов, видно, что алюмоцезиевые квасцы обладают наименьшей растворимостью по сравнению с другими квасцами

Рис. 1 Растворимость алюмоквасцов аммония (1), калия(2), рубидия(3) и цезия (4) в воде
Алюмоквасцы — это один из первых промежуточных продуктов производства рубидий и цезия из лепидолитов, которые представляют собой изоморфную смесь калиевых, рубидиевых и це-зиевых квасиов. Последующее разделение этих квасцов основано на различной их растворимости и осуществляется многократной фракционной кристаллизацией.
При нагревании алюмоцезиевые квасцы сначала плавятся (при 109 и 122° С соответственно), а затем постепенно теряют гидратную воду. Полное обезвоживание для СsА1 (S04)·12Н20 температуры равны соответственно 235 и 780° С.
Железоцезиевые квасцы имеют достаточно высокий температурный коэффициент растворимости и резко отличаются по растворимости и устойчивости от квасцов щелочных металлов. Этим можно воспользоваться для эффективного отделения цезия от других щелочных металлов.
Для получения квасцов железный купорос сначала окисляют в водном растворе азотной кислотой, а затем смешивают с сернокислым раствором сульфата цезия и упаривают до начала кристаллизации.
Среди марганцевых квасцов наиболее устойчивыми являются цезиево-марганцевые СзМн (304)г-12Н20. В воде эти квасны гидролизуются с выделением гидратированной трехокиси марганца, плавятся они при 40° С.
Нитраты цезия(МеNОз) представляют собой бесцветные гигроскопичные иглы и призмы. У нитрата цезия известны четыре две модификации.
Термическое разложение нитратов цезияс выделением кислорода
происходит по реакции: 2МеNОз = 2МеNО2 О2, при 490° С для цезия.
Как видно на рис. 2 растворимость нитратов в воде с повышением температуры возрастает, но в органических растворителях они нерастворимы.
Нитраты цезия легко получают взаимодействием азотной кислоты с их карбонатами, хлоридами или гидроокисями. Растворимость нитратов в азотной кислоте возрастает в ряду щелочных металлов и не подчиняется правилу периодичности свойств:
NaNОз< RbNОз<СsNОз< КNОз
Карбонаты цезия представляют собой белые очень гигроскопичные непрозрачные ромбические кристаллы, расплывающиеся на воздухе и переходящие вследствие поглощения С02 в соответствующие гидрокарбонаты МеНСО3·К2С03 с выделением тепла, для Сs2С03 11,87 ккал / моль. В атмосфере двуокиси углерода он плавится без заметного разложения при 873° С, но при нагревании их выше температур плавления (особенно в вакууме) наблюдается диссоциация с отщеплением СО2.
В отличие от карбоната лития карбонаты цезия легко раство100 г. воды соответственно следующая, г: 111,8; 223,0 н 308,3). Карбонат цезия (в отличие от карбонатов рубидия и калия) растворим в абсолютном спирте до 10% при 20° С. На этом свойстве карбоната цезия основана очистка цезия рубидия и калия.
Карбонаты цезия образуют целый ряд кристаллогидратов, точный состав которых до сих пор окончательно не установлен. Для карбоната цезия известны кристаллогидраты: Сs2С03·8Н2O и Сs2С08·5Н2О при низких температурах и 2Сs2С03·7Н20 — стабильный при обычной температуре. Полная дегидратация Сs5С03 проходит при 150° С.
Основной метод получения карбонатов цезия — прокаливание:их тетраоксалатов или кислых тартратов]
Гидрокарбонаты (бикарбонаты) цезияMеНСО3 выделяются в виде безводных призм или игл ромбической сингонии из 13-20%-ных растворов карбонатов при пропускании двуокиси углерода. При нагревании выше 170-180? С. гидрокарбонаты разлагаются с выделением двуокиси углерода.
Комплексные соединения цезия. Гетерополисоединения цезия представляют собой соли с комплексными анионами сложного строения.
Крeмнемолибдаты цезия Ме3Н6 [Si(Мо2О7)6]·Н20 сравнительно мало растворимы в воде, серной, азотной и щавелевой кислотах. Растворимость почти не зависит от температуры и при 25° С составляет 0,48г на 100 г. воды. В соляной кислоте растворимость еще меньше.

Рис. 2. Растворимость нитратов цезия (1), калия(2) и рубидия
Кремневольфраматы цезия состава (Сs)8Si(W8O7)8·nН2О Плохо растворимы в воде, нерастворимы в спирте и разбавленной соляной кислоте. Обычным методом получения кремнсвольфраматов является взаимодействие кремневольфрамовой кислоты и хлоридов цезия.
Фосфоромолибдаты цезия состава Ме3H4 [Р(Мо3O7)6)]·nН2О выпадают при взаимодействии фосформолибденовой кислоты и 1%-ных водного раствора CsCl. Растворимость фосфоромолибдатов К RЬ и Сs при 20° С равна 3,8·10-9, 6,2-10-4; 5,6-10-4 г в 100 г. воды соответственно; в 0,1н. азотной кислоте растворимость этих солей К, КЬ и Сs составляет соответственно 8,02; 1,7-10-9 и 9,4-10-4 г в 100 г. растворителя. Эннеахлордиарсенаты цезия Ме9[As2С19] мало растворимы в концентрированной соляной кислоте, растворимость их при 20° С в 100 г. воды 36%-ной НС1 составляет 2,935 и 0,429 г. соответственно. Аналогичной соли калия не обнаружено.
Эннеахлордистнблаты цезияМе3 [SЬ2С19] — довольно устойчивые на воздухе соединения, разлагающиеся с выделением SbС18 только при нагревании до 450° С в вакууме. В воде Cs3 [Sb2 С19] подвергаются сильному гидролизу.
Селенид Сs2 Sе и теллурид Cs2Te синтезируют сплавлением цезий соответственно с Sе и Те в вакууме. CsN2 в обычных условиях цезий не взаимодействует, с жидким N2 при электрическом разряде между электродами, изготовленными из цезия, образует нитрид Cs3N. Цезий растворяется в жидком NH3, алкиламинах и полиэфирах, образуя синие растворы, обладающие электронной проводимостью; в аммиачном растворе цезий медленно реагирует с NH3 с выделением Н2 и образованием амида СsNH2. С газообразным NH3 при 120 °С образует Cs NH2, с красным Р в вакууме при 400-430 °С — фосфид Cs2P, с порошком графита при 200-500 °С — карбид С8Cs, а при более высоких температурах — С24Cs, Cs36Cs и др. карбиды, с ацетиленом при 300 °С в вакууме — ацетиленид Cs2C2, с Si и Gе в атмосфере Аr при 600 °С — соответственно силицид CsSi и германид CsСе. Цезий, взаимодействуя с С02, ССl4 со взрывом. Выше 300 ?С разрушает стекло, восстанавливая Si из SiO2 и силикатов. Цезий реагирует со всеми компонентами с образованием соответствующих солей, со спиртами дает алкоголяты.
Цезий образует твердые растворы с К и КЬ, эвтектическая смесь с Nа, не смешивается с Li, Со многими металлами дает интерметаллады, например CsАu, CsSn4.

Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
