Относительная плотность газа — что это за величина
При изучении свойств газообразных веществ используют множество параметров. Одной из наиболее важных характеристик газов является их плотность.
Плотность — скалярная физическая величина, которая вычисляется путем деления массы вещества на занимаемый им объем.
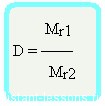
Рассматриваемую величину обозначают с помощью греческой буквы ρ или латинских D и d. Единицей измерения плотности в системе СИ принято считать кг/м3, а в ОпределениеВ распространенных случаях по отношению к газам применяют термин «относительная плотность». Данная характеристика является отношением массы рассматриваемого газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении. Параметр называют относительной плотностью первого газа по второму.К примеру, при нормальных условиях диоксид углерода СО2 в объеме 1 л обладает массой 1,98 г, а водород в том же объеме и при тех же условиях — массой 0,09 г. Таким образом, плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.O2 2H2 = 2H2O (550oС, сгорание H2в O2); O2 F2 = O2F2 (-183oС, электрический разряд); O2 N2↔2NO (электрический разряд); O2 S = SO2 (сгорание на воздухе); 5O2 4P = P4O10 (сгорание на воздухе); O2 C = CO2 (600-700oС, сжигание на воздухе); O2 2Na = Na2O2 (сжигание на воздухе); O2 2Mg = 2MgO (сгорание на воздухе); 3O2 4Al = 2Al2O3 (сгорание на воздухе). Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Объемные отношения газов при химических реакциях
Вещество из жидкого или твердого переходит в газообразное агрегатное состояние при нагреве, примерами таких процессов являются: кипение жидкостей;возгонка твердых веществ (переход из твердого состояния сразу в газообразное).В связи с тем, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, является объемом свободного пространства между молекулами газа, перемещающимися хаотично. Величина этого пространства зависит от условий, при которых находится газ:Данная характеристика практически равна для всех газов. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Вывод из вышесказанного сформулирован в законе Авогадро. ОпределениеСледствие 1Молярный объем газа определяют как отношение объема газа к его количеству:
Относительная плотность по… задачи
24-Фев-2022 | комментариев 26 | Лолита Окольнова В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительнаяплотность вещества по… водороду, кислороду, воздуху, азоту и т.д. Например: Относительная плотность вещества – отношение плотности вещества Б к плотности вещества АОтносительная плотность — величина безразмернаяФормула достаточно простая, и из нее вытекает другая формула — Формула молярной массы вещества Mr1 = D•Mr2 и т.д. В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…» Давайте решим нашу задачу: Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества — Mr (вещества)=Mr(воздуха)•D=29 гмоль • D Mr(вещества)=29 гмоль • 1.448 = 42 гмоль Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода. Для этого надо молярную массу вещества умножить на процентное содержание элемента: Mr(Cx)=Mr(вещества)•ω Mr(Cx)= 42 гмоль · 0.8571=36 гмоль x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3. Точно так же находим все данные для водорода: Mr(Hy)=Mr(вещества)•ω Mr(Hy)= 42 гмоль · 0.1429=6 гмоль x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6. Искомое вещество — C3H6 — пропен. Еще раз повторим определение — Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.Дана относительная плотность по аргону. Mr (вещества)=Ar(Ar)•D Mr (CxHy)=40 гмоль ·1.05=42 гмоль Запишем уравнение горения: СхHy O2 = xCO2 y2H2O Найдем количество углекислого газа и воды: n(CO2)=V22,4 лмоль = 33.622.4=1.5 n(H2O)=mMr=2718=1.5 Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n Выражаем в общем виде молярную массу: Mr=Mr(C) Mr(H) 12n 2n=42 n=3 Наше вещество — C3H6 — пропен
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oC растворяют 4,9, а при 20oC – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже: Таблица 1. Физические свойства и плотность кислорода. Плотность, кг/м31,42987 – газ1141 – жидкостьТемпература плавления, oС-218,35Температура кипения, oС-182,96Энергия ионизации атома, эВ9,32Относительная электроотрицательность1,51Радиус атома, нм112Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500oC она становится заметной.Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул. Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
По какой формуле высчитывается
Формула 1Формула 2Плотность газообразного вещества в лабораторных условиях определяют следующим методом: Измеряют вес стеклянной колбы с краном с помощью аналитических весов.Принимают за исходную массу колбы, а за конечную — массу колбы, которую наполняют рассматриваемым газом до определенного давления.Путем вычитания из второй массы исходной определяют их разность, которую затем делят на объем колбы.Полученное в результате значение является плотностью газа в заданных условиях.Расчет плотности газообразного вещества при нормальных условиях выполняют с помощью уравнения состояния идеального газа: p2=pN V2=VN T2=TN p1/pN×V1/m×m/VN=T1/TN;m/V1=r1 m/VN=rN Таким образом: rN=r1×pN/p1×T1/TNЗначения плотностей некоторых газообразных веществ при нормальных условиях представлены в таблице:
Примеры решения задач
Задача 1Задача 2Задача 3Задача 4Задача 5
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы.В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Рассчитать относительную плотность кислорода по азоту и по воздуху
1. Определим относительную плотность по азоту:DN₂ (O₂) = M (O₂) : M (N₂);M (O₂) = 16 * 2 = 32 г/моль;M (N₂) = 14 * 2 = 28 г/моль;DN₂ (O₂) = 32 : 28 = 1,1429;2. находим относительную плотность по воздуху:Dвозд (O₂) = M (O₂) : M (воздуха);M (воздуха) = 29 г/моль;Dвозд (O₂) = 32 : 29 = 1,1034.Ответ: DN₂ (O₂) = 1,1429; Dвозд (O₂) = 1,1034.