- Возможные степени окисления
- Какая степень окисления у серебра?
- Окислители и восстановители
- Окислительные свойства азотной кислоты
- Применение серебра:
- Промышленное производство серной кислоты
- Разложение нитратов
- Свойства атома серебра:
- Схема восстановления перманганатов
- Таблица степени окисления химических элементов
- Тренировочные задания
- Факторы, влияющие на скорость химической реакции
- Физические свойства серебра:
Возможные степени окисления
В соединениях медь проявляет две степени окисления: 1 и 2. Первая из них склонна к
диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или
комплексах (например, [Cu(NH3)2] ).
Её соединения бесцветны. Более устойчива степень окисления 2,
которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со
степенью окисления 3 и даже 5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−,
полученных в 1994 году.
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не
вступает в реакцию с водой и разбавленной соляной кислотой. Переводится враствор
кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
2Cu H2O CO2 O2 à Cu2CO3(OH)2↓
Реагирует с концентрированной холодной серной кислотой:
Cu H2SO1 àCuO SO2 ↑ H2O
С концентрированной горячей серной кислотой:
Cu 2H2SO4 à CuSO4 SO2 ↑ 2H2O
- В электротехнике
- Теплообмен
- Для производства труб
- Сплавы
- Сплавы на основе меди
- Сплавы, в которых медь значима
- Ювелирные сплавы
- Соединения меди
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C:
0,01724-0,0180 мкОм·м), медь широко применяется в электротехнике для изготовления силовых и других
кабелей, проводов или других проводников, например, при печатном монтаже.
Медные провода, в свою
очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых
трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую
проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость
почти на 10 %.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных
теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известныерадиаторы
охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные
трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во
внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и
холодильных агрегатах.
В ряде стран трубы из меди являются основным материалом, применяемым для этих
целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США,
Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р
52318-2005, а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того,
трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для
транспортировки жидкостей и пара.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко
распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими
названиями для целого семейства материалов, в которые, помимо олова и цинка, могут входить никель,
висмут и другие металлы.
Например, в состав пушечной бронзы, использовавшейся для изготовления
артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк;
рецептура менялась от времени и места изготовления орудия.
Большое количество латуни идёт на
изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой
пластичности. Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др.
(а не чистую медь) из-за их большей прочности:
30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически
чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют
механических свойств при термической обработке, и их механические свойства и износостойкость
определяются только химическим составом и его влиянием на структуру.
Модуль упругости медных сплавов
(900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент
трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих
сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред
(медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью.
Величина коэффициента
трения практически одинакова у всех медных сплавов, тогда как механические свойства и
износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно,
от структуры.
Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав
(мельхиор) используются для чеканки разменной монеты. Медноникелевые сплавы, в том числе и так
называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов
отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с
возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь
является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов
Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения
разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до
жидкостных ракетных двигателей.
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к
деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим
воздействиям.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой
для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных
гальванических элементов и батарей.
Какая степень окисления у серебра?
Серебро может существовать в виде простого вещества – металла, а степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
Известно, что серебро может проявлять в своих соединениях степени окисления ( 1), ( 2) и ( 3), однако наиболее устойчивыми из них являются те, в которых степень окисления серебра равна ( 1), что обусловлено прочностью конфигурации ![]() :
: ![]() :
:  ,
, ![]() ,
, ![]() ,
,  ,
, ![]() ,
, ![]() ,
,  ,
, ![]() (ответ на вопрос «какая степень окисления у серебра»).
(ответ на вопрос «какая степень окисления у серебра»).
В первой реакции происходит изменение степеней окисления у элементов серебро, кислород и азот, причем первый и третий из них восстанавливаются, а второй – окисляется. Схемы электронного баланса имеют следующий вид:
![]()
![]()
![]()
Во второй реакции происходит изменение степеней окисления у элементов серебро и кислород, причем первый из них восстанавливается, а второй – окисляется. Схемы электронного баланса имеют следующий вид:
![]()
![]()
Окислители и восстановители
Окислители— это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN 5O3, HCl 7O4), соли (KN 5O3, KMn 7O4), оксиды (S 6O3, Cr 6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4 , Fe3 , Au3 и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2 , Fe2 , Cr2 ), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S 4O3)2–, (НР 3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
перманганат калия (KMnO4);
дихромат калия (K2Cr2O7);
азотная кислота (HNO3);
концентрированная серная кислота (H2SO4);
пероксид водорода (H2O2);
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются влабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления 5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота металл = соль металла продукт восстановления азота H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N 4); оксид азота (II) NO (N 2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3.
Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от 4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn 10HNO3 = 4Zn(NO3)2 NH4NO3 3H2O
- концентрированная азотная кислота на холодепассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платинойPt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV)NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu 4HNO3 = Cu(NO3)2 2NO2 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота(I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na 10HNO3 = 8NaNO3 N2O 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%).
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Применение серебра:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Промышленное производство серной кислоты
Какие катализаторы используются при производстве серной кислоты?
Серная кислота — одно из важнейших неорганических соединений в химической промышленности. Сырьем для промышленного производства серной кислоты служат: чистая сера S, железный колчедан (пирит) 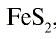
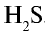
Процессы промышленного производства серной кислоты, начиная с подготовки сырья и кончая получением готового продукта, подразделяются на несколько этапов.
1. Получение оксида серы (IV). 2. Очистка оксида серы (IV). 3. Окисление оксида серы (IV) и получение оксида серы (VI).
1. Получение оксида серы (IV).
Для получения оксида серы (IV) из имеющегося сырья необходимо осуществить следующие химические реакции:
В промышленности для производства 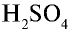
1) реакции обжига проводить при участии чистого кислорода вместо воздуха. Это позволяет увеличить концентрацию одного из реагирующих веществ — кислорода, а следовательно, и скорость реакции;
2) измельчать частицы пирита, при этом увеличивается поверхность столкновения частиц пирита с кислородом, в результате чего реакция ускоряется. Однако чрезмерное измельчение пирита замедляет реакцию, так как пирит спекается и кислород не может проникнуть в уплотненные слои. Но использование чрезмерно измельченного пирита по принципу противотока также дает хорошие результаты. Пирит засыпается в печь для обжига колчедана (окисление 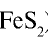 Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—
Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—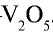
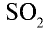
3. Окисление оксида серы (IV) и получение оксида серы (VI).
Для получения оксида серы (VI) из оксида серы (IV) последний окисляется в присутствии катализатора:
Реакция является экзотермической, и при 400°С выход оксида серы (VI) составляет 99,2%. С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
Теплота, выделяющаяся в ходе реакции, расходуется на нагревание 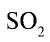
Для выбора оптимальных условий окисления оксида серы (IV) необходимо подобрать факторы, позволяющие сдвинуть равновесие обратимой реакции вправо.
1. Температура. Для увеличения выхода оксида серы (VI) температуру реакции следует постепенно понижать с 600°С до 400—450°С .
2. Катализатор. Катализатором могут служить оксиды железа, платины и ванадия. К катализаторам предъявляются следующие требования: а) низкая цена; б) устойчивость к каталитическим донорам; в) долговечность. В настоящее время в качестве катализатора используется оксид ванадия (V).
3. Оксид серы (IV), поступающий в контактный аппарат, должен быть осушен от водяных паров и очищен от различных твердых частиц и пыли, повреждающих катализатор. Оксид серы (IV), осушенный от водяного пара и очищенный от пыли и различных примесей, в смеси с воздухом поступает в теплообменник, где он нагревается до определенной температуры, а оттуда в контактный аппарат, где он окисляется до 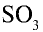
Образовавшийся в контактном аппарате и охлажденный в теплообменнике оксид серы (VI) подается в поглотительную башню.
Гидратация оксида серы (VI), то есть получение серной кислоты.
В поглотительной башне из оксида серы (VI) получается серная кислота, для чего 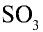
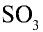
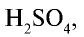
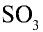
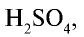
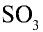
Процесс промышленного производства серной кислоты является непрерывным (рис. 25).
Элементы знаний, умений и навыков: сырье, обжиг пирита, кипящий слой, контактный аппарат, теплообменник, олеум.
Пример:
Во сколько раз увеличится скорость реакции, если коэффициент скорости равен 3, а температура повышена с 50°С до 70°С? При первоначальной температуре (50°С) реакция завершается за 2 мин 15 с, за какое время она завершится при 70°С?
Решение:
1) увеличение скорости реакции (при переходе от 50°С к 70°С) найдем согласно правилу Вант-Гоффа:
Скорость химической реакции увеличится в 9 раз;
2) при начальной температуре 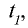
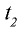
Ответ. 15 с.
Разложение нитратов
Соли-нитраты содержат азот в степени окисления 5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярногокислородаO2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления 3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО 4NO2 O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N 5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag 2NO2 O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложениенитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления 5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I)(«веселящий газ») и вода:
NH4NO3 → N2O 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 O2 4H2O
При разложениинитрита аммонияNH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N 3 и восстановителя N-3
NH4NO2 → N2 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления 3:
2Fe(NO3)2 → 2FeO 4NO2 O2 при 60°C 4Fe(NO3)2 → 2Fe2O3 8NO2 O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Свойства атома серебра:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 165 пм |
| 205 | Эмпирический радиус атома* | 160 пм |
| 206 | Ковалентный радиус* | 145пм |
| 207 | Радиус иона (кристаллический) | Ag 81 (2) пм, 114 (4) пм, 129 (6) пм, 142 (8) пм, Ag2 108 (6) пм, Ag3 89 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 172 пм |
| 209 | Электроны, Протоны, Нейтроны | 47 электронов, 47 протонов, 61 нейтрон |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганецв степени окисления 7. Соли марганца 7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2 . Оксид марганца в степени окисления 2 проявляет основные свойства, поэтому в кислой средеобразуется соль.
Соли марганца 2 бесцветны. В нейтральном растворемарганец восстанавливается до степени окисления 4, с образованием амфотерного оксида MnO2 — коричневогоосадка, нерастворимого в кислотах и щелочах.
В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления 6. Соединения марганца 6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S 2 KMnO4 8 H2SO4 = 5 S 2 MnSO4 6 K2SO4 8 H2O,
3 K2S 2 KMnO4 4 H2O = 2 MnO2↓ 3 S↓ 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции.
K2S 2 KMnO4 –(KOH)= 2 K2MnO4 S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия.
Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно?
Перманганаты окисляют:
- неметаллыс отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения— фосфор, мышьяк — до 5;
- неметаллыс промежуточной степенью окисления до высшей степени окисления;
- активные металлыиз простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 неМе (низшая с.о.) = неМе0 другие продукты
KMnO4 неМе (промежуточная с.о.) = неМе(высшая с.о.) др. продукты
KMnO4 Ме0 = Ме (стабильная с.о.) др. продукты
KMnO4 P-3, As-3= P 5, As 5 др. продукты
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na 1I-1, Mg 2Cl-12, Al 3F-13, Zr 4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно ( 1) и ( 2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, ( 2), ( 4), ( 6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
1 | Водород / Hydrogen | H | ( 1), (-1) |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | ( 1) |
4 | Бериллий / Beryllium | Be | ( 2) |
5 | Бор / Boron | B | (-1), 0, ( 1), ( 2), ( 3) |
6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, ( 2), ( 4) |
7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, ( 1), ( 2), ( 3), ( 4), ( 5) |
8 | Кислород / Oxygen | O | (-2), (-1), 0, ( 1), ( 2) |
9 | Фтор / Fluorine | F | (-1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | ( 1) |
12 | Магний / Magnesium | Mg | ( 2) |
13 | Алюминий / Aluminum | Al | ( 3) |
14 | Кремний / Silicon | Si | (-4), 0, ( 2), ( 4) |
15 | Фосфор / Phosphorus | P | (-3), 0, ( 3), ( 5) |
16 | Сера / Sulfur | S | (-2), 0, ( 4), ( 6) |
17 | Хлор / Chlorine | Cl | (-1), 0, ( 1), ( 3), ( 5), ( 7), редко ( 2) и ( 4) |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | ( 1) |
20 | Кальций / Calcium | Ca | ( 2) |
21 | Скандий / Scandium | Sc | ( 3) |
22 | Титан / Titanium | Ti | ( 2), ( 3), ( 4) |
23 | Ванадий / Vanadium | V | ( 2), ( 3), ( 4), ( 5) |
24 | Хром / Chromium | Cr | ( 2), ( 3), ( 6) |
25 | Марганец / Manganese | Mn | ( 2), ( 3), ( 4), ( 6), ( 7) |
26 | Железо / Iron | Fe | ( 2), ( 3), редко ( 4) и ( 6) |
27 | Кобальт / Cobalt | Co | ( 2), ( 3), редко ( 4) |
28 | Никель / Nickel | Ni | ( 2), редко ( 1), ( 3) и ( 4) |
29 | Медь / Copper | Cu | 1, 2, редко ( 3) |
30 | Цинк / Zinc | Zn | ( 2) |
31 | Галлий / Gallium | Ga | ( 3), редко ( 2) |
32 | Германий / Germanium | Ge | (-4), ( 2), ( 4) |
33 | Мышьяк / Arsenic | As | (-3), ( 3), ( 5), редко ( 2) |
34 | Селен / Selenium | Se | (-2), ( 4), ( 6), редко ( 2) |
35 | Бром / Bromine | Br | (-1), ( 1), ( 5), редко ( 3), ( 4) |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | ( 1) |
38 | Стронций / Strontium | Sr | ( 2) |
39 | Иттрий / Yttrium | Y | ( 3) |
40 | Цирконий / Zirconium | Zr | ( 4), редко ( 2) и ( 3) |
41 | Ниобий / Niobium | Nb | ( 3), ( 5), редко ( 2) и ( 4) |
42 | Молибден / Molybdenum | Mo | ( 3), ( 6), редко ( 2), ( 3) и ( 5) |
43 | Технеций / Technetium | Tc | ( 6) |
44 | Рутений / Ruthenium | Ru | ( 3), ( 4), ( 8), редко ( 2), ( 6) и ( 7) |
45 | Родий / Rhodium | Rh | ( 4), редко ( 2), ( 3) и ( 6) |
46 | Палладий / Palladium | Pd | ( 2), ( 4), редко ( 6) |
47 | Серебро / Silver | Ag | ( 1), редко ( 2) и ( 3) |
48 | Кадмий / Cadmium | Cd | ( 2), редко ( 1) |
49 | Индий / Indium | In | ( 3), редко ( 1) и ( 2) |
50 | Олово / Tin | Sn | ( 2), ( 4) |
51 | Сурьма / Antimony | Sb | (-3), ( 3), ( 5), редко ( 4) |
52 | Теллур / Tellurium | Te | (-2), ( 4), ( 6), редко ( 2) |
53 | Иод / Iodine | I | (-1), ( 1), ( 5), ( 7), редко ( 3), ( 4) |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | ( 1) |
56 | Барий / Barium | BA | ( 2) |
57 | Лантан / Lanthanum | La | ( 3) |
58 | Церий / Cerium | Ce | ( 3), ( 4) |
59 | Празеодим / Praseodymium | Pr | ( 3) |
60 | Неодим / Neodymium | Nd | ( 3), ( 4) |
61 | Прометий / Promethium | Pm | ( 3) |
62 | Самарий / Samarium | Sm | ( 3), редко ( 2) |
63 | Европий / Europium | Eu | ( 3), редко ( 2) |
64 | Гадолиний / Gadolinium | Gd | ( 3) |
65 | Тербий / Terbium | Tb | ( 3), ( 4) |
66 | Диспрозий / Dysprosium | Dy | ( 3) |
67 | Гольмий / Holmium | Ho | ( 3) |
68 | Эрбий / Erbium | Er | ( 3) |
69 | Тулий / Thulium | Tm | ( 3), редко ( 2) |
70 | Иттербий / Ytterbium | Ib | ( 3), редко ( 2) |
71 | Лютеций / Lutetium | Lu | ( 3) |
72 | Гафний / Hafnium | Hf | ( 4) |
73 | Тантал / Tantalum | Ta | ( 5), редко ( 3), ( 4) |
74 | Вольфрам / Tungsten | W | ( 6), редко ( 2), ( 3), ( 4) и ( 5) |
75 | Рений / Rhenium | Re | ( 2), ( 4), ( 6), ( 7), редко (-1), ( 1), ( 3), ( 5) |
76 | Осмий / Osmium | Os | ( 3), ( 4), ( 6), ( 8), редко ( 2) |
77 | Иридий / Iridium | Ir | ( 3), ( 4), ( 6), редко ( 1) и ( 2) |
78 | Платина / Platinum | Pt | ( 2), ( 4), ( 6), редко ( 1) и ( 3) |
79 | Золото / Gold | Au | ( 1), ( 3), редко ( 2) |
80 | Ртуть / Mercury | Hg | ( 1), ( 2) |
81 | Талий / Thallium | Tl | ( 1), ( 3), редко ( 2) |
82 | Свинец / Lead | Pb | ( 2), ( 4) |
83 | Висмут / Bismuth | Bi | ( 3), редко ( 3), ( 2), ( 4) и ( 5) |
84 | Полоний / Polonium | Po | ( 2), ( 4), редко (-2) и ( 6) |
85 | Астат / Astatine | At | — |
86 | Радон / Radon | Ra | 0 |
87 | Франций / Francium | Fr | — |
88 | Радий / Radium | Ra | ( 2) |
89 | Актиний / Actinium | Ac | ( 3) |
90 | Торий / Thorium | Th | ( 4) |
91 | Проактиний / Protactinium | Pa | ( 5) |
92 | Уран / Uranium | U | ( 3), ( 4), ( 6), редко ( 2) и ( 5) |
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al H2O KNO3 KOH → K[Al(OH)4] NH3↑.
2. KNO3 Al → KAlO2 Al2O3 N2.
3. Na2O2 H2SO4 KMnO4 → O2↑ MnSO4 Na2SO4 K2SO4 H2O.
4. NaCl H2SO4 MnO2 → Cl2 MnSO4 Na2SO4 H2O.
5. NaCl H2SO4 KMnO4 → Cl2 MnSO4 Na2SO4 K2SO4 H2O.
6. KNO2 H2SO4 MnO2 → MnSO4 KNO H2O.
7. KI H2SO4 KMnO4 → I2 MnSO4 K2SO4 H2O.
8. KI K2Cr2O7 H2SO4 → I2 Cr2(SO4)3 K2SO4 H2O.
9. C K2Cr2O7 H2SO4 → CO2 Cr2(SO4)3 K2SO4 H2O.
10. PbO2 HNO3 KI → Pb(NO3)2 I2 KNO3 H2O.
11. PbO2 HNO3 Mn(NO3)2 → Pb(NO3)2 HMnO4 H2O.
12. NaNO2 KMnO4 H2SO4 → NaNO3 MnSO4 K2SO4 H2O.
13. KNO2 KMnO4 H2SO4 → KNO3 MnSO4 K2SO4 H2O.
14. KNO2 K2Cr2O7 H2SO4 → KNO3 Cr2(SO4)3 K2SO4 H2O.
15. KNO2 KI H2SO4 → NO I2 K2SO4 H2O.
16. KNO2 FeSO4 H2SO4 → NO Fe2(SO4)3 K2SO4 H2O.
17. Ca3(PO4)2 C SiO2 → CaSiO3 P CO.
18. Sb HNO3 → Sb2O5 NO2 H2O.
19. H2O2 H2SO4 KMnO4 → MnSO4 O2 H2O K2SO4.
20. S HNO3 → H2SO4 NO2 H2O.
21. H2S HNO3 → H2SO4 NO2 H2O.
22. H2S KMnO4 → MnO2 S H2O KOH.
23. H2S K2Cr2O7 H2SO4 → S Cr2(SO4)3 K2SO4 H2O.
24. KMnO4 Na2SO3 H2SO4 → MnSO4 Na2SO4 K2SO4 H2O.
25. KMnO4 Na2SO3 H2O → MnO2 Na2SO4 KOH.
26. KMnO4 Na2SO3 KOH → K2MnO4 Na2SO4 H2O.
27. K2Cr2O7 K2SO3 H2SO4 → Cr2(SO4)3 K2SO4 H2O.
28. H2SO4 C → SO2 CO2 H2O.
29. H2SO4 Zn → ZnSO4 H2S H2O.
30. H2SO4 KBr → SO2 Br2 KHSO4 H2O.
31. H2SO4 KI → H2S I2 K2SO4 H2O.
32. PbO2 HCl → PbCl2 Cl2 H2O.
33. K2Cr2O7 HCl → CrCl3 Cl2 KCl H2O.
34. KMnO4 HCl → MnCl2 Cl2 KCl H2O.
35. KClO3 HCl → KCl Cl2 H2O.
36. HClO3 FeSO4 H2SO4 → Fe2(SO4)3 HCl H2O.
37. NaBrO3 NaBr H2SO4 → Br2 Na2SO4 H2O.
38. HNO3 I2 → HIO3 NO2 H2O.
39. HNO3 I2 → HIO3 NO H2O.
40. H2SO4 HI → I2 H2S S H2O.
41. Fe2(SO4)3 HI → FeSO4 I2 H2SO4.
42. HIO3 FeSO4 H2SO4 → Fe2(SO4)3 I2 H2O.
43. NaIO3 NaI H2SO4 → I2 Na2SO4 H2O.
44. KMnO4 Cu2O H2SO4 → MnSO4 CuSO4 K2SO4 H2O.
45. HNO3 Cu2S → CuSO4 Cu(NO3)2 NO2 H2O.
46. H2SO4 Cu2S → CuSO4 SO2 H2O.
47. Ag HNO3 → AgNO3 NO H2O.
48. Zn HNO3 → Zn(NO3)2 N2O H2O.
49. PH3 KMnO4 H2SO4 → H3PO4 MnSO4 K2SO4 H2O.
50. FeSO4 KMnO4 H2SO4 → Fe2(SO4)3 MnSO4 K2SO4 H2O.
51. H2S KMnO4 H2SO4 → S MnSO4 K2SO4 H2O.
52. Ca3P2 KMnO4 H2SO4 → CaSO4 H3PO4 MnSO4 K2SO4 H2O.
Факторы, влияющие на скорость химической реакции
1. Влияние концентрации реагирующих веществ на скорость химических реакций.
При изучении химических свойств кислорода в курсе химии 7 класса вы узнали, что на воздухе сера горит очень медленно, а в присутствии чистого кислорода быстро сгорает ярким пламенем.
При горении серы в присутствии чистого кислорода количество молекул кислорода, ударяющихся о поверхность серы, намного больше, чем в воздухе. Это связано с тем, что кислород занимает 21% объема воздуха.
Скорость химических реакций равна произведению концентраций веществ, участвующих в реакции. Например, для реакции А В=С v = к [А] • [В], где [А] и [В] — молярные концентрации веществ А и В, к — коэффициент пропорциональности.
2. Влияние температуры на скорость химических реакций.
При повышении температуры скорость реакции увеличивается в 2—4 раза:
где 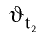
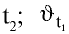
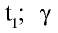
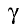
3. Влияние природы веществ на скорость химической реакции.
4. Для твердых веществ скорость реакции прямо пропорциональна поверхности веществ, вступающих в реакцию.
Рассмотрим эту зависимость на примере реакции соединения железа с серой.
Реакция Fe S = FeS протекает быстрее до строго определенной степени измельчения частиц железа. При увеличении степени измельчения частиц до порошкообразного состояния скорость реакции ослабевает, так как происходит спекание, которое снижает взаимное столкновение молекул.
5. Влияние катализатора на скорость химической реакции.
Реакция расщепления пероксида водорода ускоряется в присутствии
МпОг Процесс получения оксида серы (VI) ускоряется в присутствии катализатора оксида ванадия (V).
— Вещества, которые ускоряют химические реакции, но сами остаются без изменений, называются катализаторами.
Ингибиторы — это вещества, которые снижают возможность веществ вступать в химическую реакцию.
Элементы знаний, умений и навыков: скорость химической реакции, концентрация, температура, температурный коэффициент скорости, столкновение молекул, катализатор, ингибитор.
Физические свойства серебра:
| 400 | Физические свойства | |
| 401 | Плотность* | 10,49 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,320 г/см3 (при температуре плавления 961,78 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 961,78 °C (1234,93 K, 1763,2 °F) |
| 403 | Температура кипения* | 2162 °C (2435 K, 3924 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 11,28 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 254 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,235 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,36 Дж/(K·моль) |
| 411 | Молярный объём | 10,282955 см³/моль |
| 412 | Теплопроводность | 429 Вт/(м·К) (при стандартных условиях), 429 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 18,9 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | 174 мм2/С (при 300 K) |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |


