- Алгоритм действий
- Валентные возможности атома азота
- Валентные возможности атома углерода
- Давайте порассуждаем вместе
- История открытия
- Как определить степень окисления
- Нахождение в природе
- Оксид серы (iv)
- Оксид серы (vi)
- Соли серной кислоты – сульфаты
- Способы получения
- Таблица степеней окисления химических элементов (1 часть):
- Таблица степеней окисления химических элементов (2 часть):
- Таблица степеней окисления химических элементов (3 часть):
- Таблица степени окисления химических элементов
- Химические свойства
- Химические свойства кислорода
- Химические свойства сероводорода
- Химические свойства серы
- Химические свойства сульфидов
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Степень окисления Cl2, S8 равна 0.
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 равен 1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна 1.
Также известно, что водород всюду, кроме гидридов, имеет заряд 1. В данном случае есть 4 атома водорода, т. е. 1 × 4.
Составим формулу: х ( 1) × 4 = 1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4 1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число 1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: ( 1) × 2 х (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 1S-6O4-2.
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор(
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованнаяπ-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления 5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4 , азотная кислота и д.р).
Валентные возможности атома углерода
Рассмотрим электронное строение атома углерода. В основном состоянии электронная конфигурация его внешнего уровня выглядит следующим образом:
Т.е. в основном состоянии на внешнем энергетическом уровне невозбужденного атома углерода находится 2 неспаренных электрона. В таком состоянии он может проявлять валентность, равную II. Однако атом углерода очень легко переходит в возбужденное состояние при сообщении ему энергии, и электронная конфигурация внешнего слоя в этом случае принимает вид:
Несмотря на то что на процесс возбуждения атома углерода тратится некоторое количество энергии, траты с избытком компенсируются при образовании четырех ковалентных связей. По этой причине валентность IV намного более характерна для атома углерода. Так, например, валентность IV углерод имеет в молекулах углекислого газа, угольной кислоты и абсолютно всех органических веществ.
Помимо неспаренных электронов и неподеленных электронных пар на валентные возможности также влияет наличие вакантных (
Резюмируя информацию по валентным возможностям атома углерода:
1) Для углерода возможны валентности II, III, IV
2) Наиболее распространенная валентность углерода в соединениях IV
3) В молекуле угарного газа CO связь тройная (!), при этом одна из трех связей образована по донорно-акцепторному механизму
Давайте порассуждаем вместе
1. Атом азота в азотной кислоте имеет степень окисления:
1) 0
2) 3
3) 5
4) -5
Ответ: Формула азотной кислоты HNO3, степень окисления водорода равна 1, кислорода -2, степень окисления азота обозначим за х и рассчитаем ее по уравнению: 1 х 3* (-2) = 0
х = 5
2. Степень окисления -2 атом серы проявляет в каждом из соединений
1) CuSO4 и H2S
2) SO2 и Na2S
3) H2SO3 и SO3
4) CaS и FeS
Ответ: степень окисления -2 атом серы проявляет в бинарных соединениях с металлами (сульфидах) и водородом (H2S), поэтому правильный ответ CaS и FeS
3. Максимально возможную степень окисления атом хлора проявляет в соединении
1) HCl
2) HClO3
3) KClO4
4) Ba(ClO2)2
Ответ: атом хлора расположен в 7 группе, поэтому может иметь максимальную степень окисления 7. Такую степень окисления атом хлора проявляет в веществе KClO4. Проверим это. У калия степень окисления 1, у кислорода -2, у хлора х. Из уравнения: 1 х 4* (-2) = 0 находим х = 7
4. В соединениях NO2 и NH3 степени окисления азота соответственно равны:
1) 4 и -3
2) 2 и 3
3) 2 и -2
4) 5 и 3
Ответ: В оксиде азота (IV) у кислорода степень окисления -2, значит у азота степень окисления 4. В аммиаке у водорода степень окисления 1, значит у азота степень окисления -3.
5. Установите соответствие между схемами превращения веществ и изменением степени окисления хлора
Ответ:
В молекуле хлора Cl2 степень окисления хлора равна 0
В молекуле ClF3 у фтора степень окисления -1, значит у хлора 3
В молекуле ICl3 у хлора степень окисления -1
В молекуле ClO2 у кислорода степень окисления -2, значит у хлора 4
В молекуле HCl у водорода 1, а у хлора -1
6. Установите соответствие между схемами превращения веществ и изменением степени окисления серы
Ответ:
В молекуле сероводорода у водорода степень окисления 1, а у серы -2
В молекуле SO2 у кислорода степень окисления -2, а у серы 4
В молекуле сернистой кислоты у водорода степень окисления 1, у кислорода -2, значит у серы 4
В молекуле серной кислоты у водорода степень окисления 1, у кислорода -2, значит у серы 6
7. Установите соответствие между схемами превращения веществ и изменением степени окисления азота
Ответ:
В молекуле NO степень окисления у кислорода равна -2, а у азота 2
В молекуле азота N2 степень окисления азота равна 0
В молекуле NO2 степень окисления азота равна 4
В молекуле N2H4 степень окисления азота равна -2
8. В каких реакциях железо выступает в роли восстановителя?
1) Fe S = FeS
2) 2FeCl3 H2 = 2FeCl2 2HCl
3) 2Fe(OH)3 = Fe2O3 3H2O
4) 3Fe 2O2 = Fe3O4
5) 2FeCl2 Cl2 = 2FeCl3
Ответ: 1, 4, 5 , т.к. в этих реакциях железо отдает электроны и повышает свою степень окисления.
9. В каких реакциях сера не изменяет степень окисления?
1) Cu S = CuS
2) 2HCl Na2SO3 = 2NaCl SO2 H2O
3) Cu 2H2SO4 = CuSO4 SO2 2H2O
4) SO2 H2O = H2SO3
5) SO2 2H2 = S 2H2O
Ответ: 2, 4, т.к. в этих реакциях сера не изменяет свою степень окисления.
10. В каком соединении фосфор проявляет степень окисления -3
1) P2O3
2) Na3PO4
3)Ca3P2
4) PCl3
Ответ: степень окисления -3 фосфор проявляет в бинарных соединениях с металлами, значит в фосфиде кальция Ca3P2 у кальцая степень окисления 2, а у фосфора -3.
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
- 2HgO →ot 2Hg O2↑
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Как определить степень окисления
Загрузить PDF
Загрузить PDF
X
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 13 человек(а).
Количество просмотров этой статьи: 629 961.
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Оксид серы (iv)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1.Сжигание серы на воздухе:
S O2 → SO2
2.Горение сульфидов и сероводорода:
2H2S 3O2 → 2SO2 2H2O
2CuS 3O2 → 2SO2 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 H2SO4 → Na2SO4 SO2 H2O
4.Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu 2H2SO4 → CuSO4 SO2 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотныйоксид. За счет серы в степени окисления 4 проявляет свойства окислителяи восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочамии оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 2NaOH(изб) → Na2SO3 H2O
SO2(изб) NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 Br2 2H2O → H2SO4 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 2HNO3 → H2SO4 2NO2
Озон также окисляет оксид серы (IV):
SO2 O3 → SO3 O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 2H2O 2KMnO4 → 2H2SO4 2MnSO4 K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 2Н2S → 3S 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 2CO → 2СО2 S
SO2 С → S СO2
Оксид серы (vi)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 O3 → SO3 O2
SO2 NO2 → SO3 NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 3SO3
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 2NaOH(избыток) → Na2SO4 H2O
SO3(избыток) NaOH → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления ( 6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 2KI → I2 K2SO3
3SO3 H2S → 4SO2 H2O
5SO3 2P → P2O5 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 Na2SO4 → BaSO4↓ 2NaCl
Видеоопытвзаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
2CuSO4 → 2CuO SO2 O2 (SO3)
2Al2(SO4)3 → 2Al2O3 6SO2 3O2
2ZnSO4 → 2ZnO SO2 O2
2Cr2(SO4)3 → 2Cr2O3 6SO2 3O2
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
4FeSO4 → 2Fe2O3 4SO2 O2
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления 6 сульфаты проявляют окислительныесвойстваи могут взаимодействовать с восстановителями.
Например, сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 4C → CaS 4CO
4.Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Способы получения
1. Серную кислоту в промышленностипроизводят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 11O2 → 2Fe2O3 8SO2 Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 O2 ↔ 2SO3 Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Таблица степеней окисления химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Степень окисления |
| 1 | Водород | H | 1, 0, -1 |
| 2 | Гелий | He | 0 |
| 3 | Литий | Li | 1 |
| 4 | Бериллий | Be | 0, 1, 2 |
| 5 | Бор | B | -1, 0, 1, 2, 3 |
| 6 | Углерод | C | -4 , -3 , -2 , -1 , 0 , 1, 2, 3, 4 |
| 7 | Азот | N | -3 , -2, -1, 0, 1, 2, 3 , 4, 5 |
| 8 | Кислород | O | -2, -1, -0,5, 0, 1, 2 |
| 9 | Фтор | F | -1, 0 |
| 10 | Неон | Ne | 0 |
| 11 | Натрий | Na | -1, 0, 1 |
| 12 | Магний | Mg | 0, 2 |
| 13 | Алюминий | Al | 0, 1, 2, 3 |
| 14 | Кремний | Si | -4 , -3, -2, -1, 0, 1, 2, 3, 4 |
| 15 | Фосфор | P | -3 , -2, -1, 0, 1, 2, 3 , 4, 5 |
| 16 | Сера | S | -2 , -1, 0 , 1 , 2 , 3, 4 , 5, 6 |
| 17 | Хлор | Cl | -1 , 0, 1 , 2, 3 , 4, 5 , 6, 7 |
| 18 | Аргон | Ar | 0 |
| 19 | Калий | K | 0, 1 |
| 20 | Кальций | Ca | 0, 2 |
| 21 | Скандий | Sc | 0, 1, 2, 3 |
| 22 | Титан | Ti | -2, -1, 0, 1, 2, 3, 4 |
| 23 | Ванадий | V | -3, -1, 0, 1, 2, 3, 4, 5 |
| 24 | Хром | Cr | -4, -2, -1, 0, 1, 2 , 3 , 4, 5, 6 |
| 25 | Марганец | Mn | -3, -2, -1, 0, 1, 2 , 3, 4 , 5, 6, 7 |
| 26 | Железо | Fe | -4, -2, -1, 0, 1, 2 , 3 , 4, 5, 6 , 7 |
| 27 | Кобальт | Co | -3, -1, 0, 1, 2 , 3 , 4, 5 |
| 28 | Никель | Ni | -2, -1, 0, 1, 2 , 3, 4 |
| 29 | Медь | Cu | -2, 0, 1, 2 , 3, 4 |
| 30 | Цинк | Zn | -2, 0, 1, 2 |
| 31 | Галлий | Ga | -5, -4, -3, -2, -1, 1, 2, 3 |
| 32 | Германий | Ge | -4 -3, -2, -1, 0, 1, 2 , 3, 4 |
| 33 | Мышьяк | As | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
| 34 | Селен | Se | -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 35 | Бром | Br | -1, 0, 1, 3, 4, 5, 7 |
Таблица степеней окисления химических элементов (2 часть):
| 36 | Криптон | Kr | 0, 1, 2 |
| 37 | Рубидий | Rb | -1, 0, 1 |
| 38 | Стронций | Sr | 0, 1, 2 |
| 39 | Иттрий | Y | 0, 1, 2, 3 |
| 40 | Цирконий | Zr | -2, 0, 1, 2, 3, 4 |
| 41 | Ниобий | Nb | -3, -1, 0, 1, 2, 3, 4, 5 |
| 42 | Молибден | Mo | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 43 | Технеций | Tc | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 44 | Рутений | Ru | -4, -2, 0, 1, 2, 3, 4, 5, 6, 7, 8 |
| 45 | Родий | Rh | -3, -1, 0, 1, 2, 3, 4, 5, 6 |
| 46 | Палладий | Pd | 0, 1, 2, 3, 4, 5, 6 |
| 47 | Серебро | Ag | -2, -1, 1, 2, 3 |
| 48 | Кадмий | Cd | -2, 1, 2 |
| 49 | Индий | In | -5, -2, -1, 1, 2, 3 |
| 50 | Олово | Sn | -4, -3, -2, -1, 0, 1, 2, 3, 4 |
| 51 | Сурьма | Sb | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
| 52 | Теллур | Te | 2, -1, 1, 2, 3, 4, 5, 6 |
| 53 | Йод | I | -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 54 | Ксенон | Xe | 0, 1, 2, 4, 6, 8 |
| 55 | Цезий | Cs | -1, 1 |
| 56 | Барий | Ba | 1, 2 |
| 57 | Лантан | La | 0, 1, 2, 3 |
| 58 | Церий | Ce | 1, 2, 3, 4 |
| 59 | Празеодим | Pr | 0, 1, 2, 3, 4, 5 |
| 60 | Неодим | Nd | 0, 2, 3, 4 |
| 61 | Прометий | Pm | 2, 3 |
| 62 | Самарий | Sm | 0, 2, 3 |
| 63 | Европий | Eu | 1, 2, 3 |
| 64 | Гадолиний | Gd | 0, 1, 2, 3 |
| 65 | Тербий | Tb | 0, 1, 2, 3, 4 |
| 66 | Диспрозий | Dy | 0, 1, 2, 3, 4 |
| 67 | Гольмий | Ho | 0, 1, 2, 3 |
| 68 | Эрбий | Er | 0, 1, 2, 3 |
| 69 | Тулий | Tm | 2, 3 |
| 70 | Иттербий | Yb | 1, 2, 3 |
Таблица степеней окисления химических элементов (3 часть):
| 71 | Лютеций | Lu | 0, 1, 2, 3 |
| 72 | Гафний | Hf | -2, 0, 1, 2, 3, 4 |
| 73 | Тантал | Ta | -3, -1, 1, 2, 3, 4, 5 |
| 74 | Вольфрам | W | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 75 | Рений | Re | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7 |
| 76 | Осмий | Os | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6, 7, 8 |
| 77 | Иридий | Ir | -3, -1, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 |
| 78 | Платина | Pt | -3, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| 79 | Золото | Au | -3, -2, -1, 0, 1, 2, 3, 5 |
| 80 | Ртуть | Hg | -2, 1, 2 |
| 81 | Таллий | Tl | -5, -2, -1, 1, 2, 3 |
| 82 | Свинец | Pb | -4, -2, -1, 0, 1, 2, 3, 4-4, -2, -1, 0, 1, 2, 3, 4 |
| 83 | Висмут | Bi | -3, -2, -1, 1, 2, 3, 4, 5 |
| 84 | Полоний | Po | -2, 2, 4, 5, 6 |
| 85 | Астат | At | -1, 1, 3, 5, 7 |
| 86 | Радон | Rn | 0, 2, 6, 8 |
| 87 | Франций | Fr | 0, 1 |
| 88 | Радий | Ra | 2 |
| 89 | Актиний | Ac | 3 |
| 90 | Торий | Th | 1, 2, 3, 4 |
| 91 | Протактиний | Pa | 2, 3, 4, 5 |
| 92 | Уран | U | 1, 2, 3, 4, 5, 6 |
| 93 | Нептуний | Np | 2, 3, 4, 5, 6, 7 |
| 94 | Плутоний | Pu | 2, 3, 4, 5, 6, 7 |
| 95 | Америций | Am | 2, 3, 4, 5, 6, 7 |
| 96 | Кюрий | Cm | 3, 4, 5, 6 |
| 97 | Берклий | Bk | 2, 3, 4, 5 |
| 98 | Калифорний | Cf | 2, 3, 4, 5 |
| 99 | Эйнштейний | Es | 2, 3, 4 |
| 100 | Фермий | Fm | 2, 3 |
| 101 | Менделевий | Md | 2, 3 |
| 102 | Нобелий | No | 2, 3 |
| 103 | Лоуренсий | Lr | 3 |
| 104 | Резерфордий (Курчатовий) | Rf | 2, 3, 4 – предположительно |
| 105 | Дубний (Нильсборий) | Db | 3, 4, 5 – предположительно |
| 106 | Сиборгий | Sg | 0, 3, 4, 5, 6 – предположительно |
| 107 | Борий | Bh | 3, 4, 5, 7 – предположительно |
| 108 | Хассий | Hs | 2, 3, 4, 6, 8 – предположительно |
| 109 | Мейтнерий | Mt | 1, 3, 4, 6, 8, 9 – предположительно |
| 110 | Дармштадтий | Ds | 0, 2, 4, 6, 8 – предположительно |
Коэффициент востребованности 2 897
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na 1I-1, Mg 2Cl-12, Al 3F-13, Zr 4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно ( 1) и ( 2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, ( 2), ( 4), ( 6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
1 | Водород / Hydrogen | H | ( 1), (-1) |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | ( 1) |
4 | Бериллий / Beryllium | Be | ( 2) |
5 | Бор / Boron | B | (-1), 0, ( 1), ( 2), ( 3) |
6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, ( 2), ( 4) |
7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, ( 1), ( 2), ( 3), ( 4), ( 5) |
8 | Кислород / Oxygen | O | (-2), (-1), 0, ( 1), ( 2) |
9 | Фтор / Fluorine | F | (-1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | ( 1) |
12 | Магний / Magnesium | Mg | ( 2) |
13 | Алюминий / Aluminum | Al | ( 3) |
14 | Кремний / Silicon | Si | (-4), 0, ( 2), ( 4) |
15 | Фосфор / Phosphorus | P | (-3), 0, ( 3), ( 5) |
16 | Сера / Sulfur | S | (-2), 0, ( 4), ( 6) |
17 | Хлор / Chlorine | Cl | (-1), 0, ( 1), ( 3), ( 5), ( 7), редко ( 2) и ( 4) |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | ( 1) |
20 | Кальций / Calcium | Ca | ( 2) |
21 | Скандий / Scandium | Sc | ( 3) |
22 | Титан / Titanium | Ti | ( 2), ( 3), ( 4) |
23 | Ванадий / Vanadium | V | ( 2), ( 3), ( 4), ( 5) |
24 | Хром / Chromium | Cr | ( 2), ( 3), ( 6) |
25 | Марганец / Manganese | Mn | ( 2), ( 3), ( 4), ( 6), ( 7) |
26 | Железо / Iron | Fe | ( 2), ( 3), редко ( 4) и ( 6) |
27 | Кобальт / Cobalt | Co | ( 2), ( 3), редко ( 4) |
28 | Никель / Nickel | Ni | ( 2), редко ( 1), ( 3) и ( 4) |
29 | Медь / Copper | Cu | 1, 2, редко ( 3) |
30 | Цинк / Zinc | Zn | ( 2) |
31 | Галлий / Gallium | Ga | ( 3), редко ( 2) |
32 | Германий / Germanium | Ge | (-4), ( 2), ( 4) |
33 | Мышьяк / Arsenic | As | (-3), ( 3), ( 5), редко ( 2) |
34 | Селен / Selenium | Se | (-2), ( 4), ( 6), редко ( 2) |
35 | Бром / Bromine | Br | (-1), ( 1), ( 5), редко ( 3), ( 4) |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | ( 1) |
38 | Стронций / Strontium | Sr | ( 2) |
39 | Иттрий / Yttrium | Y | ( 3) |
40 | Цирконий / Zirconium | Zr | ( 4), редко ( 2) и ( 3) |
41 | Ниобий / Niobium | Nb | ( 3), ( 5), редко ( 2) и ( 4) |
42 | Молибден / Molybdenum | Mo | ( 3), ( 6), редко ( 2), ( 3) и ( 5) |
43 | Технеций / Technetium | Tc | ( 6) |
44 | Рутений / Ruthenium | Ru | ( 3), ( 4), ( 8), редко ( 2), ( 6) и ( 7) |
45 | Родий / Rhodium | Rh | ( 4), редко ( 2), ( 3) и ( 6) |
46 | Палладий / Palladium | Pd | ( 2), ( 4), редко ( 6) |
47 | Серебро / Silver | Ag | ( 1), редко ( 2) и ( 3) |
48 | Кадмий / Cadmium | Cd | ( 2), редко ( 1) |
49 | Индий / Indium | In | ( 3), редко ( 1) и ( 2) |
50 | Олово / Tin | Sn | ( 2), ( 4) |
51 | Сурьма / Antimony | Sb | (-3), ( 3), ( 5), редко ( 4) |
52 | Теллур / Tellurium | Te | (-2), ( 4), ( 6), редко ( 2) |
53 | Иод / Iodine | I | (-1), ( 1), ( 5), ( 7), редко ( 3), ( 4) |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | ( 1) |
56 | Барий / Barium | BA | ( 2) |
57 | Лантан / Lanthanum | La | ( 3) |
58 | Церий / Cerium | Ce | ( 3), ( 4) |
59 | Празеодим / Praseodymium | Pr | ( 3) |
60 | Неодим / Neodymium | Nd | ( 3), ( 4) |
61 | Прометий / Promethium | Pm | ( 3) |
62 | Самарий / Samarium | Sm | ( 3), редко ( 2) |
63 | Европий / Europium | Eu | ( 3), редко ( 2) |
64 | Гадолиний / Gadolinium | Gd | ( 3) |
65 | Тербий / Terbium | Tb | ( 3), ( 4) |
66 | Диспрозий / Dysprosium | Dy | ( 3) |
67 | Гольмий / Holmium | Ho | ( 3) |
68 | Эрбий / Erbium | Er | ( 3) |
69 | Тулий / Thulium | Tm | ( 3), редко ( 2) |
70 | Иттербий / Ytterbium | Ib | ( 3), редко ( 2) |
71 | Лютеций / Lutetium | Lu | ( 3) |
72 | Гафний / Hafnium | Hf | ( 4) |
73 | Тантал / Tantalum | Ta | ( 5), редко ( 3), ( 4) |
74 | Вольфрам / Tungsten | W | ( 6), редко ( 2), ( 3), ( 4) и ( 5) |
75 | Рений / Rhenium | Re | ( 2), ( 4), ( 6), ( 7), редко (-1), ( 1), ( 3), ( 5) |
76 | Осмий / Osmium | Os | ( 3), ( 4), ( 6), ( 8), редко ( 2) |
77 | Иридий / Iridium | Ir | ( 3), ( 4), ( 6), редко ( 1) и ( 2) |
78 | Платина / Platinum | Pt | ( 2), ( 4), ( 6), редко ( 1) и ( 3) |
79 | Золото / Gold | Au | ( 1), ( 3), редко ( 2) |
80 | Ртуть / Mercury | Hg | ( 1), ( 2) |
81 | Талий / Thallium | Tl | ( 1), ( 3), редко ( 2) |
82 | Свинец / Lead | Pb | ( 2), ( 4) |
83 | Висмут / Bismuth | Bi | ( 3), редко ( 3), ( 2), ( 4) и ( 5) |
84 | Полоний / Polonium | Po | ( 2), ( 4), редко (-2) и ( 6) |
85 | Астат / Astatine | At | — |
86 | Радон / Radon | Ra | 0 |
87 | Франций / Francium | Fr | — |
88 | Радий / Radium | Ra | ( 2) |
89 | Актиний / Actinium | Ac | ( 3) |
90 | Торий / Thorium | Th | ( 4) |
91 | Проактиний / Protactinium | Pa | ( 5) |
92 | Уран / Uranium | U | ( 3), ( 4), ( 6), редко ( 2) и ( 5) |
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 MgO → MgSO4 H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 КОН → KHSО4 H2O
H2SO4 2КОН → К2SО4 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 2Al(OH)3 → Al2(SO4)3 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 2NaHCO3 → Na2SO4 CO2 H2O
Или с силикатом натрия:
H2SO4 Na2SiO3 → Na2SO4 H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) H2SO4 → NaHSO4 HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) H2SO4 → NaHSO4 HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 BaCl2 → BaSO4 2HCl
5.Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) Fe → FeSO4 H2
Серная кислота взаимодействует с аммиакомс образованием солей аммония:
H2SO4 NH3 → NH4HSO4
Концентрированнаясерная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) 2Fe → Fe2(SO4)3 3SO2 6H2O
6H2SO4(конц.) 2Al → Al2(SO4)3 3SO2 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) Cu → CuSO4 SO2 ↑ 2H2O
2H2SO4(конц.) Hg → HgSO4 SO2 ↑ 2H2O
2H2SO4(конц.) 2Ag → Ag2SO4 SO2↑ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg 4H2SO4 → 3MgSO4 S 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) 4Zn → 4ZnSO4 H2S↑ 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 Na2SO4 → BaSO4↓ 2NaCl
Видеоопытвзаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7.Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) 2P → 2H3PO4 5SO2↑ 2H2O
2H2SO4(конц.) С → СО2↑ 2SO2↑ 2H2O
2H2SO4(конц.) S → 3SO2 ↑ 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) 2KBr → Br2↓ SO2↑ 2KHSO4 2H2O
5H2SO4(конц.) 8KI → 4I2↓ H2S↑ K2SO4 4H2O
H2SO4(конц.) 3H2S → 4S↓ 4H2O
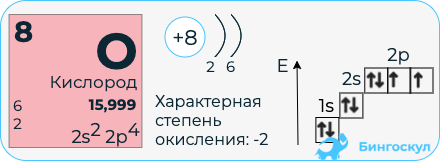
Химические свойства кислорода
Кислород входит в VI группу главной подгруппы периодической системы химических элементов. На внешнем энергетическом уровне 6 электронов, то есть незавершенный. Поэтому он способен достраивать свой уровень, присоединяя электроны и проявляя окислительные свойства. Степень окисления характерна -2, исключение составляют пероксиды, в которых он проявляет степень окисления -1 и фторид кислорода (степень окисления у кислорода 2). Кислород никогда не проявляет положительных степеней окисления, что говорит о его высокой окислительной способности. Кислород является универсальным окислителем. Реакции горения так же относятся к реакциям окисления.
Кислород способен образовывать две аллотропные модификации O2 и O3 (озон). Причем озон является более сильным окислителем, чем кислород.
Кислород характеризуется проявлением преимущественно окислительных свойств, в виде исключения и восстановительных.
Восстановительные свойства проявляет в реакции с фтором, которая протекает при высоких температурах. Продуктом реакции является фторид кислорода (II) – бесцветный ядовитый газ.
F2 O2 → OF2
Окислительные свойства
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
Химические свойства сероводорода
1.В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S 2NaOH → Na2S 2H2OH2S NaOH → NaНS H2O
2.Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S O2 → 2S 2H2O
В избытке кислорода:
2H2S 3O2 → 2SO2 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S Br2 → 2HBr S↓
H2S Cl2 → 2HCl S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S 4Cl2 4H2O → H2SO4 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S 2HNO3(конц.) → S 2NO2 2H2O
При кипячении сера окисляется до серной кислоты:
H2S 8HNO3(конц.) → H2SO4 8NO2 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S SO2 → 3S 2H2O
Соединения железа (III) также окисляют сероводород:
H2S 2FeCl3 → 2FeCl2 S 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S K2Cr2O7 4H2SO4 → 3S Cr2(SO4)3 K2SO4 7H2O
2H2S 4Ag O2 → 2Ag2S 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S H2SO4(конц.) → S SO2 2H2O
Либо до оксида серы (IV):
H2S 3H2SO4(конц.) → 4SO2 4H2O
4.Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S Pb(NO3)2 → PbS 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопытвзаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя(при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горениисеры на воздухе образуется оксид серы (IV):
S O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода)образуются галогениды серы:
S Cl2 → SCl2 (S2Cl2)
S 3F2 → SF6
1.3. При взаимодействии фосфора иуглерода с серой образуются сульфиды фосфора и сероуглерод:
2P 3S → P2S3
2P 5S → P2S5
2S C → CS2
1.4. При взаимодействии с металламисера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S Fe → FeS
S Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S 2Al → Al2S3
1.5. С водородомсера взаимодействует при нагревании с образованием сероводорода:
S H2 → H2S
2.Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителямисера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S 6HNO3 → H2SO4 6NO2 2H2O
Серная кислотатакже окисляет серу. Но, поскольку S 6 не может окислить серу же до степени окисления 6, образуется оксид серы (IV):
S 2H2SO4 → 3SO2 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до 4:
S 2KClO3 → 3SO2 2KCl
Взаимодействие серы с сульфитами(при кипячении) приводит к образованию тиосульфатов:
S Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S 6NaOH → Na2SO3 2Na2S 3H2O
При взаимодействии с перегретым паром сера диспропорционирует:
3S 2H2O (пар) → 2H2S SO2
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуютсяпо аниону, среда водных растворов сульфидов щелочная:
K2S H2O ⇄ KHS KOHS2– H2O ⇄ HS– OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS 2HCl → CaCl2 H2S
А сульфид никеля, например, не растворяется:
NiS HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS 8HNO3 → CuSO4 8NO2 4H2O
или горячей концентрированной серной кислоте:
CuS 4H2SO4(конц. гор.) → CuSO4 4SO2 4H2O
4.Сульфиды проявляют восстановительныесвойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS 4H2O2 → PbSO4 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS Cl2 → CuCl2 S
5.Сульфиды горят(обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS 3O2 → 2CuO 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 9O2 → 2Cr2O3 6SO2
2ZnS 3O2 → 2SO2 ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественныена ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S Pb(NO3)2 → PbS↓ 2NaNO3
Na2S 2AgNO3 → Ag2S↓ 2NaNO3
Na2S Cu(NO3)2 → CuS↓ 2NaNO3
7.Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 6H2O → 2Al(OH)3 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S 2AlCl3 6H2O → 2Al(OH)3 3H2S 6NaCl

