Внимание: угарный газ!
 Отравление угарным газом – одна из наиболее частых причин смертельных случаев при использовании природного газа в быту.
Отравление угарным газом – одна из наиболее частых причин смертельных случаев при использовании природного газа в быту.
Что нужно знать о процессе горения, чтобы не угореть?
Ядовитый для человека угарный газ образуется при неполном сгорании любого топлива.
Горение является химической реакцией, при которой происходит взаимодействие имеющихся в топливе углеводородов с кислородом, который содержится в воздухе.
При полном горении топлива, будь то дрова, уголь, мазут или природный газ, в окружающую среду вместе с выделяемым теплом и дымом поступают практически безвредные углекислый газ (СО2) и водяные пары.
При полном сгорании природного газа пламя горелки визуально светло-голубое или голубовато-фиолетовое.
Если же вследствие недостаточного количества воздуха сгорание топлива происходит не полностью, то выделяются горючие вещества – водород, сажа, а также смертельный для человека угарный газ — он же окись углерода (СО).
При неполном горении можно заметить в пламени языки копоти.
Молчаливый убийца
Угарный газ часто называют «молчаливым убийцей». Он не имеет ни цвета, ни вкуса, ни запаха. При этом распространяется очень быстро, смешиваясь с воздухом без потери своих отравляющих свойств. Поступая в организм при дыхании, угарный газ проникает из легких в кровеносную систему, где соединяется с гемоглобином. В результате кровь утрачивает способность переносить и доставлять тканям кислород, и организм очень быстро начинает испытывать его недостаток.
Токсичность угарного газа весьма высока и определяется его концентрацией в воздухе. Содержание СО в воздухе 0,01-0,02% может вызвать легкое отравление. Нахождение человека в течение часа в помещении, где концентрация угарного газа достигает 0,1%, приводит к острому отравлению средней тяжести; тяжелое отравление наступает при концентрации угарного газа 0,3 % в течение получаса. Смерть наступает, когда человек вдыхает воздух с 0,4% угарного газа в течение 30 мин или при концентрации СО 0,5% на протяжении всего одной минуты.
Внимание!
При интенсивном горении топлива в помещении с нарушенным воздухообменом (при герметично закрытых окнах и дверях, отсутствии тяги) смертельная концентрация угарного газа иногда достигается за считанные минуты!
Неотложная помощь при отравлении угарным газом
Симптомами отравления угарным газом в зависимости от степени поражения и общего состояния организма являются: головокружение, головная боль, тошнота, рвота, шум в ушах, одышка, кашель, слезящиеся глаза.
Неотложная помощь при первых признаках отравления заключается в немедленном прекращении дальнейшего проникновения ядовитой окиси углерода в организм потерпевшего. Его следует срочно вывести из загрязненного помещения, обеспечить доступ чистого воздуха. Вызвать «скорую помощь» по телефону 03. До приезда врача можно поднести к носу ватку, смоченную нашатырным спиртом, растереть грудь, на ноги наложить грелки, на грудь и спину горчичники, напоить пострадавшего горячим чаем или кофе. При тяжелых отравлениях и поражениях средней тяжести необходима срочная госпитализация.
Спасительный воздух
Гарантированно избежать отравления угарным газом в помещении, где используются газовые приборы, можно, обеспечив достаточный приток воздуха с улицы к газовой горелке и хорошую тягу в дымоходе. По этому принципу работают современные безопасные газовые котлы и водонагреватели с закрытой камерой сгорания: забор воздуха для горения в них осуществляется прямо с улицы по отдельному воздуховоду; продукты сгорания также выводятся по индивидуальному дымоходу и не соприкасаются с воздухом помещения.
Особую опасность с точки зрения рисков отравления угарным газом представляют проточные газовые водонагреватели (колонки) с камерой сгорания открытого типа без отвода продуктов сгорания, которые ранее массово устанавливались (в том числе в многоквартирных домах) и до сих пор используются в населенных пунктах, не имеющих централизованного горячего водоснабжения.
В целях обеспечения безопасности при использовании таких колонок для них предусмотрено принудительное нагнетание воздуха в помещение. Однако многие жители, проводя в своих квартирах ремонты, в нарушение правил эксплуатации со временем ликвидируют такие вентиляторы, также существенно ухудшают циркуляцию воздуха за счет установки герметичных пластиковых окон и дверей.
Самовольное изменение системы воздухообмена в помещениях нередко приводит к отравлениям угарным газом даже при исправно работающем газовом оборудовании!
О чем надо помнить, чтобы не отравиться угарным газом:
 Чтобы избежать отравления угарным газом во время работы газового оборудования обязательно открывайте форточки, приоткрывайте окна для обеспечения притока воздуха в помещение.
Чтобы избежать отравления угарным газом во время работы газового оборудования обязательно открывайте форточки, приоткрывайте окна для обеспечения притока воздуха в помещение.
Герметичное закрытие окон и дверей во время использования газовых приборов способствует выгоранию кислорода в помещении и приводит к неполному сгоранию топлива — выделению ядовитого угарного газа.
Газовый проточный водонагреватель используется для кратковременного подогрева воды. Его работа в постоянном режиме увеличивает риск отравления продуктами неполного сгорания топлива.
Не используйте для обогрева помещений газовую плиту или духовку – при недостаточной циркуляции воздуха это также может привести к выгоранию кислорода в помещении и, как следствие – к образованию угарного газа.
Проверяйте тягу перед использованием газовой колонки или отопительного котла.
Не забудьте заключить договор на проведение проверки дымовых и вентиляционных каналов!
В соответствии с п. 14 Постановления Правительства РФ от 14 мая 2022г. № 410 «О мерах по обеспечению безопасности при использовании и содержании внутридомового и внутриквартирного газового оборудования» ответственным за содержание общего имущества в многоквартирном доме, а в домовладениях собственникам домовладений необходимо заключить договор о проверке, а также при необходимости об очистке и (или) ремонте дымовых и вентиляционных каналов со специализированной организацией.
Реквизиты организаций, допущенных к выполнению данного вида работ:
1. Всероссийское добровольное пожарное общество:
г. Владимир, ул. Новоямская, д.77, тел. 54-18-80;
г. Александров, Советский пер., д. 27А, тел. (49244)3-06-70;
г. Вязники, ул. Мочалова. д. 2, тел. (49233)2-66-84;
г. Гусь-Хрустальный, ул. Ванцетти, д. 38, тел. (49241)2-85-86;
г. Ковров, ул. Свердлова, д. 91/1, тел. (49232)2-22-14;
г. Муром, Площадь революции, д. 3, тел. (49234)3-31-62;
г. Петушки, ул. Вокзальная, д. 105, тел. (49243)2-22-83;
г. Собинка, ул. Шибаева, д. 1Б, тел. (49242)2-24-89.
2. Печной центр. ИП Коляганов Андриан Владимирович
г. Владимир, ул. Связи, д. 8, оф. 7, тел. 33-42-69, моб. 9107752620.
3. Компания Евротекс на ул. Гражданская, 1
Адрес: 600000, Владимир, ул. Гражданская, 1
Телефон: 7 (4922) 32-22-05
4. Рута ТС на ул. Куйбышева, 28а
Адрес: 600026, Владимир, ул. Куйбышева, 28а
Телефон: 7 (4922) 33-57-74
5. ИП Чиркова М.Ю. на ул. Куйбышева, 26ж
Адрес: 600035, Владимир, ул. Куйбышева, 26ж, маг. Тандем, секция 46С, 19А, 35А, блок Запад 9/1
Телефон: 7 (4922) 47-02-33
Режим работы: пн-пт 09:00-18:00
6. Техно Стрим Владимир на ул. Куйбышева, 4
Адрес: Владимир, ул. Куйбышева, 4
Телефон: 7 (4922) 46-11-11
Режим работы: пн-пт 09:00-17:00
7. Строй Климат на ул. Батурина, 37б
Адрес: 600017, Владимир, ул. Батурина, 37б
Телефон: 7 (4922) 42-31-02; 7 (4922) 53-67-51
8. Энерго-Спектр на ул. Добросельская, 217
Адрес: Владимир, ул. Добросельская, 217
Телефон: 7 (4922) 31-32-04
Режим работы: пн-пт 09:00-18:00
9. Группа Компаний Альянс на ул. Чехова, 1
Адрес: Владимир, ул. Чехова, 1
Телефон: 7 (4922) 46-13-32; 7 (961) 257-55-77
Режим работы: пн-пт 09:00-18:00
10. По Автоматика на ул. Дворянская, 27а
Адрес: Владимир, ул. Дворянская, 27а
Телефон: 7 (4922) 45-10-45
Режим работы: пн-пт 08:30-17:00
11. Вент на ул. Добросельская, 212
Адрес: Владимир, ул. Добросельская, 212
Телефон: 7 (4922) 34-84-14
12. Веза на пр. 19-й, 1
Адрес: 600028, Владимир, 19-й пр-д, 1, оф. 410
Телефон: тел./факс: 7 (4922) 34-92-50; 7 (905) 147-01-10
Режим работы: пн-пт 09:00-18:00
13. Климатвентмаш на ул. Тракторная, 43
Адрес: 600005, Владимир, ул. Тракторная, 43
Телефон: 7 (4922) 40-85-46; факс: 7 (4922) 40-85-51
Режим работы: пн-пт 08:00-16:45
14. Альтернатива-Климат на ул. Подбельского, 1
Адрес: 600000, Владимир, ул. Подбельского, 1
Телефон: 7 (4922) 42-05-15; факс: 7 (4922) 32-74-74
Режим работы: пн-пт 09:00-18:00
15. Коминтэл Систем на ул. Большая Московская, 34б
Адрес: Владимир, ул. Большая Московская, 34б, оф. 322
Телефон: 7 (4922) 37-01-12; 7 (905) 614-73-10; 7 (905) 611-79-33; 7 (960) 737-22-55
16. Компания АРС на ул. 16 лет Октября, 36а
Адрес: Владимир, ул. 16 лет Октября, 36а
Телефон: 7 (4922) 60-04-45; 7 (903) 647-44-33
Режим работы: пн-пт 08:00-17:00
17. Инженерные системы на просп. Суздальский, 11а
Адрес: 600031, Владимир, Суздальский просп., 11а
Телефон: 7 (4922) 44-64-96
Режим работы: пн-пт 09:00-18:00
18. Прогресс Плюс на ул. Безыменского, 17, корп.Г
Адрес: Владимир, ул. Безыменского, 17, корп.Г
Телефон: 7 (4922) 60-30-31
Режим работы: пн-пт 09:00-19:00
19. Свежий ветер на ул. Горького, 70
Адрес: 600017, Владимир, ул. Горького, 70
Телефон: 7 (4922) 53-77-33; 7 (4922) 53-78-50
Режим работы: пн-сб 09:00-18:00
20. Вентстроймонтаж на ул. Юрьевская, 5
Адрес: 600005, Владимир, ул. Юрьевская, 5
Телефон: тел./факс: 7 (4922) 33-54-79
Режим работы: пн-пт 08:30-17:30
21. Армада-Строй на ул. Батурина, 39
Адрес: Владимир, ул. Батурина, 39, оф. 504
Телефон: 7 (4922) 44-99-13; 7 (4922) 44-78-05
Режим работы: пн-пт 08:30-17:30
22. Климат-Сервис на ул. Поселок РТС, 1
Адрес: Владимир, ул. Поселок РТС, 1
Телефон: 7 (4922) 32-34-32
Режим работы: пн-пт 08:00-17:00
23. Компания Бионика на ул. Дзержинского, 9
Адрес: Владимир, ул. Дзержинского, 9
Телефон: 7 (4922) 46-20-20; 7 (4922) 52-99-46
Режим работы: 08:30-21:00
24. Фрион Сервис Монтаж на ул. Красноармейская, 44
Адрес: Владимир, ул. Красноармейская, 44
Телефон: 7 (910) 675-25-21
Режим работы: 09:00-20:00
25. Фирма Климат Сервис на ул. Ильича, 5
Адрес: 600000, Владимир, ул. Ильича, 5
Телефон: 7 (4922) 32-67-14; факс: 7 (4922) 32-34-32
Режим работы: пн-пт 08:00-17:00
26. ТПК Юниум на ул. Лакина, 1а
Адрес: Владимир, ул. Лакина, 1а
Телефон: 7 (901) 992-37-81
Режим работы: пн-пт 09:00-19:00; сб 09:00-16:00
27. ВладКлиматТорг на ул. Ставровская, 7
Адрес: Владимир, ул. Ставровская, 7
Телефон: 7 (4922) 44-45-77
Режим работы: пн-пт 09:00-18:00
28. СКВ на ул. Девическая, 9
Адрес: Владимир, ул. Девическая, 9
Телефон: 7 (4922) 46-24-04
29. Конвент-Сервис на ул. Гастелло, 19
Адрес: 600026, Владимир, ул. Гастелло, 19
Телефон: 7 (915) 778-23-26
Режим работы: пн-пт 09:00-18:00
30. Магазин Мир Климата на ул. Дворянская, 27а
Адрес: 600001, Владимир, ул. Дворянская, 27а
Телефон: 7 (4922) 37-13-42
31. Регион-Сервис на просп. Октябрьский, 22
Адрес: Владимир, Октябрьский просп., 22, оф. 24
Телефон: 7 (4922) 47-04-11; 7 (930) 836-26-66
Режим работы: пн-сб 09:00-18:00
32. ИцТеплосфера на ул. Семашко, 8
Адрес: Владимир, ул. Семашко, 8
Телефон: 7 (4922) 37-62-30
Режим работы: пн-пт 09:00-18:00
33. ТПК Вот на ул. Комиссарова, 20
Адрес: 600027, Владимир, ул. Комиссарова, 20
Телефон: 7 (4922) 21-25-70
34. Вентизделия на ул. Мещёрская, 11в
Адрес: Владимир, ул. Мещёрская, 11в
Телефон: 7 (4922) 44-10-76
Режим работы: пн-пт 08:00-17:00
35. Промвентиляция
Адрес: Владимир, 14
Телефон: 7 (49232) 2-16-59
Режим работы: пн-пт 09:00-17:00
36. AirHome на ул. Горького, 57
Адрес: 600017, Владимир, ул. Горького, 57, эт. 1
Телефон: 7 (4922) 53-65-38
37. Нью-Эйр на ул. Мещерская, 11в
Адрес: 600033, Владимир, ул. Мещерская, 11в
Телефон: 7 (4922) 44-39-57
38. ООО «ВладСтройКлимат» на ул. Ноябрьская, 130
Адрес: Владимир, улица Ноябрьская, 130, микр-н Юрьевец, бывшее здание «ЗооВетснаб», 2 этаж
Телефон: тел./факс: тел./факс: 7 (4922) 45-35-74, Коммерческий директор; 7 (903) 830-50-42, Руководитель
Режим работы: сб-вс, 09:00-18:00
Все новое — забытое старое! о горелках, угарном газе и… читаем, запоминаем! —
Илья Кижватов, Олег Один
poga at westra.ru
Версия 0.2, 2022-11-11
Версия для печати (PDF, 704 KB)
Вместо введения
Перевод заключения из одной англоязычной статьи 2004 года [1]:
Описания произошедших случаев подтверждают, что отравление угарным газом в палатках и снежных пещерах — реальная проблема, которая обойдена вниманием. Эта проблема особо серьёзна на высоте из-за множества факторов, увеличивающих риск отравления CO. Несмотря на множество ходящих в альпинистских кругах баек о восходителях, почивших от отравления CO на гималайских пиках, не похоже, что эта опасность широко известна.
Ну а чистапаруски — некоторая практика показывает, что если пользоваться горелкой в палатке без определённой предосторожности, особенно в горных условиях, то можно отравиться угарным газом, что очень негативно сказывается на головном мозге, вызывая ряд весьма неприятных острых и хронических неврологических проявлений типа внезапной смерти. Пережившие острое отравление обычно страдают от различных пагубных последствий, которые могут преследовать несчастных в течение месяцев, лет, или даже пожизненно.
Цель этого обзора — заполнить пробел, наблюдаемый по теме в русскоязычном Интернете. Тема несколько раз всплывала в горных и туристических форумах при обсуждении ЧП (например [4-6]), но какого-либо систематического материала нет1. При этом на английском языке информации об опасности отравления CO от горелок обнаружилось достаточно.
Обзор написан в практической последовательности: сначала краткие факты, без которых совсем никак, потом — список действий, снижающих риск отравления, и затем — чуть подробнее про сравнение горелок на предмет выделения угарного газа. Детали для «ботанов» (the devil is in the detail!) — в приложениях и в источниках.
Факты
Или краткий курс молодого бойца, чтобы знать врага. Сначала общие:
1. Угарный газ, он же мон(о)оксид углерода, он же CO, выделяется вместе c углекислым газом (CO2) при сгорании газа (пропана, бутана, …), бензина, дров и прочих органических топлив.
В зависимости от условий горения количество выделяемого CO может быть разным.
2. Туристические горелки, как газовые, так и бензиновые — не исключение. Они выделяют как CO2, так и некоторое количество CO.
Подробнее — см. ниже.
3. Как и CO2, угарный газ бесцветен и не имеет запаха и вкуса.
Без специального датчика вы его не заметите. Внимание: далеко не все портативные датчики хорошо работают в типичных для высоты условиях низкого давления, низкой температуры и высокой влажности; смотрите на характеристики! (Тема в разработке.)
4. В отличие от CO2, угарный газ немного легче воздуха (сухого).
Но поднимется к потолку палатки он не из-за этого; см. ниже.
5. В отличие от CO2, угарный газ очень прочно связывается с гемоглобином в крови, не позволяя гемоглобину переносить кислород, и долго выходит из крови.
Подробно про патофизиологию — см. в приложении.
6. При высокой концентрации CO в крови наступает кома и смерть.
Даже если тяжело отравившегося успеют заметить и «откачать», могут остаться долговременные последствия.
7. Высокая концентрация CO в крови может наступить не только при высокой концентрации CO в воздухе, но и при длительном нахождении в простанстве с невыской концентрацией CO в воздухе.
Таком, как закрытая от непогоды палатка с работающей горелкой или другим прибором, сжигающим органическое топливо.
8. Симптомы начала отравления угарным газом — мягкая головная боль, тошнота, ощущение разбитости.
Чем-то очень похоже на горняшку. Подробности в приложении.
9. Избыток углекислого газа, напротив, стимулирует дыхательную активность.
Именно поэтому часто описываемые случаи «проснулся от того, что задыхаюсь, чиркнул зажигалкой — не горит, полез откапывать палатку» связаны с избытком углекислого газа, а не с отравлением угарным газом. В случае угарного газа рассказчик скорее всего не проснулся бы.
И специфические для горного туризма и альпинизма:
10. На высоте из-за пониженного давления отравление CO наступает при более низких его концентрациях в крови, чем на уровне моря.
Подробности — в приложении.
11. На высоте симптомы отравления CO легко перепутать с горной болезнью.
И потому проигнорировать.
12. При отсидке в палатке в непогоду симптомы отравления CO легко не заметить.
В основном из-за отсутствия двигательной активности.
13. При отсидке в снегопад вентиляция палатки ухудшается.
От этого, конечно, тепло и хорошо…
Как уменьшить риск отравления угарным газом в палатке?
Вот список с рекомендациями, как надо обращаться с горелкой, чтобы не отравиться CO. Список взят из [2] и немного изменён с учётом более свежей информации из [3]. Курсивом даны примечания авторов этого обзора. Объяснение причин — частично в следующих секциях и в первоисточнике.
Фактор риска — приготовление пищи на горелке. Действие:
Держать посуду не в пламени, а над ним. Раннее охлаждение пламени — основной фактор повышенного выделения CO, см. ниже. Избегать длительной готовки на слабом огне. Выставить голубое пламя, избегать жёлтого пламени и длинного пламени. Держать высокое давление в топливном баллоне. Использовать очищенные топлива.
Фактор риска — жёлтое пламя. Действие:
Выключить горелку, подкачать топливный баллон, зажечь снова. Максимально провентилировать палатку в течение нескольких минут.
Фактор риска — неадекватная вентиляция палатки. Действие:
Вентиляция по крайней мере эквивалентная отверстию в 50 см2..Для круглого отверстия это соответствует радиусу 4 см, то есть примерно как ладонь или чуть меньше (если вы не Кинг-Конг и не Дюймовочка). Отверстие для выхода СO расположить как можно более высоко, потому что CO вместе с другими продуктами горения будет вознесён конвекционным потоком под свод палатки. Отверстие для притока свежего воздуха расположить низко. Избегать минимальной вентиляции, которая (парадоксально) увеличивает концентрацию CO. Имеется в виду ситуация, когда оставлено очень маленькое отверстие. Лучше в таком случае закрыть совсем, но устраивать регулярные мощные проветривания. Учитывать повышенный риск накопления CO в палатке в полный штиль.
Фактор риска -скрытое начало отравления в условиях низкой подвижности. Действие:
Обращать внимание на головную боль и тахикардию (учащённый пульс). Регулярно совершать вылазки наружу, чтобы демаскировать симптомы.
Фактор риска -продолжительность воздействия CO. Действие:
См. выше и ниже.
Фактро риска -застой воздуха в палатке (низкое содержание кислорода). Действие:
Регулярно проветривать. Можно обойтись без постоянного вентилирования.
Фактор риска — обезвоживание. Действие:
Достаточное питьё.
Фактор риска — Обледенение тента и накопление снега на тенте. Действие:
Регулярно чистить палатку, чтобы поддержать проницаемость ткани тента. Старые снежные пещеры хуже, чем палатки.
Сравнение горелок по выделению CO.
Австралийский турист (и обладатель Ph.D. по физике) Роджер Каффин написал целый цикл статей [3] про выделение угарного газа горелками. Как и обзор [2], это «мастрид» по теме для тех, кто читает по-английски. Здесь — практические выжимки.
Во-первых, Каффин провёл много экспериментов с горелками на предмет того, в каких случаях выделяется больше CO. Кратко в таблице выше уже было об этом сказано: а) не ставить посуду прямо в пламя и б) не допускать жёлтого пламени. Потому что:
· Посуда в огне охлаждает пламя (англ. термин flame quenching) и препятствует полному окислению углерода, оставляя много угарного газа.
· Жёлтое пламя, а также длинное пламя — свидетельство такого неполного окисления.
(В некоторых статьях было отмечено, что на процесс горения влияет ещё и диаметр посуды. Эксперименты Каффина показали , что это не имеет большого эффекта и вторично; главное — не засовывать посуду в пламя.)
Во-вторых, Каффин сравнил множество горелок на предмет выделения CO. В результате он выявил несколько патологических случаев, и попробовал разобраться, в чём там дело. Чтобы на такой патологических случай не нарваться при покупке горелки (либо при пользовании таковой, если уже есть) — вот выдержка из итоговой таблицы с результатами тестов для газовых горелок на разных режимах работы.
Горелка Достигаемая концентрация CO в воздухе, в ppm
низкая мощность средняя мощность высокая мощность
Brunton Flex 160 158 142
Brunton Raptor 88 — 286
Coleman Xtreme 5 — 5
Coleman F1 Ultralight 75 — 154
Jetboil GCS, с ёмкостью 5 6 90
Kovea Expedition 6 — 12
Kovea Moonwalker 30 — 50
МSR WindPro 30 85
MSR PocketRocket 240 220 140
MSR Reactor, c ёмкостью 1000 — 50
Primus Gravity MF 10 — 100
Primus Eta Power EF, с ёмкостью 3 8 13
Primus Micron Ti 2.5 40 88 90
Snow Peak GS(T)100 5 — 21
Snow Peak GS200D 260 — 130
В таблицу включены не все горелки из первоисточника. Включенные по-прежнему показывают, что а) горелки ведут себя очень по-разному и б) даже у одного производителя разные горелки показывают разные результаты. Условия эксперимента опускаем, оставляя здесь только сравнение. Кому нужны подробности — см. первоисточник.
Здесь приведём только данные из таблицы концентраций из статьи Каффина, без которых не очень понятно, что значат цифры в таблице выше. Таблица составлена на основе норм США и Великобритании (ВБ)2, которые рассчитаны для уровня моря. Ppm — это parts per million, частей на миллион, то есть 1 ppm — это 0.0001%.
Концентрация СO в воздухе, ppm Эффект, описание
0-1 Нормальный уровень
9 Макс. допустимое значение для кратковременной экспозиции в гостиной (США)
25 Часто встречается на главных дорогах
30 8-часовой предел, по нормам здоровья и безопасности (ВБ)
35 Предлагаемая макс. допустимая концентрация для непрерывной экспозиции в течение 8 часов (США)
100 Может наблюдаться на главных дорогах во время метеорологических инверсий (ВБ)
200 15-минутный предел по нормам здоровья и безопасности (ВБ)
200 Слабая головная боль, слабость, тошнота, сонливость после 2-3 часов; предел для кратковременной экспозиции (США)
300 Может привести к коллапсу (ВБ)
400 Фронтальная головная боль, более 3 часов — опасно для жизни
Подробно про то, как и при каком времени воздействия эти концентрации влияют на организм, и сколько примерно держатся в палатке, см. в приложении и в статьях [1] и [2].
Возвращаясь к результатам по горелкам: получается, что некоторые горелки в определённых режимах приводят к потенциально опасным концентрациям угарного газа в замкнутом объёме. Чтобы быть конкретным: представим, что вы отсиживаетесь в непогоду в палатке, плотно её закрыв, иногда работает некая горелка, которая создаёт концентрации CO в воздухе внутри палатки на уровне 50-100 ppm (таких моделей хватает, как видно из таблицы). При воздействии в несколько часов такая концентрация опасна.
Почему некоторые горелки выделяют больше CO на повышенной мощности? Каффин по результатам экспериментов делает вывод, что у них недостаточно велики воздухозаборные отверстия: на повышенной мощности необходимо больше воздуха, чтобы пламя было достаточно коротким и не охлаждалось посудой. Ещё нужно учитывать, что тесты проводились на уровне моря, а на высоте с понижением давления для горения без выделения большого количества CO необходим ещё больший приток кислорода.
Отдельно про MSR Reactor, который на низкой мощности приводит к запредельной концентрации CO. Каффин объясняет это (проведя отдельное исследование) тем, что на низкой мощности воздух из-за особенностей конструкции этой горелки практически перестаёт подсасываться во входое отверстие, и потому топливо сжигается в режиме исключительного кислородного голодания. Недостаток кислорода приводит к тому, что вторая стадия процесса горения (окисление CO в CO2) просто не может произойти, и потому в результате остаётся большое количество CO.
Итак, ещё раз основные результаты из [3]:
· основная причина повышенного выделения CO — раннее охлаждение пламени, в результате которого не происходит полного окисления углерода;
· основной источник раннего охлаждения пламени — слишком низко расположенная ёмкость для готовки (в одном из тестов увеличение клиренса всего на 5 мм сократило выделение CO в два раза);
· недостаток притока воздуха на некоторых режимах работы горелок, связанный с размером воздухозаборников; усугубляется с высотой.
Оставляя прочие детали: любая горелка в палатке требует адекватной вентиляции!
Вместо заключения
Из той же статьи 2004 года [1]:
Мы надеемся не видеть более сообщений о случаях, когда молодые, тренированные люди умирают от причины, которую можно полностью предотвратить.
Источники:
[1] Leigh-Smith S. Carbon monoxide poisoning in tents — a review. Wilderness and Environmental Medicine, 2004, 15(3):157-63. «Мастрид» для тех, кто поботанистее. Полный текст можно свободно взять тут: www.wemjournal.org/article/S1080-6032(04)70474-3.
[2] zenstoves.net/COHazard.htm. Обзорная статья, в основном более доступно излагающая содержание статьи Лей-Смита [1], с основательным список источников.
[3] Roger Сaffin. Stoves, Tents and Carbon Monoxide — Deadly or Not. Фундаментальный практический труд. Самое интересное в нескольких первых частях. Полный текст за деньги тут: www.backpackinglight.com/cgi-bin/backpackinglight/stoves_tents_carbon_monoxide_index.html. Для тех, кто не может заплатить за доступ к статьям, четыре первые части находятся в открытом доступе на сайте Scribd. На персональном сайте Роджера есть некоторая дополнительная информация по горелкам.
[4] www.lifeo2.ru/users/robbi/17221/
[5] www.lifeo2.ru/users/voladores/191726/, www.lifeo2.ru/users/abugarib/191898/ В частности, в одной из этих веток есть подборка других случаев с отечественными туристами, в которых виновником происшествий скорее всего был угарный газ от горелки.
[6] skitalets.ru/wwwthreads/showflat.php?Cat=0&Board=antol&Number=364942&page=7&view=collapsed&sb=6∂all&vc=1
Авторы выражают респект и уважуху юзерам сообщества lifeo2.ru: Leb — за привлечение внимания к проблеме, comp3v и kombrig — за запощенные ссылки на некоторые источники.
Кислородные соединения углерода. химия 9 класс. габриелян
Глава 3. Неметаллы




Углерод образует два оксида — оксид углерода (II) СО и оксид углерода
(IV) CO2.
Оксид углерода (II) СО — бесцветный, не имеющий запаха газ, малорастворимый в воде. Его называют угарным газом, так как он очень ядовит. Попадая при дыхании в кровь, он быстро соединяется с гемоглобином, образуя прочное соединение карбоксигемоглобин (объясните происхождение этого термина), тем самым лишая гемоглобин возможности переносить кислород. При вдыхании воздуха, содержащего 0,1% СО, человек может внезапно потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива (напишите уравнение соответствующей химической реакции), вот почему так опасно преждевременное закрывание дымоходов печей (рис. 152).
Оксид углерода (II) относят, как вы уже знаете, к несолеобразующим оксидам. Будучи оксидом неметалла, он должен реагировать с щелочами и основными оксидами с образованием соли и воды, однако этого не наблюдается.
СО — хороший восстановитель {почему?). Он сгорает в кислороде, образуя углекислый газ:
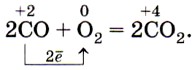
Оксид углерода (II) способен отнимать кислород у оксидов металлов, т. е. восстанавливать металлы из их оксидов:
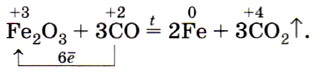
Именно это свойство оксида углерода (II) используют в металлургии при выплавке чугуна.
Оксид углерода (IV) СO2 — бесцветный, не имеющий запаха газ, широко известный под названием углекислый газ. Он примерно в полтора раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого газа.
При давлении примерно 60 атм углекислый газ превращается в бесцветную жидкость. При испарении жидкого углекислого газа часть его превращается в твёрдую снегообразную массу, которую в промышленности прессуют, — это известный вам «сухой лёд», который применяют для хранения пищевых продуктов. Вы уже знаете, что твёрдый углекислый газ имеет молекулярную решётку и способен к возгонке (что это такое?).
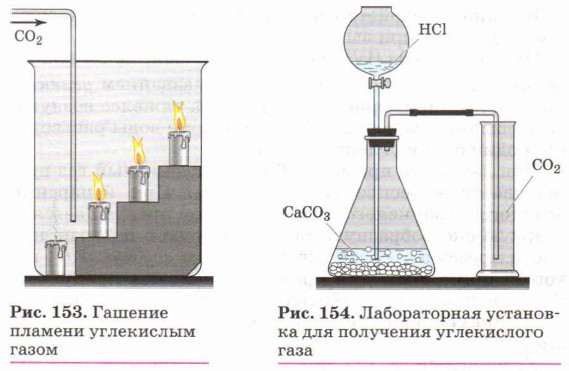
Углекислый газ СO2 как типичный кислотный оксид взаимодействует с щелочами (например, вызывает помутнение известковой воды), с основными оксидами и водой. Он не горит и не поддерживает горения (рис. 153) и потому применяется для тушения пожаров. Однако магний продолжает гореть в углекислом газе с образованием оксида и выделением углерода в виде сажи:
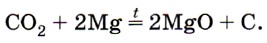
Углекислый газ получают, действуя на соли угольной кислоты — карбонаты растворами соляной, азотной и даже уксусной кислот. В лаборатории углекислый газ получают при действии соляной кислоты на мел или мрамор (рис. 154):
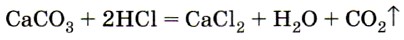
{как собирают и распознают углекислый газ?).
В промышленности углекислый газ получают обжигом известняка:
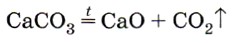
{вспомните, производство какого продукта служит основной целью этой реакции).
Углекислый газ используют также для изготовления шипучих напитков и получения соды.
Применение углекислого газа показано на рисунке 155.
При растворении оксида углерода (IV) в воде образуется очень нестойкая угольная кислота Н2СO3, которая легко разлагается на исходные компоненты — углекислый газ и воду:
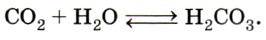


Будучи двухосновной, угольная кислота образует два ряда солей: средние — карбонаты, например СаСO3, и кислые — гидрокарбонаты, например Са(НСO3)2. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Кислые соли, как правило, растворимы в воде.
При избытке углекислого газа в присутствии воды карбонаты могут превращаться в гидрокарбонаты. Так, если через известковую воду пропускать углекислый газ, то она сначала помутнеет из-за выпавшего в осадок нерастворимого в воде карбоната кальция, однако при дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
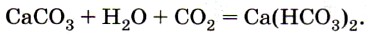

Именно наличием гидрокарбонатов кальция и магния в природной воде и объясняется её временная жёсткость. Почему временная? Потому что при нагревании растворимый гидрокарбонат кальция снова превращается в нерастворимый карбонат:
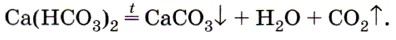
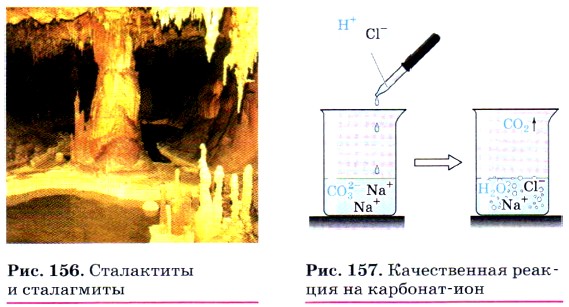
Эта реакция приводит к образованию накипи на стенках котлов, труб парового отопления и домашних чайников. В природе в результате этой реакции в пещерах формируются свисающие вниз причудливые сталактиты, навстречу которым снизу вырастают сталагмиты (рис. 156).
Другие соли кальция и магния, в частности хлориды и сульфаты, придают воде постоянную жёсткость, которую невозможно устранить кипячением. Для удаления солей, вызывающих постоянную жёсткость, приходится использовать другой карбонат — соду Na2CO3,
которая переводит ионы Са2 в осадок, например:
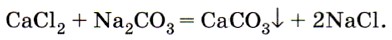
Соду можно использовать и для устранения временной жёсткости воды.
Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот: при действии на них кислот наблюдается характерное «вскипание» из-за выделяющихся пузырьков углекислого газа (рис. 157):
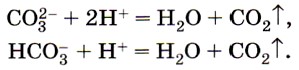
Эта реакция является качественной на соли угольной кислоты.
О применении важнейших карбонатов Na2CO3, CaCO3, K2CO3, (NH4)2CO3, гидрокарбонатов NaHCO3 и NH4HCO3 вы уже знаете.


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.

1. Рассмотрите реакцию восстановления оксида железа (III) оксидом углерода (II) как окислительно-восстановительный процесс.
2. Какие несолеобразующие оксиды вам ещё известны, кроме оксида углерода (II)? Верно ли с химической точки зрения другое синонимическое название их — безразличные, или индифферентные, оксиды?
3. Напишите уравнения реакций, характеризующие свойства оксида углерода (IV). Рассмотрите взаимодействие оксида углерода (IV) с магнием как окислительно-восстановительный процесс.
4. Почему раствор углекислого газа окрашивает лакмус в красный цвет? Почему при длительном хранении этого раствора лакмус снова приобретает фиолетовую окраску?
5. Напишите формулы следующих солей: карбоната меди (II), гидрокарбоната меди (II), гидроксокарбоната меди (II). К какой группе солей относится каждая соль? Как ещё называют последнюю соль?
6. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
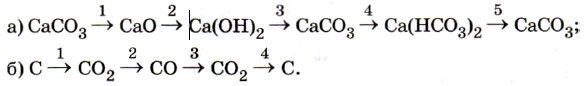
Рассмотрите процессы окисления-восстановления.
7. В 1060 г 2%-го раствора карбоната натрия растворили 14,3 г кристаллической соды (Na2CO3 • 10Н2O). Вычислите массовую долю соли в полученном растворе. Вычислите объём углекислого газа (н. у.), который образуется при взаимодействии полученного раствора с избытком соляной кислоты.
