- Что такое овр
- Основные правила составления овр
- Горение веществ на воздухе и в кислороде
- Классификация окислительно-восстановительных реакций
- Лекция 2 кислород и сера.
- Реакции, взаимодействие серы с металлами и полуметаллами. уравнения реакции:
- Реакции, взаимодействие серы с солями. уравнения реакции:
- Реакции, взаимодействие серы. уравнения реакции серы с веществами.
- Сера, химические свойства, получение
- Химические свойства
- Химические свойства серы
Что такое овр
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 KOH = KBrO3 KBr H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Основные правила составления овр
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку: При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
межмолекулярные ОВР;
внутримолекулярные ОВР;
реакции диспропорционирования;
реакции контрпропорционирования.
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI Br2 = 2KBr I2, где Br2 — окислитель, а KI — восстановитель (за счёт I−1).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl 5 — окислитель, а O−2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 8NO2 O2. Здесь железо окисляется до 3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 2NO H2O, где N 3 переходит в N 5, являясь восстановителем, и N 3 переходит в N 2, являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Лекция 2 кислород и сера.
План.
- Общая характеристика подгруппы. Кислород как химический элемент.
- Кислород как простое вещество.
- Озон.
- Сера как химический элемент.
- Сера как простое вещество.
- Соединения серы с отрицательной степенью окисления.
- Оксиды серы.
- Серная кислота и ее соли.
Главную подгруппу 6 группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы (их иногда называют халькогены) имеют на внешнем валентном слое конфигурацию типа s2p4 , т.е. близкую к завершению. Это обуславливает окислительные способности этих элементов. Следует отметить, что их ЭО при переходе от кислорода к теллуру резко снижается, т.к. появление новых электронных слоев ведет к увеличению радиуса атомов. Наибольшей окислительной способностью обладают типичные неметаллы — кислород и сера.
Кислород как химический элемент. Кислород или Оксиген №8. 2 период, 6 группа, главная подгруппа.
Состав атома:8р, 8е—, 8n.
Схема строения: заряд ядра 8, два электронных слоя (2 е—, 6 е—)
Электронная и графическая формулы: 1s22s22p4
Типичный неметалл, сильный окислитель. Практически единственная степени окисления: -2.
Практически единственная валентность: II.
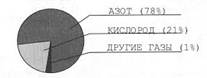 Самый распространенный элемент на Земле. На его долю приходится почти половина массы земной коры и около 90% массы мирового океана. Встречается в свободном состоянии в виде двух аллотропных модификаций: кислород О2 и озон О3. Эти газы входят в состав атмосферы, кислород в нем составляет около 21% по объему, озон – доли процента. Входит в состав неорганических соединений оксидов и гидроксидов, а также в состав многих солей. Содержится в важнейших органических соединениях: спиртах, альдегидах, кислотах и сложных эфирах. Является органогеном, входит в состав белков, жиров и углеводов, нуклеотидов и т.д.
Самый распространенный элемент на Земле. На его долю приходится почти половина массы земной коры и около 90% массы мирового океана. Встречается в свободном состоянии в виде двух аллотропных модификаций: кислород О2 и озон О3. Эти газы входят в состав атмосферы, кислород в нем составляет около 21% по объему, озон – доли процента. Входит в состав неорганических соединений оксидов и гидроксидов, а также в состав многих солей. Содержится в важнейших органических соединениях: спиртах, альдегидах, кислотах и сложных эфирах. Является органогеном, входит в состав белков, жиров и углеводов, нуклеотидов и т.д.
2. Физические свойства кислорода. При н.у. это бесцветный газ, не имеющий запаха. Температура кипения кислорода (-183оС). Немного тяжелее воздуха, немного растворим в воде (в 100 объемах воды — около 5 объемов кислорода при 0оС). Жидкий кислород притягивается магнитом.
Химические свойства кислорода. Кислород во всех химических реакциях проявляет сильные окислительные свойства. Его бинарные соединения с элементами называются оксидами. Кислород образует оксиды со всеми элементами, кроме гелия, неона и аргона. Оксиды образуются при окислении простых веществ (непосредственно не взаимодействуют с кислородом только галогены, золото и платина), при окислении сложных веществ. Реакции взаимодействия веществ с кислородом часто сопровождаются выделением тепла и света и поэтому их называют горением. При горении веществ на воздухе выделяется такое же тепла, но часть его тратится на нагревание азота, входящего в состав воздуха, поэтому температура пламени значительно снижается. Оксиды могут образовываться и при разложении сложных веществ (гидроксидов и солей), эти реакции, наоборот, обычно идут с поглощением энергии.
P0 O20 => P2 5 O5-2
S O2 => SO2
Mg O2 => MgO
Fe O2 => Fe2O3
CH4 O2 => CO2 H2O
ZnS O2 => ZnO SO2
Cu(OH)2 => CuO H2O
CaCO3 => CaO CO2
Роль в природе: процессы дыхания, гниения по химической сути являются процессами окисления сложных органических веществ.
Применение: Как сырье для получения различных соединений; для интенсификации процессов в химической и металлургической промышленности; для получения высоких температур (сварка и резка металла, ракетное топливо); жидкий кислород в смеси с опилками или другими горючими веществами используют как ВВ; газообразный кислород используют в медицине для лечения различных заболеваний (оксигенотерапия).
3. Озон. При н.у. это газ, обладающий характерным запахом. Температура кипения озона (-112оС). Он тяжелее воздуха, растворим в воде (в 100 объемах воды — около 50 объемов озона при 0оС). 
Озон образуется из кислорода при пропускании через него электрического разряда или жесткого УФ излучения.
О2 => O3
Обратная реакция – распад озона – протекает самопроизвольно, т.е. озон неустойчивое соединение. Озон – один из сильнейших окислителей, при его взаимодействии с веществами тоже образуются оксиды, но реакции протекают более энергично, чем с кислородом. Как сильный окислитель озон убивает бактерии и применяется для обеззараживания воды и помещений. Озон ядовит, ПДК в воздухе 10-5% , при этой концентрации хорошо ощущается его запах. В верхних слоях атмосферы концентрация озона обычно лежит в пределах 10-7-10-6.
Оксиды- один из важнейших классов неорганических веществ. Они делятся на основные, кислотные и амфотерные оксиды. Все они образуют гидроксиды и соответствующие соли. Кислород входит также в состав большого количества органических соединений.
Роль кислорода в организме и использование кислорода и озона в медицине. Содержание кислорода в организме 62,43%. Взрослый человек потребляет 264 см3 кислорода в мин. Оксиген имеет исключительное биологической значение, от него зависят важнейшие биохимические процессы, он участвует во всех видах обмена веществ. Наиболее известный физиологический процесс с участием кислорода – дыхание. Этот сложный физиологический процесс включает в себя не только процесс газообмена в легких, но и транспорт кислорода с током крови от легких к клеткам. Именно там в митохондриях происходит процесс тканевого дыхания, т.е. процесс окисления органических веществ. Продукты окисления (СО2) кровь уносит к легким. А энергия, которая выделяется в процессе реакции окисления тратится на образование молекул АТФ. При гидролизе АТФ энергия снова выделяется и расходуется на нужды организма. Т.е. с участием кислорода проходят все окислительные реакции в организме, за счет энергии этих реакций протекают все физиологические процессы. С кислородом связаны также фагоцитарные функции организма. Вспомните особенности строения атома кислорода. У него ярко выраженные неметаллические, окислительные свойства. В медицинской практике используются не только множество соединений кислорода (оксидов, гидроксидов, кислот, солей, органических и неорганических соединений) но и простые вещества – кислород и озон. Оксигенотерапия – кислородом лечат гельминтозы, сердечно-сосудистые и инфекционные заболевания, он стимулирует работу нервной системы, обладает снотворным действием и т.д. Оксигенотерапия лежит в основе климатолечения. Оксигенобаротерапия – метод лечения, в котором используется дыхание воздушной смесью с повышенным содержанием кислорода, в специальных герметичных помещениях барокамерах. В озонотерапии используют озон. Это сильнейший окислитель, в больших количествах он ядовит. Образуется из кислорода при электрическом разряде, под действием УФ. Озон обладает бактерицидным, дезодорирующим действием; используется для обработки питьевой воды, помещений, белья; в смеси с кислородом используется для лечения различных заболеваний.
4.Сера как химический элемент. Сульфур №16. 3 период,6 группа, главная подгруппа.
Состав атома: 16р, 16е—, 16n.
Схема строения: заряд ядра 16, три электронных слоя (2 е—, 8 е—, 6 е—)
Электронная и графическая формулы:
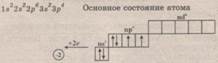
 Типичный неметалл. Характерные степени окисления: 6 и -2, возможна 4.
Типичный неметалл. Характерные степени окисления: 6 и -2, возможна 4.
Возможные валентности: II, IV, VI.

 Широко распространен в природе, содержание в земной коре 0,1%. Встречается в свободном состоянии (самородная сера) и в виде соединений. Например: сульфидов (железный колчедан FeS2, свинцовый блеск PbS) и сульфатов (гипс CaSO4∙2H2O, глауберова соль Na2SO4∙10H2O).Органоген, входит в состав белка
Широко распространен в природе, содержание в земной коре 0,1%. Встречается в свободном состоянии (самородная сера) и в виде соединений. Например: сульфидов (железный колчедан FeS2, свинцовый блеск PbS) и сульфатов (гипс CaSO4∙2H2O, глауберова соль Na2SO4∙10H2O).Органоген, входит в состав белка
.
5. Сера как простое вещество. Для серы характерна аллотропия. Три модификации. Сера ромбическая: твердое вещество желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 112,8оС, плотность 2,07 г/см3. Нерастворима в воде, не смачивается. Растворяется в бензоле. Сера моноклинная: твердое вещество темно-желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 119,3оС, плотность 1,96г/см3 . При н.у. неустойчива, превращается в ромбическую. Сера пластическая: резиноподобная коричневая масса, аморфное строение, S∞. При н.у. неустойчива, превращается в ромбическую.
 Химические свойства: типичный неметалл, может быть и окислителем и восстановителем.
Химические свойства: типичный неметалл, может быть и окислителем и восстановителем.
Как окислитель взаимодействует с металлами и водородом:
Al S→ Al2S3
Na S → Na2S
H2 S → H2S
Как восстановитель – с активными неметаллами:
S O2 →SO2


Получение:
1). Самородная сера. Перегретым водяным паром обрабатывают породу.
2). Разложение пирита без доступа воздуха: FeS2 → FeS S
3). Неполное сгорание сероводорода: H2S O2 → S H2O
Применение:
1). Получение серной кислоты и сульфатов.
2). Получение сульфитов.
3). Производство красителей, резины, черного пороха, спичек, лекарств.
Сера в организме человека и ее использование в медицине.
Содержание в организме 0,16%, суточная потребность 4-5 грамм. Больше всего серы содержится в кератине волос, костях, нервной ткани; входит в состав белков (аминокислоты цистеин и метионин), гормонов, витаминов. В организме серная кислота, образующаяся в процессе метаболизма, обезвреживает ядовитые продукты метаболизма (фенол, скатол, крезол) и чужеродные токсины (тяжелые металлы). Простое вещество сера оказывает противомикробное и противопаразитарное действие, серные мази и суспензии используют для лечения кожных заболеваний, гельминтозов. 1% раствор серы в персиковом масле (сульфозин) используют при лечении шизофрении и алкоголизма. Тиосульфат натрия обладает противовоспалительным и противоаллергическим действием.
Дата добавления: 2022-02-09; просмотров: 82; Нарушение авторских прав
§

 H2S — сероводород, бесцветный газ с характерным запахом гниющего белка. Кристаллизуется при -85,7оС, кипит при -60,8оС. Немного тяжелее воздуха, при н.у. в 1л воды растворяется 2,5 л сероводорода.
H2S — сероводород, бесцветный газ с характерным запахом гниющего белка. Кристаллизуется при -85,7оС, кипит при -60,8оС. Немного тяжелее воздуха, при н.у. в 1л воды растворяется 2,5 л сероводорода.
Восстановитель, окисляется кислородом воздуха (горение)
H2S O2 →SO2 H2O, при недостатке кислорода или низкой температуре H2S O2 →S H2O
Водный раствор называют сероводородной водой, на воздухе, на свету она становится мутной (опалесцирует) в результате образования коллоидного раствора серы в воде (см. предыдущую реакцию). Кроме того раствор сероводорода обладает свойствами кислоты, поэтому его называют сероводородной кислотой, это слабая кислота. Образуется при гниении белков, встречается в водах минеральных источников и вулканических газах. Такие источники могут быть причиной гибели человека ( Сероводород очень ядовит!), но могут использоваться и для лечения желудка, почек, кожи. Соли сероводородной кислоты называют сульфидами. Большинство из них нерастворимо в воде. В природе эти соли образуют минералы, которые используют как руды цветных металлов: ZnS, CuS, PbS…Многие сульфиды имеют переменный состав. В легкой промышленности используют сульфиды натрия и кальция для очистка кожи от шерсти. Сульфиды щелочноземельных металлов служат основой люминофоров. А в лабораториях реакции образования сульфидов используют для определения многих металлов, т.к. эти соли имеют характерный цвет.


Дата добавления: 2022-02-09; просмотров: 17; Нарушение авторских прав
§
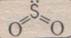 SO2 — оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
SO2 — оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
Химические свойства: кислотный оксид, характерны восстановительные свойства.
Как восстановитель:
SO2 O2 SO3, катализатор V2O5
SO3, катализатор V2O5
Как кислотный оксид сернистый газ взаимодействует со щелочами:
SO2 NaОН →NaНSO3 и Na2SO3 H2O (соли гидросульфиты и сульфиты).
С водою образуется сернистая (сульфитная) кислота.
SO2 H2O ↔ H2 SO3 Это слабый электролит. Нестойкая, существует только в водных растворах, легко окисляется кислородом воздуха до серной кислоты: H2 SO3 O2 → H2 SO4.
 Обесцвечивает органические красители.
Обесцвечивает органические красители.
Получение:
1). Горение серы: S O2 →SO2
2). Обжиг сульфидов: ZnS O2 → ZnO SO2 и т.д.
Большое количество сернистого газа образуется при горении органических соединений (каменный уголь).
Применение:
1). Производство серной кислоты.
2). Производство сульфитов и гидросульфитов.
3). В с/х для уничтожения насекомых и микроорганизмов.
4). В текстильной промышленности для отбеливания тканей, соломки и т.д.
5). При консервировании фруктов и ягод.
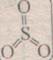 SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
Химические свойства: сильный окислитель, кислотный оксид.
Как кислотный оксид:
SO3 H2O →H2 SO4 Q, взаимодействует с водой, образуя серную кислоту, при этом выделяется большое количества тепла.
SO3 NaОН →NaНSO4 и Na2SO4 H2O, т.е. образует гидросульфаты и сульфаты
Получение: в промышленности SO2 O2 SO3, катализатор V2O5
SO3, катализатор V2O5
Применение: как промежуточный продукт при производстве серной кислоты, в лаборатории как сильное водопоглощающее средство.
Дата добавления: 2022-02-09; просмотров: 13; Нарушение авторских прав
§
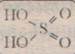 H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,— нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,— нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
Химические свойства: 1. Сильная кислота, распадается на ионы по двум ступеням практически на 100%, образует два ряда солей.
H2SO4 ↔ H HSO4— — гидросульфат –ион
HSO4— ↔ H SO4 2- — сульфат- ион
Разбавленная кислота H2 SO4 обладает всеми общими свойствами кислот: изменяет окраску растворов индикаторов); взаимодействует с основаниями, основными оксидами и солями (реакции ионного обмена, не ОВР!):
H2SO4 2 KOH → K2SO4 2H2O;
2H SO42- 2K 2OH— = 2K SO42- 2H2O; H OH— = H2O
H2SO4 KOH → KНSO4 H2O
3H2SO4 Al2O3 → Al2(SO4)3 3H2O;
2H 3SO42- Al2O3 → 2Al3 3SO42- H2O ; 2H Al2O3 → 2Al3 H2O
H2SO4 Na2CO3→ Na2SO4 H2CO3 → Na2SO4 H2O CO2↑;
2H SO42- 2Na CO3→ 2Na SO42- H2O CO2↑; 2H CO3→ H2O CO2↑;
Во всех этих реакциях главную роль играют ионы водорода, а SO42- просто присутствует в растворе. Специфической реакцией иона SO42- (т.е. серной кислоты и всех ее солей) является реакция с солями бария.
H2SO4 BaCl2 → 2HCl BaSO4↓
2H SO42- Ba2 2Cl— → 2H 2Cl— BaSO4↓
SO42- Ba2 → BaSO4↓
Na2SO4 Ba(NO3)2 → 2NaNO3 BaSO4↓
2Na SO42- Ba2 2NO3— → 2Na 2NO3— BaSO4↓
SO42- Ba2 → BaSO4↓
Эту реакцию называют «качественной реакцией» на серную кислоту и ее соли, потому что в ней образуется характерный мелкокристаллический белый осадок BaSO4. Реакцию используют в лабораторной практике для определения наличия в растворе иона SO42-.
При взаимодействии с металлами серная кислота может вести себя по-разному, в зависимости от концентрации и активности металла.
В разбавленной H2SO4 окислителем является ион Н , поэтому разбавленная серная кислота взаимодействует только с металлами стоящими в ряду напряжений до водорода, причем, одним из продуктов реакции будет газ водород.
H2SO4(разб.) Zn → H2 ↑ ZnSO4
Zn0 – 2e— → Zn 2 H e— → H0
Но если мы возьмем концентрированную кислоту, то в роли окислителя выступит S 6 , и вместо водорода мы получим продукт ее восстановления – какое-то соединение серы. Какое? Это зависит от активности металла, температуры, концентрации кислоты. Обычно образуется смесь таких веществ. Но, упрощая, можно считать, что чем активнее металл, тем более глубоко идет процесс восстановления, и степень окисления серы в продукте реакции будет ниже. Следует также отметить, что с концентрированной H2SO4 взаимодействуют все металлы, кроме золота и платины, но на холоду железо, алюминий и хром пассивируются (не реагируют из-за образования прочной пленки на поверхности металла), а некоторые металлы не реагируют и с разбавленной серной кислотой (если при этом образуется нерастворимая соль).
H2SO4(конц.) Zn → ZnSO4 H2О S Zn0 – 2e— → Zn2 S 6 6e— → S0
H2SO4(конц.) Cu → ZnSO4 H2О SO2 Cu0 – 2e— → Cu2 S 6 2e— → S 4
H2SO4(конц.) Ca → CaSO4 H2О CaS Ca0 – 2e— → Ca2 S 6 8e— → S-2
H2SO4(конц.)– сильный окислитель, и может окислять не только металлы, но и неметаллы и даже их соединения, обугливает органические вещества (т.к. забирает воду, например, у углеводов)
H2SO4(конц.) C → СО2↑ H2О SO2↑
C0 – 4e— → C4 S 6 2e— → S 4
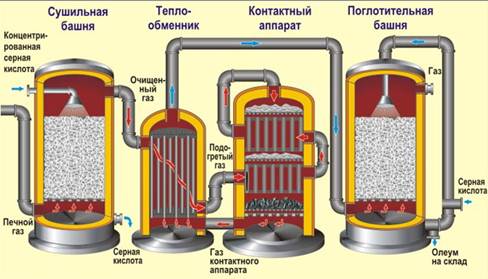
 Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
1) обжиг колчедана (принцип теплообмена, в «кипящем слое», воздух обогащен кислородом):
FeS2 O2 → Fe2O3 SO2 13746кДж
2) каталитическое окисление сернистого газа (4500С, катализатор V2O5 оксид ванадия (V), принцип противотока):
SO2 O2 ↔ SO3 197,9кДж
 3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
SO3 H2O →H2 SO4 130,6 кДж
Конечным продуктом является «олеум» — раствор SO3 в концентрированной H2 SO4.
В производстве серной кислоты часто используют сернистый газ, получаемый при обжиге цветных руд, горении топлива или свободной серы. Т.е. первая стадия может быть немного другой, а вот две последние – всегда одинаковы.
Применение. Серная кислота – «хлеб» химической промышленности.
 1) получение сульфатов, которые широко используются в народном хозяйстве, например:
1) получение сульфатов, которые широко используются в народном хозяйстве, например:
— K2SO4 и (NH4)2 SO4 — сульфаты калия и аммония, в с/х как минеральные удобрения
— CuSO4∙5H2O – медный купорос, в с/х как средство борьбы с болезнями растений, в легкой промышленности как краситель, в строительстве как противогрибковое средство, в гальванопластике (покрытие слоем меди)
FeSO4∙ 7H2O – железный купорос, в с/х средство борьбы с вредителями растений, в легкой промышленности при крашении тканей.
CaSO4∙ 2H2O – минерал гипс, в строительстве используют «жженый гипс» 2CaSO4∙ H2O под названием «алебастр» в состав шпаклевок, в медицине — слепки, шины, в художественно- прикладном творчестве.
Na2SO4∙ 10H2O – глауберова соль, в медицине как слабительное, в производстве стекла
BaSO4 –в медицине, (рентген желудка), в производстве бумаги, резины как наполнитель
2) в цветной металлургии (гидрометаллургия, получение меди, никеля и т.д.) и обработке металлов (печатные платы, гальваника, аккумуляторы и т.д.)
3) неорганический синтез (производство минеральных удобрений, пигментов, кислот…) и органический синтез (производство красителей, ВВ, полимеров…)
4) производство бумаги
5) производство соды (стекло, СМС)
Соли серной кислоты не обладают окислительными свойствами, вступают в обычные реакции ионного обмена.
Дата добавления: 2022-02-09; просмотров: 38; Нарушение авторских прав
Реакции, взаимодействие серы с металлами и полуметаллами. уравнения реакции:
1. Реакция взаимодействия серы и кальция:
Ca S → CaS (t = 150 °C).
Реакция взаимодействия кальция и серы происходит с образованием сульфида кальция.
2. Реакция взаимодействия серы и кобальта:
Co S → CoS (t ≈ 650 °C).
Реакция взаимодействия кобальта и серы происходит с образованием сульфида кобальта. В результате реакции также образуются CoS2, Co3S4, Co9S8.
3. Реакция взаимодействия серы и калия:
2K S → K2S (t = 100-200 °C).
Реакция взаимодействия калия и серы происходит с образованием сульфида калия.
4. Реакция взаимодействия серы и лития:
2Li S → Li2S (t > 130 °C).
Реакция взаимодействия лития и серы происходит с образованием сульфида лития.
5. Реакция взаимодействия серы и натрия:
2Na S → Na2S (t > 130 °C).
Реакция взаимодействия натрия и серы происходит с образованием сульфида натрия.
6. Реакция взаимодействия серы и рубидия:
2Rb S → Rb2S (t = 100-130 °C).
Реакция взаимодействия рубидия и серы происходит с образованием сульфида рубидия.
7. Реакция взаимодействия серы и серебра:
2Ag S → Ag2S (t > 200°C).
Реакция взаимодействия серебра и серы происходит с образованием сульфида серебра.
8. Реакция взаимодействия серы и меди:
2Cu S → Cu2S (t = 300-400 °C).
Реакция взаимодействия меди и серы происходит с образованием сульфида меди.
9. Реакция взаимодействия серы и железа:
Fe S → FeS (t = 600-950°C).
Реакция взаимодействия железа и серы происходит с образованием сульфида железа.
10. Реакция взаимодействия серы и цинка:
Zn S → ZnS (t = 130 °C).
Реакция взаимодействия цинка и серы происходит с образованием сульфида цинка.
11. Реакция взаимодействия серы и таллия:
2Tl S → Tl2S (t = 320 °C).
Реакция взаимодействия таллия и серы происходит с образованием сульфида таллия. Реакция протекает в атмосфере водорода.
Реакции, взаимодействие серы с солями. уравнения реакции:
1. Реакция взаимодействия серы и сульфита натрия:
Na2SO3 S → Na2S2O3 (t°)
или
8Na2SO3 S8 → 8Na2S2O3 (t°).
Реакция взаимодействия сульфита натрия и серы происходит с образованием тиосульфата натрия. Реакция происходит в кипящем водном растворе.
2. Реакция взаимодействия серы и сульфида калия:
K2S S → K2S2 (t°).
Реакция взаимодействия сульфида калия и серы происходит с образованием дисульфида калия.
3. Реакция взаимодействия серы и трисульфида гадолиния:
Gd2S3 S → 2GdS2.
Реакция взаимодействия трисульфида гадолиния с серой происходит с образованием сульфида гадолиния.
4. Реакция взаимодействия серы и сульфида таллия (I):
Tl2S 2S → Tl2S3.
Реакция взаимодействия сульфида таллия (I) и серы происходит с образованием трисульфида таллия (I).
5. Реакция взаимодействия серы и сульфида бора (III):
B2S3 2S → B2S5.
Реакция взаимодействия сульфида бора (III) с серой происходит c образованием сульфида бора (V).
6. Реакция взаимодействия серы и трисульфида диванадия:
V2S3 2S → V2S5.
Реакция взаимодействия трисульфида диванадия с парами серы происходит с образованием сульфида ванадия.
Реакции, взаимодействие серы. уравнения реакции серы с веществами.
Сера реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, солями и пр. веществами.
Реакции, взаимодействие серы с неметаллами
Реакции, взаимодействие серы с металлами и полуметаллами
Реакции, взаимодействие серы с оксидами
Реакции, взаимодействие серы с солями
Реакции, взаимодействие серы с кислотами
Реакции, взаимодействие серы с водородсодержащими соединениями
Реакции, связанные с изменением молекулярного состава серы
Сера, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
Химические свойства серы
При
обычных температуре и давлении химическая активность серы небольшая. При
нагревании сера довольно активна, и проявляет свойства как окислителя, так и восстановителя.
Свойства окислителя сера проявляет при взаимодействии с элементами, расположенными ниже и левее в Периодической системе, а свойства восстановителя — с элементами, расположенными выше и правее в Периодической системе.
Непосредственно сера не взаимодействует с азотом и йодом.
Взаимодействие с простыми веществами
С
кислородом
Горение серы на воздухе с образованием оксида серы (IV):
S O2 → SO2
В присутствии
катализаторов:
2S 3O2 = 2SO3
С водородом
С водородом сера вступает
в реакцию при нагревании, образуя сероводород:
S H2 → H2S
С
галогенами
При
взаимодействии со всеми галогенами, кроме йода образуются галогениды:
S Cl2 → SCl2 (S2Cl2)
S 3F2 → SF6
С
фосфором
Взаимодействие серы с фосфором приводит к образованию сульфидовфосфора
2P 3S → P2S3
2P 5S → P2S5
С углеродом
В реакции серы суглеродомобразуется сероуглерод:
2S C → CS2
С металлами
При
взаимодействии с металлами сера выступает
в качестве окислителя, образуя сульфиды.
Щелочные металлы реагируют с серой без нагревания, остальные металлы (кроме золота Au и платины Pt) –при нагревании:
S Fe → FeS
S Hg → HgS
3S 2Al → Al2S3
S Сu = CuS
S 2Ag = Ag2S
Взаимодействие со сложными веществами
С водой
Сера вступает в реакцию диспропорционирования
с перегретым паром:
S H2O (пар) → 2H2S SO2
С окислителями
В реакциях с окислителями сера окисляется до оксида серы (IV) SO2 или до серной кислоты H2SO4 при протекании реакции в растворе:
S 2HNO3(разб.) = H2SO4 2NO↑
S 6HNO3(конц.) → H2SO4 6NO2↑ 2H2O
S 2H2SO4(конц.)→ 3SO2↑ 2H2O
S 2KClO3 → 3SO2↑ 2KCl
S К2Сr2O7 = Сr2O3 K2SO4
S Na2SO3 → Na2S2O3
С щелочами
При взаимодействии с щелочами сера диспропорционирует до сульфита и сульфида:
S NaOH → Na2SO3 Na2S H2O

