- Электронное строение щелочных металлов и основные свойства
- Основное и возбужденное состояние азота
- Аммиак
- Есть ответ: 1)формула простого вещества: литий, берилий, бор, углерод, азот, кислород, фтор, неон
- Качественные реакции
- Литий, свойства атома, химические и физические свойства.
- Нахождение в природе
- Нитраты и нитриты щелочных металлов
- Общая характеристика элементов va группы
- Оксид азота i — n2o
- Оксид азота ii — no
- Оксид азота iii — n2o3
- Оксид азота iv — no2
- Оксид лития, химические свойства, получение
- Получение оксида лития:
- Применение и использование оксида лития:
- Применение лития:
- Природные соединения
- Реакции, взаимодействие лития с оксидами. уравнения реакции:
- Реакции, взаимодействие лития. уравнения реакции лития с веществами.
- Реакция взаимодействия лития и кислорода
- Соли аммония
- Способ получения
- Способы получения
- Физические свойства
- Физические свойства лития:
- Физические свойства оксида лития:
- Формула оксида лития в химии
- Химические и физические свойства лития, его реакция с кислородом
- Химические свойства
- Химические свойства оксида лития. химические реакции оксида лития:
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns1, на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях 1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрица-тельность.
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl NaOH → NH3 NaCl H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
Есть ответ: 1)формула простого вещества: литий, берилий, бор, углерод, азот, кислород, фтор, неон
1)Формула простого вещества: Литий, Берилий, Бор, Углерод, Азот, Кислород, Фтор, Неон.
2)Формула вищего оксида: Литий, Берилий, Бор, Углерод, Азот, Кислород, Фтор, Неон.
3)Формула гидрату оксда: Литий, Берилий, Бор, Углерод, Азот, Кислород, Фтор, Неон.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов.
Цвет пламени:Li — карминно-красныйNa — жѐлтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
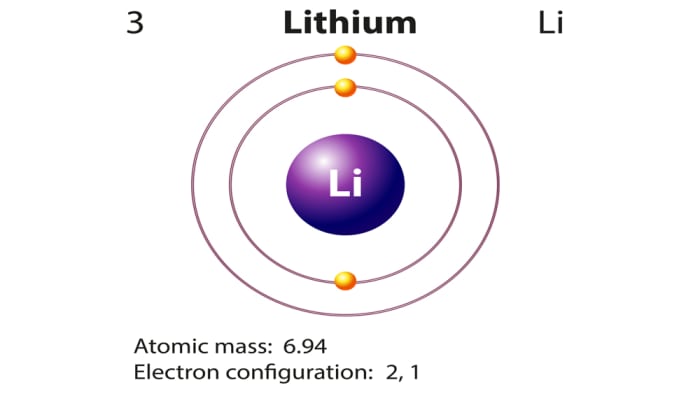
Литий, свойства атома, химические и физические свойства.
Li 3 Литий
6,938-6,997* 1s2 2s1
Литий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 3. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), втором периоде периодической системы.
Атом и молекула лития. Формула лития. Строение атома лития
Изотопы и модификации лития
Свойства лития (таблица): температура, плотность и пр.
Физические свойства лития
Химические свойства лития. Взаимодействие лития. Химические реакции с литием
Получение лития
Применение лития
Таблица химических элементов Д.И. Менделеева
Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия
Сильвин KCl — хлорид калия
СильвинитNaCl · KCl
Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия
Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например, нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
2NaNO3 → 2NaNO2 O2
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например, нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
NaNO3 4Zn 7NaOH 6H2O = 4Na2[Zn(OH)4] NH3↑
Сильные окислители окисляют нитриты до нитратов.
Например, перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
5NaNO2 2KMnO4 3H2SO4 = 5NaNO3 2MnSO4 K2SO4 3H2O
Общая характеристика элементов va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Оксид азота i — n2o
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 O2
Оксид азота ii — no
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 O2 → (t, кат) NO H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu HNO3(разб.) → Cu(NO3)2 NO H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO O2 → NO2
Оксид азота iii — n2o3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 HNO3 H2O → H3AsO4 NO↑
As2O3 HNO3 H2O → H3AsO4 NO2↑
При охлаждении газов образуется оксид азота III.
NO NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O N2O3 → HNO2
NaOH N2O3 → NaNO2 H2O
Оксид азота iv — no2
Бурый газ, имеет острый запах. Ядовит.
Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu HNO3(конц) → Cu(NO3)2 NO2 H2O
Cu(NO3)2 → (t) CuO NO2 O2
Pb(NO3)2 → (t) PbO NO2 O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 C → CO2 N2
NO2 P → P2O5 N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 NO2 → SO3 NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 H2O → HNO3 HNO2
NO2 LiOH → LiNO3 LiNO2 H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 H2O O2 → HNO3
Оксид лития, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Получение оксида лития:
Оксид лития получается в результате следующих химических реакций:
- 1. путем разложения пероксида лития:
2Li2О2 → 2Li2О О2 (t = 195 oC).
- 2.путем взаимодействия лития с кислородом:
4Li О2 → 2Li2О.
Применение и использование оксида лития:
Оксид лития используется как компонент в производстве стекол, а также в химической промышленности.
Применение лития:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) Zn → Zn(NO3)2 N2 H2O
Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до 5.
- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 Li → Li3N (нитрид лития)
N2 Mg → (t) Mg3N2
N2 Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 H2 ⇄ (t, p) NH3
Реакции, взаимодействие лития с оксидами. уравнения реакции:
1. Реакция взаимодействия лития, оксида азота (II) и оксида азота (IV):
Li2O NO2 NO → 2LiNO2 (t = 300 °C).
Реакция взаимодействия лития, оксида азота (II) и оксида азота (IV) происходит с образованием нитрита лития.
2. Реакция взаимодействия лития и воды:
2Li 2H2O → 2LiOH H2.
Реакция взаимодействия лития и воды происходит с образованием гидроксида лития и водорода. Реакция протекает бурно.
3. Реакция взаимодействия лития и оксида фосфора (V):
3P4O10 16Li → 10LiPO3 2Li3P (t = 300-400 °C).
Реакция взаимодействия оксида фосфора (V) и лития происходит с образованием метафосфата лития и фосфида лития.
Реакции, взаимодействие лития. уравнения реакции лития с веществами.
Литий реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, органическими соединениями и пр. веществами.
Реакции, взаимодействие лития с неметаллами
Реакции, взаимодействие лития с металлами и полуметаллами
Реакции, взаимодействие лития с оксидами
Реакции, взаимодействие лития с кислотами
Реакции, взаимодействие лития с водородосодержащими соединениями
Реакции, взаимодействие лития с органическими соединениями
Реакция взаимодействия лития и кислорода
Соли аммония
Получение
NH3 H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
Способ получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li Cl2
Способы получения
1. Щелочи получают электролизомрастворов хлоридов щелочных метал-лов:
2NaCl 2H2O → 2NaOH H2 Cl2
2.При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например, натрий, оксид натрия, гидрид натрия ипероксид натрия при растворении в воде образуют щелочи:
2Na 2H2O → 2NaOH H2
Na2O H2O → 2NaOH
2NaH 2H2O → 2NaOH H2
Na2O2 H2O → 2NaOH H2O2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бариятакже образуют щелочи.
Например, карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
K2CO3 Ca(OH)2 → CaCO3↓ 2KOH
Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.
Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.
Физические свойства лития:
Литий представляет собой серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. В связи с ем его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2.
Однако ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседних атома, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Литий – очень легкий металл.
Литий имеет самую низкую плотность при комнатной температуре среди всех металлов (0,534 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Литий не растворяется в воде, но реагирует с ней. Литий плохо растворяется в органических растворителях, ртути. Растворяется в жидком аммиаке с образованием синего раствора с металлической проводимостью. Растворяется в расплавленном алюминии.
Расплавленный литий растворяет металлы и обезуглероживает стали, что приводит к изменению прочности конструкционных материалов. Расплавленный литий не растворяет инертные газы.
Пары лития имеют ярко-красный цвет.
Температура плавления лития (Li) составляет 180,54 °C.
Температура кипения лития (Li) составляет 1330 °C.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1339,85 °C, соответственно).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие пары щелочных металлов смешиваются друг с другом в любых соотношениях.
Теплопроводность лития при 300 K составляет 84,8 Вт/(м·К).
Физические свойства оксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | Li2O |
| Синонимы и названия иностранном языке | lithium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2022 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,013 |
| Температура кипения, °C | 2600 |
| Температура плавления, °C | 1570 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 29,8774 |
* Примечание:
— нет данных.
Формула оксида лития в химии
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов углерода в молекуле через «х», водорода — «у», брома – «z», фтора — «w» и хлора «k» (CxHyBrzFwClk).
Найдем соответствующие относительные атомные массы элементов углерода, водорода, брома, фтора и хлора (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(С) = 12; Ar(H) = 1; Ar(Br) = 80; Ar(F) = 19; Ar(Cl) = 35,5.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z:w:k= ω(C)/Ar(C) : ω(H)/Ar(H) : ω(Br)/Ar(Br) : ω(F)/Ar(F): ω(Cl)/Ar(Cl);
x:y:z:w:k= 12,2/12 : 0,51/1 : 40,4/80 : 28,9/19: 18,0/35,5;
x:y:z:w:k = 1 : 0,51 : 0,5 : 1,5 : 0,5;
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,5):
2 : 1 : 1 : 3 : 1.
Следовательно, простейшая формула соединения углерода, водорода, брома, фтора и хлора имеет вид C2HBrF3Cl, а молярная масса 197,5 г/моль [M(C2HBrF3Cl) = 2×Ar(C) Ar(H) Ar(Br) 3×Ar(F) Ar(Cl) = 2×12 1 80 3×19 35,5 = 24 81 57 35,5 =197,5 г/моль].
Чтобы найти эмпирическую (истинную) формулу фторотана найдем отношение молярных масс (полученной и указанной в условии задачи):
Msubstance / M(C2HBrF3Cl) = 197,5 / 197,5 = 1.
Значит эмпирическая формула фторотана имеет вид C2HBrF3Cl.
Химические и физические свойства лития, его реакция с кислородом
Химические свойства
1. Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na S = Na2S
1.3.Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K P = K3P
2Na H2 = 2NaH
1.4.С азотомлитий реагирует при комнатной температуре с образованием нитрида:
6Li N2 = 2Li3N
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
2Na 2C = Na2C2
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
4Li O2 = 2Li2O
2Na O2 = Na2O2
K O2 = KO2
Цезийсамовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопытсамовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой. Взаимодействие щелочных металлов с водойприводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например, калий реагирует с водойочень бурно:
2K0 H2 O = 2K OH H20
Видеоопыт:взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2.Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например, натрий бурно реагирует с соляной кислотой:
2Na 2HCl = 2NaCl H2↑
2.3.При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например, при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
8Na 5H2SO4(конц.) → 4Na2SO4 H2S 4H2O
2.4.Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
8Na 10HNO3 (конц) → N2O 8NaNO3 5H2O
С разбавленной азотной кислотой образуется молекулярный азот:
10Na 12HNO3 (разб)→ N2 10NaNO3 6H2O
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
8Na 10HNO3 = 8NaNO3 NH4NO3 3H2O
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства. Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами, феноломи органическими кислотами.
Например, при взаимодействии лития с аммиакомобразуются амиды и водород:
2Li 2NH3 = 2LiNH2 H2 ↑
Ацетиленс натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н 2Na → Na ─ C≡C ─ Na H2
Фенолс натрием реагирует с образованием фенолята натрия и водорода:
2C6H5OH 2Na → 2C6H5ONa H2↑
Метанолс натрием образуют метилат натрия и водород:
2СН3ОН 2Na → 2 CH3ONa H2↑
Уксусная кислотас литием образует ацетат лития и водород:
2СH3COOH 2Li → 2CH3COOLi H2↑
Щелочные металлы реагируют с галогеналканами(реакция Вюрца).
Например, хлорметанс натрием образует этан и хлорид натрия:
2CH3Cl 2Na → C2H6 2NaCl
2.6.В расплавещелочные металлы могут взаимодействовать с некоторыми солями. Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, натрий взаимодействует в расплаве с хлоридом алюминия :
3Na AlCl3 → 3NaCl Al
Химические свойства оксида лития. химические реакции оксида лития:
Химические свойства оксида лития аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида лития с магнием:
Li2O Mg → 2Li MgO (t > 800 oC).
В результате реакции образуется оксид магния и литий.
2. реакция оксида лития с магнием и водородом:
Li2O Mg H2 → 2LiH MgO (t = 450-500 oC).
В результате реакции образуется оксид магния и гидрид лития.
3. реакция оксида лития с алюминием:
3Li2O 2Al → 6Li Al2O3 (t > 1000 oC).
В результате реакции образуется оксид алюминия и литий.
4. реакция оксида лития с алюминием и водородом:
3Li2O 2Al 3H2 → 6LiH Al2O3 (t = 600-700 oC).
В результате реакции образуется оксид алюминия и гидрида лития.
5. реакция оксида лития с кремнием:
2Li2O Si → 4Li SiO2 (t = 1000 oC).
В результате реакции образуется оксид кремния и литий.
6. реакция оксида лития с водой:
Li2О Н2О → 2LiОН.
Оксид лития медленно реагирует с водой, образуя гидроксид лития.
7. реакция оксида лития с оксидом углерода (углекислым газом):
Li2О СО2 → Li2СО3.
Оксид лития на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат лития.
8. реакция оксида лития с оксидом кремния:
Li2О SiО2 → Li2SiО3 (t = 1200-1300 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – метасиликат лития.
9. реакция оксида лития с оксидом серы:
Li2О SО2 → Li2SО3.
Оксид серы также является кислотным оксидом. В результате реакции образуется соль – сульфит лития.
10. реакция оксида лития с оксидом азота (IV) и оксидом азота (II):
Li2O NO2 NO → 2LiNO2 (t = 300 oC).
В результате реакции образуются соль – нитрит лития.
11. реакция оксида лития с оксидом ванадия:
V2O3 Li2O → 2LiVO2 (t = 1200 oC).
В результате реакции образуется диоксованадат лития.
12. реакция оксида лития с оксидом теллура:
TeO2 Li2O → Li2TeO3 (to).
В результате реакции образуется теллурит лития.
13. реакция оксида лития с оксидом марганца:
Mn2O3 Li2O → 2LiMnO2 (t = 800-900 oC).
В результате реакции образуется оксид марганца-лития.
14. реакция оксида лития с йодоводородом:
Li2O 2HI → 2LiI H2O.
В результате химической реакции получается соль – йодид лития и вода.
15. реакция оксида лития с сероводородом:
Li2O H2S → Li2S H2O (t = 900-1000 oC).
В результате химической реакции получается соль – сульфид лития и вода.
16. реакция оксида лития с плавиковой кислотой:
Li2O 2HF → 2LiF H2O.
В результате химической реакции получается соль – фторид лития и вода.
17. реакция оксида лития с азотной кислотой:
Li2O 2HNO3 → 2LiNO3 H2O.
В результате химической реакции получается соль – нитрат лития и вода.
Аналогично проходят реакции оксида лития и с другими кислотами.
18. реакция оксида лития с бромистым водородом (бромоводородом):
Li2O 2HBr → 2LiBr H2O.
В результате химической реакции получается соль – бромид лития и вода.