Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Валентность — как определить? примеры и определение
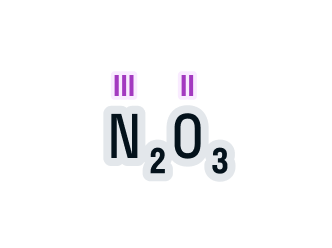
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.

В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
- 4Р 6Н2О → РН3 3Н3РО2 (фосфатная кислота).
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
- 4P 5O2 → 2P2O5 (с избытком кислорода),
- 4P 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
- 2P 3Ca → Ca3P2,
- 2P 3Mg → Mg3P2.
с неметаллами — восстановитель:
- 2P 3S → P2S3,
- 2P 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
- 4Р 3KOH 3Н2О → РН3 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P 5HNO3 2H2O → 3H3PO4 5NO;
- 2P 5H2SO4 → 2H3PO4 5SO2 2H2O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P 5KClO3 → 5KCl 3P2O5
Оксид фосфора v — p2o5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P O2 → P2O5
Химические свойства
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Получение
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора,
взаимодействия оксида фосфора V с водой.
Ca3(PO4)2 H2SO4 → CaSO4 H3PO4
P2O5 H2O → H3PO4
PCl5 H2O → H3PO4 HCl
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
P HNO3 H2O → H3PO4 NO
Химические свойства
- Кислотные свойства
- Реакции с солями
- Реакции с металлами
- Дегидратация
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные
соли (фосфаты, гидрофосфаты и дигидрофосфаты).
3K2O H3PO4 = 2K3PO4 3H2O
3KOH H3PO4 = K3PO4 3H2O
2KOH H3PO4 = K2HPO4 H2O
KOH H3PO4 = KH2PO4 H2O
Реакции идут, если выделяется газ, выпадает осадок или образуется слабый электролит (вода). Например, характерный осадок
желтого цвета — фосфат серебра — образуется в результате реакции с нитратом серебра.
AgNO3 H3PO4 → Ag3PO4 HNO3
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
K2CO3 H3PO4 → K3PO4 H2O CO2
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
Mg H3PO4 → Mg3(PO4)2 H2↑
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
H3PO4 → (t) HPO3 H2O
Получение
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).
Получение фосфора и его применение
Существует разные способы получения фосфора. Белый фосфор синтезируют с помощью прокаливания природных фосфатов совместно с коксом и песком в электрической печи. При выдерживании продукта реакции в печи в течении некоторого времени белый фосфор Валентность — количество химических связей, которые может образовывать атом элемента с другими атомами за счет объединения неспаренных электронов в общую электронную пару (не зря ковалентная связь так названа). Валентность обозначают римской цифрой. Валентность часто равна количеству неспаренных электронов у атома. Для элементов IV – VII А — групп валентность определить легко, задав вопрос: «Сколько электронов нужно данному элементу до завершения внешнего энергетического уровня?» или по формуле: 8 — № группы (действует только для элементов главных подгрупп IV – VII групп). Но не стоит забывать, что многие элементы в процессе возбуждения могут распаривать электроны, в таком состоянии валентность может достигать номера группы (это характерно для всех элементов, кроме азота, кислорода и фтора). Рассмотрим примеры. Валентность азота и фосфораАзот и фосфор, находящиеся в одной группе. Для них по формуле 8 – 5 = 3 мы можем найти низшую валентность (количество неспаренных электронов в основном состоянии), равную трем (III). В таком случае азот образует аммиак (NH3) и оксид азота III (N2O3), а фосфор – фосфин (PH3) или оксид фосфора III (P2O3). Но вспомним про возможность образовывать донорно-акцепторные связи некоторыми атомами. И азот, и фосфор имею такую возможность, поэтому кроме трех обычных ковалентных связей, они могут образовать дополнительную донорно-акцепторную. В таком случае, в основном состоянии оба могут иметь валентность IV, что соответствует катиону аммония и катиону фосфония (NH4 и PH4 ). Ковалентные связи обозначают черточкой («‒»).Рис. Образование ковалентных и донорно-акцепторных (выделено красным) связей атомом азота.У фосфора, в отличие от азота, на внешнем уровне есть незаполненная d-орбиталь, на которую могут переходить электроны при возбуждении. У фосфора в возбужденном состоянии появляется пять неспаренных электронов, поэтому он способен образовывать пять ковалентных связей, соответственно проявлять валентность V, например в ортофосфорной кислоте (H3PO4). Рис. Строение фосфорной кислоты в соответствии с валентными состояниями атомов: фосфор в возбужденном состоянии имеет пять неспаренных электронов, его валентность равна V; кислород имеет два неспаренных электрона, поэтому его валентность равна II и он может образовывать две ковалентные связи; водород имеет один неспаренных электрон и его валентность равна I. Валентность обозначена красными римскими цифрами. У азота нет свободной d-орбитали (она появляется с третьего энергетического уровня, а у азота всего два уровня), поэтому распарить электроны не может и высшую валентность, равную номеру группы, проявлять он не способен. Валентность кислорода и серыАналогичную ситуацию можно наблюдать у атомов кислорода и серы. Кислород, находясь во втором периоде может иметь только два энергетических уровня, поэтому d-орбитали, появляющейся с третьего уровня, у него нет. Тогда как у серы три энергетических уровня, на внешнем уровне есть d-орбиталь и возможность распаривать на нее электроны в процессе возбуждения.Рис. Количество неспаренных электронов у кислорода и серы в основном и возбужденном состоянии.Таким образом, кислород способен проявлять валентность II, а сера – валентность II, IV, VI, например, в сероводороде (H2S) валентность равна двум; в сернистом газе и сернистой кислоте (SO2 и H2SO3) валентность равна четырём; в серном ангидриде и серной кислоте (SO3 и H2SO4) – шести. Валентность фтора и хлораПо причинам, описанным выше, фтор так же не способен распаривать свои электроны и переходить в возбужденное состояние, а хлор может. Поэтому у фтора есть одно валентное состояние (I), например, в HF (H ‒ F) и OF2 (F ‒ O ‒ F). Хлор, как и другие нижестоящие галогены (элементы VIIА-подгруппы), может образовывать несколько возбужденных состояний, поэтому в разных соединениях имеет разную валентность. Например, валентность I хлор проявляет в хлороводороде HCl. Валентность III в хлористой кислоте HClO2. Валентность равную V – в хлорноватой кислоте HClO3. Равную VII – в хлорной кислоте HClO4. Постоянная и непостоянная валентностьКак уже можно было заметить, некоторые элементы способны проявлять только одну валентность, тогда как другие могут иметь множество валентностей. По этой черте все элементы можно разделить на две группы: элементы с постоянной и непостоянной валентностью.Таб. Классификация элементов по валентностиС постоянной валентностью С непостоянной валентностью I: H и FII: OВсе остальные неметаллы.Иногда валентность определяют и у металлов, хотя для них характерна ионная, а не ковалентная связь, в таком случае таблица будет выглядеть следующим образом:С постоянной валентностью С непостоянной валентностью I: H, F, все металлы IА-подгруппы (Li, Na…).II: O и все металлы IIА-подгруппы, а также цинк.III: элементы IIIА-подгруппы.Все остальные неметаллы и металлы.Низшая и высшая валентностьВысшая валентность равна номеру группы, в которой находится элемент (исключения: кислород, азот и фтор, как и было описано выше). Так, для брома высшей валентностью будет VII, для теллура – VI, для мышьяка V. Низшая валентность возможна для элементов четвёртой группы, она равна двум. Для элементов V – VII групп она определяется по описанной выше формуле (8 — №группы элемента). Поэтому у брома низшей валентностью будет I, у теллура II, а у мышьяка III.
Применение
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфоритCa10(PO4)6(F,Cl,OH)2 — апатитПолучение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 SiO2 C → (t) CaSiO3 P CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Соединения фосфора, биологическая роль
Типичные соединения фосфора можно представить в виде таблицы:
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
3Ca(OH)2 2H3PO4 = Ca3(PO4)2 6H2O
Фосфаты являются хорошими удобрениями, которые повышают урожайность. Перечислим наиболее значимые:
Фосфоритная мука — Ca3(PO4)2Простой суперфосфат — смесь Ca(H2PO4)2*H2O и CaSO4Двойной суперфосфат — Ca(H2PO4)2*H2OПреципитат — CaHPO4*2H2OКостная мука — продукт переработки костей домашних животных Ca3(PO4)2Аммофос — в основном состоит из моноаммонийфосфата — NH4H2PO4
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.Ваша оценка?
Таблица валентностей химических элементов. Максимальная и минимальная валентность. — Инженерный справочник / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..Таблица валентностей химических элементов.Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.1Водород valency/валентность HydrogenH(-1), 12Гелий valency/валентность HeliumHe03Литий valency/валентность LithiumLi 14Бериллий valency/валентность BerylliumBe 25Бор valency/валентность BoronB-3, 36Углерод valency/валентность CarbonC( 2), 47Азот valency/валентность NitrogenN-3, -2, -1, ( 1), 2, 3, 4, 58Кислород valency/валентность OxygenO-29Фтор valency/валентность FluorineF-1, ( 1)10Неон valency/валентность NeonNe011Натрий valency/валентность SodiumNa 112Магний valency/валентность MagnesiumMg 213Алюминий valency/валентность AluminumAl 314Кремний valency/валентность SiliconSi-4, ( 2), 415Фосфор valency/валентность PhosphorusP-3, 1, 3, 5Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.16Сера valency/валентность SulfurS-2, 2, 4, 617Хлор valency/валентность ChlorineCl-1, 1, ( 2), 3, ( 4), 5, 718Аргон valency/валентность ArgonAr019Калий valency/валентность PotassiumK 120Кальций valency/валентность CalciumCa 221Скандий valency/валентность ScandiumSc 322Титан valency/валентность TitaniumTi 2, 3, 423Ванадий valency/валентность VanadiumV 2, 3, 4, 524Хром valency/валентность ChromiumCr 2, 3, 625Марганец valency/валентность ManganeseMn 2, ( 3), 4, ( 6), 726Железо valency/валентность IronFe 2, 3, ( 4), ( 6)27Кобальт valency/валентность CobaltCo 2, 3, ( 4)28Никель valency/валентность NickelNi( 1), 2, ( 3), ( 4)29Медь valency/валентность CopperСu 1, 2, ( 3)30Цинк valency/валентность ZincZn 2Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.31Галлий valency/валентность GalliumGa( 2). 332Германий valency/валентность GermaniumGe-4, 2, 433Мышьяк valency/валентность ArsenicAs-3, ( 2), 3, 534Селен valency/валентность SeleniumSe-2, ( 2), 4, 635Бром valency/валентность BromineBr-1, 1, ( 3), ( 4), 536Криптон valency/валентность KryptonKr037Рубидий valency/валентность RubidiumRb 138Стронций valency/валентность StrontiumSr 239Иттрий valency/валентность YttriumY 340Цирконий valency/валентность ZirconiumZr( 2), ( 3), 441Ниобий valency/валентность NiobiumNb( 2), 3, ( 4), 542Молибден valency/валентность MolybdenumMo( 2), 3, ( 4), ( 5), 643Технеций valency/валентность TechnetiumTc 644Рутений valency/валентность RutheniumRu( 2), 3, 4, ( 6), ( 7), 845Родий valency/валентность RhodiumRh( 2), ( 3), 4, ( 6)Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.46Палладий valency/валентность PalladiumPd 2, 4, ( 6)47Серебро valency/валентность SilverAg 1, ( 2), ( 3)48Кадмий valency/валентность CadmiumCd( 1), 249Индий valency/валентность IndiumIn( 1), ( 2), 350Олово valency/валентность TinSn 2, 451Сурьма valency/валентность AntimonySb-3, 3, ( 4), 552Теллур valency/валентность TelluriumTe-2, ( 2), 4, 653Иод valency/валентность IodineI-1, 1, ( 3), ( 4), 5, 754Ксенон valency/валентность XenonXe055Цезий valency/валентность CesiumCs 156Барий valency/валентность BariumBa 257Лантан valency/валентность LanthanumLa 358Церий valency/валентность CeriumCe 3, 459Празеодим valency/валентность PraseodymiumPr 360Неодим valency/валентность NeodymiumNd 3, 4Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.61Прометий valency/валентность PromethiumPm 362Самарий valency/валентность SamariumSm( 2), 363Европий valency/валентность EuropiumEu( 2), 364Гадолиний valency/валентность GadoliniumGd 365Тербий valency/валентность TerbiumTb 3, 466Диспрозий valency/валентность DysprosiumDy 367Гольмий valency/валентность HolmiumHo 368Эрбий valency/валентность ErbiumEr 369Тулий valency/валентность ThuliumTm( 2), 370Иттербий valency/валентность YtterbiumYb( 2), 371Лютеций valency/валентность LutetiumLu 372Гафний valency/валентность HafniumHf 473Тантал valency/валентность TantalumTa( 3), ( 4), 574Вольфрам valency/валентность TungstenW( 2), ( 3), ( 4), ( 5), 675Рений valency/валентность RheniumRe(-1), ( 1), 2, ( 3), 4, ( 5), 6, 7Порядковый номерхимического элемента,он же: атомный номер,он же: зарядовое числоатомного ядра,он же: атомное числоРусское /Английское наименование Химическийсимвол ВалентностьВ скобках обозначеныболее редкие валентности.Химические элементы сединственной валентностью- одну и имеют.76Осмий valency/валентность OsmiumOs( 2), 3, 4, 6, 877Иридий valency/валентность IridiumIr( 1), ( 2), 3, 4, 678Платина valency/валентность PlatinumPt( 1), 2, ( 3), 4, 679Золото valency/валентность GoldAu 1, ( 2), 380Ртуть valency/валентность MercuryHg 1, 281Талий valency/валентность ThalliumTl 1, ( 2), 382Свинец valency/валентность LeadPb 2, 483Висмут valency/валентность BismuthBi(-3), ( 2), 3, ( 4), ( 5)84Полоний valency/валентность PoloniumPo(-2), 2, 4, ( 6)85Астат valency/валентность AstatineAtнет данных86Радон valency/валентность RadonRn087Франций valency/валентность FranciumFrнет данных88Радий valency/валентность RadiumRa 289Актиний valency/валентность ActiniumAc 390Торий valency/валентность ThoriumTh 491Проактиний valency/валентность ProtactiniumPa 592Уран valency/валентность UraniumU( 2), 3, 4, ( 5), 6
Таблица валентности химических элементов (1 часть):
Атомный номерХимический элементСимволВалентностьПримеры соединенийПримечание1ВодородHIHCl, H2O22ГелийHeотсутствует3ЛитийLiILiOH, Li2O4БериллийBeI, II5БорBIIIB2O36УглеродCII, IV7АзотNI, II, III, IVN2O;NO;N2O3, Ca(NO2)2,(NO)F, HNO2, NH2OH, NH3;NO2, N2O4, HNO3, NH4NO3, Ca(NO3)2, N2O5В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным8КислородOII(NO)F, CaO, O2, H2O2,Cl2O, H2O9ФторFIHF, (NO)F10НеонNeотсутствует11НатрийNaINa2S, Na2O12МагнийMgIIMg(NO3)213АлюминийAlIIIAl2O3, Al2S3, AlCl314КремнийSiII, IV15ФосфорPIII, VP2O3, PH3, H3PO3, H3PO4;P2O516СераSII, IV, VIH2S, K2S, PbS, Al2S3, Fe2S3, FeS2;SO2;SF6, SO3, H2SO417ХлорClI, III, IV, V, VI, VIICl2O, NaCl, Cl2, HCl, NH4Cl;NaClO2;NaClO2;KClO3, Cl2O5;Cl2O6;Cl2O718АргонArотсутствует19КалийKIKOH, K2O, K2S20КальцийCaIICa(OH)221СкандийScIIISc2O322ТитанTiII, III, IV23ВанадийVII, III, IV, V24ХромCrII, III, VI25МарганецMnII, III, IV, VI, VIIMn(OH)2;Mn2O3;MnO2;MnO3;Mn2O726ЖелезоFeII, IIIFe(OH)2, FeS2, FeO;Fe2O3, Fe(OH)3, Fe2Cl3, Fe2S327КобальтCoII, III28НикельNiII, III29МедьCuI, II30ЦинкZnIIZnSO4, ZnO, ZnS
Таблица валентности химических элементов (2 часть):
31ГаллийGaI, II, III32ГерманийGeII, IV33МышьякAsIII, V34СеленSeII, IV, VI35БромBrI, III, V, VII36КриптонKrотсутствует37РубидийRbIRbOH38СтронцийSrIISrO39ИттрийYIIIY(NO3)340ЦирконийZrII, III, IV41НиобийNbI, II, III, IV, V42МолибденMoII, III, IV, V, VIMoCl2;Mo(OH)3;MoO2;MoCl5;MoF643ТехнецийTcII, III, IV, V, VI, VIITcCl2;TcBr3;TcBr4;TcF5;TcCl6;Tc2O744РутенийRuII, III, IV, V, VI, VII, VIIIRu(OH)2;RuCl3;Ru(OH)4;Ru2O5;RuB2;NaRuO4;RuO445РодийRhII, III, IV, V, VIRhO;Rh2(SO4)3;Rh(OH)4;RhF5;RhF646ПалладийPdII, IV47СереброAgI, II, III48КадмийCdI, II49ИндийInI, II, III50ОловоSnII, IV51СурьмаSbIII, V52ТеллурTeII, IV, VI53ЙодII, III, V, VII54КсенонXeотсутствует55ЦезийCsICs2O56БарийBaIIBa(OH)257ЛантанLaIIILa2(SO4)358ЦерийCeIII, IV59ПразеодимPrII, III, IV60НеодимNdII, III
Таблица валентности химических элементов (3 часть):
61ПрометийPmIIIPmBr362СамарийSmII, III63ЕвропийEuII, III64ГадолинийGdII, III65ТербийTbII, III, IV66ДиспрозийDyII, III67ГольмийHoIIIHo2(SO4)368ЭрбийErIIIEr2O369ТулийTmII, III70ИттербийYbII, III71ЛютецийLuIIILuBr372ГафнийHfI, II, III, IV73ТанталTaI, II, III, IV, VTa2O;TaO;TaCl3;TaO2;Ta2O574ВольфрамWII, III, IV, V, VIW6Cl12;WO3;WO2;W2Cl10;WF675РенийReI, II, III, IV, V, VI, VIIRe2O;ReO;Re2O3;ReO2;ReF5;ReCl6;ReF776ОсмийOsI, II, III, IV, V, VI, VII, VIIIOsI;OsI2; OsBr3;OsO2;OsCl4;OsF5;OsF6;OsOF5; OsO477ИридийIrI, II, III, IV, V, VIIrCl;IrCl2;IrCl3;IrO2;Ir4F20;IrF678ПлатинаPtII, III, IV, V, VI79ЗолотоAuI, II, III, V80РтутьHgI, II81ТаллийTlI, II, III82СвинецPbII, IV83ВисмутBiIII, V84ПолонийPoII, IV, VI85АстатAtнет данных86РадонRnотсутствует87ФранцийFrIFrOH88РадийRaIIRa(OH)289АктинийAcIIIAc2O390ТорийThII, III, IV91ПротактинийPaII, III, IV, V92УранUIII, IV, V, VI93НептунийNpIII, IV, V, VI, VII94ПлутонийPuIII, IV, V, VI, VII95АмерицийAmII, III, IV, V, VI96КюрийCmII, III, IV97БерклийBkIII, IV98КалифорнийCfII, III, IV99ЭйнштейнийEsII, III100ФермийFmII, IIIПервоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная. Коэффициент востребованности 5 668
Физические и химические свойства
Фосфор способен образовывать разнообразные простые вещества, то есть аллотропные модификации. В нормальных условиях вещество характеризуется твердым агрегатным состоянием. Основные аллотропные модификации фосфора: Они отличаются по таким показателям, как: строение кристаллической решетки;цвет;плотность;физические характеристики;химическая активность.В процессе трансформации вещества в более термодинамически устойчивую модификацию показатели химической активности снижаются. В качестве примера можно привести последовательное превращение белого фосфора в красный, затем красного в черный. СвойстваБелый фосфор представляет собой вещество состава Р4. Мягкое вещество белого цвета является ядовитым и обладает характерным чесночным запахом. Вещество характеризуется молекулярной кристаллической решеткой, что объясняет невысокую температуру плавления в 44°С и высокую летучесть. Белый фосфор плавится в резервуаре с подогретой водой, реакционно способен и может самовоспламеняться на воздухе.При покрытии бумаги раствором белого фосфора в сероуглероде после испарения сероуглерода можно наблюдать, как вещество воспламеняет бумагу. На основе данной реакции поставлено множество различных фокусов с самовозгоранием или получением огня из ничего.
Физические свойства
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства. Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.Так выглядят разные виды фосфора.Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Фосфорные кислоты
Существует несколько кислородсодержащих фосфорных кислот:
Ортофосфорная кислота — H3PO4 (трехосновная кислота, соли — фосфаты PO43-)Метафосфорная кислота — HPO3 (одноосновная кислота, соли — метафосфаты PO3-)Фосфористая — H3PO3 (двухосновная кислота, соли — фосфиты HPO32-)Фосфорноватистая — H3PO2 (одноосновная кислота, соли гипофосфиты — H2PO2- )
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
CuSO4 H3PO2 H2O → Cu H2SO4 H3PO4
Электронная схема фосфора
P: 1s2 2s2 2p6 3s2 3p3Короткая запись:P: [Ne]3s2 3p3Одинаковую электронную конфигурацию имеют атом фосфора и -1Si, 1S, 2Cl Порядок заполнения оболочек атома фосфора (P) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p. На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14 Фосфор имеет 15 электронов, заполним электронные оболочки в описанном выше порядке: 2 электрона на 1s-подуровне 2 электрона на 2s-подуровне 6 электронов на 2p-подуровне 2 электрона на 3s-подуровне 3 электрона на 3p-подуровне

