Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Оксид меди (определение валентности) — мегаобучалка
Вычислить валентность меди (Cu) в составе оксида меди, в котором на 1 грамм кислорода приходится 3,97 грамм меди.
Решение задачи
Учитывая, что молярная масса эквивалентов кислорода (O) в составе оксида меди равна 8 г/моль, определим молярную массу эквивалентов меди (Cu) в составе оксида меди по закону эквивалентов:
Откуда выразим молярную массу эквивалентов меди (Cu) в составе оксида меди:
Получаем:
M экв (Cu) = 3,97 ∙ 8 / 1= 31,76 (г/моль).
Валентность меди (Cu) в оксиде меди находим из соотношения:
Mэкв(Cu)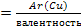
Отсюда:
валентность 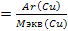
Получаем:
валентность = 63,55 / 31,76 = 2
Следовательно, металл – двухвалентная медь, оксид– оксид меди (II).
Ответ:
валентность меди равна 2.
2. Определить эквивалентную массу
Вычислить фактор эквивалентности и определить эквивалентную массу ортофосфорной кислоты (H3PO4) в реакциях образования гидрофосфата, дигидрофосфата и ортофосфата.
Решение задачи
Мэкв = М •fэкв
Фактор эквивалентности и эквивалентная масса вещества определяются той реакцией в которой данное вещество принимает участие, так как у одного и того же вещества в различных реакциях различны фактор эквивалентности и эквивалентная масса.
Запишем уравнения реакций образования
А. гидрофосфата
H3PO4 2NaOH = Na2HPO4 2H2O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 2 атома водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/2:
f экв. (H3PO4) = 1/2
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 ) = 98• 1/2 = 49 (г/ моль)
Б. дигидрофосфата
H 3 PO 4 NaOH = NaH 2 PO 4 H 2 O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 1 атом водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1:
f экв. (H3PO4) = 1
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 )= 98 • 1 = 98 (г/моль)
В. ортофосфата
H 3 PO 4 3 NaOH = Na 3 PO 4 3 H 2 O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 3 атома водорода (H), следовательно фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/3:
f экв. (H3PO4) = 1/3
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 )= 98 • 1 /3= 32,667 (г/моль)
Ответ:
фактор эквивалентности ортофосфорной кислоты в реакции образования гидрофосфата равен 1/2, молярная масса эквивалента равна 49 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования дигидрофосфата равен 1, молярная масса эквивалента равна 98 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования ортофосфата равен 1/3, молярная масса эквивалента равна 32,667 г/моль.
3.Молярная масса эквивалента металла
При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
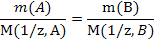
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
Получаем:
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
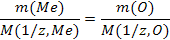
Из уравнения находим молярную массу эквивалента металла:
M (1/ z , Me ) 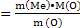
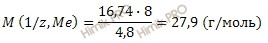
Рассчитаем молярную массу металла по формуле:
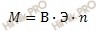
М – молярная масса,
В – валентность,
Э – эквивалентная масса
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
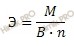
Получаем:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
4.Степень окисления в соединениях
Вычислите степень окисления свинца (Pb) в оксиде, в котором на 1 грамм свинца (Pb) приходится 0,1544 грамма кислорода (O).
Решение задачи
Учитывая, что молярная масса эквивалентов кислорода (O) равна 8 г/моль, определим молярную массу эквивалентов свинца (Pb) в оксиде по закону эквивалентов:
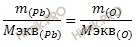
Откуда выразим молярную массу эквивалентов свинца (Pb) в оксиде:

Получаем:
M экв (Pb) = 1 ∙ 8/0,1544 = 51,8135 (г/моль).
Степень окисления в соединениях свинца (Pb) находим из соотношения:
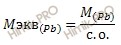
Отсюда:
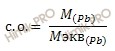
Получаем степень окисления в соединении:
с. о. = 207,2/51,8135 = 4
Ответ:
степень окисления свинца (Pb) в соединении равна 4.
Вопросы для самоконтроля
1. Какова мольная масса следующих веществ: HNO3, Al(OH)3, Cr2O3, FeSO4, K2SO4,
Na3PO4, NaCl,
K2CO3? Определите число молей, содержащихся в 200 г каждого вещества.
2. Выразите в молях: а) 6,02•1024 молекул метана; б) 1,8•1028 атомов хлора; в) 3,01•1023 молекул диоксида углерода; г) 30,1•1025 молекул фосфина; д) 19,6 г серной кислоты.
3. Сколько молекул содержит водород объемом 2 см3 (н.у.)?
4. Вычислите молекулярную массу газа, если относительная плотность его по воздуху равна 1,45.
5. Вычислите молекулярные массы газов, если: а) плотность газа по кислороду равна 0,50; б) плотность газа по азоту равна 0,93.
Практическая работа № 2
§
Тема: Характеристика элементов с учётом местонахождения в Периодической системе. Составление электронных формул атомов элементов и графических схем, заполнения их электронами.
Цель работы:рассмотрение плана общей характеристики химического элемента; овладение умениями характеризовать химический элемент на основании его положения в Периодической системе Д.И. Менделеева; овладение навыками составления электронных формул и графических схем атомов элементов.
Пояснение к работе:
Повторите основные понятия и химические термины по учебному тексту. Рассмотрите примеры и правилами записи электронных формул атомов элементов и графических схем; план характеристики химического элемента и образец ответа. Далее приступайте к выполнению заданий.
Учебный текст:
Для полного описания состояния каждого электрона в атоме в квантово-волновой механике используются параметры п, l— квантовые числа.
Главное квантовое число (n) — это положительное целое число (1,2,3,4,… ∞), которое характеризует в основном энергию электрона, т.е. энергетический уровень.
Значение главного квантового числа также указывает на число энергетических подуровней, соответствующих данному уровню, — оно равно значению п.Таким образом, главное квантовое число определяет уровень электрона в атоме.
Орбитальное квантовое число (l) характеризует величину орбитального момента количества движения электрона, другими словами, уточняет энергетическое состояние электронов в пределах данного уровня, т. е. энергию подуровня.
Электроны, которые при движении образуют облако шаровой формы, принято называть s-электронами. Электронные облака называют также орбиталями.
Электроны, которые при движении образуют облака гантелеобразной формы, называют р-электронами.
Вращение электрона вокруг собственной оси называется спином{в пер. с англ.— веретено).
На одной орбитали может находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами, т. е. один электрон как бы вращается вокруг оси по часовой стрелке, а другой — против часовой стрелки.
Пользуясь этими понятиями, расположение электронов в атомах изображают при помощи электронных формул, например Н — Is’, Не — Is2, где цифраперед буквой показывает номер энергетического уровня, буква — форму электронного облака, а цифра справа над буквой— число электронов с данной формой облака. Клетка — орбиталь, стрелка — электрон, разнонаправленные стрелки — электроны с противоположными (анти-параллельными) спинами.
Энергетические уровни принято делить на подуровни. Группа делится на две подгруппы: главную и побочную.
К главным подгруппам относят те элементы, у которых очередные электроны (идущие по порядку) помещаются на s- и р-орбиталях. Это s- и р-электроны. В связи с этим и сами элементы главных подгрупп часто называют s и р-элементами.
К побочным подгруппам относят элементы, очередные электроны которых помещаются на d-орбиталях.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, делят на четыре электронных семейства или блока.
1) s-элементы; заполняется электронами s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп; число возможных электронов —2; графическое изображение – одна клетка.
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III—VIII групп; число возможных электронов-6; графическое изображение – три клетки.
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, их называют переходными элементами; число возможных электронов-10; графическое изображение – пять клеток.
4) f-элементы; заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды; число возможных электронов-14; графическое изображение – семь клеток.
Номер периода соответствует номеру внешнего уровня.
Число валентных электронов равно номеру группы.
Строение электронных оболочек атомов можно изображать с помощью энергетических или квантовых ячеек — записывают графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электронобозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение. Сначала первым заполняется s-подуровень, вторым- p- подуровень, третьим – d-подуровень и четвёртым – f- подуровень (см. в таблице 1 и 2).
Таблица 1 Строение электронных оболочек атомов элементов второго периода
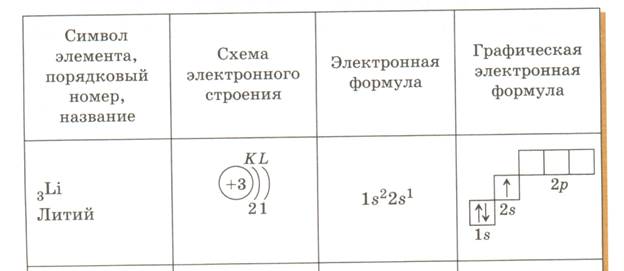
Таблица 2 Строение электронных оболочек атомов элементов третьего периода
План характеристики химических элементов.
1)Положение в периодической системе: порядковый номер, период, ряд, группа, подгруппа, относительная атомная масса.
2) Строение атома: заряд ядра; количество протонов, нейтронов, электронов; количество энергетических уровней и размещение на них электронов; формула электронной конфигурации — размещение электронов по подуровням; графическая формула расположения электронов; число электронов на последнем слое (металл или неметалл); высшая положительная степень окисления.
3) Формулы соединений: оксида, гидроксида (кислоты или основания), летучего водородного соединения (для неметаллов).
4) Химический характер элемента, его доказательство: кислотный (имеет кислотный оксид, который реагирует со щелочью с образованием соли и воды; кислотному оксиду соответствует кислота, взаимодействующая с основанием также с образованием соли и воды), основный (имеет основной оксид, которому соответствует основание; они реагируют с кислотой с образованием соли и воды), амфотерный (имеет оксид с соответствующим ему гидроксидом, которые реагируют и со щелочами, и с кислотами),
5) Сравнение с соседями: по периоду и по подгруппе (нужно помнить, что металл с неметаллами сравнивать нельзя).
Приведем пример характеристики химических элементов главных подгрупп на основании положения в периодической системе и строения атома.
Учитывая положение в периодической системе, дадим общую характеристику и укажем основные свойства фосфора.
Фосфор имеет порядковый номер 15, находится в третьем периоде, третьем ряду, главной подгруппе V группы периодической системы, относительная атомная масса 31. Ядро атома имеет заряд 15, состоит из 15 протонов и 31 — 15 = 16 нейтронов, вокруг ядра вращается 15 электронов, расположенных на трех энергетических уровнях, на внешнем уровне находится 5 электронов. Формула электронной конфигурации:
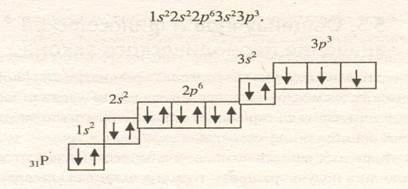
Наличие 5 электронов в наружном слое атома указывает, что это неметалл. Высшая положительная степень окисления элемента должна равняться 5. Формула высшего оксида Р2О5, кислоты — НРО3 (прибавляем Н2О к формуле оксида Р2О5, получаем Н2Р2О6, сокращаем индексы на 2), летучего соединения с водородом РН3.
Приведем доказательства кислотного характера оксида (Р2О5 или Р4О|0) и соответствующего ему гидроксида Р(НРО3):
Р4О10 12NaOH (разб.) = 4Na3PO4 6Н2О.
НРО3 NaOH (конц.) = NaPO3 Н2О.
Сравним Р с соседями по периоду (слева — кремний Si, справа — сера S) и подгруппе (сверху — азот N, снизу — мышьяк As).
Свойства любого элемента являются средними из свойств окружающих его соседей. Кремний, сера, азот и мышьяк — неметаллы. В периоде слева направо усиливаются неметаллические свойства и ослабевают металлические. Поэтому фосфор обладает более сильными неметаллическими свойствами, чем кремний, но более слабыми, чем сера. В главных подгруппах неметаллические свойства возрастают снизу вверх: азот — более сильный неметалл, чем фосфор; мышьяк— более слабый неметалл, чем фосфор.
Выполните задания по вариантам.
вариант -1
- Дайте характеристику химическому элементу Mg (магний) согласно плану.
- Напишите электронные формулы и графические электронные формулы для элементов: Cu, Zn, Mn
- Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 18ē 2ē.
вариант-2
- Дайте характеристику химическому элементу P (фосфор) согласно плану.
- Напишите электронные формулы и графические электронные формулы для элементов: Cr, O, Cl
- Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 18ē 5ē.
вариант-3
1. Дайте характеристику химическому элементу Сa (кальций) согласно плану.
2. Напишите электронные формулы и графические электронные формулы для элементов; К, F, S
3. Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 13ē 2ē.
§
Электролитическая диссоциация веществ
в водной среде

Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
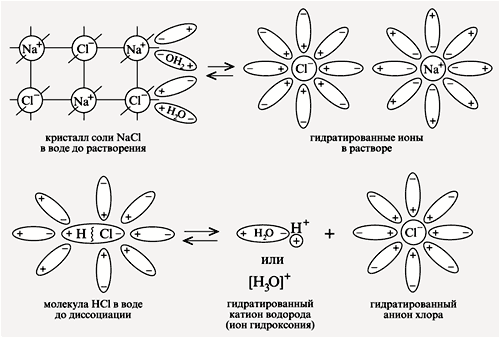
Основные положения теории электролитической диссоциации сформулированы в 1887 г. шведским ученым С.А.Аррениусом. Теория Аррениуса не учитывала роли молекул полярного растворителя в процессах диссоциации.
В гидратной теории, разработанной Д.И.Менделеевым и получившей дальнейшее развитие в трудах русских ученых И.А.Каблукова и В.А.Кистяковского, рассмотрен физико-химический процесс диссоциации электролитов в среде полярного растворителя.
Основные положения теории
электролитической диссоциации
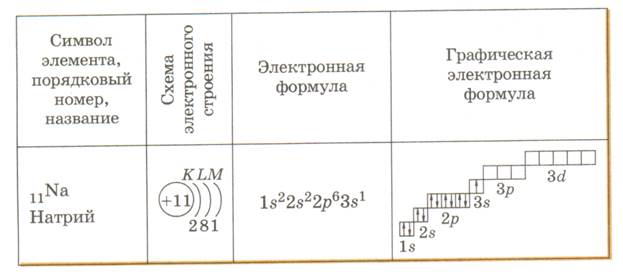
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия
11Na 1s22s22p63s1
при обычных условиях легко отдает наружный (3s1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия
11Na 1s22s22p6
не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
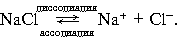
Электролиз.
Электролиз –окислительно-восстановительный процесс, происходящий на электродах под действием электрического тока. При пропускании электрического тока через растворы или расплавы электролитов, положительно заряженные ионы (катионы) перемещаются в направлении катода, отрицательно заряженные (анионы) – анода. На катоде происходит восстановление (приём электронов), на аноде – окисление (отдача электронов).
Электролиз расплавов солей
э.т.
2NaCl → 2Na Cl2
Схема процессов, происходящих на катоде и аноде:
| К | : Na 1ē = Na0 | восстановление |
| А- | : Cl— — 1ē = Cl0, Сl2↑ | окислитель |
Проблема: Какие продукты получаться при электролизе раствора хлорида натрия?
В отличие от расплава в растворе солей присутствуют и молекулы воды.
Рассмотрим процесс электролиза раствора хлорида натрия:
Какое явление происходит в растворе хлорида натрия под действием воды?
Диссоциация соли хлорида натрия на катионы натрия и анионы хлора.
NaCl → Na Cl-
Составим схему процессов, происходящих на катоде и аноде:
| К | Na , H2O | Na , H2O 1ē = Na0 | восстановление |
| А- | Cl- , H2O | Cl- — 1ē = Cl0, Сl2↑ | окислитель |
В данном случае, необходимо выбрать приоритетное вещество, то которое первым будет окисляться и восстанавливаться. Для этого существует правила, позволяющие выполнить эти действия.
Правило разрядки на катоде:
а) Если металл находится в электрохимическом ряду напряжения металлов до алюминия (включительно), то на катоде первой восстанавливается вода:
2H2O 2ē = H2↑ 2OH—, металл остается в виде иона.
б) Если металл находится в электрохимическом ряду напряжения металлов между алюминием и водородом, то на катоде восстанавливается металл и вода.
Ме n n ē = Me0,
2H2O 2ē = H2↑ 2OH—
в) Если металл находится в электрохимическом ряду напряжения металлов после водорода, то на катоде восстанавливается сам металл.
Ме n n ē = Me0
Рассмотрим наш пример: на катоде находится ион натрия (расположен в ряду активности до алюминия) и вода. Согласно правилу разрядки на катоде восстанавливается вода:
2H2O 2ē = H2↑ 2OH-
Ион натрия остается в растворе.
Правила разрядки на аноде:
Процесс на аноде зависит от материалов анода и от природы аниона. Если анод растворяется (железо, цинк, медь, серебро и т.д.), то окисляется металл анода, несмотря на природу аниона.
Если анод не растворяется (инертный), то:
а) Первыми на аноде окисляются бескислородные остатки кислот (I- , Br- , Cl- и т.д.)
Cl- — 1ē = Cl0, Сl2↑;
б) Затем вода (2H2O — 4ē = О2↑ 4H );
в) Следующие по очереди кислородсодержащие кислотные остатки и фторид-ион.
Рассмотрим наш пример: на аноде находятся ионы хлора и вода. Согласно правилу разрядки на аноде первой будет окисляться вода: 2H2O — 4ē = О2↑ 4H .
Анион хлора останется в растворе.
Подведем итог: в результате электролиза раствора хлорида натрия на катоде образуется газообразный водород, на аноде – газообразный кислород, в растворе находятся ионы: катионы натрия и анионы хлора.
Суммарное уравнение реакции: (схема демонстрируется на интерактивной доске):
э.т.
2NaCl 2H2O → Н2↑ Cl2 ↑ 2NaOH
§
1. Электролиз используется для получения многих активных металлов и неметаллов, щелочей и некоторых солей.
2. Электролизом пользуются в гальванопластике для покрытия изделий другим металлом: никелем, цинком, оловом, хромом, золотом и др.
3. С помощью электролиза получают сложные неорганические и органические соединения.
4. Электролиз используют для очистки некоторых металлов от примесей (рафинирование металлов).
Ход выполнения практической работы:
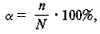
где 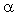 – степень диссоциации;
– степень диссоциации;
n – число диссоциированных молекул;
N – общее число молекул вещества в растворе.
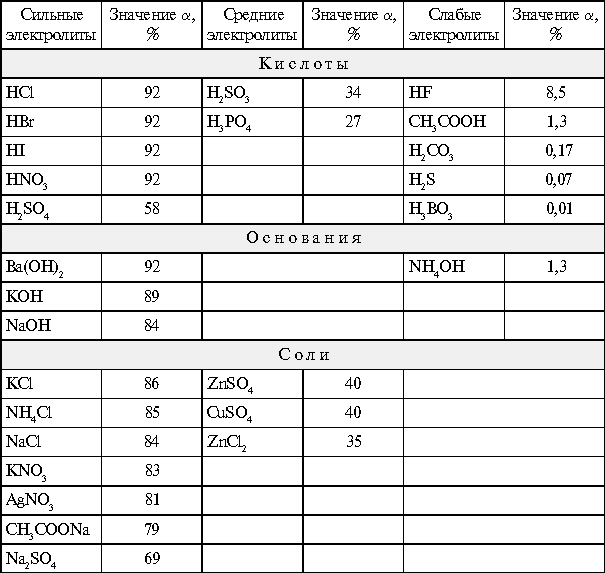
Для 0,1н. растворов электролитов при 18 °С значения степени диссоциации 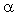 приведены в табл. 1.
приведены в табл. 1.
Степени диссоциации 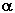 0,1н. растворов электролитов при 18 °С
0,1н. растворов электролитов при 18 °С
Таблица 1
Для диссоциации электролита AB:
AB  A B–.
A B–.
константа диссоциации Kдис более точно характеризует силу электролита, чем степеньдиссоциации  .
.
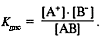
Если диссоциация электролита ступенчатая, то для каждой ступени выводится своя Kдис (табл. 2).
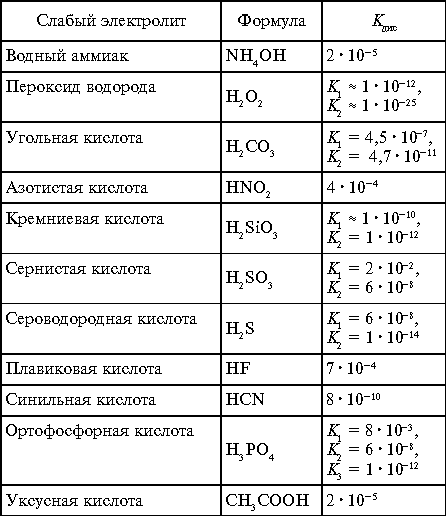
Константы диссоциации слабых электролитов
в водных растворах при 25 °С
Таблица 2
Задание 1. Рассмотреть представленные на демонстрационном столе водные растворы веществ. Заполнить таблицу.

Задание 2. Привести примеры окрашенных растворов веществ и указать, какими гидратированными ионами обусловливается их окраска.
БЕСЦВЕТНАЯ NaNO3 (Na – б/цв., 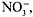 – б/цв.),
– б/цв.),
………………………………………………………………………………………
СИНЯЯ
………………………………………………………………………………………
РОЗОВАЯ
………………………………………………………………………………………
ЗЕЛЕНАЯ
………………………………………………………………………………………
ЖЕЛТАЯ
………………………………………………………………………………………
САЛАТОВАЯ
………………………………………………………………………………………
ФИОЛЕТОВАЯ
………………………………………………………………………………………
ОРАНЖЕВАЯ
………………………………………………………………………………………
ЖЕЛТО-БУРАЯ
………………………………………………………………………………………
Задание 3. Рассмотреть безводную хлорную медь(II). Растворить небольшое ее количество в 1–2 мл воды, затем постепенно (no каплям) разбавить раствор. Выпарить раствор, следить за изменениями окраски.
Задание 4. В первые три пронумерованные пробирки влить по 2 мл соляной кислоты (  = 1,19 г/см3), в три другие – по 2 мл уксусной кислоты (
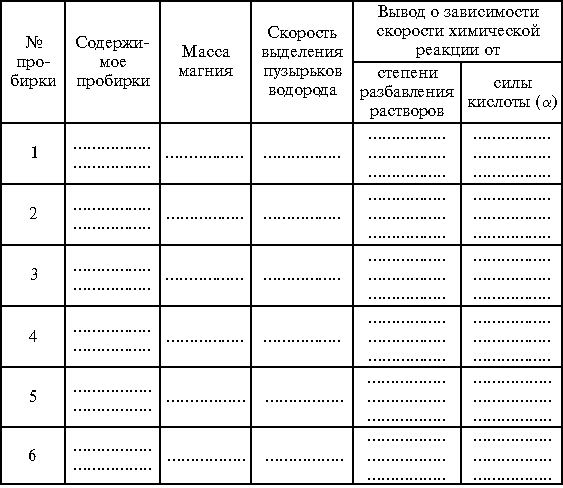
= 1,19 г/см3), в три другие – по 2 мл уксусной кислоты ( 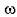 = 80%). В пробирки № 2 и 5 с соляной и уксусной кислотами соответственно прилить по 1 мл воды, в пробирки № 3 и 6 – по 2 мл воды. Затем во все пробирки присыпать по 1 г заранее приготовленных навесок магниевого порошка. Внимательно следить за признаками реакции и скоростью выделения водорода в каждой из пробирок.
= 80%). В пробирки № 2 и 5 с соляной и уксусной кислотами соответственно прилить по 1 мл воды, в пробирки № 3 и 6 – по 2 мл воды. Затем во все пробирки присыпать по 1 г заранее приготовленных навесок магниевого порошка. Внимательно следить за признаками реакции и скоростью выделения водорода в каждой из пробирок.
Задания по теме «Электролиз»
Задание № 1: Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его раствора (для этого нужно во вторую колонку к вопросу передвинуть цифру, соответствующую правильному ответу:
| Формула вещества | Продукт электролиза |
| А) CuSO4 | 1) водород |
| Б) K2SO4 | 2) серебро |
| В) AgNO3 | 3) медь |
| Г) CuBr2 | 4) гидроксид калия |
| 5) кислород | |
| 6) оксид серы (IV) |
Сначала необходимо убрать заведомо неправильные ответы. Согласно правилам разрядки на катоде не могут выделяться кислород и оксид серы (IV). Затем, используя правила разрядки на катоде, выбираем правильные ответы.
Четыре человека последовательно рассматривают каждый случай, пишут схемы и выбирают правильный ответ:
А) CuSO4 – на катоде восстанавливается медь, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – медь. Ответ – 3.
Б) K2SO4 – на катоде восстанавливается вода до водорода, т.к. калий – металл, который находится в электрохимическом ряду напряжения металлов до алюминия (включительно), поэтому на катоде первой восстанавливается вода. Ответ – 1.
В) AgNO3 — на катоде восстанавливается серебро, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – серебро. Ответ – 2
Г) CuBr2, на катоде восстанавливается медь, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – медь. Ответ – 3.
Запись на доске:
Задание № 2. Установите соответствие между формулой вещества и продуктом, который образуется на аноде в результате электролиза его раствора:
| Формула вещества | Продукт электролиза |
| А) CuSO4 | 1) фтор |
| Б) KCl | 2) бром |
| В) AgF | 3) хлор |
| Г) CuBr2 | 4) хлороводород |
| 5) кислород | |
| 6) оксид серы (IV) |
А) CuSO4 – на аноде, согласно правилу, первой будет окисляться вода до кислорода.
Ответ – 5.
Б) KCl — на аноде первым будет окисляться хлорид-ион до хлора. Ответ — 3
В) AgF – на аноде первой будет окисляться вода до кислорода. Ответ – 5.
Г) CuBr2 – на аноде первым будет окисляться бромид-ион до брома. Ответ – 2.
На доске появляются правильные ответы:
Вопросы для самоконтроля
1. Написать схемы электролиза растворов хлорида хрома (III), нитрата меди (II), фосфата калия, хлорида натрия и расплава иодида цинка.
2. Написать схемы электролиза растворов хлорида кальция, нитрата железа (III), сульфата калия, хлорида железа (II) и расплава хлорида железа (II).
3. Какая среда будет в водных растворах следующих солей: FеСlз, Li2СО3, MgS, NaCl. Напишите уравнения гидролиза в молекулярном и ионном виде.
4. При упаривании раствора хлорида натрия массой 500г с долей NaCl 1% получен новый раствор массой150 грамм. Какова массовая доля (в%) полученного раствора?
5. Как называется электрод, имеющий положительный заряд? (анод)
6. Как называется электрод, имеющий отрицательный заряд? (катод)
7. Чем отличается расплав соли от раствора? (в расплаве происходит диссоциация соли под действием высокой температуры, а в растворе диссоциация солей под действием воды).
8. Что произойдет с ионами соли при помещении в ее расплав электродов, подсоединенных к источнику тока?
9. Как записать этот процесс с помощью химических реакций?
§
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моль железа (Fe), молекул в 1 моль воды H2O и т. д.
Важнейшей характеристикой раствора является содержание в нем растворенного вещества, которое называется концентрацией раствора. Концентрацию раствора выражают многими способами, но чаще всего применяются два способа.
1. Массовая доля растворенного вещества (w). Это отношение массы растворённого вещества к массе раствора. Например, 20%-й раствор гидроксида натрия – это такой раствор, в 100 кг (или г) которого содержится 20 кг (или 20 г) NaOH и 80 кг (или 80 г) воды.
Если растворенное вещество является жидким, то состав такого раствора может быть выражен не только в массовых, но и в объемных долях или объемных процентах. Объемная доля растворенного вещества (φ) – это отношение объема этого вещества к объему всего раствора. Например, если в 0,5 л раствора содержится 200 мл этанола, то его объемная доля равна 0,4, или 40 %.
2. Молярная концентрация (СМ) – это количество растворенного вещества в одном литре раствора. Например, в одном литре двумолярной (2 М) серной кислоты содержится 2 моль, то есть 196 г H2SO4, а в таком же объёме децимолярной (0,1 М) кислоты – 9,8 г H2SO4.
Плотность раствора отличается от плотности растворителя. Растворы неорганических соединений, молярная масса которых больше молярной массы воды (18 г/моль), имеют плотность больше плотности воды, причем с увеличением концентрации растворов их плотность увеличивается.
Взаимосвязь плотности и концентрации раствора выражается в виде таблиц; такая таблица имеется в справочнике, которым пользуются студенты (таблица ).
C концентрацией растворов связано много различных расчётов, которые проводятся не только в химии и химической технологии, но и в других областях техники, в которых применяются растворы.
Ход выполнения практической работы:
1. 2 г сплава меди с алюминием обработали раствором щелочи. Остаток растворили в разбавленной азотной кислоте, образовавшуюся при этом смесь выделили и прокалили. Масса остатка после прокаливания составила 0,8 г. Определите объем израсходованного 40%-го раствора гидроксида натрия (плотность 1,22 г/мл) и содержание металлов в сплаве.
Дано:
m (Cu Al) = 1,2 г
m (остатка) = 0,8 г
ω (NaOH) = 40%
r (p-pa NaOH) = 1,22 г/мл
М (NaOH) = 40 г/моль
М (Cu) = 64 г/моль
М (Al) = 27 г/моль
М (CuO) = 80 г/моль
Найти :
V (p-pa NaOH)
ω (Cu)
ω (Al)
Решение:
Для решения задачи необходимо знать химические свойства меди и алюминия. Медь обладает металлическими свойствами и не реагирует со щелочами. С раствором гидроксида натрия будет реагировать только алюминий, который проявляет амфотерные свойства:
2Al 2NaOH 6H2O = 2Na[Al(OH)4] H2(1)
Остатком является медь, которую растворили в разбавленной азотной кислоте:
3Cu 8HNO3 = 3Cu(NO3)2 2NO 4H2O (2)
После выделения и прокаливания смеси образуется оксид меди (II):
2Cu(NO3)2 = 2CuO 4NO2 O2(3)
Определим массу меди в исходной смеси. Для этого найдем количество вещества оксида меди (II), по условию задачи его масса равна 0,8 г:
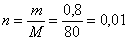 (моль).
(моль).
По уравнению (3) 2 моль оксида меди (II) образуется из 2 моль нитрата меди (II), (соотношение n(CuO) : n(Cu(NO3)2) = 1 : 1), следовательно, 0,01 моль оксида меди (II) образуется из 0,01 моль нитрата меди (II). По уравнению (2) из 3 моль меди дает 3 моль нитрата меди (II) (соотношение n(Cu) : n(Cu(NO3)2) = 1 : 1), тогда для образования 0,01 моль нитрата меди (II) необходимо 0,01 моль меди. Количество вещества меди равно 0,01 моль. Рассчитаем массу меди в исходной смеси:
m = n · M = 0,01 · 64 = 0,64 г.
По условию задача масса смеси равна 2 г, определим массу алюминия:
m(Al) = m(смеси) – m(Cu) = 2 – 0,64 = 1,36 (г).
Рассчитаем массовые доли металлов в смеси:
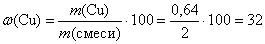 (%);
(%);
 (%).
(%).
Для определения объема израсходованного раствора гидроксида натрия, необходимо определить количество вещества NaOH вступившего во взаимодействие с алюминием. По уравнению реакции (1) 2 моль Al реагирует с 2 моль NaOH (соотношение n(Al) : n(NaOH) = 1 : 1). Количество вещества алюминий равно:
 моль,
моль,
следовательно, количество вещества n (NaOH) = 0,05 моль.
Определим массу гидроксида натрия:
m (в-ва) = n · M = 0,05 · 40 = 2 (г).
Вычислим массу раствора гидроксида натрия, зная массовую долю NaOH в растворе:
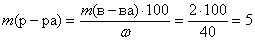 (г).
(г).
Определим объем раствора 40%-го раствора гидроксида натрия необходимый для взаимодействия:
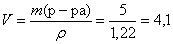 (мл).
(мл).
Ответ: V (p-pa NaOH) = 4,1 мл; ω (Cu) = 32%, ω (Al) = 68%.
2. При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве.
Дано:
m (Cu Ag) = 3 г
М (Cu) = 64 г/моль
М (Ag) = 108 г/моль
М (Cu(NO3)2) = 188 г/моль
М (AgNO3) = 170 г/моль
Найти:
ω (Cu)
ω (Ag)
Решение:
На примере решения данной задачи рассмотрим два способа решения задач на определение состава смеси.
Первый способ (алгебраический):
Запишем уравнения реакций растворения меди и серебра в концентрированной азотной кислоте:
Cu 4HNO3 = Cu(NO3)2 2NO2 2H2O (1)
Ag 2HNO3 = AgNO3 NO2 H2O (2)
Обозначим массу меди в сплаве – х г, а массу нитрата меди (II) – у г, тогда масса серебра в сплаве – (3 – х) г, а масса нитрата серебра – (7,34 – у) г.
По уравнению (1) количество вещества меди вступившего в реакцию равно количеству вещества нитрата меди (II) образовавшемуся в результате взаимодействия:
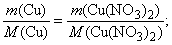
или 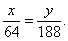
По уравнению (2) количество вещества серебра вступившего в реакцию равно количеству вещества нитрата серебра образовавшемуся в результате взаимодействия:
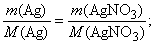
или 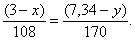
Получили систему уравнений с двумя неизвестными:
Решив систему уравнений методом подстановки, найдем значение х равное 1,92 г, то есть масса меди в сплаве равна 1,92 г. Тогда масса серебра составляет:
m (Ag) = m (сплава) – m (Cu) = 3 – 1,92 = 1,08 (г)
Рассчитаем массовые доли металлов в смеси:
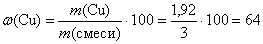 (%);
(%);
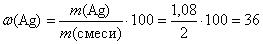 (%).
(%).
Ответ: ω(Cu) = 64%, ω(Al) = 36%.
Второй способ (мольный):
Запишем уравнения реакций растворения меди и серебра в концентрированной азотной кислоте:
Cu 4HNO3 = Cu(NO3)2 2NO2 2H2O (1)
Ag 2HNO3 = AgNO3 NO2 H2O (2)
Обозначим количество меди в сплаве – х моль, а количество серебра – у моль. Тогда масса меди будет равна 64х (m =n·M), а масса серебра 108у. По условию задачи масса сплава равна 3 г, следовательно:
64х 108у = 3
По уравнению (1) количество вещества меди вступившего в реакцию равно количеству вещества нитрата меди (II) образовавшемуся в результате взаимодействия, тогда масса нитрата меди (II) равна 188х. По уравнению (2) количество вещества серебра вступившего в реакцию равно количеству вещества нитрата серебра образовавшемуся в результате взаимодействия, следовательно масса нитрата серебра равна 170у. По условию задачи масса смеси нитратов равна 7,34 г, поэтому:
188х 170у = 7,34.
Получили систему уравнений с двумя неизвестными:
Решив систему уравнений методом подстановки, найдем значение у,равное 0,01 моль, масса серебра составляет:
m (Ag) = n (Ag) · M (Ag) = 0,01 · 108 = 1,08 (г).
Тогда масса меди равна:
m (Cu) = m (сплава) – m (Ag) = 3 – 1,08 = 1,92 (г).
Рассчитаем массовые доли металлов в смеси:
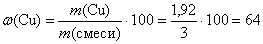 (%);
(%);
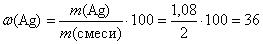 (%).
(%).
Ответ: ω(Cu) = 64%, ω(Al) = 36%.
Вопросы для самоконтроля
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K, Al, Cr, Sn
2) Sn, Cr, Al, Zn
3) Sn, Ca, Al, K
4) Au, Al, Ca, Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al, Zn, Fe
2) Al, Na, K
3) Fе, Zn, Mg
4) Fe, Zn, Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
§
Тема: Качественный анализ органических соединений
Цель: Определить углерод и водород, и наличие хлора.
На выполнение практической работы отводится 2 часа
Теоретический материал
По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе. Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы.
Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями.
Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов.
Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические.
К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е.
Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами.
Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С — связи (339 КДж) — весьма устойчивы.
Области применения
Лекарственные вещества.
Высокомолекулярные органические соединения: синтетические смолы и органическое стекло; пластические массы (пластмассы) и синтетические волокна; синтетический каучук.
Красящие вещества (красители).
Гербициды (вещества, уничтожающие сорняки).
Инсектициды и фунгициды (вещества, уничтожающие, соответственно насекомых и грибы).
Дефолианты (вещества, ускоряющие опадение листьев; применение их укоряет созревание хлопчатника и облегчает машинную уборку).
Десиканты (соединения, способствующие высушиванию растений на корню).
Витамины (сложные физиологически активные органические вещества, отсутствие которых в пище человека или животных ведет к нарушению нормальных функций организма).
Ферменты (сложные органические соединения, являющиеся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т.п.)
Консерванты (органические вещества, предохраняющие от закисания и порчи вина, соки, варенья, маринады и другие пищевые продукты).
Органическая химия достигла огромных успехов в изучении состава и переработке каменного угля, нефти и природного газа; таким образом, она тесно связана с угольной, нефтяной и газовой отраслями промышленности, обеспечивающими с одной стороны, получение различных видов топлива, с другой – сырьем различные производства. Так, каменный уголь используют не только как топливо, путем переработки из него добывают необходимый для металлургии кокс, а так же светильный газ и каменноугольный деготь. Последний, свою очередь служит источником для получения многочисленных органических соединений, необходимых для синтеза ВМС, красителей, лекарственных и взрывчатых веществ и т.п. Из нефти путем её перегонки получают различные виды горючего, смазочные материалы и другие ценные продукты. Природный газ, особенно попутный нефтяной газ, также представляет собой ценное химическое сырье и топливо, используемое как в промышленности, так и в быту.
Ход выполнения практической работы:
Опыт № 1
Соберите прибор, как показано на рисунке.
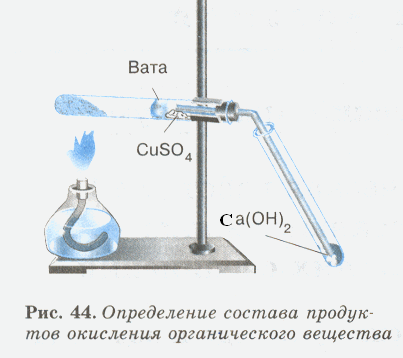
Смесь 1 – 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция). Нагрейте пробирку (2–3 мин). Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения. После изменения окраски сульфата меди (П) следует прекратить нагревание.
Сделайте выводы.
Опыт № 2

Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди(П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки. Сделайте вывод.
Опыт № 3
Докажите, что сахар содержит углерод.
Поместите в фарфоровую чашку несколько кристаллов сахара. Поставьте чашку на кольцо лабораторного штатива. Нагревайте сахар в чашке. Что наблюдаете?
Сделайте вывод.
Оформите работу:
| № опыта | Что наблюдали? УХР. | Выводы |
Вопросы для самоконтроля
1. Почему помутнел раствор известковой воды? Напишите уравнение реакции, считая условно формулу парафина С16Н34.
2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая что безводному сульфату меди (П) присоединяется 5 молекул воды.
3.Что произошло с чёрным порошком оксида меди (П)?
§
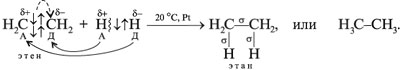
Общая формула алкенов: СnH2n.
Формулы этилена (этена)
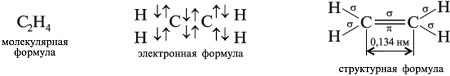
M(С2Н4) = 28 г/моль, VМ(С2Н4) = 22,4 л/моль, Dвозд(С2Н4) = 28/29 = 0,96.
Энергия связи атомов углерода:
Есв(С=С) = 587 кДж/моль,
Есв = 352 кДж/моль,
Есв = 235 кДж/моль.
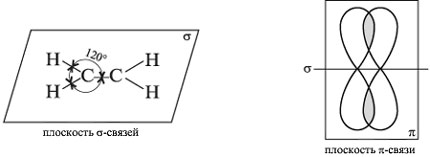
Перекрывание орбиталей атомов, связываемых -связями:
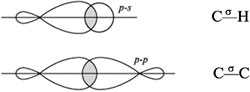
Прочность -связи меньше прочности -cвязи, т. к. «боковое» перекрывание орбиталей менее эффективно, чем «лобовое». А вот поляризуемость -связи выше, чем у -связи. В отличие от
-связи (С–С) -связь пространственно более доступна для электрофильной атаки.
Двойная связь в целом – место повышенной электронной плотности: в ней четыре электрона приходится на 0,134 нм, а у -связи – два электрона на 0,154 нм. Следовательно, -связь – самое реакционноспособное место в молекуле этилена.
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения (галогенов, кислот, воды в присутствии кислот, водорода на катализаторах Pt или Ni). В ходе реакции под действием радикальных , а чаще электрофильных реагентов типа H -связь разрывается:
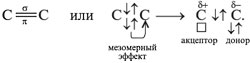
Ионы, в которых на атоме углерода имеется положительный заряд, – это карбокатионы.
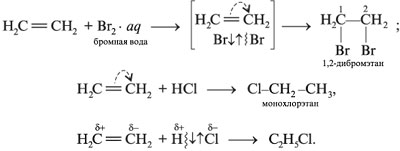
Гомологи этилена присоединяют галогеноводород согласно правилу Марковникова: водород галогеноводорода соединяется с наиболее гидрогенизованным атомом углерода алкена (т. е. содержащим больше атомов H).
При взаимодействии этилена с водой в присутствии концентрированной H2SO4 в зависимости от условий можно получить сложный эфир или спирт:
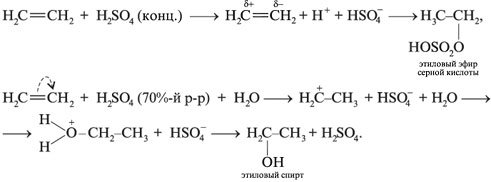
Cледовательно, H2SO4 является катализатором.
В промышленности гидратацией этилена получают этиловый спирт (этанол):
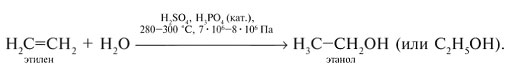
Особым случаем присоединения является полимеризация.
Если алкен реагирует с небольшим количеством концентрированной H2SO4, то карбокатион атакуется не (их мало), а другой молекулой алкена. В результате многократного присоединения образуется высокомолекулярное вещество – полимер (от греч. – многочисленный, – доля, часть):
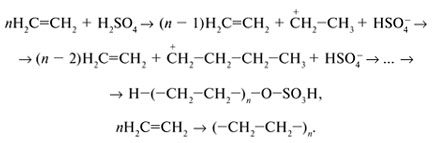
Реакцию соединения большого числа молекул (мономеров) в макромолекулы полимера называют полимеризацией.
Алкены легко окисляются по -связи. Обесцвечивание, а затем побурение раствора KMnО4 (подщелоченного содой) при пропускании через него алкена – качественная реакция на алкены:
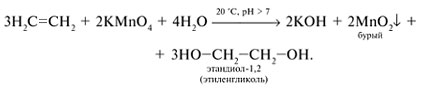
Этилен горит светящимся коптящим пламенем.
Физические свойства алкенов
По физическим свойствам алкены похожи на алканы (т. е. их молекулы тоже практически неполярны).
Получение алкенов
Алкены получают крекингом и дегидрированием алканов, отщеплением воды от спиртов, отщеплением галогеноводородов от алкилгалогенидов. Например:
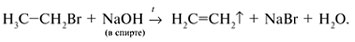
В промышленности алкены получают пиролизом ( 700 °С) алканов.
Применение алкенов
Присоединением к алкенам галогенов или галогеноводородов получают галогенопроизводные, используемые для синтеза более сложных веществ, а также в качестве растворителей
(СН2Cl–СH2Cl и др.).
Присоединением воды получают спирты R–OH.
Больше всего С2Н4 и С3Н6 идет на производство высокомолекулярных соединений – полимерных материалов.
Этилен – главное сырье современной химической отрасли промышленности – основного органического синтеза. Из этилена получают этиловый спирт, стирол, уксусный альдегид, винилхлорид, винилацетат, этиленоксид и другие соединения:
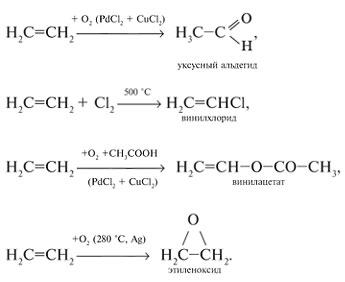
Этилен ускоряет созревание плодов, поэтому его добавляют в атмосферу теплиц.
Ход выполнения практической работы:
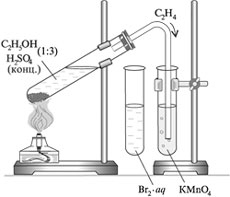
Получение этилена
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
Осторожно, равномерно нагрейте смесь.
Внимание!!!
§
Окисление этилена кислородом перманганата калия
Пропустите выделяющийся газ в пробирку с водным раствором перманганата калия, подкисленного серной кислотой.
Взаимодействие этилена с бромной водой
Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой.
Окисление этилена кислородом воздуха (горение)
Поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ.
5. Оформите работу в тетради в виде таблицы:
| Название опыта | Ваши наблюдения | Уравнение реакции, выводы |
| 1 | Какой газ выделяется? | Закончите уравнение реакции: CH3-CH2-OH t>140°C, H2SO4(конц.) → |
| 2 | Что происходит с раствором марганцовки? | Закончите уравнение реакции: CH2=CH2 [O] H2O KMnO4 → Назовите продукты и тип реакции? |
| 3 | Что происходит с бромной водой? | Закончите уравнение реакции: CH2=CH2 Br2 → Назовите продукты и тип реакции? |
| 4 | Почему этилен горит более светящимся пламенем, чем этан? | Закончите уравнение реакции: C2H4 O2 t → Назовите тип реакции и продукты? |
5. Вывод: (из цели)
Практическая работа № 8
Тема: Составление структурных формул спиртов, закрепление знаний номенклатуры.
Цель: закрепить полученные знания о классификации спиртов, их строении, их реакционной способности; развивать навыки составления названий веществ, структурных формул изомеров; закрепить умения решать расчетные задачи.
На выполнение практической работы отводится 2 часа.
Теоретический материал
Общая формула всех одноатомных спиртов СпН2п 1ОН или ROH. Рассмотрим строение молекулы спирта на примере С2Н5ОН – этилового спирта.
Один из атомов водорода отличается от других атомов.(Вопрос учащимся – Почему?)Он соединен с атомом углерода через кислород. Следовательно, можно предположить, что он будет вести себя по-другому. На чем основано это предположение? На этот вопрос вы ответите сами, так как знаете, что кислород обладает более высокой электроотрицательностью. Он будет оттягивать на себя электроны атома водорода. Связь О-Н получается полярной. Это обозначается направленной стрелочкой:
О Н. Именно эта группа -ОН в спиртах и будет определять их химические свойства, т.е. их химическую функцию. Такие группы называются функциональными.
Функциональной называется группа атомов, определяющая химические свойства вещества.
То, что остается в молекуле спирта после мысленного удаления функциональной группы, называют углеводородным радикалом.
Теперь мы можем вывести определение спиртов… (формулируют сами учащиеся, предлагают разные варианты определения спиртов)
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на функциональные (гидроксильные) группы.
Спирты – это органические соединения, в молекулах которых содержатся одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
Номенклатура спиртов
- Тривиальная номенклатура – названия спиртов происходят от названий радикалов:
СН3ОН – метиловый спирт.(С2Н5ОН,С3Н7ОН – называют самостоятельно.)
- Систематическая номенклатура – названия спиртов образуются из названий предельных углеводородов добавлением суффикса –ол:
СН3ОН – метанол.
Основные принципы номенклатуры спиртов:
- Выбирают самую длинную углеродную цепь и нумеруют с того конца цепи, к которому ближе находится гидроксо-группа.
- Называют заместители в основной углеродной цепи и цифрами указывают их положения.
- Называют основную цепь как алкан и добавляют суффикс –ол.
- Цифрой указывают положение ОН-группы.
Классификация спиртов
Спирты по-разному классифицируют.
1. В зависимости от валентности спиртовой группировки спирты бывают:
первичные – содержат одновалентную спиртовую группировку –СН2ОН (например, СН3-СН2ОН этанол);
вторичные – содержат двухвалентную спиртовую группировку =СНОН (например, СН3-СНОН-СН3 пропанол-2);
третичные – содержат трехвалентную спиртовую группировку =С-ОН (например, 2-метилбутанол:
2.По характеру углеводородного радикала спирты бывают:
предельные – углеводородный радикал содержит только одинарные связи (например, СН3ОН метанол, С4Н9ОН бутанол);
непредельные– содержат ненасыщенный углеводородный радикал (например, СН2=СН-СН2ОН аллиловый спирт);
ароматические – содержат ароматический углеводородный радикал (например, С6Н5-СН2ОН бензиловый спирт).
- По количеству гидроксильных групп различают спирты: одноатомные – содержат одну ОН-группу (например, СН3-СН2-ОН этанол); двухатомные – содержат две ОН-группы (например, НО-СН2-СН2-ОН этиленгликоль или этандиол-1,2); трехатомные – содержат три ОН-группы в молекуле (например, НО-СН2-СНОН-СН2-ОН глицерин или пропантриол-1,2,3).
- По количеству атомов углерода в молекуле спирта: низшие – содержат от 1 до 10 атомов углерода в молекуле; высшие – содержат более 11 атомов углерода.
Изомерия спиртов
Для спиртов характерны следующие виды изомерии:
- Изомерия углеродного скелета
Например,
| СН3-СН2-СН2-СН2-ОН | и СН3-СН(СН3)-СН2ОН |
| Бутанол-1 | 2-метилпропанол-1 |
- Изомерия положения функциональной группы
Например,
| СН3-СН2-СН2ОН | и СН3-СН(ОН)-СН3 |
| Пропанол-1 | пропанол-2 |
- Межклассовая изомерия: спирты изомерны простым эфирам.
Например,
| СН3-СН2ОН | и СН3-О-СН3 |
| Этанол | диметиловый эфир |
Ход выполнения практической работы:
1. Каждому названию типа спирта подберите соответствующую формулу соединения:
1.1. Одноатомный А
1.2. Непредельный Б
1.3. Вторичный В
1.4. Предельный Г
1.5. Двухатомный Д
1.6. Первичный> Е
1.7. Ароматический Ж
1.8. Третичный З
1.9. Трехатомный И
2. Приведите структурные формулы соединений состава С5Н12О. Дайте названия.
3. Изобразите схему образования водородной связи в спиртах. Как влияет способность спиртов к образованию водородной связи на их физические свойства?
4. Какие соединения образуются при внутримолекулярной и межмолекулярной дегидратации пропанола-2? Назовите. Запишите уравнения реакции.
5. Приведите уравнения реакций, с помощью которых можно осуществить превращения:
СН3ОH → CH3Br → C2H6 → C2H5Cl →C2H5OH
6. Вычислите объем водорода (н.у), который образуется при взаимодействии металлического натрия массой 3,45 г с избытком этанола.
7. При сгорании органического вещества массой 6,9 г образовалось 13,2 г углекислого газа и 8,1 г воды. Плотность паров этого вещества по воздуху 1,59. Определите молкулярную формулу вещества.
Вопросы для самоконтроля
1. Восстановите уравнения реакций:
4.1. 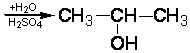
4.2. 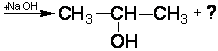
4.3. 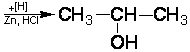
- Напишите уравнения реакции получения первичного, вторичного, третичного спиртов из алкенов соответствующего строения.
§
В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей.
Алгоритм составления названий альдегидов
- Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс -аль.
Физические свойства:формальдегид — газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид — бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон — бесцветная жидкость с резким запахом, растворим в воде.
В ряду алканы  альдегиды (кетоны)
альдегиды (кетоны) 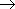 спирты растворимость в воде и температура кипения увеличивается.
спирты растворимость в воде и температура кипения увеличивается.
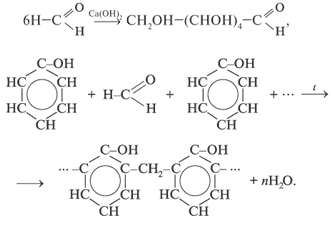
Химические свойства
Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь 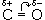 поляризована в сторону атома кислорода). Чем больше частичный заряд (
поляризована в сторону атома кислорода). Чем больше частичный заряд (  ) на атоме углерода этой группы, тем выше активность соединения.
) на атоме углерода этой группы, тем выше активность соединения.
- Горение:
2CH3CHO 5O2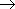 4CO2 4H2O
4CO2 4H2O
2CH3COCH3 9O2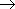 6CO2 6H2O
6CO2 6H2O
- Присоединение (по двойной связи карбонильной группы).
Гидрирование (восстановление водородом):
HCHO H2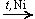 CH3OH
CH3OH
CH3—CO—CH3 H2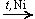 CH3—CH(OH)—CH3
CH3—CH(OH)—CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов — вторичные.
- Окисление:
CH3CHO Ag2O 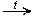 2Ag
2Ag 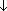 CH3COOH (реакция «серебряного зеркала» — качественная реакция)
CH3COOH (реакция «серебряного зеркала» — качественная реакция)
HCHO 2Cu(OH)2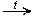 2H2O Cu2O
2H2O Cu2O 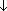 HCOOH (образуется красный осадок — качественная реакция)
HCOOH (образуется красный осадок — качественная реакция)
Кетоны слабыми окислителями не окисляются.
- Замещение атомов водорода в углеводородном радикале (замещение происходит в
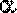 — положение, т. е. замещается атом водорода у 2-го атома углерода):
— положение, т. е. замещается атом водорода у 2-го атома углерода):
- Реакции полимеризации и поликонденсации:
Читайте также:

©2022-2020 lifeo2.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (211)
Почему 1285321 студент выбрали МегаОбучалку…
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы
(0.006 сек.)
§
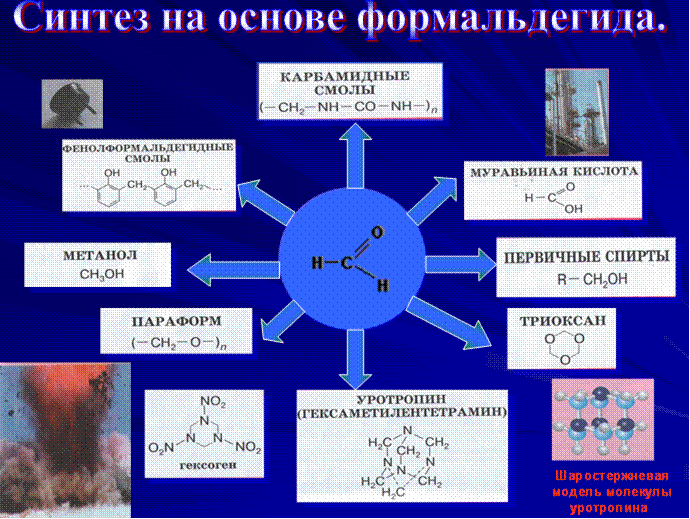
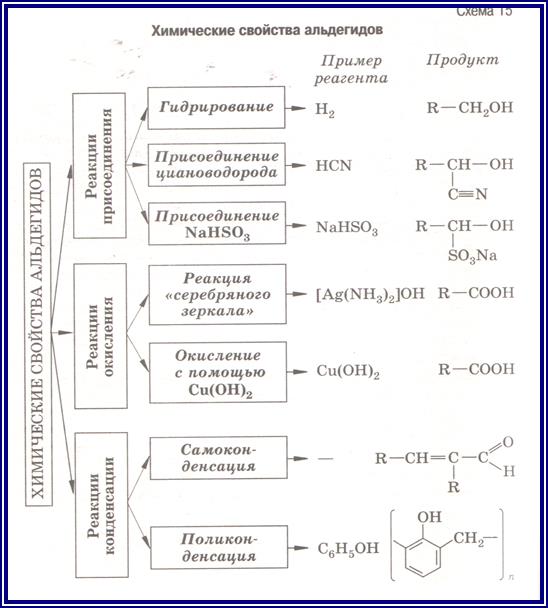
В таблице представлены основные направления органических синтезов на основе формальдегида: получение полимерных материалов (карбамидные и фенолформальдегидные смолы); образование продуктов конденсации формальдегида (триоксан, параформ); синтез взрывчатых веществ (гексоген), лекарственных препаратов (уротропин), первичных спиртов.
Мы упоминули очень интересное соединение — уротропин. Впервые оно было получено А. М. Бутлеровым в 50-х гг. XIX в. при действии на формальдегид аммиаком. Молекулярная формула вещества (СН2)6N4 определила его химическое название — гексаметилентетрамин. Структура вещества
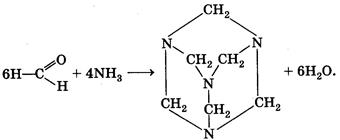
При нагревании в присутствии кислот уротропин вновь разлагается на аммиак и формальдегид. Это его свойство позволяет использовать уротропин в медицине в качестве антисептического средства. В организме человека он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы. На том же свойстве основано применение препарата кальцекс, представляющего собой комплекс уротропина с хлоридом кальция.
Большое количество формальдегида используется для производства фенолоформальдегидных смол. Их смешивают с различными наполнителями и изготавливают пластмассы, называемые фенопластами. При растворении фенолоформаль-дегидных смол в ацетоне или спирте получают лаки/
При взаимодействии формальдегида с карбамидом {мочевиной) (NН2)2СО получают карбамидную смолу, а из нее — амино-пласты. Из этой пластмассы изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звукоизоляционные пористые материалы.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
Ход выполнения практической работы:
Задание 1.
Назовите альдегид по международной номенклатуре:
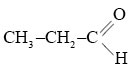
Назовите альдегид по международной номенклатуре:
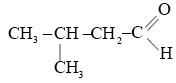
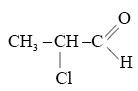
Назовите альдегид по международной номенклатуре:
Назовите альдегид по международной номенклатуре:
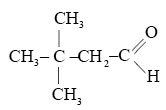
Задание 2. Составьте как можно больше возможных изомеров вещества, брутто-формула которого С4Н8О.
(О т в е т . Два альдегида (бутаналь и 2-метилпропаналь) и метилэтилкетон соответствуют брутто-формуле С4Н8О. Но, кроме этого, такую же брутто-формулу имеют четыре непредельных спирта, три непредельных простых эфира и тетрагидрофуран:
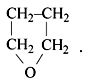
И это тоже можно назвать межклассовой изомерией.)
Задание 3. Решите задачу.Формальдегид, образующийся при окислении 2 моль метанола растворили в 100г воды. Какова массовая доля формальдегида в этом растворе?
Задание 4. Сравните альдегиды и кетоны по: а) физическим свойствам; б) составу; в) химическим свойствам; г) реакционной способности.
Задание 5. Кроссворд
Альдегиды, Кетоны
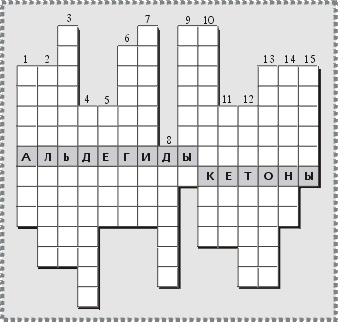
По вертикали: 1. Концентрированный (37–40%-й) водный раствор бесцветного газа СН2О, используемый для дезинфекции, сохранения анатомических препаратов, протравливания семян, бальзамирования. 2. Процесс присоединения молекул воды к молекулам, атомам и ионам, широко применяемый в промышленности процесс для получения кислот, спиртов, альдегидов, кетонов.
3. Простейший представитель кетонов, бесцветная жидкость с характерным запахом, применяемая как растворитель многих органических веществ. 4. Роль перманганата калия по отношению к первичным спиртам при лабораторном получении альдегидов. 5. Иное название муравьиного альдегида, ядовитого соединения, вызывающего свертывание белковых веществ. 6. Органические вещества, молекулы которых содержат карбонильную группу, обычно соединенную с атомами углерода и водорода. 7. Альдегид, полимеризующийся в параформ [–CH2–O–]n – твердый полимер (n = 8–100). 8. Формалин, широко применяемый в кожевенном производстве, оказывает ………. действие на белки кожи, делая их более твердыми, негниющими. 9. Альдегид, молекулярная формула которого СН3СН2СН2СНО, бесцветная прозрачная токсичная жидкость. 10. В быту формалин используется для ………. . 11. Русский химик-органик, открывший в 1881 г. реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений, в частности, превращения ацетилена в уксусный альдегид в присутствии ртутных солей. 12. Широко известное лекарственное вещество, антисептическое средство, получаемое взаимодействием формальдегида с аммиаком. 13. Альдегид, молекулярная формула которого СН3СН2СНО, бесцветная жидкость, применяется в синтезе природных соединений, душистых веществ. 14. Альдегид, формула которого СН3СНО, бесцветная жидкость, получают по реакции Кучерова или окислением этилового спирта. 15. Органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Вопросы для самоконтроля
1. Какие классы соединений с карбонильной группой известны?
2. Каковы общие формулы альдегидов, кетонов и карбоновых кислот?
3. Какие виды изомерии характерны для альдегидов и кетонов?
4. Каковы тривиальные названия первых семи гомологов альдегидов?
5. В чем различие физических свойств спиртов, альдегидов и кетонов? Каковы причины этих различий?
6. Каковы способы получения альдегидов и кетонов?
7. Каковы химические свойства предельных альдегидов?
§
 Впервые понятия об органических веществах и об органической химии ввёл шведский учёный Берцелиус. В своём учебнике химии Берцелиус (1827) высказывает убеждение, что «… в живой природе элементы повинуются иным законам, чем в безжизненной» и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой «жизненной силы». Органическую химию он и определил, как химию растительных и животных веществ. Последующее развитие органической химии доказало ошибочность этих взглядов.
Впервые понятия об органических веществах и об органической химии ввёл шведский учёный Берцелиус. В своём учебнике химии Берцелиус (1827) высказывает убеждение, что «… в живой природе элементы повинуются иным законам, чем в безжизненной» и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой «жизненной силы». Органическую химию он и определил, как химию растительных и животных веществ. Последующее развитие органической химии доказало ошибочность этих взглядов.
 В 1928 году Вёллер показал, что неорганическое вещество-циановокислый аммоний-при нагревании превращается в продукт жизнедеятельности животного организма-мочевину.
В 1928 году Вёллер показал, что неорганическое вещество-циановокислый аммоний-при нагревании превращается в продукт жизнедеятельности животного организма-мочевину.
 В 1845 г. Кольбе синтезировал органическое вещество-уксусную кислоту, в качествеисходных веществ он использовал древесный уголь, серу, хлор и воду. За сравнительно короткий период были синтезированы и другие органические кислоты, которые раньше выделялись только из растений.
В 1845 г. Кольбе синтезировал органическое вещество-уксусную кислоту, в качествеисходных веществ он использовал древесный уголь, серу, хлор и воду. За сравнительно короткий период были синтезированы и другие органические кислоты, которые раньше выделялись только из растений.
 В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу спиртов.
В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу спиртов.
 В 1861 г. А.М.Бутлеров действуя известковой водой на параформальдегид впервые осуществил синтез метиленитана, которое относится к сахарам, которые играют важную роль в процессах жизнедеятельности организмов.
В 1861 г. А.М.Бутлеров действуя известковой водой на параформальдегид впервые осуществил синтез метиленитана, которое относится к сахарам, которые играют важную роль в процессах жизнедеятельности организмов.
Развитиие органической химии требовали разрешения вопроса, являются ли молекулы беспорядочным нагромождением атомов, удерживаемых силами притяжения, или же они представляют собой частицы с определённым строением, которое можно установить, исследуя свойства вещества. В органической химии к тому моменту накопились факты и обобщения, которые могли служить основойсдля решения вопроса о строении молекул.
Решающую роль сыграло открытие валентности элементов. Её открытие непосредственно подводило к мысли, что молекулы имеют определённое строение. Оставался открытым вопрос: как определять строение молекулы. Этот вопрос не мог быть решён без подлинно научной теории органической химии, которая и была создана А.М.Бутлеровым в 1861 году. Он писал: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы, я называю химическим строением распределение действия данной сил, вследствие которого химические атомы, посредственно влияя друг на друга, соединяются в химическую частицу.»
§
Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов ; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s22s22p2.
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
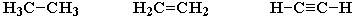
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Гибридизация. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s22s22p3.
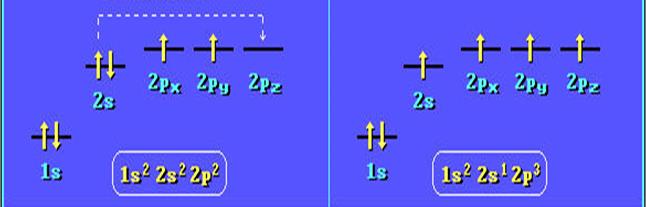
Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали отталкиваются и располагаются на максимальном расстоянии друг от друга. Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
1) sp3 – гибридизация. В процессе гибридизации принимает участие одна s и 3 p орбитали. Четыре совершенно одинаковые sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .
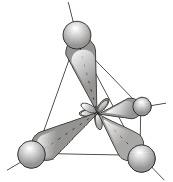
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
2) sp2 – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и двух р-орбиталей (sp2-гибридизация), при этом образуются три одинаковые sp2 — гибридные орбитали, расположенные под углом 120° друг к другу 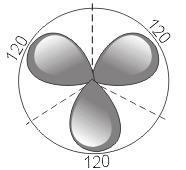 .
.
Посредством образования sp2-гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен, схематично можно изобразить следующую структуру 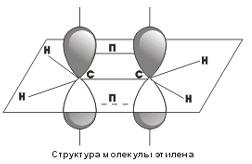 .
.
Как видно, у каждого атома углерода есть σ-связи, образованные sp2-гибридными облаками, кроме того, между атомами углерода образуется П-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и одной р-орбитали. Эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации — sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное направление 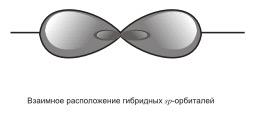 .
.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые П-связями .
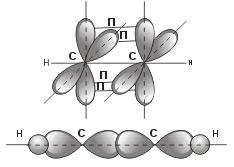
4.Основные положения теории строения Бутлерова.
§


Ход выполнения практической работы
Качественный анализ веществ — важная тема при изучении органической химии. Знание её помогает в работе не только химикам, но и медикам, экологам, биологам, эпидемиологам, фармацевтам, работникам пищевой промышленности. Надеюсь, что эти знания помогут вам и в повседневной жизни. Качественные реакции в химии связаны с выделением газа, образованием осадка и изменением окраски раствора.
Задания для решения
№ 1. Найдите соответствия:
| 1. Наличие альдегидной группы в молекуле H-COH можно доказать с помощью реактивов: | А) Гидроксид меди (II) |
| 2. Наличие карбоксильной группы в молекуле CH3-COOH можно доказать реакцией с: | Б) Аммиачный раствор оксида серебра (I) |
| 3. Двойственные функции муравьиной кислоты проявляются при взаимодействии с: | В) Бромная вода |
| 4. Для качественного определения уксусной кислоты применяют: | Г) Раствор перманганата калия |
| 5. Для определения непредельных углеводородов используют: | Д) Раствор хлорида железа (III) |
| 6. Для качественного определения непредельной олеиновой кислоты применяют: | Е) Раствор йода |
| 7. Для определения фенола используют: | Ж) Индикаторы |
| 8. Для определения крахмала применяют: | З) Концентрированная азотная кислота |
| 9. Для качественного определения многоатомных спиртов применяют: | И) Горение (запах жженых перьев) |
| 10 Для качественного определения глюкозы применяют: | К) Специфический запах |
| 11. Двойственные функции аминокислот проявляются при реакциях с: | Л) Раствор щелочи |
| 12. Для определения белка применяют: | М) Растворы неорганических кислот |
№2. Как распознать муравьиную и уксусную кислоты с помощью специфических реакций?
№3. Как распознать вещества: этанол, глицерин, уксусный альдегид, уксусную кислоту и глюкозу? Написать соответствующие уравнения реакций.
№4. Назовите несколько органических веществ, которые можно определить с помощью свежеприготовленного гидроксида меди (II).
№5. Назовите несколько органических веществ, для определения которых можно воспользоваться аммиачным раствором нитрата серебра.
№6. Как распознать следующее пары веществ:
А) олеиновая и стеариновая кислота
Б) формалин и глицерин
В) формалин и глюкоза
Г) глюкоза и белок
Д) глюкоза и глицерин
Е) метан и этилен
№7. Решите тест:
Вариант 1
1. Соединения, в состав которых входит функциональная группа NН2, относятся к классу:
1) аминов; 2) нитросоединений; 3) карбоновых кислот; 4) альдегидов.
2. Гомологом этана является:
1) С2Н4; 2) С2Н6; 3) С6Н6; 4) С3Н8.
3. Пропан взаимодействует с:
1) бромом; 2) хлороводородом; 3) водородом; 4) гидроксидом натрия (р-р).
4. Этанол не взаимодействует с:
1) Сu; 2) Nа; 3) НСl; 4) О2.
5. Этилацетат образуется при взаимодействии уксусной кислоты с:
1) ацетальдегидом; 2) этиленом; 3) этиловым спиртом; 4) ацетиленом.
6. Ацетальдегид взаимодействует с:
1) этаном; 2) водородом; 3) оксидом углерода(IV); 4) толуолом.
7. Вещество Х в схеме реакции СН3СООН СН3ОН  Х Н2О:
Х Н2О:
1) этилацетат; 2) этанол; 3) метилацетат; 4) диэтиловый эфир.
8. Метиламин взаимодействует с:
1) метаном; 2) кислородом; 3) гидроксидом кальция; 4) бензолом.
9. Непредельные углеводороды отличают от предельных с помощью:
1) H2SO4 (конц.); 2) NaOH (р-р);
3) Ag2O; 4) KMnO4 (р-р).
10. Количество вещества брома Вr2, которое может присоединить ацетилен объемом 11,2 л (н.у.) по уравнению реакции С2Н2 2Вr2 С2Н2Вr4, равно:
С2Н2Вr4, равно:
1) 1 моль; 2) 2 моль; 3) 0,5 моль; 4) 0,25 моль.
Вариант 2
1. Вещество с молекулярной формулой С6Н6 относится к классу:
1) алканов; 2) аренов; 3) алкинов; 4) алкенов.
2. Изомерами являются:
1) этилен и ацетилен; 2) 2-метилпропан и 2-метилбутан;
3) 2-метилбутан и н-пентан; 4) н-пентан и н-бутан.
3. При полном сгорании пропана С3Н8 образуются:
1) С и Н2О; 2) СО2 и Н2О; 3) СО и Н2; 4) СО и Н2О.
4. Сходство фенола и одноатомных спиртов проявляется во взаимодействии с:
1) NаОН (р-р); 2) Nа; 3) НСl; 4) НNО3 (р-р).
5. Бутилацетат образуется при взаимодействии бутанола с:
1) ацетальдегидом; 2) уксусной кислотой;
3) этиловым спиртом; 4) ацетиленом.
6. Формальдегид взаимодействует с:
1) метаном; 2) кислородом;
3) гидроксидом кальция; 4) бензолом.
7. Уксусная кислота может реагировать с каждым веществом пары:
1) метанол и серебро;
2) гидроксид меди(II) и метанол;
3) серебро и гидроксид меди(II); 4) магний и метан.
8. Этиламин может реагировать с:
1) KOH и HNO3; 2) H2SO4 и O2; 3) NaOH и CH3OH; 4) NaCl и O2.
9. Глицерин в водном растворе можно обнаружить с помощью:
1) хлорной извести; 2) хлорида железа(III);
3) гидроксида меди(II); 4) гидроксида натрия.
10. Масса брома, взаимодействующего с 140 г этилена по уравнению реакции С2Н4 Вr2 С2Н4Вr2, равна:
С2Н4Вr2, равна:
1) 400 г; 2) 140 г; 3) 800 г; 4) 80 г.
Ответы к тесту:
1вариант
| 1 – 1, 2 – 4, 3 – 1, 4 – 1, 5 – 3, 6 – 2, 7 – 3, 8 – 2, 9 – 4, 10 – 1. |
2вариант
| 1 – 2, 2 – 3, 3 – 2, 4 – 2, 5 – 2, 6 – 2, 7 – 2, 8 – 2, 9 – 3, 10 – 3. |
Вопросы для самоконтроля
- Свойство, присущее большинству органических веществ:
а) высокие температуры кипения и плавления;
б) высокая электропроводность;
в) горючесть;
г) большая плотность.
- Каких веществ на Земле больше?
а) органических; б) неорганических; в) одинаково; г) амфотерных.
- Теорию химического строения органических веществ сформулировал:
а) Н.Н.Зинин; б) Ф.Велер; в) А.М.Бутлеров; г) Д.И.Менделеев.
- Валентность углерода в пропане равна:
а) 4; б) 2; в) 8; г) 3.
- Явление существования нескольких веществ одинакового состава, с одной и той же молекулярной массой, но с разным строением молекул – это:
а) амфотерность; б) гомология; в) изомерия; г) аллотропия.
§
Тема: Генетическая связь между основными классами неорганических веществ
Цель: закрепить понятия «генетический ряд», «генетическая связь»; научиться составлять генетические ряды элементов (металлов и неметаллов), составлять уравнения реакций, соответствующих генетическому ряду; повторить свойства оксидов, кислот, солей, оснований.
На выполнение практической работы отводится 2 часа.
Теоретический материал
Генетическая связь – это связь между веществами, которые относятся к разным классам.
Основные признаки генетических рядов:
1. Все вещества одного ряда должны быть образованы одним химическим элементом.
2. Вещества, образованные одним и тем же элементом, должны принадлежать к различным классам химических веществ.
3. Вещества, образующие генетический ряд элемента, должны быть связаны между собой взаимопревращениями.
Таким образом, генетическим называют ряд веществ, которые представляют разные классы неорганических соединений, являются соединениями одного и того же химического элемента, связаны взаимопревращениями и отражают общность происхождения этих веществ.
Для металлов выделяют три ряда генетически связанных веществ, для неметаллов — один ряд.
1. Генетический ряд металлов, гидроксиды которых являются основаниями (щелочами):
металл → основный оксид → основание (щелочь) → соль.
Например, генетический ряд кальция:
Ca → CaO → Ca(OH)2 → CaCl2
2. Генетический ряд металлов, которые образуют амфотерные гидроксиды:
соль
↑
металл → амфотерный оксид → (соль) → амфотерный гидроксид
↓
cоль
Например: ZnCl2
↑
Zn → ZnO → ZnSO4 → Zn(OH)2
(H2ZnO2) ↓
Na2ZnO2
Оксид цинка с водой не взаимодействует, поэтому из него сначала получают соль, а затем гидроксид цинка. Так же поступают, если металлу соответствует нерастворимое основание.
3. Генетический ряд неметаллов (неметаллы образуют только кислотные оксиды):
неметалл → кислотный оксид → кислота → соль
Например, генетический ряд фосфора:
P → P2O5 → H3PO4 → K3PO4
Переход от одного вещества к другому осуществляется с помощью химических реакций.
Ход выполнения практической работы
- Запишите определения понятий:
Генетическая связь — __________________________________________
Генетический ряд — ___________________________________________
Генетический ряд металлов, в котором в качестве основания выступает щёлочь можно представить в общем виде: металл →основный оксид → щёлочь → соль. Составьте данный ряд, используя калий. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений.
Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота можно представить в следующем виде: неметалл → кислотный оксид → растворимая кислота → соль. Составьте данный ряд, используя фосфор. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений.
Генетический ряд, где в качестве основания выступает нерастворимое основание можно представить цепочкой превращений: металл → основный оксид → соль→ нерастворимое основание →основный оксид → металл. Составьте данный ряд, используя медь. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений.
Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота можно представить цепочкой превращений : неметалл → кислотный оксид → соль→ кислота → кислотный оксид → неметалл. Составьте данный ряд, используя кремний. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений.
- Выполните задания по вариантам:
| Вариант 1 | Вариант 2 | |
| 1 | CaO | HNO3 |
| 2 | Fe(OH)3 | N2O |
| 3 | Zn(NO3)2 | Cr(OH)3 |
| 4 | H2SO3 | H2S |
| 5 | PbO | LiOH |
| 6 | Ag3PO4 | P2O5 |
| 7 | NaOH | ZnO |
| 8 | CO2 | BaCl2 |
| 9 | HCl | H2CO3 |
| 10 | H2SO4 | CuSO4 |
1. Выберите в вашем варианте формулы оксидов, объясните свой выбор, опираясь на знание признаков состава данного класса соединений. Назовите их.
2. В столбце формул вашего варианта найдите формулы кислот и объясните свой выбор на основании анализа состава этих соединений.
3. Определите валентности кислотных остатков в составе кислот.
4. Выберите формулы солей и назовите их.
5. Составьте формулы солей, которые могут быть образованы магнием и кислотами вашего варианта. Запишите их, назовите.
6. В столбце формул вашего варианта найдите формулы оснований и объясните свой выбор на основании анализа состава этих соединений.
7. В вашем варианте выберите формулы веществ, с которыми может реагировать раствор ортофосфорной кислоты (соляной, серной). Составьте соответствующие уравнения реакций.
9. Среди формул своего варианта выберите формулы веществ, способных взаимодействовать между собой. Составьте соответствующие уравнения реакций.
10. Составьте цепочку генетических связей неорганических соединений, в состав которой войдет вещество, формула которого дана в вашем варианте под номером один.
- Из данных веществ составьте генетический ряд, используя все формулы. Напишите уравнения реакций, с помощью которых можно осуществить эту цепочку превращений:
I вариант: ZnSO4, Zn, ZnO, Zn, Zn(OH)2
II вариант : Na2SO4, NaOH, Na, Na 2O2, Na2O
Вопросы для самоконтроля
Составьте схему постепенного перехода от кальция к карбонату кальция и подготовьте сообщение об использовании в медицине любой соли.
ЛИТЕРАТУРА
Основные источники:
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического
профиля: учебник для студ. учреждений сред. проф. образования. — М., 2022.
Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественнонаучного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2022..
Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей социально-
экономического и гуманитарного профилей: учебник для студ. учреждений сред. проф. образования. — М., 2022.
Габриелян О. С., Остроумов И. Г., Сладков С. А., Дорофеева Н.М. Практикум: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2022.
Габриелян О. С., Остроумов И. Г., Сладков С. А. Химия: пособие для подготовки к ЕГЭ:
учеб. пособие для студ. учреждений сред. проф. образования. — М., 2022. Габриелян О. С., Лысова Г. Г. Химия. Тесты, задачи и упражнения: учеб. пособие для студ.
учреждений сред. проф. образования. — М., 2022.
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред. проф. образования. М., 2022.
Ерохин Ю. М. Химия: Задачи и упражнения: учеб. пособие для студ. учреждений сред.
проф. образования. — М., 2022.
Ерохин Ю.М. Сборник тестовых заданий по химии: учеб. пособие для студ. учреждений
сред. проф. образования. — М., 2022.
Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического про-
филя. Электронный учебно-методический комплекс. — М., 2022.
Сладков С. А., Остроумов И. Г., Габриелян О. С., Лукьянова Н. Н. Химия для профессий
и специальностей технического профиля. Электронное приложение (электронное учебное издание) для студ. учреждений сред. проф. образования. — М., 2022.
Журналы : «Химия и жизнь»
« Химия в школе»
« Наука и жизнь»
Дополнительная литература:
Федеральный закон от 29.11.2022 № 273-ФЗ «Об образовании в Российской Федерации».
Приказ Министерства образования и науки РФ от 17.05.2022 № 413 «Об утверждении
федерального государственного образовательного стандарта среднего (полного) общего образования».
Приказ Министерства образования и науки РФ от 29.12.2022 № 1645 «О внесении изменений в Приказ Министерства образования и науки РФ от 17.05.2022 № 413 “Об утверждении федерального государственного образовательного стандарта среднего (полного) общего образования”».
Письмо Департамента государственной политики в сфере подготовки рабочих кадров и
ДПО Минобрнауки России от 17.03.2022 № 06-259 «Рекомендации по организации получения среднего общего образования в пределах освоения образовательных программ среднего профессионального образования на базе основного общего образования с учетом требований федеральных государственных образовательных стандартов и получаемой профессии или специальности среднего профессионального образования».
Габриелян О. С., Лысова Г. Г. Химия: книга для преподавателя: учеб. метод. пособие. —
М., 2022.
Габриелян О. С. и др. Химия для профессий и специальностей технического профиля
(электронное приложение).
.
Интернет-ресурсы
www. pvg. mk. ru (олимпиада «Покори Воробьевы горы»).
www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
www. alhimikov. net (Образовательный сайт для школьников).
www. chem. msu. su (Электронная библиотека по химии).
www. enauki. ru (интернет-издание для учителей «Естественные науки»).
www. 1september. ru (методическая газета «Первое сентября»).
www. hvsh. ru (журнал «Химия в школе»).
www. hij. ru (журнал «Химия и жизнь»).
www. chemistry-chemists. com (электронный журнал «Химики и химия»).
Ответы и решения
CuCl2 Cu Сl2
на катоде на аноде
Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
2Cu(NO3)2 =2CuO 4NO2↑ O2↑
6NaOH(гор.) 3Cl2 = NaClO3 5NaCl 3H2O
CuCl2 = Cu Сl2
на катоде на аноде
Cu S = CuS
CuS 8HNO3(конц.гор.) = CuSO4 8NO2↑ 4H2O
или CuS 10HNO3(конц.) = Cu(NO3)2 H2SO4 8NO2↑ 4H2O
4NO2 2Ba(OH)2 = Ba(NO3)2 Ba(NO2)2 2H2O
NaNO3(тв.) H2SO4(конц.) = HNO3 NaHSO4
Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
2NaNO3 = 2NaNO2 O2↑
Cu(NO3)2 2NaOH = Cu(OH)2↓ 2NaNO3
Cu(OH)2 2HNO3 = Cu(NO3)2 2H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
CuO 2HNO3 = Cu(NO3)2 H2O
5. 3Cu 8HNO3(разб.) = 3Cu(NO3)2 2NO2↑ 4H2O
Cu(NO3)2 2КOH = Cu(OH)2↓ 2КNO3
Cu(OH)2 = CuO H2O
CuO C Cu CO
6. Hg(NO3)2 Cu = Cu(NO3)2 Hg
Cu(NO3)2 2NaOH = Cu(OH)2↓ 2NaNO3
Сu(OH)2 4(NH3 · H2O) = [Cu(NH3)4](OH)2 4H2O
[Cu(NH3)4](OH)2 5H2SO4 = CuSO4 4NH4HSO4 2H2O
7. Cu2O 6HNO3(конц.) = 2Cu(NO3)2 2NO2 3H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
4NO2 O2 2H2O = 4HNO3
10HNO3 4Mg = 4Mg(NO3)2 N2O 5H2O
8. (CuOH)2CO3 = 2CuO CO2 H2O
CuO H2 = Cu H2O
Cu 2H2SO4(конц.) = CuSO4 SO2 2H2O
CuSO4 Cu 2NaCl = 2CuCl↓ Na2SO4
3Cu 8HNO3(разб.) = 3Cu(NO3)2 2NO2↑ 4H2O
2Cu(NO3)2 2H2O = 2Cu O2 4HNO3
на катоде на аноде
2Na O2 = Na2O2
2Na2O2 CO2 = 2Na2CO3 O2
10.
(CuOH)2CO3 = 2CuO CO2 H2O
CuO 2HNO3 = Cu(NO3)2 H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
3CuO 2NH3 = 3Cu N2 3H2O
11.
CuO H2SO4 = CuSO4 H2O
CuSO4 2NaOH = Cu(OH)2 Na2SO4
Cu(OH)2 = CuO H2O
CuO H2 = Cu H2O
12.
Cu Cl2 = CuCl2
CuCl2 2NaOH = Cu(OH)2↓ 2NaCl
Cu(OH)2 = CuO H2O
CuO C = Cu CO
13.
Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
4NO2 O2 2H2O = 4HNO3
CuO H2 = Cu H2O
14.
2Cu O2 = 2CuO
CuO H2SO4 = CuSO4 H2O
CuSO4 NaOH = Cu(OH)2↓ Na2SO4
Сu(OH)2 4(NH3 · H2O) = [Cu(NH3)4](OH)2 4H2O
15.
СuSO4 2NaOH = Cu(OH)2 Na2SO4
Cu(OH)2 = CuO H2O
CuO C = Cu CO
Cu 2H2SO4(конц.) = CuSO4 SO2 2H2O
16.
2Cu I2 = 2CuI
2CuI 4H2SO4 = 2CuSO4 I2 2SO2 4H2O
СuSO4 2KOH = Cu(OH)2 K2SO4
Cu(OH)2 = CuO H2O
17.
2CuCl2 2Na2CO3 H2O = (CuOH)2CO3 CO2 4NaCl
(CuOH)2CO3 = 2CuO CO2 H2O
CuO H2 = Cu H2O
3Cu 8HNO3(разб.) = 3Cu(NO3)2 2NO2↑ 4H2O
18.
3Cu 8HNO3(разб.) = 3Cu(NO3)2 2NO2↑ 4H2O
Сu(NO3)2 2NH3· H2O = Cu(OH)2↓ 2NH4NO3
Cu(OH)2 4NH3· H2O = [Cu(NH3)4](OH)2 4H2O
[Cu(NH3)4](OH)2 3H2SO4 = CuSO4 2(NH4)2SO4 2H2O
19) Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
Сu(NO3)2 2NH3· H2O = Cu(OH)2↓ 2NH4NO3
Cu(OH)2 4NH3· H2O = [Cu(NH3)4](OH)2 4H2O
[Cu(NH3)4](OH)2 6HCl = CuCl2 4NH4Cl 2H2O
20.
Fe 2HCl = FeCl2 H2
CuO H2 = Cu H2O
Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
2Cu(NO3)2 2H2O = 2Cu O2 4HNO3
21.
I2 10HNO3 = 2HIO3 10NO2 4H2O
4NO2 2H2O O2 = 4HNO3
Cu(OH)2 2HNO3 = Cu(NO3)2 2H2O
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
22.
Cu2O 3H2SO4 = 2CuSO4 SO2 3H2O
СuSO4 2KOH = Cu(OH)2 K2SO4
Cu(OH)2 = CuO H2O
3CuO 2NH3 = 3Cu N2 3H2O
23.
CuO H2SO4 = CuSO4 H2O
2CuSO4 2H2O = 2Cu O2 2H2SO4
4NO2 O2 2H2O = 4HNO3
10HNO3 4Mg = 4Mg(NO3)2 NH4NO3 3H2O
24.
CuO CO = Cu CO2
Cu Cl2 = CuCl2
2CuCl2 2KI = 2CuCl↓ I2 2KCl
CuCl2 2AgNO3 = 2AgCl↓ Cu(NO3)2
25.
2Cu(NO3)2 = 2CuO 4NO2↑ O2↑
CuO H2SO4 = CuSO4 H2O
2CuSO4 2H2O = 2Cu O2 2H2SO4
Cu 4HNO3(конц.) = Cu(NO3)2 2NO2↑ 2H2O
26.
H2C2O4 = CO↑ CO2↑ H2O
CO2 Ca(OH)2 = CaCO3 H2O
2Cu(NO3)2 =2CuO 4NO2↑ O2↑
CuO CO = Cu CO2
27.
Cu 2H2SO4(конц.) = CuSO4 SO2 2H2O
SO2 2KOH = K2SO3 H2O
СuSO4 2NaOH = Cu(OH)2 Na2SO4
Cu(OH)2 2HCl = CuCl2 2H2O
