Взаимодействие со сложными веществами
Некоторые сложные вещества также взаимодействуют с кислородом с образованием оксидов. Например, при горении пропана, который входит в состав природного газа, протекает следующая реакция:
При автогенной сварке и резке металлов горит ацетилен:
В металлургии в обжиговых печах протекают реакции окисления обогащенных руд:
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
ДЕЛЛЕМ ВЫВОДЫ
- 1. Кислород — самый распространенный в природе элемент. Он встречается в виде двух аллотропных модификаций: кислород (О.,) и озон (О3).
- 2. С участием кислорода идут процессы медленного окисления, горения, гниения, брожения.
- 3. Явление образования нескольких простых веществ одним элементом называется аллотропией.
- 4. Кислород вступает в реакцию с металлами, неметаллами и сложными веществами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Какие газы легче воздуха? — faq | урал-тест в перми
Количество газов, которые легче воздуха, невелико.
Способ определения того, какие газы легче или тяжелее воздуха, заключается в сравнении их молекулярного веса (который вы можете найти в списке обнаруживаемых газов). Вы даже можете вычислить молекулярный вес M вещества, если вам известна химическая формула, установив H = 1, C = 12, N = 14, и O = 16 г/моль.
Пример:
Этанол, химическая формула C2H5OH, содержит 2 C, 6 H, и 1 O,
отсюда M = 2∗12 6∗1 1∗16 =46 г/моль.
Метан, химическая формула CH4, содержит 1 C и 4 H,
отсюда M = 1∗12 4∗1 = 16 г/моль.
Молекулярный вес воздуха, состоящего из 20,9 объемн. % O2 (M = 2∗16 = 32 г/моль) и 79,1 объемн. % N2 (M = 2∗14 = 28 г/моль), составляет 0,209∗32 0,791∗28 = 28,836 г/моль.
Вывод: любое вещество с молекулярным весом менее 28,836 г/моль легче воздуха.
Удивительно, что существует лишь 12 газов легче воздуха:
| ГАЗ | ФОРМУЛА | МОЛ.ВЕС | ОТН.ВЕС (Воздух=1) | ТОЧКА КИПЕНИЯ | ГОРЮЧЕСТЬ |
| Водород | Н2 | 2 | 0,069 | — 252.8 °C | Да |
| Гелий | He | 4 | 0,139 | — 268.9 °C | Нет |
| Метан | СН4 | 16 | 0,560 | — 161.5 °C | Да |
| Аммиак | NH3 | 17 | 0,589 | — 33.4 °C | Да |
| Фтористый водород | HF | 20 | 0,694 | 19.5 °C | Нет |
| Неон | Ne | 20 | 0,694 | — 246.1 °C | Нет |
| Ацетилен | С2Н2 | 26 | 0,902 | — 84.0 °C | Да |
| Диборан | В2Н6 | 27 | 0,936 | — 92.5 °C | Да |
| Синильная кислота | HCN | 27 | 0,936 | 25.7 °C *) | Да |
| Угарный газ | СО | 28 | 0,971 | — 191.6 °C | Да |
| Азот | N2 | 28 | 0,971 | — 195.8 °C | Нет |
| Этилен(Этен) | С2Н4 | 28 | 0,971 | — 103.8 °C | Да |
*) На самом деле синильная кислота в большей степени жидкость, нежели газ, давление ее паров составляет 817 мбар при 20 °C (по определению, газы имеют точку кипения ниже 20°C).
Кстати: пары еще одного, крайне важного негорючего вещества легче воздуха: H2O, молярный вес — 18 г/моль. Вывод: сухой воздух тяжелее влажного, который поднимается и конденсируется наверху в облаках.
Что касается размещения сенсоров на горючие газы, то это необходимо учитывать лишь для метана, водорода и аммиака. Эти газы поднимаются вверх до потолка, где и следует устанавливать сенсоры.
Помните, что любые горючие пары тяжелее воздуха!
Краткие сведения о кислороде, пропан-бутане и ацетилене — газресурс
Кислород — это газ без вкуса, запаха и цвета, не горючий, но активно поддерживает горение, немного тяжелее воздуха. При нормальном атмосферном давлении (760 мм ртутного столба) при температуре 0° С масса 1 м куб. кислорода равна 1.43 кг, а при нормальном атмосферном давлении и температуре 20° С, масса 1 м куб. кислорода равна 1.33 кг, масса 1 м куб воздуха равна 1.29 кг.
Кислород — это газ без вкуса, запаха и цвета, не горючий, но активно поддерживает горение, немного тяжелее воздуха. При нормальном атмосферном давлении (760 мм ртутного столба) при температуре 0° С масса 1 м куб. кислорода равна 1.43 кг, а при нормальном атмосферном давлении и температуре 20° С, масса 1 м куб. кислорода равна 1.33 кг, масса 1 м куб воздуха равна 1.29 кг.
В промышленности кислород получают из атмосферного воздуха методом глубокого охлаждения и ректификации.
Технический кислород для газопламенных работ получают в специальных установках из атмосферного воздуха в жидком состоянии. Жидкий кислород — это легко подвижная, голубоватая жидкость. Температура кипения (начало испарения) жидкого кислорода минус 183° С.
При нормальных условиях и температуре минус 183° С. легко испаряется, превращаясь в газообразное состояние. При повышении температуры интенсивность испарении увеличивается. Из 1 литра жидкого кислорода, образуется около 860 литров газообразного.
Кислород обладает большой химической активностью. Реакция соединения его с маслами, жирами, угольной пылью, ворсинками ткани и т.д., приводит их к мгновенному окислению, самовоспламенению и взрыву при обычных температурах.
Кислород в смеси с горючими газами и парами горючих жидкостей образует в широких пределах взрывчатые смеси.
«Кислород газообразный технический» согласно ГОСТ 5583- 78 выпускается для сварки и резки трех сортов: 1-й — чистотой не менее 99,7%, 2-й — не менее 99,5%, 3-й — не менее 99,2% по объёму. Чем меньше в кислороде газовых примесей, тем выше скорость реза, чище кромки и меньше расход кислорода. На предприятие поставляется в газообразном состоянии, в стальных кислородных баллонах «голубого» цвета ёмкостью 40 дм. куб. и давлением 150 кгс/см2. Сжатый кислород хранят и транспортируют в баллонах по ГОСТ 949-73.
Пропан — технический, бесцветный газ с резким запахом, состоящий из пропана С3Н8 или из пропана и пропилена С3Н6, суммарное содержание которых должно быть не менее 93%. Получают пропан при переработке нефтепродуктов. Пропанобутановая смесь – это смесь газов главным образом технического пропана и бутана. Эти газы относятся к группе тяжёлых углеводородов. Сырьём для их получения являются природные нефтяные газы, отходящие газы нефтеперерабатывающих заводов. Эти газы в чистом виде или в виде смесей при нормальной температуре и на большом повышении давления могут быть переведены из газообразного состояния в жидкое состояние.Хранится и транспортируется пропанобутановая смесь в жидком состоянии, а используется в газообразном.
Газообразная пропанобутановая смесь — это горючий газ без вкуса, запаха и цвета, тяжелее воздуха в 2 раза, поэтому при утечке газа он не рассеивается в атмосфере, а опускается вниз и заполняет углубления пола или местности.
При содержании газа пропан-бутана в воздухе или кислороде до нижнего предела взрываемости и внесении открытого огня происходит горение газа вокруг источника открытого огня.
При содержании газа пропан-бутана в воздухе или кислороде свыше нижнего предела взрываемости и внесении открытого огня или искры происходит пожар, т.е. интенсивное горение газа.
Газообразная пропанобутановая смесь при атмосферном давлении не обладает токсичным (отравляющим) воздействием на организм человека, так как мало растворяется в крови. Но, попадая в воздух, смешивается с ним, вытесняет и уменьшает содержание кислорода в воздухе. Человек, находящийся, а такой атмосфере испытывает кислородное голодание, а при значительных концентрациях газа в воздухе может погибнуть от удушья.
Предельно допустимая концентрация пропан-бутана в воздухе рабочей зоны должна быть не более 300 мг/м3(в пересчёте на углерод).При попадании жидкого пропан-бутана на кожные покровы тела, нормальная температура которого 36,6 град. С, происходит быстрое его испарение и интенсивный отбор тепла с поверхности тела, затем наступает обморожение.
По ГОСТ 20448-80 промышленность выпускает пропанобутановую смесь 3 марок:
- пропан технический, с содержанием пропана более 93%, бутана — менее 3 процентов;
- бутан технический, с содержанием бутана менее 93%, пропана не более 4 процентов;
- пропанобутановая смесь, 2-х типов: зимняя и летняя.
На предприятия для газопламенной обработки металлов поставляется пропанобутановая смесь в стальных баллонах зимняя и летняя.
Зимняя пропанобутановая смесь содержит 15% пропана, 25% бутана и прочих компонентов.
Летняя пропанобутановая смесь содержит 60% бутана, 40% пропана и прочих компонентов.
Для сжигания I куб. м газообразной пропано-бутановой смеси требуется 25-27 куб. м воздуха или 3,58 — 3,63 кг кислорода.
Температура воспламенения с воздухом:
- пропана — 510 град. С;
- бутана — 540 град. С
Температура воспламенения пропанобутановой смеси:
- с воздухом 490-510 град. С;
- с кислородом — 465-480 град. С.
Температура пламени пропанобутановой смеси с кислородом зависит от её состава и равна 2200-2680 град. С. При окислительном пламени (избыток кислорода) температура повышается.
Теплотворная способность пропанобутановой смеси равна 93000 Дж/м куб. (22000 ккал/м куб.).
Скорость горения пропанобутановой смеси:
- при обычном горении 0,8 – 1,5 м/сек.;
- при дистанционном (со взрывом) 1,5 — 3,5 км/сек.
Пределы взрывоопасности пропан-бутана при нормальном давлении составляют:
- нижний – 1,5%;
- верхний – 9,5%.нижний – 2%;
- верхний – 46%.
Пропанобутановые смеси в жидком виде разрушают резину, поэтому необходимо тщательно следить за резиновыми изделиями, применяемыми в газопламенной аппаратуре, и в случае необходимости производить их своевременную замену.
Наибольшая опасность разрушения резины существует зимой, вследствие большей вероятности попадания жидкой фазы пропанобутановой смеси в рукава.
Ацетилен — это горючий газ, без цвета, вкуса, с резким специфическим чесночным запахом, он легче воздуха. Его плотность по отношению к воздуху 0,9.
При нормальном атмосферном давлении (760 мм ртутного столба) и температуре плюс 20 град. С 1 м куб. имеет массу 1,09 кг, воздух 1,20 кг.
При нормальном атмосферном давлении и температуре от — 82,4 градуса до — 84 градусов С ацетилен переходит из газообразного в жидкое состояние, а при температуре минус 85 град. С затвердевает.
Ацетилен — единственный широко применяемый в промышленности газ, горение и взрыв которого возможны в отсутствии кислорода или других окислителей.
При газопламенной обработке металлов ацетилен используют либо в газообразном состоянии, получая его в передвижных или стационарных ацетиленовых генераторах, либо растворённым в ацетиленовых баллонах. Растворенный ацетилен по ГОСТ 5457-75 представляет собой раствор газообразного ацетилена в ацетоне, распределённый в пористом наполнителе под давлением до 1,9 МПА (19 кгс/см2). В качестве пористых наполнителей используются насыпные – берёзовый активированный уголь (БАЦ) и литые пористые массы.
Основным сырьём для получения ацетилена является карбид кальция. Это твёрдое вещество тёмно-серого или коричневатого цвета. Ацетилен получается в результате разложения (гидролиза) кусков, карбида кальция водой. Выход ацетилена на 1 кг карбида кальция составляет 250 дм куб. Для разложения 1 кг карбида кальция требуется от 5 до 20 дм куб. воды. Карбид кальция транспортируется в герметически закрытых барабанах. Масса карбида в одном барабане от 50 до 130 кг.
При нормальном атмосферном давлении ацетилен с воздухом и кислородом образуют взрывоопасные смеси. Пределы взрывоопасности ацетилена с воздухом:
- нижний – 2,2%;
- верхний – 81%.
Пределы взрывоопасности ацетилена с кислородом:
- нижний – 2,3%;
- верхний – 93%.
Наиболее взрывоопасные концентрации ацетилена с воздухом и кислородом составляют:
- нижний – 7%;
- верхний – 13%.
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий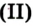
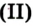 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий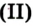 оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган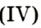
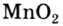
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 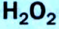 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган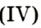
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 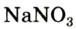

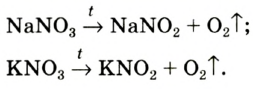
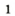
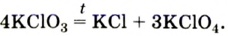
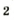 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: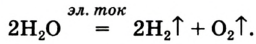
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 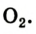
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 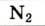 | 78,09 | 75,51 |
| Кислород | 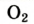 | 20,95 | 23,15 |
| Аргон | 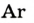 | 0,93 | 1,28 |
| углекислый газ | 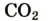 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 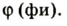
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 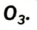 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 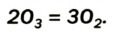
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
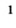
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
Заключение
Какой газ самый легкий? Теперь вы и сами знаете ответ. Самыми легкими считаются водород, азот и кислород, относящиеся к нулевой группе периодической системы. После них следуют метан (углерод водород) и оксид углерода (углерод кислород).
Что-то
я одни только серьёзные вещи делаю. Так устал от этого, что решил, для отдыха, фигнёй вчера вечером позаниматься. Составить, скажем, топ-лист самых тяжёлых газов. Если кому интересно — вот результаты.
Точнее, сначала несколько замечаний.
Замечание №1. Список, особенно в лёгкой своей части, наверняка неполон. Веществ всяких синтезировано до чёрта, и мои тыканья вряд ли покрыли всё поле.
Замечение №2. «Тяжёлый» определялось по молекулярной массе. На самом деле, для достаточно сложных молекул, да ещё вблизи температуры кипения, простая линейная связь между плотностью газа и его молекулярной массой может нарушаться (в тяжёлых случаях, как, например, у HF, процентов аж на 30).
Но ясно же, что никто никогда не набирал литр какого-нибудь TeClF5 только чтобы его точно взвесить. Да кой-каких из этих веществ, вероятно, и литра-то за всю историю не произведено! Поэтому, за неимением лучшей линейки, будет всё-таки молекулярный вес. Делим его на 29 — и получаем, в первом приближении, во сколько раз газ тяжелее воздуха.
Замечание №3. «Газом» полагается субстанция, кипящая или полностью сублимирующая при температуре ниже 20 Цельсия и давлении в 1 атмосферу.
Ну вот. Теперь, наконец, слайды наш хит-парад:
10. N(CF 3) 3 . Взяли аммиак и заменили водороды на метиловые группы, в каждой из которых заменили водороды на фтор. Получился perfluorotrimethylamine. Масса: 221, температура кипения -6 C. , .
9.5. Мне тут радон Rn подсказали, с массой в 222 и температурой кипения в -62 C.
9. C 4 F 10 . Обычный бутан, в котором весь водород поменяли на фтор. Так и называется: perfluorobutane. Масса: 238, температура кипения -1.7 C. . Вещество, кстати, весьма химически стойкое, первым никого не атакующее, физиологически инертное, а потому используется как наполнитель некоторых огнетушителей и контрастный агент для УЗИ в медицине.
8. TeF 6 . Теллур, обвешанный со всех сторон фтором, т.е. теллура гексафторид (tellurium hexafluoride). Масса: 241.6, температура кипения -37.6 C. . В отличие от предыдущего газа, правда, очень токсичен и обладает чрезвычайно неприятным запахом, как и большинство летучих соединений теллура. Реагирует с водой.
7. CF 3 CF 2 I. Взяли этан, заменили весь водород фтором и одним атомом иода. В комментариях подсказали, что это называется перфторэтил иодид. Или 1,1,1,2,2-pentafluoro-2-iodoethane, если по IUPAC (ссылка). Масса: 245.9, температура кипения 13 C. (если промотать на страницу 424) сообщает, что вещество является анестетиком, пригодным для наркоза. Так что вряд ли оно совсем уж «злое» по своим свойствам.
6. C 4 F 10 O. Это, в общем, эфир, но тоже со фтором везде вместо водорода. Называется decafluorodiethyl ether. Масса: 254, температура кипения 0 C. тот же и указывает, что вещество является физиологически инертным, но тоже потенцально применимым для наркоза.
5. TeClF 5 . Масса: 258, температура кипения 13.5 C. . По аналогии с родственником №8 наверняка тоже гадость страшная.
4. F 5 TeOF. Масса: 259.6, температура кипения 0.6 C. Называется, предположительно, tellurium hypofluorite, если я правильно проинтерпретировал . И это наверняка тоже не мёд.
3. IF 7 . Масса: 259.6, температура кипения 4.8 C. Гептафторид иода (iodine heptafluoride). . Раздражитель, сильный окисилитель, в контакте с органическими материалами может вызвать пожар. При взгляде на это вещество тут же возникает соблазн «сконструировать» что-нибудь ещё потяжелее, заменив фтор на хлор — скажем, IClF 6 .
2. W(CH 3) 6 . Атом вольфрама, облепленный метиловыми группами. Hexamethyltungsten, гексаметилвольфрам; тетраэтилсвинец помните? Та же порода. Масса: 274.05, температура кипения -30 C (сублимирует). сообщает, что при комнатной температуре соединение разлагается, так что работать с ним надо очень быстро, и вообще помещение его в этот список — некоторая натяжка. Но пусть будет.
Ну и, наконец, победитель:
1. WF 6 . Гексафторид вольфрама, tungsten hexafluoride. Масса: 297.3 (в 10 раз тяжелее воздуха, 12.4 грамма на литр), температура кипения 17.1 C. На грани, но всё-таки газ. . Вещество это довольно стабильно, хорошо изучено и применяется в производстве полупроводников. Правда, вдыхать его не советую: это яд, плюс коррозионно очень активный.
Википедия однако, осторожно именует его лишь «одним из самых тяжёлых газов». Почему? Во-первых, поди перебери всю химию, чтобы проверить. Кто знает, не таятся ли среди многочисленных галогенооргаников какие-нибудь ещё более тяжёлые газы, ведомые только паре экспертов?
А во-вторых, у WF 6 имеется несколько и вполне конкретных конкурентов, способных изменить его статус в будущем. Например:
1. WClF 5 с молекулярной массой в 314.2. Вещество это точно существует (например , и есть ещё много указаний), достаточно стабильно, чтобы его «добавлять» к другим реагентам в каких-то эзотерических фокусах, и достоверно летучее. Но найти его точную
температуру кипения мне так и не удалось. Сильно подозреваю, что она попросту неведома никому за её полной практической ненадобностью.
2. PoF 6 (323) (), OsF 8 (342) (), AmF 6 (357) (). Все эти вещества считаются теоретически возможными, (в частности, гексафторид полония PoF 6 , предположительно, должен быть газом с т. кип. -40 C). Всех их пытались синтезировать — но удача пока никому не улыбнулась.
Так что вопрос «самого тяжёлого газа» остаётся открытым.
И на закуску. Полученные результаты наводят на мысль о следующем «рецепте» построения тяжёлых газов:
1. Взять что-то симметричное потяжелее. Атом или функциональную группу.2. Обвесить симметрично со всех сторон фтором. Это уже даёт результат, но затем:3. Заменить один фтор другим галогеном, если получится.
Так я нашёл почти все газы в этом списке. Возможны ли другие пути? Я видел кое-какие вариации, но все они, похоже, менее перспективны:
а) Хлор, а не фтор? Гораздо худшая летучесть. Правда, PbCl 4 выступает любопытным исключением, но даже его температура кипения — 50 C.
б) Кислород, при той же почти массе, что у фтора, связывает вдвое больше электронов и соединение получается легче. Вероятно, вершина на этом пути — Mn 2 O 7 , нестойкий, взрывоопасный , но чисто формально вроде как сублимирующий при -10 C. Из более стабильных соединений стоит отметить, пожалуй, OsO 4 с температурой кипения аж в 130 градусов.
в) Карбонилы, в том числе тяжёлых металлов, существуют, стойки, хорошо изучены. Но, хоть и летучи, при комнатной температуре в большинстве своём тверды. Самые летучие из них — никелевый Ni(CO) 4 (кипит при 43) и кобальтовый Co 2 (CO) 8 ( 52). Оба — ядовитейшие соединения, которых, по возможности, лучше избегать.
с) Метиловые группы и металлорганика в целом. Уже упомянутый тетраэтилсвинец, хоть и жидкий при комнатной температуре, выглядит многообещающе. Особенно если в метиловые группы галогенов добавить. Увы, толком рассмотреть это поле мне не удалось. Может, из экспертов кто чего подскажет.
Спасибо за внимание. Всё.

