Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Оксид цинка, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
С. т. жуков химия 8-9 класс глава 10. водород, кислород, вода
С. Т. Жуков Химия 8-9 класс
10.1.Водород
Название «водород»относится и к
химическому элементу, и к простому веществу.
Элемент водород состоит из атомов водорода.
Простое вещество водород состоит из молекул
водорода.
а) Химический элемент водород
В естественном ряду элементов
порядковый номер водорода – 1. В системе
элементов водород находится в первом периоде в IA
или VIIA группе.
Водород – один из самых
распространенных элементов на Земле. Молярная
доля атомов водорода в атмосфере, гидросфере и
литосфере Земли (все вместе это называется
земной корой) равна 0,17. Он входит в состав воды,
многих минералов, нефти, природного газа,
растений и животных. В теле человека в среднем
содержится около 7 килограммов водорода.
Существуют три изотопа водорода:
а) легкий водород ![]() – протий,
– протий,
б) тяжелый водород ![]() – дейтерий (D),
– дейтерий (D),
в) сверхтяжелый водород ![]() – тритий (Т).
– тритий (Т).
Тритий неустойчивый (радиоактивный)
изотоп, поэтому в природе он практически не
встречается. Дейтерий устойчив, но его очень
мало: wD = 0,015% (от массы всего земного
водорода). Поэтому атомная масса водорода очень
мало отличается от 1 Дн (1,00794 Дн).
б) Атом водорода
Из предыдущих разделов курса химии вам
уже известны следующие характеристики атома
водорода:
Валентные возможности атома водорода
определяются наличием одного электрона на
единственной валентной орбитали. Большая
энергия ионизации делает атом водорода не
склонным к отдаче электрона, а не слишком высокая
энергия сродства к электрону приводит к
незначительной склонности его принимать.
Следовательно, в химических системах
образование катиона Н![]()
невозможно, а соединения с анионом Н![]() не очень устойчивы.
не очень устойчивы.
Таким образом, для атома водорода наиболее
характерно образование с другими атомами
ковалентной связи за счет своего одного
неспаренного электрона. И в случае образования
аниона, и в случае образования ковалентной связи
атом водорода одновалентен.
В простом веществе степень окисления атомов
водорода равна нулю, в большинстве соединений
водород проявляет степень окисления I, и только в
гидридах наименее электроотрицательных
элементов у водорода степень окисления –I.
Сведения о валентных возможностях атома
водорода приведены в таблице 28. Валентное
состояние атома водорода, связанного одной
ковалентной связью с каким-либо атомом, в таблице
обозначено символом «H—».
Таблица 28.Валентные
возможности атома водорода
Валентное состояние | W э | W к | С/О | Примеры химических |
H — | 0 | 1 | I | HCl, H2O, H2S, NH3, |
H | 1 | 0 | –I | NaH, KH, CaH2, BaH2 |
в) Молекула водорода
Двухатомная молекула водорода Н2
образуется при связывании атомов водорода
единственной возможной для них ковалентной
связью. Связь образуется по обменному механизму.
По способу перекрывания электронных облаков это
s-связь (рис. 10.1 а). Так как атомы одинаковы,
связь неполярная.
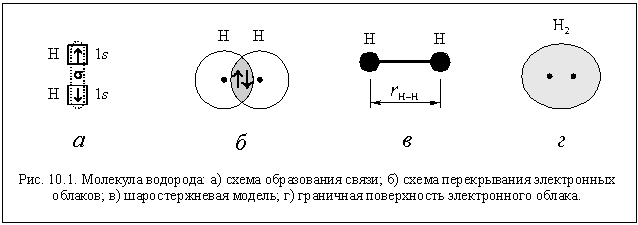
Межатомное расстояние (точнее
равновесное межатомное расстояние, ведь атомы-то
колеблются) в молекуле водорода r(H–H) = 0,74 A
(рис.10.1 в), что значительно меньше суммы
орбитальных радиусов (1,06 A). Следовательно,
электронные облака связываемых атомов
перекрываются глубоко (рис. 10.1 б), и связь в
молекуле водорода прочная. Об этом же говорит и
довольно большое значение энергии связи
(454 кДж/моль).
Если охарактеризовать форму молекулы граничной
поверхностью (аналогичной граничной поверхности
электронного облака), то можно сказать, что
молекула водорода имеет форму слегка
деформированного (вытянутого) шара (рис. 10.1 г).
г) Водород (вещество)
При обычных условиях водород – газ без
цвета и запаха. В небольших количествах он
нетоксичен. Твердый водород плавится при 14 К (–259
°С), а жидкий водород кипит при 20 К (–253 °С). Низкие
температуры плавления и кипения, очень маленький
температурный интервал существования жидкого
водорода (всего 6 °С), а также небольшие значения
молярных теплот плавления (0,117 кДж/моль) и
парообразования (0,903 кДж/моль) говорят о том, что
межмолекулярные связи в водороде очень слабые.
Плотность водорода r(Н2) = (2 г/моль):(22,4 л/моль)
= 0,0893 г/л. Для сравнения: средняя плотность
воздуха равна 1,29 г/л. То есть водород в 14,5 раза
«легче»воздуха. В воде он практически
нерастворим.
При комнатной температуре водород малоактивен,
но при нагревании реагирует со многими
веществами. В этих реакциях атомы водорода могут
как повышать, так и понижать свою степень
окисления: Н2 2е– = 2Н–I, Н2
– 2е– = 2Н I.
В первом случае водород является окислителем,
например, в реакциях с натрием или с кальцием: 2Na
H2 = 2NaH, (t) Ca H2 = CaH2. (t)
Но более характерны для водорода
восстановительные свойства: O2 2H2 = 2H2O,
(t)
CuO H2 = Cu H2O. (t)
При нагревании водород окисляется не только
кислородом, но и некоторыми другими неметаллами,
например, фтором, хлором, серой и даже азотом.
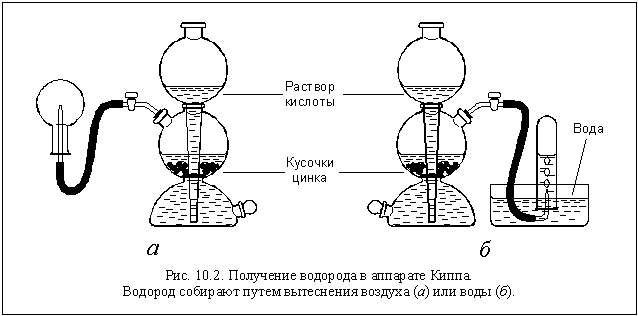
В лаборатории водород получают в результате
реакции
Zn H2SO4 = ZnSO4 H2.
Вместо цинка можно использовать
железо, алюминий и некоторые другие металлы, а
вместо серной кислоты – некоторые другие
разбавленные кислоты. Образующийся водород
собирают в пробирку методом вытеснения воды (см.
рис. 10.2 б) или просто в перевернутую колбу
(рис. 10.2 а).
В промышленности в больших
количествах водород получают из природного газа
(в основном это метан) при взаимодействии его с
парами воды при 800 °С в присутствии никелевого
катализатора:
CH4 2H2O = 4H2 CO2 (t,
Ni)
или обрабатывают при высокой
температуре парами воды уголь:
2H2O С = 2H2 CO2. (t)
Чистый водород получают из воды,
разлагая ее электрическим током (подвергая
электролизу):
2H2O = 2H2 O2
(электролиз).
д) Соединения водорода
Гидриды (бинарные соединения,
содержащие водород) делятся на два основных типа:
а) летучие(молекулярные) гидриды,
б) солеобразные (ионные) гидриды.
Элементы IVА – VIIA групп и бор образуют
молекулярные гидриды. Из них устойчивы только
гидриды элементов, образующих неметаллы:
B2H6 ;CH4; NH3; H2O;
HF
SiH4 ;PH3; H2S; HCl
AsH3; H2Se; HBr
H2Te; HI
За исключением воды, все эти соединения при
комнатной температуре – газообразные вещества,
отсюда их название – «летучие гидриды» .
Некоторые из элементов, образующих неметаллы,
входят в состав и более сложных гидридов.
Например, углерод образует соединения с общими
формулами CnH2n 2, CnH2n,
CnH2n–2 и другие, где n может
быть очень велико (эти соединения изучает
органическая химия).
К ионным гидридам относятся гидриды щелочных,
щелочноземельных элементов и магния. Кристаллы
этих гидридов состоят из анионов Н![]() и катионов металла в высшей
и катионов металла в высшей
степени окисления Ме![]()
или Ме2![]() (в
(в
зависимости от группы системы элементов).
| LiH | |
| NaH | MgH2 |
| KH | CaH2 |
| RbH | SrH2 |
| CsH | BaH2 |
И ионные, и почти все молекулярные гидриды (кроме
Н2О и НF) являются восстановителями, но
ионные гидриды проявляют восстановительные
свойства значительно сильнее, чем молекулярные.
Кроме гидридов, водород входит в состав
гидроксидов и некоторых солей. Со свойствами
этих, более сложных, соединений водорода вы
познакомитесь в следующих главах.
Главными потребителями получаемого в
промышленности водорода являются заводы по
производству аммиака и азотных удобрений, где
аммиак получают непосредственно из азота и
водорода:
N2 3H2![]() 2NH3 (Р, t, Pt –
2NH3 (Р, t, Pt –
катализатор).
В больших количествах водород
используют для получения метилового спирта
(метанола) по реакции 2Н2 СО = СН3ОН
(t, ZnO – катализатор), а также в производстве
хлороводорода, который получают непосредственно
из хлора и водорода:
H2 Cl2 = 2HCl.
Иногда водород используют в
металлургии в качестве восстановителя при
получении чистых металлов, например: Fe2O3
3H2= 2Fe 3H2O.
![]() 1.Из
1.Из
каких частиц состоят ядра а) протия, б) дейтерия,
в) трития?
2.Сравните энергию ионизации атома водорода с
энергией ионизации атомов других элементов. К
какому элементу по этой характеристике водород
ближе всего?
3.Проделайте то же для энергии сродства к
электрону
4.Сравните направление поляризации ковалентной
связи и степень окисления водорода в
соединениях: а) BeH2,CH4, NH3, H2O,
HF; б) CH4, SiH4,GeH4.
5.Запишите простейшую, молекулярную, структурную
и пространственную формулу водорода. Какая из
них чаще всего используется?
6.Часто говорят: » Водород легче воздуха». Что
под этим подразумевается? В каких случаях это
выражение можно понимать буквально, а в каких
–нет?
7.Составьте структурные формулы гидридов калия и
кальция, а также аммиака, сероводорода и
бромоводорода.
8.Зная молярные теплоты плавления и
парообразования водорода, определите значения
соответствующих удельных величин.
9.Для каждой из четырех реакций, иллюстрирующих
основные химические свойства водорода ,
составьте электронный баланс. Отметьте
окислители и восстановители.
10.Определите массу цинка, необходимого для
получения 4,48 л водорода лабораторным способом.
11.Определите массу и объем водорода, который
можно получить из 30 м3 смеси метана и паров
воды, взятых в объемном отношении 1:2, при выходе 80
%.
12.Составьте уравнения реакций, протекающихпри
взаимодействии водорода а) со фтором, б) с серой.
13.Приведенные ниже схемы реакций иллюстрируют
основные химические свойства ионных гидридов:
а) MH O2 MOH (t); б) MH Cl2
MCl HCl (t);
в) MH H2O MOH H2; г) MH HCl(p)
MCl H2
Здесь М – это литий, натрий, калий, рубидий или
цезий. Составьте уравнения соответствующих
реакций в случае, если М – натрий.
Проиллюстрируйте уравнениями реакций
химические свойства гидрида кальция.
14.Используя метод электронного баланса,
составьте уравнения следующих реакций,
иллюстрирующих восстановительные свойства
некоторых молекулярных гидридов:
а) HI Cl2 HCl I2 (t); б) NH3 O2
H2O
N2 (t); в) CH4 O2 H2O CO2 (t).
Как и в случае водорода, слово
«кислород» является названием и химического
элемента, и простого вещества. Кроме простого
вещества «кислород» (дикислород)
химический элемент кислородобразует еще одно
простое вещество, называемое » озон»(трикислород).
Это аллотропные модификации кислорода. Вещество
кислород состоит из молекул кислорода O2, а
вещество озон состоит из молекул озона O3.
а) Химический элемент кислород
В естественном ряду элементов
порядковый номер кислорода – 8. В системе
элементов кислород находится во втором периоде в
VIA группе.
Кислород – самый распространенный элемент на
Земле. В земной коре каждый второй атом – атом
кислорода, то есть молярная доля кислорода в
атмосфере, гидросфере и литосфереЗемли – около 50
%. Кислород (вещество) – составная часть воздуха.
Объемная доля кислорода в воздухе –21 %. Кислород
(элемент) входит в состав воды, многих минералов,
а также растений и животных. В теле человека
содержится в среднем 43 кг кислорода.
Природный кислород состоит из трех изотопов (16О,
17О и 18О), из которых наиболее
распространен самый легкий изотоп 16О.
Поэтому атомная масса кислорода близка к 16 Дн
(15,9994 Дн).
б) Атом кислорода
Вам известны следующие характеристики
атома кислорода.
Таблица 29. Валентные
возможности атома кислорода
Валентное состояние | W э | W к | С/О | Примеры химических |
| 2 | 4 | –II | Al2O3, Fe2O3, |
| 1 | 3 | –II | (H3O)Cl |
| 0 | 2 | –II | H2O, SO2, SO3, |
| 1 | 1 | –II | NaOH, KOH, Ca(OH)2, Ba(OH)2 |
| 2 | 0 | –II | Li2O, Na2O, MgO, CaO, |
* Эти оксиды можно рассматривать и как
ионные соединения.
** Атомы кислорода в молекуле не находятся в
данном валентном состоянии; это лишь пример
вещества со степенью окисления атомов кислорода,
равной нулю
Большая энергия ионизации (как у водорода)
исключает образование из атома кислорода
простого катиона. Энергия сродства к электрону
довольно велика (почти в два раза больше, чем у
водорода), что обеспечивает большую склонность
атома кислорода к присоединению электронов и
способность образовывать анионы О2A. Но
энергия сродства к электрону у атома кислорода
все же меньше, чем у атомов галогенов и даже
других элементов VIA группы. Поэтому анионы
кислорода (оксид-ионы) существуют только в
соединениях кислорода с элементами, атомы
которых очень легко отдают электроны.
Обобществляя два неспаренных электрона, атом
кислорода может образовать две ковалентные
связи. Две неподеленные пары электронов из-за
невозможности возбуждения могут вступать только
в донорно-акцепторное взаимодействие. Таким
образом, без учета кратности связи и
гибридизации атом кислорода может находиться в
одном из пяти валентных состояний (табл. 29).
Наиболее характерно для атома кислорода
валентное состояние с Wк = 2, то есть
образование двух ковалентных связей за счет двух
неспаренных электронов.
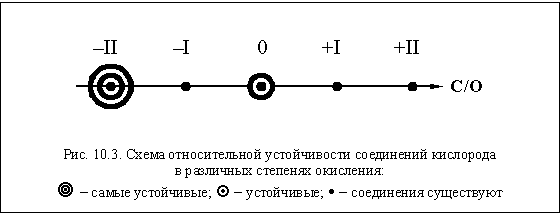
Очень высокая электроотрицательность атома
кислорода (выше – только у фтора) приводит к тому,
что в большинстве своих соединений кислород
имеет степень окисления –II. Существуют вещества,
в которых кислород проявляет и другие значения
степени окисления, некоторые из них приведены в
таблице 29 в качестве примеров, а сравнительная
устойчивость показана на рис. 10.3.
в) Молекула кислорода
Экспериментально установлено, что
двухатомная молекула кислорода О2 содержит
два неспаренных электрона. Используя метод
валентных связей, такое электронное строение
этой молекулы объяснить невозможно. Тем не менее,
связь в молекуле кислорода близка по свойствам к
ковалентной. Молекула кислорода неполярна.
Межатомное расстояние (ro–o = 1,21 A = 121 нм)
меньше, чем расстояние между атомами, связанными
простой связью. Молярная энергия связи довольно
велика и составляет 498 кДж/моль.
г) Кислород (вещество)
При обычных условиях кислород – газ
без цвета и запаха. Твердый кислород плавится при
55 К (–218 °С), а жидкий кислород кипит при 90 К (–183
°С).
Межмолекулярные связи в твердом и жидком
кислороде несколько более прочные, чем в
водороде, о чем свидетельствует больший
температурный интервал существования жидкого
кислорода (36 °С) и большие, чем у водорода,
молярные теплоты плавления (0,446 кДж/моль) и
парообразования (6,83 кДж/моль).
Кислород незначительно растворим в воде: при 0 °С
в 100 объемах воды (жидкой!) растворяется всего 5
объемов кислорода (газа!).
Высокая склонность атомов кислорода к
присоединению электронов и высокая
электроотрицательность приводят к тому, что
кислород проявляет только окислительные
свойства. Эти свойства особенно ярко проявляются
при высокой температуре.
Кислород реагирует со многими металлами: 2Ca O2
= 2CaO, 3Fe 2O2 = Fe3O4 (t);
неметаллами: C O2 = CO2, P4 5O2
= P4O10,
и сложными веществами: CH4 2O2 = CO2
2H2O, 2H2S 3O2 = 2H2O 2SO2.
Чаще всего в результате таких реакций
получаются различные оксиды (см. гл. II § 5), но
активные щелочные металлы, например натрий,
сгорая, превращаются в пероксиды:
2Na O2 = Na2O2.
Структурная формула получившегося
пероксида натрия (Na![]() )2(
)2(![]() )2(
)2(O—O
![]() ).
).
Тлеющая лучинка, помещенная в кислород,
вспыхивает. Это удобный и простой способ
обнаружения чистого кислорода.
В промышленности кислород получают из воздуха
путем ректификации (сложной разгонки), а в
лаборатории – подвергая термическому
разложению некоторые кислородсодержащие
соединения, например:
2KMnO4 = K2MnO4 MnO2 O2(200 °С);
2KClO3 = 2KCl 3O2 (150 °С, MnO2 – катализатор);
2KNO3 = 2KNO2 3O2(400 °С)
и, кроме того, путем каталитического разложения
пероксида водорода при комнатной температуре: 2H2O2
= 2H2O O2 (MnO2–катализатор).
Чистый кислород используют в промышленности для
интенсификации тех процессов, в которых
происходит окисление, и для создания
высокотемпературного пламени. В ракетной
технике в качестве окислителя используется
жидкий кислород.
Огромное значение имеет кислород для
поддержания жизнедеятельности растений,
животных и человека. В обычных условиях человеку
достаточно для дыхания кислорода воздуха. Но в
условиях, когда воздуха не хватает, или он вообще
отсутствует (в самолетах, при водолазных работах,
в космических кораблях и т. п.), для дыхания
готовят специальные газовые смеси, содержащие
кислород. Применяют кислород и в медицине при
заболеваниях, вызывающих затруднение дыхания.
д) Озон и его молекулы
Озон O3 – вторая аллотропная
модификация кислорода.
Трехатомная молекула озона имеет уголковую
структуру, среднюю между двумя структурами,
отображаемыми следующими формулами:
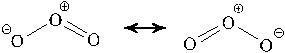
Озон – темно-синий газ с резким
запахом. Из-за своей сильной окислительной
активности он ядовит. Озон в полтора раза
«тяжелее» кислорода и несколько больше, чем
кислород, растворим в воде.
Озон образуется в атмосфере из кислорода при
грозовых электрических разрядах:
3О2 = 2О3 (![]() ).
).
При обычной температуре озон медленно
превращается в кислород, а при нагревании этот
процесс протекает со взрывом.
Озон содержится в так называемом «озоновом
слое» земной атмосферы, предохраняя все живое
на Земле от вредного воздействия солнечного
излучения.
В некоторых городах озон используется вместо
хлора для дезинфекции (обеззараживания) питьевой
воды.
![]()
Изобразите структурные формулы следующих
веществ: OF2, H2O, H2O2, H3PO4,
(H3O)2SO4, BaO, BaO2, Ba(OH)2.
Назовите эти вещества. Опишите валентные
состояния атомов кислорода в этих соединениях.
Определите валентность и степень окисления
каждого из атомов кислорода.
2.Составьте уравнения реакций сгорания в
кислороде лития, магния, алюминия, кремния,
красного фосфора и селена (атомы селена
окисляются до степени окисления IV, атомы
остальных элементов – до высшей степени
окисления). К каким классам оксидов относятся
продукты этих реакций?
3.Сколько литров озона можно получить (при
нормальных условиях) а) из 9 л кислорода, б) из 8 г
кислорода?
Вода – самое распространенное в
земной коре вещество. Масса земной воды
оценивается в 1018 тонн. Вода – основа
гидросферы нашей планеты, кроме того, она
содержится в атмосфере, в виде льда образует
полярные шапки Земли и высокогорные ледники, а
также входит в состав различных горных пород.
Массовая доля воды в человеческом организме
составляет около 70 %.
Вода – единственное вещество, у которого во всех
трех агрегатных состояниях есть свои особые
названия.
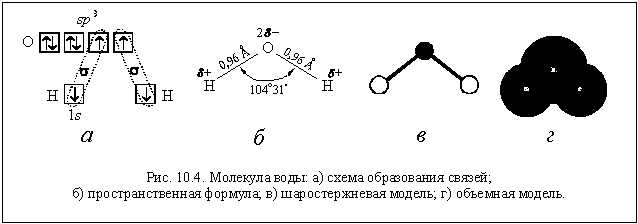
Электронное строение молекулы воды
(рис. 10.4 а) нами было подробно изучено ранее
(см. § 7.10).
Из-за полярности связей О–Н и уголковой формы
молекула воды представляет собой электрический
диполь.
| Электрический диполь – частица (или тело), несущая равные по модулю положительный и отрицательный заряды, не совпадающие в пространстве. |
Для характеристики полярности
электрического диполя используется физическая
величина, называемая «электрический момент
электрического диполя» или просто «дипольный
момент»![]() .
.
| Электрический момент электрического диполя (дипольный момент) – произведение положительного заряда диполя на вектор расстояния между заряженными концами диполя. |
В химии дипольный момент измеряют в
дебаях: 1 Д = 3,34.10–30 Кл.м
| Полярная молекула – молекула, являющаяся электрическим диполем. |
В молекуле воды – две полярные
ковалентные связи, то есть два электрических
диполя, каждый из которых обладает своим
дипольным моментом (![]() и
и ![]() и
и ). Общий дипольный момент
молекулы равен векторной сумме этих двух
моментов (рис. 10.5):
![]() (Н2О) =
(Н2О) = ![]() (Н2О) =
(Н2О) = ,
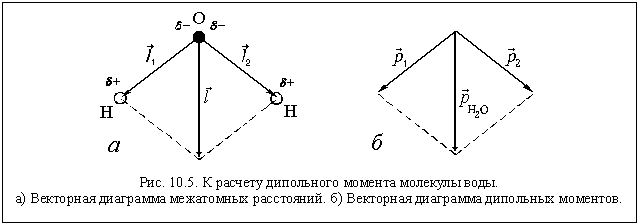
где q1 и q2 –
частичные заряды (![]() ) на атомах
) на атомах
водорода, а ![]() и
и ![]() и
и – межатомные расстояния О
– Н в молекуле. Так как q1 = q2 = q,
а ![]() , то
, то
![]()
Экспериментально определенные
дипольные моменты молекулы воды и некоторых
других молекул приведены в таблице.
Таблица 30. Дипольные
моменты некоторых полярных молекул
Молекула | р , Д | Молекула | р , Д | Молекула | р , Д |
Н2О | 1,86 | HF | 1,91 | SO2 | 1,67 |
H2S | 0,93 | HCl | 1,08 | NH3 | 1,46 |
H2Se | 0,24 | HBr | 0,79 | O3 | 0,53 |
Зная дипольные моменты, можно
рассчитать частичные заряды на атомах. Так
частичный заряд на атоме водорода равен 0,33 е,
а частичный заряд на атоме кислорода равен –0,66 е.
Учитывая дипольный характер молекулы
воды, ее часто схематически изображают следующим
образом: ![]()
Чистая вода – бесцветная жидкость без вкуса и
запаха. Некоторые основные физические
характеристики воды приведены в таблице.
Таблица 31. Некоторые
физические характеристики воды
Физические величины | Значения |
Молярная масса | 18 г/моль |
Молярный объем при 4 °С | 18 мл |
| Температура плавления | 0 ° С |
| Температура кипения | 100 ° С |
| Молярная теплота плавления | 6,01 кДж/моль |
| Молярная теплота парообразования | 40,7 кДж/моль |
| Плотность при 4 °С | 1 г/мл |
Большие значения молярных теплот
плавления и парообразования (на порядок больше,
чем у водорода и кислорода) свидетельствуют о
том, что молекулы воды, как в твердом, так и в
жидком веществе, довольно прочно связаны между
собой. Эти связи называют «водородными
связями».
![]() ЭЛЕКТРИЧЕСКИЙ
ЭЛЕКТРИЧЕСКИЙ
ДИПОЛЬ, ДИПОЛЬНЫЙ МОМЕНТ, ПОЛЯРНОСТЬ СВЯЗИ,
ПОЛЯРНОСТЬ МОЛЕКУЛЫ.![]()
Сколько валентных электронов атома кислорода
принимает участие в образовании связей в
молекуле воды?
2.При перекрывании каких орбиталей образуются
связи между водородом и кислородом в молекуле
воды?
3.Составьте схему образования связей в молекуле
пероксида водорода H2O2. Что вы можете
сказать о пространственном строении этой
молекулы?
4.Межатомные расстояния в молекулах HF, HCl и HBr
равны, соответственно, 0,92; 1,28 и 1,41![]() . Используя таблицу дипольных
. Используя таблицу дипольных
моментов, рассчитайте и сравните между собой
частичные заряды на атомах водорода в этих
молекулах.
5.Межатомные расстояния S – H в молекуле
сероводорода равны 1,34 ![]() ,
,
а угол между связями 92°. Определите значения
частичных зарядов на атомах серы и водорода. Что
вы можете сказать о гибридизации валентных
орбиталей атома серы?
Как вы уже знаете, из-за существенной
разницы в электроотрицательности водорода и
кислорода (2,10 и 3,50) у атома водорода в молекуле
воды возникает большой положительный частичный
заряд (qч = 0,33 е), а у атома
кислорода – еще больший отрицательный частичный
заряд (qч = –0,66 е). Вспомним также,
что у атома кислорода есть две неподеленные пары
электронов на sp3-гибридных АО. Атом
водорода одной молекулы воды притягивается к
атому кислорода другой молекулы, и, кроме того,
полупустая 1s-АО атома водорода частично
акцептирует пару электронов атома кислорода. В
результате этих взаимодействий между молекулами
возникает особый вид межмолекулярных связей
–водородная связь.
В случае воды образование водородной связи может
быть схематически представлено следующим
образом:
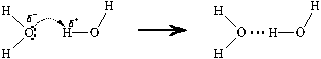
В последней структурной формуле тремя
точками (пунктирный штрих, а не электроны!)
показана водородная связь.
| Водородная связь – межмолекулярная связь, образованная за счет частичного акцептирования неподеленной пары электронов атома не связанным с ним химической связью атомом водорода. |
Водородная связь существует не только
между молекулами воды. Она образуется, если
соблюдаются два условия:
1) в молекуле есть сильно полярная связь Н–Э (Э –
символ атома достаточно электроотрицательного
элемента),
2) в молекуле есть атом Э с большим отрицательным
частичным зарядом и неподеленной парой
электронов.
В качестве элемента Э может быть фтор, кислород и
азот. Существенно слабее водородные связи, если Э
– хлор или сера.
Примеры веществ с водородной связью между
молекулами: фтороводород, твердый или жидкий
аммиак, этиловый спирт и многие другие.
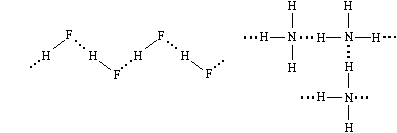
В жидком фтороводороде его молекулы
связаны водородными связями в довольно длинные
цепи, а в жидком и твердом аммиаке образуются
трехмерные сетки.
По прочности водородная связь – промежуточная
между химической связью и остальными видами
межмолекулярных связей. Молярная энергия
водородной связи обычно лежит в пределах от 5 до 50
кДж/моль.
В твердой воде (то есть в кристаллах льда) все
атомы водорода связаны водородными связями с
атомами кислорода, при этом каждый атом
кислорода образует по две водородные связи
(используя обе неподеленные пары электронов).
Такая структура делает лед более » рыхлым»по
сравнению с жидкой водой, где часть водородных
связей оказывается разорванной, и молекулы
получают возможность несколько плотнее »
упаковаться». Эта особенность структуры льда
объясняет, почему, в отличие от большинства
других веществ, вода в твердом состоянии имеет
меньшую плотность, чем в жидком. Максимальной
плотности вода достигает при 4 °С –при этой
температуре рвется достаточно много водородных
связей, а тепловое расширение еще не очень сильно
сказывается на плотности.
Водородные связи имеют очень большое значение в
нашей жизни. Представим себе на минуту, что
водородные связи перестали образовываться. Вот
некоторые последствия:
- вода при комнатной температуре стала бы
газообразной, так как ее температура кипения
понизилась бы до примерно –80 °С; - все водоемы стали бы промерзать со дна, так как
плотность льда была бы больше плотности жидкой
воды; - перестала бы существовать двойная спираль ДНК и
многое другое.
Приведенных примеров достаточно,
чтобы понять, что в этом случае природа на нашей
планете стала бы совсем иной.
![]() ВОДОРОДНАЯ
ВОДОРОДНАЯ
СВЯЗЬ, УСЛОВИЯ ЕЕ ОБРАЗОВАНИЯ. ![]()
Формула этилового спирта СН3–СН2–О–Н.
Между какими атомами разных молекул этого
вещества образуются водородные связи? Составьте
структурные формулы, иллюстрирующие их
образование.
2.Водородные связи существуют не только в
индивидуальных веществах, но и в растворах.
Покажите с помощью структурных формул, как
образуются водородные связи в водном растворе а)
аммиака, б) фтороводорода, в) этанола (этилового
спирта).
Наличие водородных связей в жидкой
воде объясняет еще одно интересное и важное
свойство этого вещества – ее автопротолиз.
Рассмотрим, что происходит с двумя молекулами
воды, связанными водородной связью.
За счет тепловых колебаний атом водорода,
образующий водородную связь, может на мгновение
занять промежуточное положение между атомами
кислорода. Из частицы с таким атомом водорода с
равной вероятностью могут образоваться как
исходные молекулы воды, связанные водородными
связями, так и два иона: гидроксид-ион и ион
оксония:
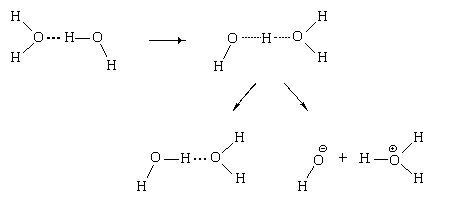
То есть, в воде протекает реакция 2Н2О
= Н3О![]() ОН
ОН![]() ОН
ОН.
Также легко происходит и обратный процесс –
образование двух молекул воды при столкновении
иона оксония с гидроксид-ионом: Н3О![]() ОН
ОН![]() ОН
ОН= 2Н2О.
Обе эти реакции протекают в воде постоянно и с
равной скоростью, следовательно, в воде
существует равновесие: 2Н2О AН3О![]() ОН
ОН![]() ОН
ОН.
Это равновесие называется равновесием
автопротолиза воды.
| Автопротолиз –обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой. |
Прямая реакция этого обратимого
процесса эндотермична, поэтому при нагревании
автопротолиз усиливается, при комнатной же
температуре равновесие сдвинуто влево, то есть
концентрация ионов Н3О![]() и ОН
и ОН![]() и ОН
и ОН
ничтожны. Чему же они равны?
По закону действующих масс
![]()
Но из-за того, что число
прореагировавших молекул воды по сравнению с
общим числом молекул воды незначительно, можно
считать, что концентрация воды при автопротолизе
практически не изменяется, и [H2O]2 = const.
Тогда
[H3O![]() ][OH
][OH![]() ][OH
][OH] = KC· [H2O]2.
Произведение KC· [H2O]2
– величина постоянная. Она называется константой
автопротолиза воды (устаревшее название – ионное
произведение воды) и обозначается ![]() или К(Н2О).
или К(Н2О).
Как и константа равновесия, константа
автопротолиза воды зависит от температуры.
Экспериментально установлено, что при 25 °С
константа автопротолиза воды
![]() = 10–14 моль2/л2.
= 10–14 моль2/л2.
Отсюда следует, что при этих условиях в
чистой воде
с
(Н3О![]() )
)
= с(ОН![]() ) = 10–7
) = 10–7
моль/л.
При увеличении температуры значение
константы автопротолиза воды несколько
возрастает.
Такая низкая концентрация разноименно
заряженных ионов в чистой воде объясняет, почему
эта жидкость, хоть и плохо, но все же проводит
электрический ток.
![]() АВТОПРОТОЛИЗ
АВТОПРОТОЛИЗ
ВОДЫ, КОНСТАНТА АВТОПРОТОЛИЗА (ИОННОЕ
ПРОИЗВЕДЕНИЕ) ВОДЫ.![]()
Ионное произведение жидкого аммиака
(температура кипения –33 °С) равно 2·10–28.
Составьте уравнение автопротолиза аммиака.
Определите концентрацию ионов аммония в чистом
жидком аммиаке. Электропроводность какого из
веществ больше, воды или жидкого аммиака?
![]() 1. Получение водорода и его
1. Получение водорода и его
горение (восстановительные свойства).
2. Получение кислорода и горение веществ в нем
(окислительные свойства).
Цинк — общая характеристика элемента, химические свойства цинка и его соединений »

Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны
3d
10
4s
2
.
В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d
10
является очень устойчивой. В соединениях для цинка характерна степень окисления 2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn O
2
→ 2ZnO.
При поджигании энергично реагирует с серой:
Zn S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn Cl
2
→ ZnCl
2
.
При действии паров фосфора на цинк образуются фосфиды:
Zn 2P → ZnP
2
или 3Zn 2P → Zn
3
P
2
.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn H
2
O → ZnO H
2
.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn 2HCl → ZnCl
2
H
2
;
Zn H
2
SO
4
→ ZnSO
4
H
2
.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn 10HNO
3
→ 4Zn(NO
3
)
2
NH
4
NO
3
3H
2
O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn 2H
2
SO
4
→ ZnSO
4
SO
2
2H
2
O;
Zn 4HNO
3
→ Zn(NO
3
)
2
2NO
2
2H
2
O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn 2NaOH 2H
2
O → Na
2
[Zn(OH)
4
] H
2
при сплавлении образует цинкаты:
Zn 2KOH → K
2
ZnO
2
H
2
.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn 2NH
3
→ Zn
3
N
2
3H
2
;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn 4NH
3
2H
2
O → [Zn(NH
3
)
4
](OH)
2
H
2
.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn CuSO
4
→ Cu ZnSO
4
;
Zn CuO → Cu ZnO.
Оксид цинка (II) ZnO
– белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см
3
, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO C → Zn CO;
ZnO CO → Zn CO
2
;
ZnO H
2
→ Zn H
2
O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO 2HCl → ZnCl
2
H
2
O;
ZnO 2NaOH H
2
O → Na
2
[Zn(OH)
4
].
При сплавлении с оксидами металлов образует цинкаты:
ZnO CoO → CoZnO
2
.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO SiO
2
→ Zn
2
SiO
4
,
ZnO B
2
O
3
→ Zn(BO
2
)
2
.
Гидроксид цинка (II) Zn(OH)
2
– бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см
3
, при температуре выше 125°С разлагается:
Zn(OH)
2
→ ZnO H
2
O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)
2
H
2
SO
4
→ ZnSO
4
2H
2
O;
Zn(OH)
2
2NaOH → Na
2
[Zn(OH)
4
];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)
2
4NH
3
→ [Zn(NH
3
)
4
](OH)
2
.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl
2
2NaOH → Zn(OH)
2
2NaCl.

