- § 27. относительная плотность газов » народна освіта
- Вычисление относительной плотности газа по другому газу
- Вычислите относительную плотность углекислого газа по кислороду и по воздуху
- Найти относительную плотность фтора по кислороду и хлору.
- Относительная плотность по… задачи
- Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
- Таблица. относительные плотности газов по воздуху по возрастанию в т.ч. горючих и опасных плотности газов, химические формулы газов и молекулярные веса. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
§ 27. относительная плотность газов » народна освіта
Вспомните:
• плотность вещества равна отношению массы вещества к его объему;
• единица измерения плотности — кг/м3 (или г/л, г/мл);
Относительная плотность газов
Плотность газов очень мала, поэтому измерять массы газообразных веществ очень неудобно. Намного удобнее сравнивать плотности газов, т. е. определять отношение их плотностей. Эту величину называют относительной плотностью газа В по газу А и обозначают Da(B). Методику экспериментального определения относительной плотности газов разработал французский химик Жан Дюма и с помощью этого метода определял молекулярные массы неизвестных газообразных веществ. Это возможно благодаря тому, что относительная плотность газов равна как отношению плотностей газообразных веществ, так и отношению их молярных масс:
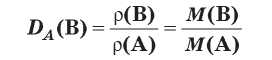
Поскольку относительная плотность является отношением двух величин с одинаковой размерностью, то сама относительная плотность является безразмерной величиной.
Для вычисления относительной плотности газов по определенному газу необходимо вычислить отношение молярных масс газов.
Относительная плотность кислорода по водороду будет равна:
Известный французский химик-органик и государственный деятель, президент французского химического общества. В юности работал аптекарем. С 1823 г. работал в Париже сначала репетитором, а затем — профессором в Сорбонне. В 1832 г. основал собственную лабораторию. Своими работами Дюма оказал влияние на развитие органической химии, открыл новые органические вещества (хлороформ, хлоруксусную кислоту), разработал новые методы органического синтеза. Предложил метод определения относительной плотности паров, с помощью которого определил атомную массу многих химических элементов и молекулярную массу многих соединений.
Относительную плотность кислорода по гелию, азоту или воздуху вычисляют таким же образом. При вычислении относительной плотности по воздуху используют среднюю молярную массу воздуха, равную 29 г/моль.
Относительная плотность показывает, во сколько раз плотность одного газа больше плотности другого. Например, если относительная плотность углекислого газа по водороду равна 22 (DHa (CO2) = 22), это означает, что углекислый газ тяжелее водорода в 22 раза. А если относительная плотность метана по кислороду равна 0,5 (D02(CH4) = 0,5), это означает, что метан легче кислорода в два раза.
Формулируя свой закон, Авогадро писал: «Плотность разных газов является мерой массы их молекул». Рассмотрим два газа — А и В — количеством 1 моль, которые находятся при одинаковых условиях. Плотность газа можно определить как отношение его массы к объему:
Если масса и объем известны для одного моля газа, то в это уравнение можно подставить, соответственно, молярную массу и молярный объем:
Молярные объемы разных газов при одинаковых условиях равны, поэтому плотность газа при заданных условиях прямо пропорциональна его молярной массе. То есть, чем больше масса одной молекулы (одного моля молекул), тем больше масса определенного объема газа — его плотность. А отношение плотностей двух газов будет равно отношению их молярных масс:
Расчеты с использованием относительной плотности газов
Задача 1. Определите, во сколько раз азот тяжелее гелия.

Задача 2. Относительная плотность газообразного простого вещества по воздуху равна 2,45. Вычислите молярную массу этого вещества. Какое это может быть вещество?

Выводы
1. Если взять два образца газообразных веществ одинакового объема при одинаковых условиях, то можно измерить отношение их плотностей и получить относительную плотность этих газов.
2. Относительная плотность газов — безразмерная величина, она показывает, какой из газов тяжелее (имеет большую плотность) и во сколько раз. Она равна отношению молярных масс газов, поэтому позволяет определить молярную массу неизвестного газа.
1. Какой физический смысл имеет относительная плотность газа?
2. Запишите формулу для вычисления относительной плотности неизвестного газа по водороду, гелию и углекислому газу.
3. Чему равна средняя молярная масса воздуха?
4. Для определения относительной плотности любого газа по водороду необходимо молярную массу этого газа: а) умножить на молярную массу водорода; б) разделить на молярную массу водорода; в) сложить с молярной массой водорода.
Задания для усвоения материала
1. Почему для воздуха нельзя использовать понятие «молярная масса», а только «средняя молярная масса»?
2. Во сколько раз кислород тяжелее: а) водорода; б) азота?
3. У какого из газов наименьшая относительная плотность по водороду: азот; кислород; гелий?
4. Определите относительную плотность гелия и неона: а) по водороду; б) по воздуху.
5. Найдите относительную плотность по гелию газов: H2, CH4, N2, O2, SO2.
6. Определите относительную плотность: а) хлора Cl2 по воздуху; б) азота по гелию; в) аммиака NH3 по кислороду; г) пропана C3H8 по хлору; д) углекислого газа CO2 по воздуху; е) аммиака по водороду; ж) сернистого газа SO2 по озону; з) кислорода по азоту; и) метана по хлору.
7. Относительная плотность неизвестного газа по водороду равна 17. Определите молярную массу этого газа. Запишите его химическую формулу.
8. Масса 1 л газа при нормальных условиях равна 1,251 г. Вычислите относительную плотность этого газа по водороду.
9. Относительная плотность неизвестного газа по воздуху равна 1,656. Вычислите массу 1 л этого газа при нормальных условиях. Какой газ это мог бы быть?
10. Почему относительные плотности всех газов по водороду больше 1?
11. Относительная плотность некоторого газа по кислороду равна 2. Чему равна относительная плотность этого газа по водороду?
12. Какой газ тяжелее по кислороду в 1,5 раза и образован одним элементом? тяжелее в 2 раза и образован двумя элементами?
13. У соединений Карбона и Нитрогена с Оксигеном при одинаковых условиях одинаковая плотность. Определите формулы этих соединений.
14*. Предложите способ экспериментального измерения относительной плотности двух газов.
Проверьте свои знания по теме «Количество вещества. Расчеты по химическим формулам».
Это материал учебника Химия 8 класс Григорович
Вычисление относительной плотности газа по другому газу
Решение
1. Найдем относительные молекулярные массы газов, о которых говорится в условии задачи и запишем их в дано.
2. Относительная плотность газа X по газу Y равна отношению относительной молекулярной массы X к относительной молекулярной массе Y.
Вычислим это отношение:
DH2(О2) = 32 / 2 = 16
Dвозд(О2) = 32 / 29 = 1,103
3. Запишем ответ
Ответ: DH2(О2) = 16;
Dвозд(О2) = 1,103
Вычислите относительную плотность углекислого газа по кислороду и по воздуху
D = 12 16 16/16=44/16=2.25
D (по воздуху) = 44/29=1.5
Найти относительную плотность фтора по кислороду и хлору.
Относительная плотность фтора по хлору: M (F) * M (Cl2) = 19 * 70 = 1330
Относительная плотность по… задачи
24-Фев-2022 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительнаяплотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy O2 = xCO2 y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) Mr(H)
12n 2n=42
n=3
Наше вещество — C3H6 — пропен
Таблица. относительные плотности газов по воздуху по возрастанию в т.ч. горючих и опасных плотности газов, химические формулы газов и молекулярные веса. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
1)NTP — Нормальная температура и давление (Normal Temperature and Pressure) — 20oC (293.15 K, 68oF) при 1 атм ( 101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 мм.рт.ст)
2)STP — Стандартная температура и давление (Standard Temperature and Pressure) — 0oC (273.15 K, 32oF) при 1 атм (101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 torr=мм.рт.ст)

