- Характеристика кислорода как химического элемента
- Химические свойства кислорода
- Закрепление изученного материала
- Все тесты
- Горение и виды горючих веществ
- Кислород и воздух
- Круговорот кислорода в природе
- Нахождение в природе
- Оксиды
- Получение кислорода в лаборатории
- Применение кислорода
- Применение кислорода в различных отраслях
- Распространенность оксигена в природе
- Реакция с серой
- Свойства и применение кислорода
- Строение и физические свойства простых веществ
- Физические свойства
- Химические свойства
- Элемент в окружающей среде
Характеристика кислорода как химического элемента
(слайды 5-8)
- Химический знак – О,
- латинское название – Оxygenium,
- Аr(O) = 16;
- валентность – II,
- степень окисления в соединениях: – 2;
- содержание в земной коре – I место – более 49% ,
- самые распространённые оксиды: оксид водорода (вода) – H2O, оксид кремния – SiO2 , оксид алюминия – Al2O3 .
Демонстрация минералов:
- кварц – SiO2– эту устойчивую при низких температурах модификацию обычно называют просто кварцем; происхождение названия остается неизвестным. Кварц является одним из наиболее распространенных в земной коре.
- аметист –SiO2
- горный хрусталь – SiO2
- агат – SiO2
- рубин – Аl2О3 – одна из разновидностей корунда
- изумруд – Be3Al2[Si6O18] – одна из разновидностей берилла. Химический состав:SiO2 66,9%.Al2O3 19,0 %, BeO 14,1%, в виде примесей содержатся Na2O, K2O, Li2O, иногда Rb2O, Cs2O.
- александрит – BeAl2O4 – разновидность хризоберилла «хризос» по гречески – золото. Химический состав. Al2O380,2 %. BeO 19,8 %, Всегда присутствуют примеси: FeO (3,5-6%), иногда TiO2 (до 3%) и Cr2O3 (до 0,4%), с чем связана окраска александрита. Цветалександрита изумрудно-зеленый, а при электрическом освещении – фиолетово-красный.
Химические свойства кислорода
( слайд 16)
- облегчает дыхание;
- поддерживает горение;
- повышает температуру пламени;
- ускоряет химические реакции;
Где и как человек использует эти свойства кислорода?
- взаимодействует с металлами (слайды 17-19)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества. Что такое оксиды?
Оксиды – бинарные соединения металлов и неметаллов с кислородом. На первом месте в формуле оксида пишут химический знак элемента, на втором – химический знак кислорода.
4Fe 3O2=2Fe2O3
2Fe O2 =2FeO
3Fe 2O2 =Fe3O4
2Mg O2 = 2MgO
Fe2O3 – оксид железа (III), FeO — оксид железа (II), (Fe2O3 и FeO) – Fe3O4 – железная окалина, MgO – оксид магния.
- взаимодействует с неметаллами; (слайды 20-21)
Записать уравнения реакций, расставить коэффициенты, назвать образующиеся вещества
4P 5O2 = 2 P2O5
2H2 O2 = 2H2O
- взаимодействует со сложными веществами, (слайд 22) демонстрационный опыт: «несгораемый платок»:
C2H6O 3O2 = 2CO2 3H2O
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
Закрепление изученного материала
(слайды 23-25)
(химический тест):
Кто назвал кислород «огненным», а азот « испорченным» воздухом?
А) Лавуазье, В) Пристли, С) Шееле.Какие вещества образует химический элемент кислород?
А) только простые вещества, В) простые и сложные вещества, С) только сложные вещества.Как называются бинарные соединения, молекулы которых образованы атомами какого-либо химического элемента и кислорода:
А) сульфиды, В) хлориды, С) оксиды.В 1774 году один учёный после проведённого эксперимента написал: «Но что поразило меня больше всего – это то, что свеча горела в этом воздухе удивительно блестящим пламенем…» Это был:
А) Лавуазье, В) Пристли, С) Шееле.Название «Оxygenium» предложил:
А) Лавуазье, В) Пристли, С) Шееле.Кислород в воде:
А) хорошо растворим, В)малорастворим, С)вообще не растворяется.При вдувании кислорода в пламя температура пламени:
А) не изменяется, В) понижается, С) повышается.Оксид железа (III) имеет формулу:
А) Fe2O3, В) FeO, С) FeO2.В каком уравнении коэффициенты расставлены правильно:
А) 2P O2 = P2O5; В) 2P 5O2 = P2O5, С) 4P 5O2 = 2P2O5В каком ряду все три формулы написаны правильно:
А) P2O5, Al2O, H2O; В) MgO, Al2O3 , CO2; С) CO2, FeO2, P2O5
Проверка диктанта. (слайд 26-27)
| Номер вопроса | Буква ответа | Правильно Неправильно — |
| 1 | С | |
| 2 | В | |
| 3 | С | |
| 4 | В | |
| 5 | А | |
| 6 | В | |
| 7 | С | |
| 8 | А | |
| 9 | С | |
| 10 | В |
Итого:Оценка:
Критерии оценки:
- «5» – 10-9 правильных ответов
- «4» – 8-7 правильных ответов
- «3» – 6-5 правильных ответов
Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Горение и виды горючих веществ
Реакция, протекающая с участием кислорода и сопровождающаяся выделением большого количества света и тепла, называется горением.
В чистом кислороде, по сравнению с воздухом, вещества горят во много раз быстрее (рис. 22). В обоих случаях выделяется равное количество теплоты, но в кислороде этот процесс протекает быстрее и выделяющаяся теплота не расходуется, как в случае с воздухом, на нагревание азота.
Температура при горении в чистом кислороде выше, чем в воздухе. Опуская тлеющую лучину в сосуд с чистым кислородом, можно увидеть, как она сразу загорается. А в воздухе тлеющая лучина может вскоре и потухнуть. Если эта лучина зажжена, то она продолжает гореть на воздухе, потому что выделяющееся при горении тепло требует большей температуры, чем температура воспламенения лучины.
Рис. 22. Горение магния в чистом кислороде
Рис. 23. Тушение пламени
Температура, необходимая для поджигания вещества на воздухе, называегся температурой воспламенения.
Значит, для обеспечения горения веществ, нужно нагревать их до температуры воспламенения и подавать кислород в достаточном количестве.
Для того чтобы потушить пламя, необходимо ликвидировать факторы, обеспечивающие его появление, т.е. охладить вещество до температуры ниже температуры возгорания и прекратить подачу кислорода (рис. 23).
Чтобы потушить горящую вещь, сначала следует понизить температуру, используя невоспламеняющиеся средства, затем накрыть источник возгорания одеялом или брезентом, чтобы прекратить подачу воздуха.
В непредвиденных ситуациях для тушения пожара необходимо использовать специальные средства, а если их нет, то применять указанный выше способ.
Вообще процесс горения имеет огромное значение в промышленности и в повседневной жизни.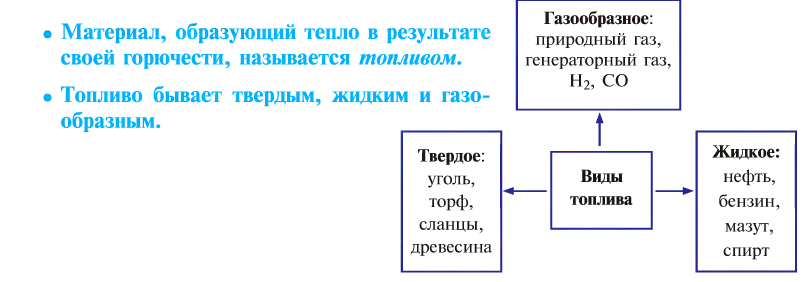
От твердого топлива остается минеральный осадок — пепел. Жидкое и газообразное топливо такого недостатка не имеет. Но любое топливо независимо от места добычи, промышленного объема, экономической эффективности имеет только свое место применения, и возможности по его взаимозамещению ограничены.
Неправильное сжигание топлива приносит вред народному хозяйству.
Топливо позволяет спокойно переносить холод, варить пищу, которая не употребляется в сыром виде, получать металлы из руд путем их выплавки, обеспечивать движение транспорта, получать другие виды энергии.
Кислород и воздух
Атмосферный воздух — это природная смесь многих газов. Помимо азота и кислорода, являющихся основной составной частью воздуха, в его состав входят в небольшом количестве инертные газы, углекислый газ, пары воды и водород (табл. 6). Кроме них, в воздухе встречаются, в зависимости от внешних условий, пыль, некоторые случайные примеси.
Один литр воздуха при 20°С и нормальном атмосферном давлении весит 1,293 г. При —192°С и давлении 101,33 кПа воздух превращается в бесцветную прозрачную жидкость. Из жидкого воздуха выделяются азот, кислород и инертные газы.
Углекислый газ и водяные пары воздуха выполняют функцию защитного экрана, препятствующего распространению во Вселенной тепла Земли, а озон не пропускает губительные для жизни на Земле коротковолновые ультрафиолетовые лучи, исходящие от Солнца и звезд.
К случайным примесям воздуха относятся сероводород и аммиак, образующиеся при гниении органических остатков, выбрасываемый промышленными предприятиями сернистый газ, образующиеся в результате электрических разрядов оксиды азота, которые периодически выводятся из состава воздуха дождем и снегом.
Воздух является необходимой составной частью жизни на Земле. Сохранение его чистоты имеет огромное значение для человечества. Для защиты воздуха от техногенных загрязнений необходимо использовать новые безотходные технологии, предупреждать уменьшение биомассы Земли, обеспечивать нормальную работу естественных механизмов очистки воздуха.
Круговорот кислорода в природе
О том, что кислород в большом количестве находится в литосфере, гидросфере и атмосфере, мы говорили в предыдущих разделах учебника (табл. 5).
Круговорот кислорода на Земле несущественно отличается от его круговорота в атмосфере, литосфере и гидросфере. На Земле круговорот в основном протекает в процессе фотосинтеза и дыхания. В процессе фотосинтеза углекислый газ, взаимодействуя с водой, образует органические вещества и кислород. В результате
При дыхании, разложении умерших организмов и горении кислород из биосферы возвращается обратно в гидросферу и атмосферу:
В биомассе Земли кислород полностью меняется каждые 20—30 лет. В литосферу кислород переходит из атмосферы в виде
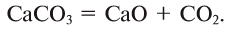
Эта реакция наблюдается в основном в зонах повышенной вулканической деятельности, тем самым постепенно обновляя углекислый газ в атмосфере.
Нахождение в природе

Накопление O
2
в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад, в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы).
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими.
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время.
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад.
Оксиды
Продуктами всех реакций, рассмотренных в параграфе, являются бинарные соединения элементов с Оксигеном.
Соединение, образованное двумя элементами, одним из которых является Оксиген, называют оксидом.
Общая формула оксидов — 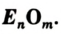
Таблица 4Формулы и названия некоторых оксидов
Выводы:
Кислород — химически активное вещество. Он взаимодействует с большинством простых веществ, а также со сложными веществами. Продуктами таких реакций являются соединения элементов с Оксигеном — оксиды.
Реакции, при которых из нескольких веществ образуется одно, называют реакциями соединения.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган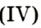
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 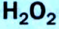 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган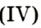
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 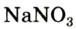

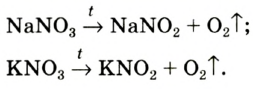
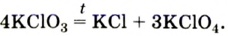
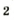 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: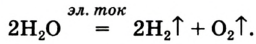
Применение кислорода
Молекулярный диоксид O2 необходим для клеточного дыхания у всех аэробных организмов. Его реакционноспособные виды, такие как супероксид-ион (O2-) и пероксид водорода (H2O2), являются опасными побочными продуктами использования кислорода в организмах.
Однако части иммунной системы высших организмов используют реактивный пероксид, супероксид и синглетный кислород для уничтожения вторгающихся микробов. Реактивные виды также играют важную роль в гиперчувствительной реакции растений на воздействие патогенных микроорганизмов.
В состоянии покоя взрослый человек вдыхает от 1,8 до 2,4 г кислорода в минуту. Это составляет более 6 миллиардов тонн элемента, вдыхаемого человечеством в год. Сферы использования включают в себя следующие:
- Люди, у которых есть проблемы с дыханием, используют кислородные маски и резервуары, чтобы получить необходимый им кислород.
- Он используется в ракетном топливе, сочетается с водородом в двигателе. Когда водород и кислород объединяются, они выделяют очень большое количество энергии. Энергия используется для запуска ракеты в космос.
- На производство металла приходится самый большой процент использования О2. Например, элемент используется для сжигания углерода и других примесей, которые содержатся в железе для производства стали. Небольшое количество этих примесей может быть полезным для стали, но слишком большое делает его ломким и непригодным для использования. Углерод и другие примеси сжигаются при производстве стали путём продувки О2 через расплавленное железо.
- Используется при производстве таких металлов, как медь, свинец и цинк. Эти металлы встречаются в земле в форме сульфидов, таких как сульфид меди (CuS), сульфид свинца (PbS) и сульфид цинка (ZnS). Первым шагом в извлечении этих металлов является превращение их в оксиды. Затем оксиды нагревают с углеродом, чтобы получить чистые металлы.
- Применяется в химической промышленности в качестве исходного материала для производства некоторых очень важных соединений. Иногда этапы перехода от кислорода к конечному соединению являются длительными. Например, газообразный этилен (C2H4) может быть обработан кислородом с образованием этиленоксида (CH2CH2O). Около 60% полученного этиленоксида превращается в этиленгликоль (CH2CH2 (OH)2). Этиленгликоль используется в качестве антифриза и служит отправной точкой при производстве полиэфирных волокон, плёнки, пластиковых контейнеров, пакетов и упаковочных материалов
- Используется в оксиацетиленовой сварке, в качестве окислителя для ракетного топлива, а также в производстве метанола и этиленоксида.
- Растения и животные используют его для дыхания.
- Чистый кислород часто используется для облегчения дыхания у пациентов с респираторными заболеваниями.
Кислород и его соединения играют ключевую роль во многих важных процессах жизни и промышленности
Применение кислорода в различных отраслях
Кислород используют в различных отраслях, причем в больших количествах (схема 9). В металлургии он ускоряет процесс выплавки стали и улучшает ее качество. Этот газ необходим в производстве многих химических соединений, используется в специальных устройствах для резки и сварки металлов (водородно-кислородные, ацетиленово-кислородные горелки).
Баллоны, наполненные кислородом (рис. 66) или его смесью с инертным газом гелием, используют космонавты, военные летчики, пожарники, водолазы. Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания. С помощью сжиженного кислорода создают необходимые условия для сгорания горючего в космических ракетах.

Схема 9.Применение кислорода
Широко используется и кислород, входящий в состав воздуха. При его участии сгорает топливо на теплоэлектростанциях, горючее в двигателях автомобилей, обжигают металлические руды на заводах цветной металлургии.
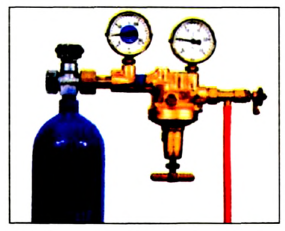
Рис. 66. Баллон с кислородомВо время сжигания топлива и горючего образуется и попадает в воздух значительное количество угарного (СО) и сернистого 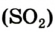
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 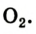
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 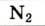 | 78,09 | 75,51 |
| Кислород | 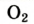 | 20,95 | 23,15 |
| Аргон | 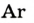 | 0,93 | 1,28 |
| углекислый газ | 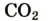 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 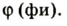
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 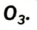 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 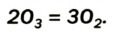
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Реакция с серой
Это химическое превращение осуществляет каждый, когда зажигает спичку; сера входит в состав ее головки. В лаборатории реакцию серы с кислородом проводят в вытяжном шкафу. Небольшое количество серы (светло-желтый порошок или кристаллы) нагревают в железной ложке. Вещество сначала плавится, потом загорается в результате взаимодействия с кислородом воздуха и горит едва заметным синим пламенем (рис. 56, б). Появляется резкий запах продукта реакции — сернистого газа (этот запах мы ощущаем в момент загорания спички). Химическая формула сернистого газа — 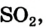
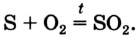
Рис. 56. Сера (а) и ее горение на воздухе (б) и в кислороде (в)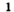
Рис. 57.Красный фосфор (а) и его горение на воздухе (б) и в кислороде (в)
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 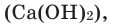
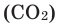
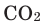
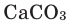
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (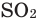
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (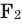
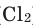
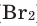
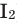
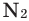
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (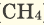
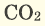
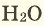
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 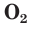 озона
озона 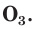
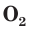
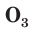
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 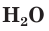
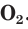
Физические свойства
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп. кипения −182,98 °C) это бледно-голубая жидкость.
Твердый кислород (темп. плавления −218,79 °C) — синие кристаллы. Известны шесть кристаллических фаз, из которых три существуют при давлении в 1 атм.:
α-О2 — существует при температуре ниже 23,65 К; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° .β-О2 — существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
Ещё три фазы образуются при высоких давлениях:δ-О2 интервал температур до 300 К и давление 6-10 ГПа, оранжевые кристаллы;ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно красного до чёрного, моноклинная сингония;
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li O2 → 2Li2O
- 2Sr O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2 → 12CO2 6H2O
- CH3CH2OH 3O2 → 2CO2 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2 → CH3COOH H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2 → Na2O2
- 2BaO O2 → 2BaO2
- H2 O2 → H2O2
- Na2O2 O2 → 2NaO2
- K O2 → KO2
- 3KOH 3O3 → 2KO3 KOH ∗ H2O 2O2↑
- PtF6 O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.
Элемент хорошо растворяется в воде, что делает возможной жизнь в реках, озёрах и океанах. Вода в этих водоёмах должна регулярно снабжаться кислородом, поскольку, когда запасы О2 в ней истощаются, она больше не может поддерживать рыбу и другие водные организмы.
Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).

