- Углерод — основа органических соединений
- Диоксид углерода (углекислый газ)
- Загрязнение воздуха внутри помещений
- Источники
- Медицина
- Монооксид углерода (угарный газ)
- Органические вещества неприродного происхождения
- Органические вещества природного происхождения
- Понятие об органических веществах
- Строение и физические свойства простых веществ
- Угольная кислота и карбонаты
- Химические свойства
Углерод — основа органических соединений
Вы не однажды наблюдали, как из выхлопной трубы неисправного автомобиля, работающего на дизельном топливе, вырываются клубы густого черного дыма (рис. 100). Он медленно поднимается вверх и смешивается с воздухом, загрязняя его. Откуда же берется этот дым? Почему он черный, хотя жидкое дизельное топливо, которым заправляется машина, прозрачное и почти
бесцветное? Дело вот в чем. В состав этого топлива входят различные соединения углерода с водородом, так называемые углеводороды, например 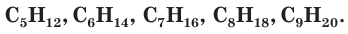
Если же двигатель неисправен, то некоторая часть углеводородов сгорает не полностью: кислород из воздуха связывается лишь с атомами Н, а оставшиеся атомы углерода образуют простое вещество углерод, например:
Углерод в виде мельчайших частичек черного цвета с силой выбрасывается выхлопными газами из двигателя наружу, образуя облако черного дыма.
Образование углерода из органических веществ можно наблюдать и в школьной лаборатории. Проведем эксперимент. В пробирку насыплем немного белого порошка глюкозы 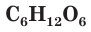
Углерод образуется и при сильном нагревании других органических веществ и материалов на их основе. О чем же свидетельствуют выделение черного дыма из выхлопных труб автомобилей и почернение глюкозы при нагревании? Конечно, о том, что в состав молекул органических веществ
входят атомы углерода. Доказательством этого является и тот факт, что при полном сгорании органических веществ в кислороде наряду с другими веществами всегда образуется углекислый газ 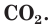
Атомы углерода, связанные с атомами других элементов, присутствуют в молекулах всех без исключения органических веществ. По этой причине раздел химии, изучающий эти вещества, — органическую химию — называют химией соединений углерода.
Почему же из 118 химических элементов именно углерод является основой всех органических веществ? Ответ на этот вопрос кроется в особенностях строения атома данного элемента.
Поскольку углерод — химический элемент с атомным номером 6, расположенный во втором периоде периодической системы, в его атоме 6 электронов распределены на двух электронных слоях. Так как углерод является элементом IVA-группы, на внешнем электронном слое его атома находится 4 электрона:
Электронное строение атома обусловливает следующие его особенности.
1. Из-за наличия на внешнем электронном слое атома углерода 4 электронов он не обладает ярко выраженной способностью отдавать или принимать электроны и превращаться таким образом в ионы. Поэтому атомы углерода образуют не ионные, а только ковалентные связи, характерные для молекул органических веществ.
2. Из-за того, что радиус атома углерода невелик, образуемые им ковалентные связи являются очень прочными. Атомы углерода образуют такие ковалентные связи с атомами большинства известных химических элементов.
3. Так как на внешнем электронном слое атома углерода имеется 4 электрона, он проявляет валентность, равную IV, — образует с другими атомами четыре ковалентные связи. Это могут быть четыре одинарные связи; две одинарные и одна двойная; две двойные; одна одинарная и одна тройная связи:
Вот примеры молекул органических веществ с такими связями:
4. Атомы углерода, в отличие от атомов других элементов, способны соединяться в цепочки любой длины. Они могут быть неразветвленными, разветвленными и замкнутыми в циклы (рис. 102):
А это примеры молекул органических веществ с такими цепочками атомов углерода (рис. 103):
Таким образом, атомы только одного химического элемента — углерода — могут соединяться как с атомами других элементов, так и между собой, образуя цепочки или циклы, в которых атомы углерода связаны с другими атомами одинарными, двойными или тройными связями.
- Атомы углерода образуют ковалентные связи, характерные для молекул органических веществ.
- Атомы углерода образуют химические связи с атомами большинства известных элементов.
- Атомы углерода соединяются с другими атомами четырьмя ковалентными связями (одинарными или кратными).
- Атомы углерода способны соединяться между собой в цепочки любой длины, которые могут быть неразветвленными, разветвленными и замкнутыми в циклы.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 2HCl → CaCl2 H2O CO2
NaHCO3 HBr → NaBr H2O CO2
2AlCl3 3K2CO3 3H2O → 2Al(OH)3↓ CO2↑ 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO CO2
2NaHCO3 → Na2CO3 H2O CO2
- При сжигании всех видов топлив:
СxHy O2 = H2O CO2
- При
спиртовом брожении глюкозы под действием ферментов:
С6H12O6 → 2CO2 2C2H5OH
Химические свойства углекислого газа
Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
Ca(OH)2 CO2 → CaCO3 H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
Na2O CO2 → 2Na2CO3
KOH CO2 → KHCO3
2KOH CO2 → K2CO3 H2O
- С карбонатами, с образованиемгидрокарбонатов:
Na2CO3 CO2 H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 CO2 H2O = H2SiO3 Na2CO3
C6H5OK CO2 H2O → C6H5OH KHCO3
- С
некоторыми восстановителями:
CO2 3H2 → 2CН3OН H2O
CO2 C → 2CO
2Мg
CO2→C
2MgO
Внимание! Магнийгорит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 mH2O = Cn(H2O)m nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 2Na2O2 → 2Na2CO3 O2
- Синтез карбамида (мочевины):
CO2 2NH3 = CO(NH2)2 H2O
- Получение питьевой соды по методу Сольвэ:
NaCl CO2 NH3 H2O= NaHCO3 NH4Cl
Загрязнение воздуха внутри помещений
 12)
12)
Источники
Окись углерода образуется в ходе частичного окисления углеродсодержащих соединений; она образуется, когда не хватает кислорода для образования двуокиси углерода (CO2), например, при работе с плитой или двигателем внутреннего сгорания, в замкнутом пространстве.
В присутствии кислорода, включая его концентрации в атмосфере, монооксид углерода горит голубым пламенем, производя углекислый газ. Каменноугольный газ, который широко использовался до 1960-х годов для внутреннего освещения, приготовления пищи и нагревания, содержал окись углерода как значительное топливное составляющее.
Некоторые процессы в современной технологии, такие как выплавка чугуна, до сих пор производят окись углерода в качестве побочного продукта.
Во всем мире наиболее крупными источниками окиси углерода являются естественные источники, из-за фотохимических реакций в тропосфере, которые генерируют около 5 × 1012 кг окиси углерода в год.
Другие природные источники СО включают вулканы, лесные пожары и другие формы сгорания.
В биологии, окись углерода естественным образом вырабатывается под действием гемоксигеназы 1 и 2 на гем от распада гемоглобина. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не вдыхают окись углерода.
После первого доклада о том, что окись углерода является нормальным нейромедиатором в 1993 году, 3) а также одним из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других – оксид азота и сероводород), окись углерода получила большое внимание ученых в качестве биологического регулятора.
Во многих тканях, все три газа, действуют как противовоспалительные средства, вазодилататоры и промоторы неоваскулярного роста. Продолжаются клинические испытания небольших количеств окиси углерода в качестве лекарственного средства. Тем не менее, чрезмерное количества монооксида углерода вызывает отравление угарным газом.
Медицина
В биологии, окись углерода естественным образом вырабатывается под действием гемоксигеназы 1 и 2 на гем от распада гемоглобина. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не вдыхают окись углерода.
После первого доклада о том, что окись углерода является нормальным нейромедиатором в 1993 году, а также одним из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других – оксид азота и сероводород), окись углерода получила большое клиническое внимание как биологический регулятор.
Во многих тканях, все три газа, как известно, действуют как противовоспалительные средства, вазодилататоры и усилители неоваскулярного роста. Тем не менее, эти вопросы являются сложными, поскольку неоваскулярный рост не всегда полезен, так как он играет определенную роль в росте опухоли, а также в развитии влажной макулодистрофии, заболевания, риск которого увеличивается от 4 до 6 раз при курении (главный источник окиси углерода в крови, в несколько раз больше, чем естественное производство).
Существует теория, что в некоторых синапсах нервных клеток, когда откладываются долгосрочные воспоминания, принимающая клетка вырабатывает окись углерода, которая обратно передается к передающей камере, заставляющей её передаваться более легко в будущем.
Некоторые такие нервные клетки, как было показано, содержат гуанилатциклазу, фермент, который активируется окисью углерода.
Во многих лабораториях по всему миру были проведены исследования с участием монооксида углерода относительно его противовоспалительных и цитопротекторных свойств.
Эти свойства могут быть использованы для предотвращения развития ряда патологических состояний, в том числе, ишемического реперфузионного повреждения, отторжения трансплантата, атеросклероза, тяжелого сепсиса, тяжелой малярии или аутоиммунных заболеваний.
Были проведены клинические испытания с участием людей, однако их результаты еще не были выпущены.
Монооксид углерода (угарный газ)
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
C O2 → CO2
CO2 C → 2CO
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
СН4 Н2O → СО 3Н2
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
СН4 CO2 → 2СО 2Н2
- горение углерода в недостатке кислорода (неполное окисление углерода):
2C O2 → 2CO
- неполное окислениеметана:
2СН4 О2 → 2СО 4Н2
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
НСООН → CO H2O
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
H2C2O4 → CO CO2 H2O
Химические свойства угарного газа
СО – несолеобразующий оксид
- Формально СО
можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при
дегидратации муравьиной кислоты:
НСООН → CO H2O
А также
образование формиата натрия в реакции с гидроксидом натрия при высоком
давлении:
CO NaOH → HCOONa
Однако при обычных условиях он не вступает в реакции с
водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов.
Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
2СO O2→ 2CO2
- Окисляется
хлором в присутствии катализатора или под
действием света с образованием ядовитого газа фосгена:
CO Cl2 → COCl2
- Окисляется другими сильными окислителями до углекислого газа или
карбонатов:
CO Na2O2→ Na2CO3
- Восстанавливает
металлы из оксидов (при Т~300 — 1500ºС):
СО CuO → Cu CO2
СО NiO → Ni CO2
4CO Fe3O4→ 3Fe 4CO2
- Восстановление
водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
СО Н2О= CO2 Н2
- Восстановление некоторых благородных металлов из солей:
СО PdCl2 Н2О→ Pd CO2 2HCl
СО 2Н2 → СН3ОН
СО 3Н2 → СН4
Н2О
nСО (2n 1)Н2 → СnН2n 2 nН2О
- Образование
карбонилов металлов при
нагревании:
4СO Ni = [Ni(СO)4]
4СO Fe = [Fe(СO)5]
- Образование
карбоксигемоглобина при
связывании угарного газа с гемоглобином крови подобно кислороду:
HbO2 CO = HbCO O2
Этим свойством СО и объясняется его
высокая токсичность для организма человека.
Органические вещества неприродного происхождения
Подавляющее большинство органических веществ — это соединения неприродного происхождения, они получены искусственно и входят в состав различных материалов, обладающих ценными свойствами.
Несомненно, первое место по своей значимости занимают материалы на основе различных полимеров — веществ с очень длинными молекулами, в которых одна и та же группа атомов повторяется много раз. Эти вещества обладают свойствами, позволяющими изготавливать из них различные пластмассы (пластики), синтетические волокна и каучуки.
Пластмассы находят широчайшее практическое применение и многие из них вам хорошо знакомы. Так, например, полиэтилен используется для производства пленки для теплиц и различных пакетов, мусорных мешков. Из полиэтилена изготавливают также канализационные и дренажные трубы, корпуса лодок и вездеходов, различные емкости.
Полипропилен обладает большей механической прочностью, чем полиэтилен. Из него изготавливают канаты, тросы, веревки, автомобильные бамперы, водопроводные трубы, корпуса компьютеров, игрушки, пластиковые стаканчики. Вы не раз видели белые полипропиленовые мешки для сахара, круп и других продуктов.
Поливинилхлорид (ПВХ) используется для производства оконных и дверных профилей, грязезащитных ковриков, линолеума, жалюзи, для электроизоляции проводов и кабелей. Из этого пластика изготавливают также пленки для натяжных потолков и моющихся обоев, клеенку, изоленту.
Полимерные материалы химически высокоустойчивы и в природных условиях разлагаются очень медленно. К сожалению, производство таких материалов с каждым годом увеличивается, и их отходы (пленка, бутылки и т. п.) все больше засоряют нашу планету, в частности мировой океан. Поэтому становится все более насущной проблема раздельного сбора и переработки мусора (особенно полимерного).
Известно много полимеров, которые используются преимущественно в производстве синтетических волокон. Это, например, лавсан, капрон, нейлон и нитрон. Из волокон лавсана изготавливают немнущуюся ткань, их используют в качестве добавок при производстве шерстяных тканей.
Значительная часть производимого лавсана идет на изготовление «вездесущих» пластиковых бутылок для воды и напитков. Волокна капрона устойчивы к истиранию, не впитывают влагу. Они используются в производстве канатов, рыболовных сетей, лески, гитарных струн, кордной ткани для автомобильных шин.
Из капроновых нитей изготавливают прочные и легкие ткани. Капрон используется и в качестве пластмассы для изготовления деталей машин и механизмов — зубчатых колес, втулок, подшипников. Из волокон нейлона изготавливают тросы, ткани для рюкзаков, зонтов, спортивной одежды и снаряжения.
Огромное значение в современном мире имеют синтетические каучуки. Из них изготавливают резину для автомобильных, авиационных и велосипедных шин (рис. 107). В ракетной технике синтетические каучуки используются в качестве основы при изготовлении твердого ракетного топлива.
Кроме синтетических полимеров, практическое применение находят и другие органические вещества неприродного происхождения. Они являются основой топлива для автомобилей, входят в состав растворителей, лаков, красок и эмалей, лекарств и взрывчатых веществ, красителей, моющих средств, удобрений и ядохимикатов, парфюмерной продукции, пищевых добавок и многих других материалов, которые прочно вошли в нашу жизнь.
Органические вещества природного происхождения
Во всех процессах, протекающих в живых организмах, участвуют органические вещества природного происхождения. Важнейшими из них являются белки, жиры, углеводы, витамины, различные кислоты, ферменты и гормоны.
Белки — жизненно важные вещества, молекулы которых представляют собой цепочки из многих тысяч атомов углерода, водорода, кислорода, азота и серы. Кроме знакомого нам с детства белка куриного яйца, известно несколько миллионов других белков.
Они содержатся в телах всех живых организмов и выполняют множество функций. Например, белки входят в состав мышц, костей, крови, образуют хрящи, кожу, волосы, ногти, рога, копыта, перья, чешую (рис. 104). Белки участвуют в процессах сокращения мышц, защищают организм от инфекций.
В организмах растений белки в наибольшем количестве содержатся в семенах, где они откладываются в запас. Особенно богаты белком семена гороха, фасоли, сои, зерна пшеницы.
Белки являются важным источником энергии для человека и животных, они входят в состав продуктов питания.
Некоторые природные яды имеют белковую природу и оказывают на человека отравляющее действие. Это белки яда змей, некоторых пауков, пчел, ос, а также белки ядовитых грибов, например бледных поганок и мухоморов.
Наряду с белками важнейшие жизненные функции выполняют нуклеиновые кислоты. Их молекулы, состоящие из огромного числа атомов углерода, водорода, кислорода, азота и фосфора, являются «шаблонами», по которым организмы синтезируют нужные белки.
Жиры — сложные органические вещества, в состав которых входят атомы углерода, водорода и кислорода. Они содержатся в организмах человека, животных, растений и др. Всем известны жиры животного происхождения, например свиной, говяжий, бараний жир, сливочное масло (рис. 105).
Жиры растительного происхождения называются маслами. К ним относятся подсолнечное, льняное, рапсовое, оливковое, арахисовое, пальмовое и другие масла. Они накапливаются в семенах или в плодах растений. Проверить это можно, положив на лист бумаги семя подсолнечника и сильно нажав на него. На бумаге появится маслянистое пятно.
Жиры являются самым важным источником энергии для человека и составной частью пищи. Образуя жировые капсулы, жиры предохраняют внутренние органы от сотрясений и защищают организм от переохлаждения. Жиры, выделяемые кожными сальными железами, делают кожу человека мягкой и эластичной, а волосы — блестящими. Вместе с белками жиры являются запасным строительным материалом, из которого образуются новые клетки организма.
Углеводы — сложные органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода. Углеводы образуются в зеленых растениях в процессе фотосинтеза из углекислого газа и воды. Они входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органических веществ на Земле.
Зеленые растения в процессе фотосинтеза ежегодно поглощают из атмосферы приблизительно 200 млрд т углекислого газа CO3. При этом в атмосферу поступает около 130 млрд т кислорода O2 и синтезируется 50 млрд т углеводов.
Животные организмы не способны синтезировать углеводы, поэтому получают их из растительных источников. К углеводам относятся, например, глюкоза, фруктоза, сахароза, крахмал, целлюлоза и др. Глюкоза, фруктоза и сахароза содержатся в соке овощей и фруктов, придавая им сладкий вкус.
Глюкоза — обязательный компонент организма человека. Сахарозой богаты сахарная свекла и сахарный тростник — основные источники сахара. Крахмал накапливается в клубнях, плодах, семенах растений. Так, в клубнях картофеля содержится до 24 % крахмала, в зернах пшеницы — до 64 %, риса — 75 %, кукурузы — 70 %.
Глюкоза, фруктоза, сахароза и крахмал являются важными источниками энергии для человека. Они легко усваиваются и входят в состав продуктов питания. Целлюлоза (клетчатка) — углевод, из которого состоят стенки клеток всех высших растений.
Целлюлоза знакома каждому человеку и встречается буквально на каждом шагу. Пух тополя и парашютики одуванчика, вата, изготовленная из семян хлопчатника (рис. 106), лен, солома, бумага — все это почти чистая целлюлоза. Она входит в состав такого важного материала, как древесина.
Витамины — это органические вещества, которые не поставляют организму энергию, но необходимы ему в небольших количествах для поддержания жизни. Естественным источником витаминов являются витаминоносные растения (шиповник, цитрусовые, петрушка, лук, капуста, морковь, смородина, рябина, облепиха и др.), а также некоторые продукты питания животного происхождения. Многие витамины сегодня получают синтетическим путем.
Витамины поступают в организм с пищей и участвуют практически во всех процессах, протекающих в нашем организме. Они необходимы для нормальной работы желез внутренней секреции, повышения умственной и физической работоспособности, устойчивости организма к воздействию неблагоприятных факторов внешней среды (жара, холод, инфекции, отравления). В настоящее время известно около 20 различных витаминов. Это, например, витамин С — знакомая вам «аскорбинка», а также витамины 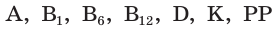
Понятие об органических веществах
Общее число известных на сегодняшний день веществ огромно — их насчитывается более 150 млн! Абсолютное большинство из них составляют органические вещества. Такое название они получили потому, что многие из них были выделены из организмов животных и растений.
Одними из первых таких веществ, вероятно, были жиры. Древний человек, занимавшийся охотой и собирательством, узнал о них в процессе приготовления пищи. Зажаривая на костре добытых на охоте животных или растирая семена некоторых растений, он наблюдал выделение вязких жидкостей, обладавших схожими свойствами.
Эти вещества были очень питательными и давали организму много сил. Люди давно научились выделять жиры из природных объектов и уже много веков используют их как продукты питания или материалы для получения других полезных веществ. Сегодня каждому знакомы жиры животного происхождения — свиной жир, сливочное масло, а также жиры, добываемые из растений, — подсолнечное, оливковое, льняное, пальмовое, арахисовое и другие масла.
Готовя на костре мясо, древний человек случайно сделал важное открытие. Оказалось, что капли жира, попадая на влажную золу и остывая, постепенно превращались в плотную массу, которая пенилась в воде и хорошо смывала грязь с рук. Вероятно, именно так люди впервые познакомились с мылом, без которого невозможно представить нашу жизнь. Конечно, сегодня мыло получают другим способом, но его основой по-прежнему остаются жиры.
Еще одно важное наблюдение было сделано в древности. При отжимании измельченных стеблей одного из видов тростника из них выделялась жидкость приятного сладкого вкуса. При упаривании этой жидкости получалось твердое, еще более сладкое вещество, получившее название сахар.
Перемалывая зерна различных злаков, люди получили муку, при замешивании которой с водой образуется тесто для выпечки хлеба. В первой половине XVIII в. из теста впервые выделили клейковину — эластичную и упругую массу. Впоследствии оказалось, что она представляет собой смесь особых веществ — белков, которые бывают растительного (клейковина) и животного (белок куриного яйца) происхождения.
Подавляющее большинство органических соединений, известных в настоящее время, являются неприродными веществами — их получают искусственно в химических лабораториях или на химических предприятиях (рис. 98, 99). Они входят в состав различных ценных материалов — синтетических волокон и каучуков, пластмасс и лекарственных препаратов, моющих средств и красителей, ядохимикатов и удобрений, взрывчатых веществ. Каждую неделю, благодаря научным исследованиям, число органических веществ увеличивается примерно на 10 000.
Все органические вещества обладают рядом общих свойств, непохожих на свойства неорганических веществ. Чем же органические вещества отличаются от неорганических?
Во-первых, количеством, которое более чем в 149 раз превосходит число неорганических соединений. Органические вещества невероятно многообразны, и количество классов этих соединений в десятки раз больше, чем неорганических веществ. Многочисленность органических веществ и многообразие их классов обусловлены особенностями их состава и строения, с которыми вы познакомитесь в следующем параграфе.
Во-вторых, в состав молекул всех органических веществ обязательно входят атомы углерода, связанные с атомами небольшого числа элементов — чаще всего водорода, кислорода, азота, серы, галогенов, фосфора. Этим органические вещества резко отличаются от неорганических, в состав которых могут входить атомы всех известных химических элементов. Отметим, что такие простейшие соединения углерода, как его оксиды CO и 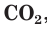
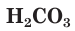
В-третьих, многие органические соединения термически неустойчивы и даже при относительно невысоких температурах разлагаются с образованием углерода, т. е. обугливаются. При сгорании в кислороде они образуют углекислый газ и воду. Что касается неорганических веществ, то большинство из них термически устойчивы или разлагаются при очень высоких температурах. Продуктами их сгорания в кислороде являются самые разнообразные вещества.
В-четвертых, для органических веществ характерны ковалентная полярная и ковалентная неполярная связи. Этим органические вещества также отличаются от неорганических, которым, кроме указанных типов связи, присущи также ионная и металлическая связи.
В-пятых, почти все органические вещества являются соединениями молекулярного строения с невысокими температурами плавления. Для них характерны молекулярные кристаллические решетки. В то же время большинство неорганических веществ относятся к соединениям немолекулярного строения с высокими температурами плавления. Для них более характерны атомные или ионные кристаллические решетки.
Несмотря на существенные различия между органическими и неорганическими веществами, их разделение на две группы является условным. И те, и другие вещества образуются и превращаются в соответствии с одними и теми же законами природы. Органические и неорганические вещества объединяет их способность к взаимному превращению.
Например, в результате фотосинтеза из неорганических веществ — углекислого газа и воды — образуется органическое вещество глюкоза. Являясь компонентом пищи, в организмах человека и животных она снова превращается в исходные неорганические соединения. Это взаимопревращение является основой круговорота углерода в природе.
Строение и физические свойства простых веществ
Так же как кислород, сера и фосфор, углерод образует несколько аллотропных модификаций. Наиболее известные из них графит и алмаз.
Графит — темно-серое вещество, состоящее из атомов углерода, которые расположены послойно (рис. 88). Эти слои относительно слабо связаны друг с другом, поэтому графит мягкий и может быть разделен на отдельные чешуйки. На способности графита оставлять черту при трении основано его широкое использование для производства карандашей.
Cажа, древесный уголь, получаемый при нагревании древесины без доступа воздуха, и кокс, получаемый из каменного угля, — это продукты с высоким содержанием углерода. Древесный уголь обладает способностью поглощать (адсорбировать) пары, газы и вещества из жидких растворов.
Это объясняется тем, что он имеет большое количество пор и, следовательно, обладает большой поверхностью. Поместим в стакан с раствором лакмуса истолченный древесный уголь (рис. 89). Через некоторое время жидкость в стакане обесцветится, так как уголь поглотит лакмус.
Сорбционные свойства древесного угля широко применяются в противогазах, в химической промышленности, для обесцвечивания и очистки сахарного сиропа, масла, жиров, вин, питьевой воды, а также в медицине.
В отличие от графита в алмазе (рис. 90) каждый атом углерода связан с другими атомами четырьмя химическими связями, направленными к вершинам тетраэдра. Все связи между атомами углерода одинаковые, небольшие по длине и очень прочные. Поэтому алмаз является самым твердым природным веществом. Алмаз образует прозрачные, сильно преломляющие свет кристаллы. Ограненные алмазы называются бриллинтами.
Графит хорошо проводит электрический ток, а алмаз является изолятором.
Известны и другие аллотропные модификации углерода: карбин, фуллерены, графен. С ними вы познакомитесь в курсе химии 11-го класса.
В том, что разные аллотропные модификации углерода состоят из атомов одного и того же элемента, можно убедиться, сжигая их в кислороде. Все они при горении образуют один и тот же продукт — оксид углерода(IV) и ничего больше. Кроме того, равные массы графита, алмаза, карбина и фуллерена дадут одно и то же количество углекислого газа.
В конце XVIII в. известный французский химик Лавуазье вместе со своими коллегами купил небольшой алмаз и сжег его в громадной «зажигательной машине» (см. рис.) с помощью сфокусированных солнечных лучей. При этом образовался только один продукт — углекислый газ СО2.
В определенных условиях возможно превращение одной модификации углерода в другую. Так, при сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит при температуре выше 2000 °С и давлении порядка 100 000 атм превращается в алмаз. Этот процесс используется для получения искусственных алмазов, нашедших техническое применение.
При записи уравнений химических реакций различные модификации углерода обозначаются буквой С.
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная
кислота – слабая двухосновная
кислота
Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 ↔ H НCO3—
НCO3— ↔ H CO32-
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 H2O = NaOH NaHCO3
CO32- H2O = OH— HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
CaCO3 → CaO CO2
Карбонат аммония при нагревании разлагается иначе:
(NH4)2CO3 → 2NH3 2H2O CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 2HCl → 2NaCl
CO2 ↑ H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
NaHCO3 HCl → NaCl CO2 ↑ H2O
CO2 Сa(OH)2 = CaCO3↓ H2O
При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает:
CaCO3 CO2 H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 CO2 H2O = 2NaНCO3
Na2CO3 HCl → NaНCO3 NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3— H2O = OH— H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 CO2 ↑ H2O
Mg(HCO3)2 = Mg(OH)2↓ 2CO2↑ H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C H2 → (t) CH4 (метан)
2С O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca C → CaC2 (карбид кальция, СО углерода = -1)
Al C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 C → Fe CO2
ZnO C → Zn CO
FeO C → Fe CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 C → (t) Si CO
Может восстановить и собственный оксид:
CO2 C → CO
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C H2O → CO↑ H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C HNO3(конц.) → (t) CO2 NO2 H2O
C HNO3 → CO2 NO H2O
C H2SO4(конц.) → CO2 SO2 H2O

