- Краткое описание химических свойств и плотность азота
- Краткое описание химических свойств и плотность кислорода
- Вычеслите плотность аммиака nh3 по кислороду вычеслите плотность аммиака nh3 по воздуху
- Вычисления с использованием числа авогадро
- Вычислите плотность по кислороду, по азоту, по воздуху: аммиака nh3 и сернистого газа so2.
- Закон авогадро
- Количество вещества
- Молярная масса
- Молярный объем
- Молярный объем газов
- Найдите относительную плотность сероводорода h2s по кислороду
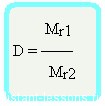
- Относительная плотность газа
- Относительная плотность газов
- Плотность азота и другие его физические свойства
- Распространенность азота в природе
- Распространенность кислорода в природе
- Рассчитайте: а) плотность (н. у.) оксида углерода (iv) (г/л) б) относительную плотность оксида азота (iv) по кислороду
- Рассчитать относительную плотность аммиака (nh3) по кислороду
- Расчеты по химическим формулам
Краткое описание химических свойств и плотность азота
Молекулярный азот обладает крайне низкой реакционной способностью, что обусловлено наличием в молекуле N2 прочной тройной связи, а также неполярностью молекулы. Действительно, энергия ионизации молекулы азота 1402 кДж/моль близка к энергии ионизации атома аргона 1520 кДж/моль, иными словами, азот – плохой восстановитель.
Сродство молекулярного азота к электрону -3,6 эВ, поэтому при комнатной температуре он реагирует лишь с некоторыми сильными восстановителями, например, с литием. Процесс протекает через стадию одноэлектронного восстановления с образованием неустойчивого пернитрида Li N2—, который в ходе реакции превращается в нитрид:
6Li N2 = 2Li3N.
Для образования нитрида магния Mg3N2 из простых веществ требуется нагревание до 300oС. Нитриды активных металлов представляют собой ионные соединения, гидролизующиеся водой с образованием аммиака.
В электрическом разряде в молекуле азота происходит переход электрона с орбитали σ(2pz) на π*(2pz). Такие возбужденные молекулы быстро возвращаются в обычное состояние, испуская желтое свечение. Иногда оно длится в течение нескольких минут после прекращения разряда.
N2 O2↔ 2NO.
Реакция с водородом протекает при повышенных значениях температуры (400oС) и давления (200 атм) в присутствии катализатора (Fe):
N2 3H2↔ 2NH3.
Азот не взаимодействует с серой и галогенами.
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.
O2 2H2 = 2H2O (550oС, сгорание H2в O2);
O2 F2 = O2F2 (-183oС, электрический разряд);
O2 N2↔2NO (электрический разряд);
O2 S = SO2 (сгорание на воздухе);
5O2 4P = P4O10 (сгорание на воздухе);
O2 C = CO2 (600-700oС, сжигание на воздухе);
O2 2Na = Na2O2 (сжигание на воздухе);
O2 2Mg = 2MgO (сгорание на воздухе);
3O2 4Al = 2Al2O3 (сгорание на воздухе).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Вычеслите плотность аммиака nh3 по кислороду вычеслите плотность аммиака nh3 по воздуху
Вычисления с использованием числа авогадро
К вычислениям по химическим формулам относятся также определение числа структурных частиц в данном количестве вещества, установление молярной массы вещества, массы или объема определенной порции вещества, по известному числу структурных частиц, из которых оно образовано. Рассмотрим конкретные примеры таких вычислений.
Определение числа атомов (молекул) в данном количестве вещества.
Пример 1. Определить число молекул в порции сульфида водорода 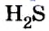
Дано:
Решение
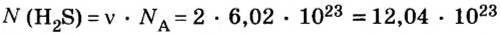
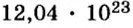
Усложним условие предыдущей задачи.
Пример 2. Определить число молекул в порции сульфида водорода 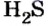
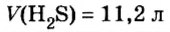
Решение1. Для определения числа молекул необходимо знать количество вещества. Поэтому из формулы 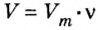
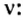
2. Определяем число молекул в порции сульфида водорода количеством вещества 0,5 моль:
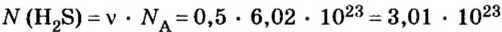
 Пример 3. Определить, где больше молекул — в порции углекислого газа массой 88 г или в порции газа пропана
Пример 3. Определить, где больше молекул — в порции углекислого газа массой 88 г или в порции газа пропана 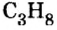
Дано: 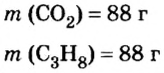
Решение
1. Вычислим относительные молекулярные и молярные массы углекислого газа и пропана:
2. Вычислим количество вещества в порции углекислого газа массой 88 г:
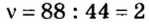
3. Вычислим количество вещества в порции пропана массой 88 г:
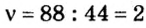
Количество вещества в обеих порциях одинаково, следовательно, число молекул также одинаково.
Ответ: число молекул в порциях углекислого газа и пропана массой 88 г каждая одинаковое.
Пример 4 Вычислить молярную массу соединения серы с кислородом и найти его формулу, если масса 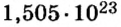
Дано:
Решение
Для вычисления молярной массы соединения нужно знать его химическую формулу. Если же химическая формула неизвестна, можно прибегнуть к вычислениям молярной массы вещества по таким формулам:
1. По формуле 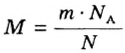
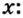
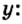
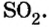
Итоги:
Используя число Авогадро, определяют числа структурных частиц вещества в данной его порции, устанавливают молекулярную формулу вещества.
Вычисления с применением числа Авогадро проводят по формулам: 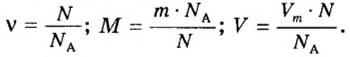
Физическую величину количество вещества можно применить не только к индивидуальным веществам, но и к их смесям. Это дает возможность проводить расчеты по более сложным химическим формулам, чем те, которые были приведены в параграфе. В частности, можно вычислять содержимое компонентов в составе газообразной смеси, а также массовые и объемные части газов в смеси.
Пример. Вычислить массовые и объемные доли газов в смеси оксида углерода 
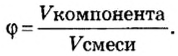
Объемную долю вычисляют в процентах или в долях от единицы.
Дано:
Решая эту задачу, важно помнить, что физическую величину количество вещества 
Решение
Вычислим молярную массу смеси по формуле: 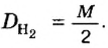
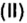
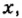
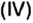
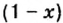

Составим алгебраическое уравнение и решим его:
Вычислим массу каждого компонента смеси:
Вычислим массовые доли компонентов смеси:
Находим объемные доли компонентов смеси. Поскольку в молярном объеме смеси объемные доли каждого компонента равны его количеству вещества, то:
Ответ: массовые и объемные доли газов в смеси составляют:
Вычислите плотность по кислороду, по азоту, по воздуху: аммиака nh3 и сернистого газа so2.
плотность аммиака по азоту 17:28=0,60
плотность аммиака по воздуху 17:29=0,59
плотность сернистого газа по кислороду 64:32=2
плотность сернистого газа по азоту 64:28=2,28
плотность сернистого газа по воздуху 64:29=2,20
а формула для нахождения D=Mn (одного газа) : Мn (другого газа) и тот газ по чему нужно искать должен быть в знаменателе
Закон авогадро
Вы уже знаете, что 1 моль водорода, кислорода или углекислого газа занимает при нормальных условиях объем 22,4 л и содержит 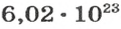
XIX ст. А. Авогадро. Получив впоследствии экспериментальное подтверждение и теоретическое обоснование, эта гипотеза стала законом.
Закон Авогадро формулируют так:в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул*.
Приводим важное следствие закона Авогадро:в равных объемах различных газов при одинаковых температуре и давлении содержатся одинаковые количества вещества.
* — Для инертных газов — одинаковое число атомов.
Изложенный материал обобщает рисунок 3.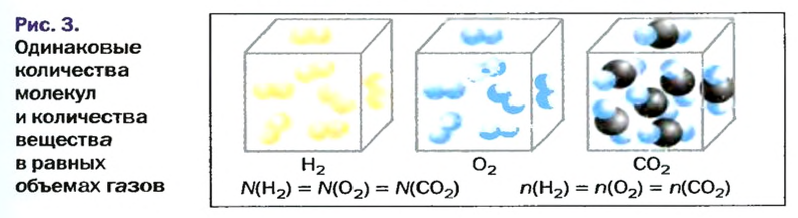
Решение задач. Рассмотрим несколько задач, при решении которых используют молярный объем газа.
ЗАДАЧА 1. Вычислить объем 0,4 г водорода при нормальных условиях.
Решение
1-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода составлением пропорции:
1 моль 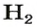
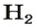 х л;
х л;
2-й способ
1. Находим количество вещества водорода:
2. Вычисляем объем водорода по соответствующей формуле:
Ответ: 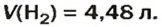 ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.
ЗАДАЧА 2. Вычислить количество молекул в 1 л кислорода при нормальных условиях.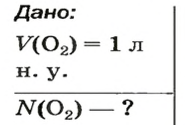
Решение
1-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях:
в 22,4 л кислорода содержится 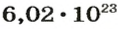
в 1 л кислорода — х молекул;
2-й способ
Вычисляем количество молекул кислорода в 1 л газа при нормальных условиях. Для этого из формулы 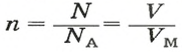
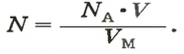
Осуществляем расчет:
Ответ: 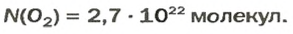
Эту задачу можно решить еще одним способом. По соответствующим формулам сначала вычисляют количество вещества кислорода, а затем — количество молекул.
ЗАДАЧА 3. Рассчитать плотность угарного газа СО при нормальных условиях.
Решение
1-й способ
1. Находим молярную массу угарного газа:
2. Вычисляем плотность газа при нормальных условиях:
1 моль угарного газа, т. е.
28 г СО занимает при н. у. объем 22,4 л,х г СО — 1л;
2-й способ
1. Находим молярную массу угарного газа:
2. Рассчитываем плотность угарного газа при нормальных условиях, преобразовав формулу 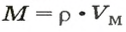
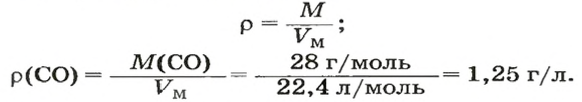
Ответ: 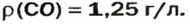
ВЫВОДЫ
Молярный объем — объем 1 моль вещества. Эта физическая величина является отношением объема к количеству вещества.
Молярные объемы твердых и жидких веществ разные, а газов (при одних и тех же температуре и давлении) — одинаковы. При нормальных условиях (температуре О°С и давлении 101,3 кПа, или 760 мм рт. ст.) 1 моль любого газа занимает объем 22,4 л.
В равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул (закон Авогадро).
Соотношение объемов газов в химических реакциях
Согласно закону Авогадро, равные объемы газов содержат одинаковое число молекул (при одинаковых условиях). Если каждая молекула одного газа реагирует с одной молекулой другого, например, во время реакции
то должны взаимодействовать одинаковые объемы веществ, скажем, 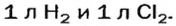
на один объем кислорода должны приходиться два объема реагирующего с ним водорода. Только при таком условии число молекул водорода будет вдвое превышать число молекул кислорода, как того «требует» химическое уравнение.
Обобщением этих выводов является закон объемных соотношений газов, который открыл французский ученый Ж. Гей-Люссак в 1808 г.: объемы газов, которые вступают в реакцию и образуются в результате реакции, соотносятся как небольшие целые числа.
Со временем ученые установили, что эти числа являются соответствующими коэффициентами в химических уравнениях.
Итак, для газов в реакциях (1) и (2)
Использование закона Гей Люссака дает возможность химику или инженеру-технологу определить, какие объемы газов нужно взять для осуществления реакции. Отобрать определенный объем газа значительно легче, чем взвесить его необходимую массу.
Количество вещества
Несколько столетий тому назад алхимики, готовясь к различным опытам и после их проведения, нередко взвешивали вещества, определяли их объемы. После открытия М. В. Ломоносовым и А. Л. Лавуазье закона сохранения массы веществ при химических реакциях химия начала быстро развиваться, обретая статус точной науки. Расчеты стали неотъемлемой частью химических исследований.
Вы уже знаете, что вещества могут иметь молекулярное, атомное или ионное строение. Превращение одних веществ в другие происходит в результате соединения атомов в молекулы, распада молекул на атомы, перегруппировки атомов или ионов.
Комментируя реакцию горения углерода
вы скажете, что каждый атом Карбона взаимодействует с молекулой кислорода с образованием молекулы углекислого газа, два атома Карбона взаимодействуют с двумя молекулами кислорода, образуя две молекулы углекислого газа, и т. д.
Чтобы подготовить какой-либо химический опыт, не имеет смысла пересчитывать атомы, молекулы. Да это и невозможно сделать. Химики используют физическую величину, которая определяется количеством частиц вещества в определенной его порции. Название этой величины — количество вещества. Ее обозначают латинской буквой 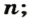
Единицей измерения количества вещества является моль*.
Ученые установили, что 1 моль любого вещества содержит 602 ООО ООО ООО ООО ООО ООО ООО его формульных единиц (атомов, молекул, совокупностей ионов). Это число можно записать как 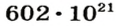
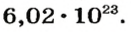
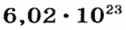
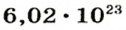
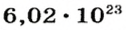
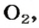
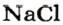
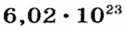
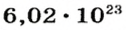
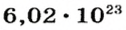
* Термин происходит от латинского слова moles — бесконечное
Понятие «количество вещества» используют не только по отношению к веществам, но и по отношению к частицам — атомам, молекулам, ионам. Например, выражение «1 моль ионов 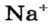
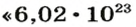
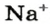
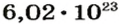
1 моль — это порция вещества, которая содержит столько формульных единиц, сколько атомов Карбона содержится в 12 г углерода.
Представление о порциях различных веществ в 1 моль можно получить из рисунка 1.
Число 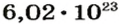
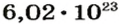
Амедео Авогадро (1776—1856)
Выдающийся итальянский физик и химик. Выдвинул гипотезу о молекулярном строении веществ, в частности газов. Открыл один из законов для газов (1811 год), позже названный его именем. Уточнил атомные массы некоторых элементов, определил состав молекул воды, аммиака, углекислого и угарного газов, метана, сероводорода и др. Разработал экспериментальные методы определения молекулярных масс газообразных веществ.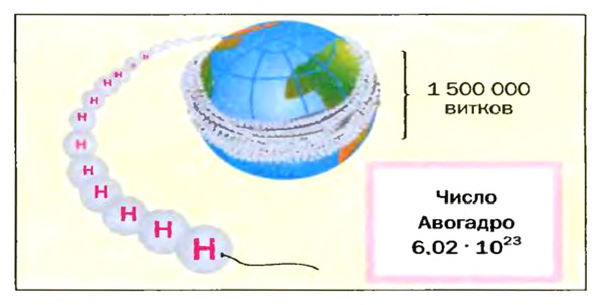

Числу Авогадро отвечает постоянная Авогадро. Ее обозначение — 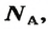
Если порция вещества содержит N частиц (формульных единиц), то можно вывести формулу для вычисления соответствующего количества вещества n:
в 1 моль вещества содержится 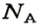
в n моль вещества — N частиц;
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Примеры словосочетаний: взято 5 моль железа, определение моля.
Решение задач. Решим несколько задач, в которых используется величина «количество вещества».
ЗАДАЧА 1. В каком количестве вещества содержится 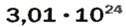
Решение
Воспользуемся формулой, которая отображает связь между количеством вещества и числом частиц (атомов):
Ответ: 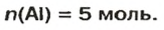
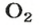

Количества вещества ионов в ионном соединении вычисляют аналогично.
ЗАДАЧА 2. Рассчитать количества вещества ионов в феррум (Ш) оксиде 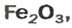
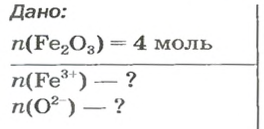
РешениеФормульная единица оксида 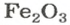
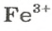
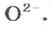
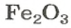
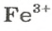
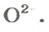
В 4 моль этого соединения количества вещества ионов в четыре раза больше:
Ответ: 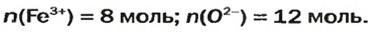

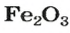
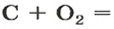
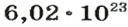
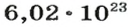
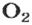
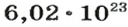
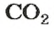
видим, что количества вещества соответствуют коэффициентам. Это справедливо для любой реакции. Приведем еще один пример:
ВЫВОДЫ. Количество вещества в химии определяют числом его частиц. Единица измерения количества вещества — моль. 1 моль содержит 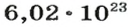
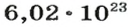
Молярная масса
Понятие молярная масса введено для определения соотношения количества вещества 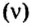
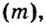 Молярная масса
Молярная масса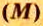
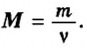
То есть, молярная масса — это величина, которая характеризует конкретное вещество и измеряется в килограммах на моль (кг/моль) или в граммах на моль (г/моль). Следует отметить, что в химии преимущественно используют единицу г/моль.
Если взять порции различных веществ, массы которых численно равны их относительным молекулярным массам, например 12 г углерода (С), 18 г воды 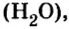
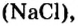
Масса одного моля любого вещества численно равна его относительной молекулярной массе и содержит число Авогадро структурных частиц (формульных единиц) вещества.
Для определения молярной массы вещества нет необходимости каждый раз делить массу порции вещества на количество вещества в ней. Достаточно вычислить ее относительную молекулярную массу и найденное число выразить в единицах молярной массы, то есть в г/моль.
Пример 1. 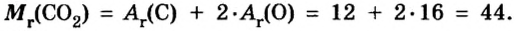
Таким образом, один моль углекислого газа — вещества молекулярного строения — имеет массу 44 г и содержит число Авогадро молекул.
Пример 2. 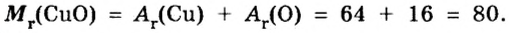
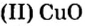
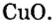
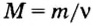
Пример 3. Вычислить молярную массу бинарного соединения серы с кислородом, если в порции массой 32 г количество вещества равно 0,5 моль.
Дано:
Решение:
Ответ: молярная масса соединения равна 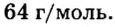 Производные формулы
Производные формулы 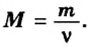 Формула
Формула 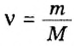 дает возможность определять количество вещества, если известны масса порции вещества и молярная масса этого вещества.Пример 4. Определить количество вещества в порции оксида алюминия
дает возможность определять количество вещества, если известны масса порции вещества и молярная масса этого вещества.Пример 4. Определить количество вещества в порции оксида алюминия 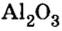
Дано:
Решение:
Ответ: количество вещества в порции оксида алюминия массой 20,4 г составляет 0,2 моль.
Формула 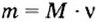 дает возможность вычислять массу
дает возможность вычислять массу 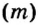 порции вещества, если известны молярная масса вещества и количество вещества в порции.Пример 5. Определить массу порции оксида серы
порции вещества, если известны молярная масса вещества и количество вещества в порции.Пример 5. Определить массу порции оксида серы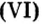
Дано:
Решение:
Ответ: масса порции оксида серы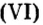 Как вычислить число структурных частиц вещества. Вам известно, что формулы многих веществ содержат индексы. Это дает возможность, характеризуя количественный состав вещества, отмечать число структурных частиц в формульной единице вещества. Число структурных частиц вещества в одном моле вещества принято помечать
Как вычислить число структурных частиц вещества. Вам известно, что формулы многих веществ содержат индексы. Это дает возможность, характеризуя количественный состав вещества, отмечать число структурных частиц в формульной единице вещества. Число структурных частиц вещества в одном моле вещества принято помечать 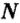 «эн»).Пример 6. Вычислить, сколько атомов фосфора и сколько атомов кислорода содержится в одном моле оксида фосфора
«эн»).Пример 6. Вычислить, сколько атомов фосфора и сколько атомов кислорода содержится в одном моле оксида фосфора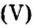
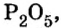
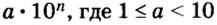
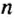
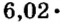
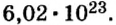
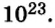
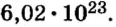
Итоги:
В примере мы ограничились найденным ответом 64 г/моль относительно молярной массы неизвестного вещества. Но вам, наверное, интересно знать, что это за бинарное соединение серы с кислородом? Для этого необходимо установить неизвестные индексы 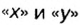
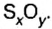
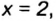
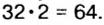
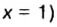
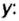
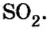
Молярный объем
Порцию вещества можно охарактеризовать не только ее массой, но и объемом. Поэтому не случайно, что, кроме молярной массы, существует другая физическая величина — молярный, объем.
Молярным объемом называют объем 1 моль вещества.
Обозначение молярного объема — 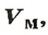
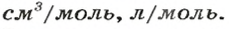
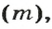
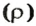
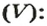
Аналогичная связь существует между молярной массой и молярным объемом:
Из этой формулы получаем другую:
По ней можно вычислять молярный объем любого вещества. Для этого нужно рассчитать молярную массу вещества и найти в справочнике его плотность.
Для каждого твердого и жидкого вещества существует свой молярный объем (например, для алюминия, поваренной соли, воды и спирта — 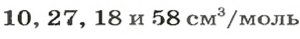
Газы при нагревании или понижении давления заметно расширяются, а при охлаждении или повышении давления сжимаются. Это происходит потому, что расстояния между молекулами в газах очень большие (в отличие от твердых и жидких веществ, где частицы соприкасаются друг с другом).
При изменении условий изменяются также плотность газа и его молярный объем. Поэтому, приводя значения этих физических величин, обязательно указывают соответствующие температуру и давление.
Нормальные условия (н. у.) = О °С; 101,3 кПа
Для газов при н. у. 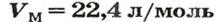
Ученые установили, что молярный объем различных газов при одинаковых условиях один и тот же. В частности, при температуре О °С и давлении 101,3 кПа (или 760 мм рт. ст.) он составляет 22,4 л/моль. Приведенные условия называют нормальными (сокращенно — н. у.).
1 моль любого газа при нормальных условиях занимает объем 22,4 л.
Описывая физические свойства вещества, указывают его агрегатное состояние при обычных условиях. В этом случае речь идет об условиях, которые чаще всего существуют в помещении, где изучают или используют вещество. Это — температура приблизительно 20 °С и давление приблизительно 760 мм рт. ст.
Связь между объемом 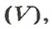
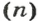
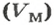
Из нее можно получить две другие:
Итак, молярный объем — это отношение объема к количеству вещества.
Молярный объем газов
Как известно, вещества могут находиться в твердом, жидком и газообразном агрегатных состояниях. Особенность газообразного состояния заключается в том, что между структурными частицами (молекулами) газов расстояния в тысячи раз большие, чем расстояния между структурными частицами жидкого, а тем более твердого вещества.
Так, один моль воды при комнатной температуре и нормальном атмосферном давлении занимает объем 18 мл (приблизительно 1 столовая ложка). Объем 1 моль мелкокристаллического хлорида натрия втрое больше объема 1 моль воды, а объем 1 моль сахара — больше почти в 20 раз (рис. 2). А для одного моля азота при тех же условиях необходим сосуд приблизительно в 1240 раз вместительнее, чем столовая ложка.
Следовательно, объем одного моля газообразного вещества азота существенно отличается от объема одного моля жидкого или твердого вещества, в то время как разница объемов одного моля жидкости воды и твердого вещества хлорида натрия или сахара незначительная.
Вычислим объем 1 моль азота и некоторых других газообразных веществ в литрах. Для этого воспользуемся такой физической характеристикой вещества, как плотность 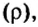
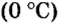
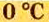 нормальные условия.
нормальные условия.
Нормальные условия сокращенно обозначаются их первыми буквами с точкой после каждой в круглых скобках — (н.у.).
Вычисление объема 1 моль азота начнем с нахождения его относительной молекулярной массы 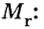
Поскольку молярная масса численно равна относительной молекулярной, то
При нормальных условиях плотность азота 1,25 г/л.
Подставляем значение молярной массы 28 г/моль и плотности азота 1,25 г/л в формулу 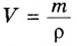
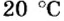
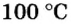
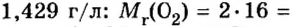
Если бы мы вычисляли молярный объем других газообразных веществ при нормальных условиях, то получили бы значения, близкие к 22,4 л.
Одной из величин, которая характеризует 1 моль любого газообразного вещества при нормальных условиях, является молярный объем газов 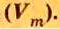
Подумайте и сделайте вывод — одинаковую ли массу они при этом имеют.
Вы, очевидно, обращали внимание на то, что определяющей физической величиной для жидкостей является объем, тогда как для твердых веществ — масса. Это потому, что твердые вещества сохраняют свою форму, а жидкие — нет, они приобретают форму сосуда, в котором содержатся. В этом отношении газы похожи на жидкости, поскольку собственной формы у них также нет.
Рассмотрим примеры вычислений с использованием молярного объема газов.
Пример 1. Вычислить объем азота количеством вещества 0,5 моль при нормальных условиях.
Решение
Воспользуемся формулой 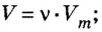
Ответ: объем азота количеством вещества 0,5 моль составляет 11,2 л.
Пример 2. Какому количеству вещества оксида углерода 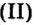
Решение
Воспользуемся формулой 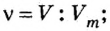
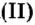
Итоги:
Теперь вы знаете, что количество вещества 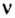
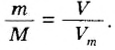
Отсюда можно определить массу порции вещества и ее объем, а также молярную массу вещества:
Все три формулы широко применяются в химической практике. Например, если в формулу 1 подставить значение объема известного вещества, то сразу вычислим массу порции этого вещества. Если же в формулу 2 подставить значение массы порции известного вещества, то вычислим объем ее порции.
Найдите относительную плотность сероводорода h2s по кислороду
Относительная плотность газа
В равных объемах различных газов содержится одно и то же число молекул*. Поскольку молекулы различных веществ обычно имеют разную массу, то массы одинаковых объемов газов, как правило, разные. Например, масса 1 
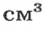
* — При одних и тех же условиях.
Число 16 называют относительной плотностью кислорода по водороду. Ее обозначают буквой D и записывают так:
Относительная плотность газа по другому газу — это отношение массы определенного объема газа к массе такого же объема другого газа (при одинаковых температуре и давлении).
Масса 1 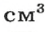
Узнать, во сколько раз кислород тяжелее водорода, можно, разделив плотность кислорода на плотность водорода:
Эта формула объясняет, почему физическую величину, о которой идет речь в параграфе, называют относительной плотностью.
Относительная плотность, как и относительная атомная (молекулярная, формульная) масса, не имеет размерности.
Если взять по 22,4 л кислорода и водорода при нормальных условиях, то массы веществ (в граммах) будут численно равны их молярным массам или относительным молекулярным массам. Отсюда — такие варианты вычисления относительной плотности кислорода по водороду:
Преобразуем все приведенные выше формулы на общие. Более тяжелый газ обозначим буквой В, более легкий — буквой А, а относительную плотность первого газа по второму — 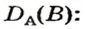
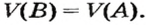
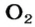
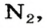
Установить, легче или тяжелее воздуха определенный газ, очень просто. Достаточно заполнить им резиновый шарик и отпустить его (рис. 5, 6).
Формулы для расчета относительной плотности газа В по воздуху имеют такой вид:
Относительная плотность газов
При изучении веществ и явлений не обойтись без сравнений. Их проводят по разным характеристикам — массе, плотности, размерам, зарядам структурных частиц, физическим или химическим свойствам веществ и т. п.
Для газообразных веществ сравнения часто проводят по относительной плотности газов (обозначается буквой латинского алфавита 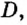 дэ»).Относительная плотность одного газа по другому газу
дэ»).Относительная плотность одного газа по другому газу 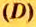
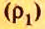
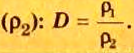
Поскольку плотность — это масса одного объема вещества, а молярный объем всех газов при нормальных условиях одинаков и составляет 22,4 л, делаем вывод, что плотности газов относятся между собой, как и их молярные массы. Вам известно, что молярные массы численно равны относительным молекулярным массам веществ. Отсюда относительная плотность газов может быть вычислена по формуле:
где 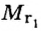
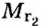
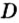
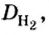
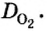
Из формулы для вычисления относительной плотности одного газа по другому следует, что необходимо знать относительные молекулярные массы обоих газообразных веществ. Как и относительная молекулярная масса, относительная плотность газа — величина безразмерная, потому что показывает, во сколько раз один газ легче или тяжелее другого.
Относительную плотность газов можно вычислить по любому газу — водороду, кислороду, углекислому газу и др., а также по газообразным смесям (рис. 4). Чаще всего ее вычисляют по водороду и воздуху. Если говорят о газообразных смесях веществ, то речь идет о средней относительной молекулярной массе смеси, определенной при нормальных условиях в объеме 22,4 л. Так, средняя относительная молекулярная масса воздуха равна 29.
Рассмотрим на примерах, как вычисляется относительная плотность газов и как, воспользовавшись формулой для ее вычисления, находят относительную молекулярную и молярную массы газообразного вещества.
Пример 1. Вычислить относительную плотность кислорода по водороду.
Решение
Ответ: 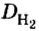
Вычисляя относительную плотность газа по водороду, в знаменателе всегда записывают число 2 (относительная молекулярная масса водорода). Отсюда формулу для вычисления относительной плотности газов по водороду можем подать в таком виде:
На практике часто необходимо определить относительную плотность газа по воздуху. Вспомните: в 7 классе вы выясняли, как необходимо располагать сосуд для собирания газообразного вещества, чтобы наполнить его газом способом вытеснения воздуха.
Поскольку относительная молекулярная масса воздуха составляет 29, то относительную плотность по воздуху вычисляют по формуле:
Пример 2. Вычислить относительную плотность кислорода по воздуху.
Решение
Ответ: относительная плотность кислорода по воздуху равна 1,1.
Таким образом, кислород несколько тяжелее воздуха и потому, чтобы собрать его способом вытеснения воздуха, сосуд располагают книзу дном.
Пример 3. Вычислить относительную плотность водорода по воздуху.
Решение
Ответ: относительная плотность водорода по воздуху равна 0,07.
В рассмотренных примерах кислород тяжелее водорода и воздуха, а водород легче воздуха. Эти и другие примеры доказывают, что если относительная плотность газа больше единицы, то газ тяжелее того газа, с которым его сравнивают. И наоборот, если полученная величина меньше единицы, то газ легче того газа, с которым его сравнивают.
Производными относительной плотности газов являются такие формулы:
Пример 4. Бинарное соединение азота с водородом имеет относительную плотность по водороду 8,5. Установить химическую формулу вещества, если массовая доля азота в ней равна 82 % .
Дано:
Решение
Поскольку относительная атомная масса азота 14, то 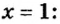
Итоги:
- Относительная плотность газов — это безразмерная величина, которая показывает, во сколько раз один газ тяжелее или легче другого.
- Для вычисления относительной плотности газа относительную молекулярную или молярную массу одного газа делят на относительную молекулярную или молярную массу другого газа.
- Выбирают способ сбора газов вытеснением воздуха по результатам вычисления относительной плотности газов по воздуху: если она больше единицы, то сосуд для наполнения газом держат книзу дном, а если меньше — вверх дном.
Плотность азота и другие его физические свойства
Прочная внутримолекулярная связь, небольшой размер и неполярность молекулы азота являются причинами слабого межмолекулярного взаимодействия, поэтому азот имеет низкие температуры кипения и плавления.
Азот не имеет запаха. Мало растворим в воде и немного легче воздуха: масса 1 л азота равна 1,25 г.
Важнейшие константы азота представлены в таблице ниже:
Таблица 1. Физические свойства и плотность азота.
Плотность, г/см3 (20oС) | 0,90 (твердый) |
Температура плавления, oС | -210 |
Температура кипения, oС | -196 |
Энергия ионизации атома, кДж/моль | 1402 |
Сродство атома к электрону, кДж/моль | -7 |
Относительная электроотрицательность | 3,0 |
Радиус атома, нм | 0,071 |
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 945 |
Молекула азота N2 в основном состоянии имеет следующую электронную конфигурацию: [σ(2s)2][ [σ*(2s)2][π(2py)2][π(2px)2][π(2pz)2]. В атоме азота в основном состоянии имеется три неспаренных электрона.
Распространенность азота в природе
Азот способен находиться в природе в форме простого вещества в природе (содержание азота в воздухе составляет -78 (об.) %). В виде аминокислот и нуклеиновых кислот азот входит всостав животных и растительных организмов. Из природных минералов промышленное значение имеют чилийская селитра (NaNO3) и калийная селитра (KNO3). Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы.
В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Рассчитайте: а) плотность (н. у.) оксида углерода (iv) (г/л) б) относительную плотность оксида азота (iv) по кислороду
CO2
Найти: ρ (CO2)
Решение:
Мr (CO2) = 12 16∙2 = 44
ρ (CO2) = M (CO2) / V = 44 г/моль/22,4 л/моль = 1,96 л/г
Ответ: ρ (CO2) = 1,96 л/г
Б) Дано:
NO2
Найти: DO2 (NO2)
Решение:
Мr (NO2) = 14 16∙2 = 46
Мr (O2) = 16∙2 = 32
DO2 (NO2) = Mr (NO2) / Mr (O2) = 46/32 = 1,44
Ответ: DO2 (NO2) = 1,44
Рассчитать относительную плотность аммиака (nh3) по кислороду
Рассчитать относительную плотность аммиака (NH3) по кислороду
Расчеты по химическим формулам
Изучая химию, вы, наверное, обратили внимание, насколько важная для характеристики вещества информация содержится в его химической формуле. Обобщая эти знания, можно сделать вывод, что химическая формула содержит сведения о молекуле или другой формульной единице вещества, а также о количестве вещества.
Химическая формула информирует о:
- качественном составе вещества (какие элементы его образуют);
- количественном составе вещества (сколько атомов каждого элемента входит в состав его формульной единицы массы);
- принадлежности вещества к простым или сложным.
- Пользуясь химической формулой, можно осуществлять расчеты:
- относительной молекулярной массы вещества;
- молярной массы вещества;
- отношения масс элементов в веществе;
- массовой части элемента в веществе;
- числа структурных частиц вещества в определенной его порции;
- молярной массы, количества и объема вещества;
- относительной плотности газов.
Частью этих расчетов вы уже овладели, ознакомимся с другими расчетами.
Расчеты отношения масс элементов в веществе. Химическая формула, как вам известно, состоит из символов химических элементов и индексов. Индексы являются теми числами, которые передают количественный состав вещества. Это дает возможность по химической формуле вычислять соотношение масс элементов. Рассмотрим такие расчеты на примере.
Пример 1. Вычислить соотношение масс элементов в оксиде фосфора 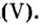
Решение
Составляем формулу соединения по валентности фосфора: 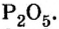
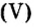
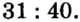


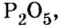
Пример 2. Какие вещества образуются в закрытом сосуде после сжигания в нем фосфора массой 93 г в кислороде массой 160 г?
Не будем строить прогнозы, а проведем четкие математические расчеты. Сначала вычислим, сколько кислорода необходимо, чтобы прореагировал весь фосфор. Для этого составим уравнение, в левой части которого запишем отношение масс элементов фосфора и кислорода по формуле, а в правой — по условию задачи, обозначив массу кислорода 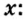
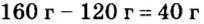
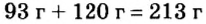
Итоги:
- Химическая формула вещества отображает ее качественный и количественный состав и дает возможность вычислять количество вещества, относительную молекулярную массу, молярную массу, объем и массу порции вещества, число структурных частиц вещества в определенной его порции.
- По химической формуле вычисляют также массовые доли элементов и отношения масс элементов в веществе.
Химики часто устанавливают не только отношения масс элементов по химической формуле вещества, но и отношения количества вещества реагентов и продуктов реакции. Так, если нужно установить массу или объем продуктов реакции, лучше воспользоваться физической величиной количество вещества.
следует, что 2 моль магния вступают в реакцию соединения с 1 моль кислорода и образуют 2 моль оксида магния.
Для этой реакции отношение количества вещества реагентов и продуктов реакции является таким:
Это значит, что, взяв определенное количество вещества магния, мы получим столько же молей оксида магния , тогда как израсходованное количество вещества кислорода будет вдвое меньшим.
Это учитывают на химических заводах по производству различных веществ и всегда проводят необходимые вычисления.