§ 2.1.2. эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 

М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 2NaOH = Na2SO4 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl NaOH = NaСl Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H , принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 NaOH = NaНSO4 Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н , принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 2НСl = СаСl2 2Н2О;
А для процесса:
Са(ОН)2 НСl = СаОНСl Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 6HCl = 2АlCl3 3H2O;
Э ≡ Al; 
а для реакции:
UO3 2HCl = UO2Cl2 H2O;
Э ≡ UO2; 
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 3 K2SO3 H2O = 2MnO2 3 K2SO4 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):

где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 3КОН = К3РО4 3Н2О;
Н3РО4 2КОН = К2НРО4 2Н2О;
Н3РО4 КОН = КН2РО4 Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 ВаСl2 = ВаSO4 2NaСl;
Na2SO4 H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O 2НСl = 2NaСl Н2О;
Na2O Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 3H2SO4 = Аl2(SO4)3 6Н2О;
Аl(OH)3 H2SO4 = АlOHSO4 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
1 Стехиометрические законы
Наиболее важное практическое значение имеют следующие законы химии: стехиометрические и газовые.
Закон эквивалентов
Отношения масс (объемов) реагирующих друг с другом веществ равны или пропорциональны их химическим эквивалентным массам (эквивалентным объемам).
Математические выражения закона эквивалентов:
а) для любых веществ с известной массой:
б) для газов с известным объемом:
где 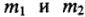
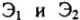
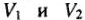
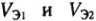
Следствие закона эквивалентов
Вещества реагируют друг с другом равным числом эквивалентов (молярных масс эквивалентов).
Математические выражения следствия закона эквивалентов:
а) для любых веществ с известным количеством эквивалентов (эквивалентных масс):
б) для растворов с известной молярной концентрацией эквивалента:
где 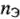
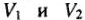
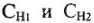
Рациональное решение задач сводиться к правильному выбору формулы из 1-4. При необходимости можно приравнять левую часть одного из приведенных уравнений к правой части любого другого.
Например, для решения реакции взаимодействия твердого вещества с раствором определенной молярной концентрации эквивалента (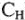
Эта теория взята со страницы подробного решения задач по всем темам химии:
Решение задач по химии
Возможно эти страницы вам помогут:
Эквивалент. молярная масса эквивалента вещества. эквивалентный объем

ХИМИЯ
Методические указания по выполнению лабораторных работ
специальностей: 110201.65-Агрономия, 110101.65- Агрохимия и агропочвоведение, 110102.65-Агроэкология, 110401.65-Зоотехния,280302.65-Комплексное использование и охрана водных ресурсов, направления 110900.62- Водные биоресурсы и аквакультура
КГТУ
Калининград – 2006
Авторы: Лемперт О.Т., доцент кафедры химии Калининградского государственного
технического университета
Поднебеснова Ф.В., старший преподаватель кафедры химии
Калининградского государственного технического университета
Введение
Методические указания предназначены, для выполнения лабораторных работ
по неорганической и аналитической химии студентами очной и заочной форм обучения специальностей: 110201.65-Агрономия, 110101.65- Агрохимия и агропочвоведение, 110102.65-Агроэкология, 110401.65-Зоотехния,280302.65-Комплексное использование и охрана водных ресурсов, направления 110900.62-Водные биоресурсы и аквакультура.
При выполнении лабораторных работ закрепляется материал по наиболее важным вопросам общей, неорганической и аналитической химии.
Каждый студент обязан вести свой лабораторный рабочий журнал (общая тетрадь), являющийся отчетом о проделанной лабораторной работе. Записи в лабораторный журнал необходимо вносить аккуратно и разборчивым почерком.
Категорически запрещается делать записи карандашом и на разрозненных листках бумаги.
Все записи сразу же вносят в журнал, не надеясь на память. Записывают результаты измерений и вычислений чернилами. В рабочем журнале ничего не исправляют, не стирают и не забеливают корректором. В случае ошибки цифру или слово зачеркивают (только один раз), написав исправленное рядом или над ошибкой. Если неправильным оказался большой материал, не вырывают страницы из журнала: достаточно перечеркнуть их по диагонали.
Перед каждым лабораторным занятием студент должен самостоятельно изучить теоретический материал по учебнику, конспекту лекций; прочитать описание лабораторной работы и подготовить форму отчета. При оформлении отчета по лабораторной работе указывают название темы, составляют краткое теоретическое введение, дату, номер и название лабораторной работы; название, цель и схему каждого опыта, записывают уравнения реакций, описанных в опыте.
Наблюдения и выводы по каждому опыту составляют и записывают после того, как лабораторная работа выполнена в учебной лаборатории.
Раздел 1: НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия –это химия элементов Периодической системы элементов Д.И. Менделеева и образованных ими простых или сложных химических соединений (веществ) Неорганическая химия неотделима от общей химии.
Общая химия изучает теоретические представления и концепции, составляющие фундамент всей системы химических знаний.
Стехиометрия – раздел химии, рассматривающий количественный состав веществ и количественные соотношения (массовые, объемные) между реагирующими веществами. Расчеты таких количественных соотношений между элементами в соединениях и между веществами в уравнениях химических реакций, вывод формул называются стехиометрическими расчетами. Их теоретической основой являются фундаментальные законы химии (стехиометрические законы).
Закон эквивалентов.
Эквивалент. Молярная масса эквивалента вещества. Эквивалентный объем.
Эквивалент (химический) – это реальная или условная частица вещества, которая в данной кислотно-основной или ионно-обменной реакции эквивалентна одному катиону водорода (протону) либо в данной окислительно-восстановительной реакции одному электрону. Количество эквивалента вещества выражается в молях (nЭ).
Масса 1 моль эквивалента вещества, т.е. молярная масса эквивалента вещества (МЭ), равна произведению фактора эквивалентности (fЭКВ) на молярную массу вещества (М). МЭ = fЭКВ · М [г/моль].
Фактор эквивалентности – число, показывающее, какая доля реальной частицы вещества эквивалентна одному катиону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
Пример1.Определить молярную массу эквивалента (эквивалентную массу) гидроксида бария Ba(OH)2 в кислотно-основной реакции
Решение. 1.Ba(OH)2 2HCl = BaCl2 2H2O; (HCl в избытке).
В данной реакции участвуют два катиона водорода (H ). Одному катиону водорода эквивалентна условная частица ½ молекулы Ba(OH)2, а fЭКВ = ½.. Молярная масса эквивалента Ba(OH)2 равна:
МЭ(Ba(OH)2) = fЭКВ · М (Ba(OH)2).
М (Ba(OH)2)= 137 2·16 2·1= 171 г/моль.
МЭ(Ba(OH)2) = ½ · 171 = 85,5 г/моль.
2. Ba(OH)2 HCl = BaОНCl H2O; (HCl в недостатке).
В этой реакции участвует один катион водорода, которому будет соответствовать 1 молекула Ba(OH)2 , а fЭКВ = 1.
МЭ(Ba(OH)2) = 1 · 171 = 171 г/моль.
Из рассмотренных примеров следует: эквивалент, фактор эквивалентности и эквивалентная масса одного и того же вещества величина переменная и зависит она от того, в какую реакцию это вещество вступает.
Примечание: Фактор эквивалентности может быть меньше единицы или равен единице.
Широко используется такое понятие, как объем эквивалента газообразного вещества (эквивалентный объем). Это объем, который занимает при нормальных условиях 1моль эквивалентов газообразного вещества. Известно, что один моль любого газа (н.у.) занимает постоянный объем, равный 22,4 л (следствие из закона Авогадро).
Пример 2. Вычислить эквивалентный объем кислорода, условия нормальные (н.у.).
Решение: 1. Вычисляем эквивалентную массу кислорода:
МЭ = А / В
Где А- атомная масса элемента, г/моль (величина табличная);
В – валентность (степень окисления) элемента.
Валентность кислорода в химических соединениях чаще всего равняется двум, степень окисления = –2. Отсюда, МЭ(О) = 16/2 = 8 г/моль.
Из закона Авогадро следует, что 32 г/моль О2 (1 моль О2) занимают объем 22,4 л, а 8 г/моль (1 моль эквивалента О2) будут занимать эквивалентный объем (объем эквивалента): кислорода:
VЭ(О2) = 22,4 · 8 /32 = 5,6 л/моль.
Закон эквивалентов
Массы (объемы) реагирующих друг с другом веществ, прямо пропорциональны их молярным массам эквивалентов (объемам эквивалентов):
m1/m2 = МЭ1 / МЭ2 или V1 / V2 = VЭ1 / VЭ2.
Эквивалентом сложного вещества является такое его количество, которое взаимодействует без остатка с одним эквивалентом любого другого вещества. Такие расчеты возможны благодаря закону эквивалентов.

Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить молярную массу эквивалента (эквивалентную массу) металла.
Решение. Находим массу кислорода m (O) = m (оксида) — m(Me);
m (O) = 3,78 – 2,28 = 1,50 г
По закону эквивалентов: m(Ме)/m(О) = МЭ(Ме) / МЭ(О),
вычисляем эквивалентную массу металла
МЭ(Ме) = m(Ме)·МЭ(О) / m(О),
МЭ(Ме) = 2,28 · 8 /1,5 = 12,16 г/моль.
Пример 2.Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (молярную массу эквивалента)
Решение. При решении задачи следует иметь в виду: а) эквивалентная масса гидроксида металла равна сумме эквивалентных масс металла и гидроксильных групп; б) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка. По закону эквивалентов:
МЭ(МеОН) / МЭ (МеNO3) = m (МеОН) /m(МеNO3) или
МЭ(Ме) МЭ(ОН−) / МЭ (Ме) МЭ(NO3−) = m (МеОН) /m(МеNO3)
подставляем числовые значения
МЭ(Ме) 17 / МЭ(Ме) 62 = 1,60 / 3,85
МЭ(Ме) = 15 г/моль.
Пример 3. Приготовить 500 мл 0,1 н раствора серной кислоты из 2 н раствора H2SO4.
Решение. Известно, что вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам: nЭ1 = nЭ2., а nЭ = V· СN.
Отсюда, V1· СN1 =. V2· СN2. Исходя из чего, растворы с молярной концентрацией эквивалента вещества (нормальность) реагируют друг с другом в объемах, обратно пропорциональным их молярным концентрациям эквивалентов (нормальностям):
V1 /V2 = СN2 / СN1 или V1 · СN1 = V2 · СN2.
где, V1, V 2 — объемы растворов реагирующих веществ,
СN1, СN 2 — молярные концентрации эквивалентов (нормальности) этих растворов.
Находим объем (V2) 2 н раствора серной кислоты, применив выражение
V1 · СN1 = V2 · СN2.;
V2 = V1 · СN1 / СN2., подставляем числовые значения
V2 = 500 · 0,1 / 2 = 25 мл.
Объем воды, необходимый для приготовления раствора вычисляем по разности
V(H2O) = V1 – V2
V(H2O) = 500 – 25 = 475 мл
Лабораторная работа №1
§

Метод основан на измерении объема водорода, который выделяется при взаимодействии кислоты с металлом по уравнению: Me 2HCl→ MeCl2 H2,
Следовательно МЭ(Н)=М(Н)/(nē), где nē – число электронов, принятых 1 моль водорода.
Из уравнения реакции видно, что 2Н 2е = Н2, отсюда МЭ(Н)=1/1= 1 г/моль.
Выполнение работы.
Проверьте прибор на герметичность, предварительно подобрав пробирку нужного диаметра. Убедившись в герметичности прибора, отсоедините пробирку, налейте в нее 1,0-1,5 мл 2 н раствора соляной кислоты и добавьте 1-2 капли раствора катализатора (CuSO4). Затем осторожно внесите в пробирку взвешенный металл и соедините пробирку с прибором. Запишите в журнал начальный объем воды в бюретке. Наклоните штатив так, чтобы металл упал в кислоту. Наблюдайте выделение водорода и вытеснение воды в уравнительный сосуд (воронку). По окончании реакции следует подождать 1-3 минуты, пока газ примет комнатную температуру, и уровень жидкости в бюретке станет постоянным. Тогда приведите воду в бюретке и уравнительном сосуде к одному уровню, т.е. создайте в бюретке давление равное атмосферному. По положению нижнего края мениска воды в бюретке определите конечный объем, а затем по разности (VКОН – VНАЧ) вычислите объем выделившегося водорода (VН2). Запишите условия проведения определения: температуру и барометрическое давление.
Запись данных опыта и расчеты:
B(валентность металла) = 2
m(масса металла), г =
VНАЧ.(начальный объем воды в бюретке), мл.=
VКОН.(конечный объем воды в бюретке), мл =
V(Н2) = VКОН.–VНАЧ. (объём, выделившегося водорода), мл =
t (температура),ºС =
T(абсолютная температура) =273 t0С, К =
Р(атмосферное давление), мм. рт. ст. =
h (Н2О) (давление насыщенного водяного пара), мм.рт.ст.=
Р(Н2)(парциальное давление водорода) = Р- h (Н2О), мм.рт.ст.=
Числовое значение h Н2О берут из справочной таблицы.
R(универсальная газовая постоянная), мм.рт.ст·мл/моль·К
По полученным данным рассчитайте молярную массу эквивалента металла двумя способами:
I-й способ. Применяя уравнение идеального газа Клапейрона — Менделеева
PV= nRT, зная, что n = m/M вычислите массу водорода в измеренном вами объеме. На основании закона эквивалентов вычислите молярную массу эквивалента металла. По закону эквивалентов:
m(H2)/m(Me) = MЭ(H2)/ MЭ(Me), откуда MЭ(Me) = m(Me)·MЭ(H2) / m(H2),
II-й способ. Приведите объем V(H2) выделившегося водорода к нормальным условиям Vo(H2), используя уравнение объединенного газового закона:
PV/T = PОVО / TО;
Заменив в выражении закона эквивалентов массу и молярную массу
эквивалента водорода на пропорциональные им объемные значения:
VО(H2)/m(Me) = VЭ(H2)/ MЭ(Me), получим расчетную формулу:
MЭ(Me)= m (Ме)·VЭ(H2) / VО(H2)
Зная, что АПРАКТ.(Ме) = МЭ(Ме)∙В(Ме), вычислите практическую атомную(мольную) массу металла. Затем по таблице Д.И.Менделеева определите какой это металл. Перепишите из таблицы Д.И.Менделеева теоретическое значение атомной массы металла.
Вычислите погрешности (ошибки) опыта: абсолютную (∆ =АТЕОР — АПРАКТ.) и относительную (∆% =.∆ ∙!00 ∕ АПРАКТ.).
Сформулируйте и запишите вывод.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химическая кинетика– раздел физической химии, изучающий вопросы о скоростях и механизмах химических реакций.
Скорость химической реакцииопределяется изменением концентрации реагирующих веществ за единицу времени в единице реакционного пространства.
Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, давления и присутствия катализатора.
Зависимость скорости химической реакции от концентрации реагирующих веществ выражается основным законом химической кинетики – законом действия масс:при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Химические реакции, в которых исходные вещества целиком превращаются в продукты реакции, называются необратимыми:
2KClO3 = 2KCl 3O2↑
υ1 = k1· С2(KClO3)
Значительно чаще происходят реакции, идущие одновременно в двух противоположных направлениях – прямом и обратном:
2NO O2 ↔ 2NO2
υ1 = k1·[NO]2·[O2],
υ2 = k2·[NO2]2,
Состояние обратимой реакции, при котором скорости прямой и обратной реакций равны между собой, называется химическим равновесием.
При химическом равновесии υ1 = υ2 , откуда
KС = k1 / k2 = [NO2]2 / [NO]2 · [O2]
Где KС – константа химического равновесия (величина табличная), выраженная через равновесные молярные концентрации реагирующих веществ,
k1, k2 – константы скоростей прямой и обратной химических реакций
[NO2],[NO],[O2] – равновесные молярные концентрации реагирующих веществ.
Для обратимой химической реакции: отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ есть величина постоянная при постоянной температуре, и называется константой химического равновесия. Она зависит от температуры, природы реагирующих веществ, наличия катализатора, и не зависит от концентраций реагирующих веществ.
Пример 1. Как изменится скорость реакции горения этилена при увеличении концентрации кислорода в три раза?
Решение. С2Н4 3О2 = 2СО2 2Н2О
Скорость реакции горения этилена до изменения концентрации кислорода
υ1= k1[C2H4]∙[O2]3 (закон действия масс)
С увеличением концентрации кислорода в три раза скорость реакции станет равной
υ1¢= k1 [C2 H4](3[O2])3 = 27k1[C2H4][O2]3=27υ1.
Следовательно, скорость увеличивается в 27 раз.
Пример 2. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 70°С, если температурный коэффициент равен 2?
Решение. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа (при повышении температуры на каждые 10оС скорость химической реакции возрастает в 2-4 раза) по формуле: υt2 =υt1×gt2-t1/10 Находим, что
υt2/υt1 = 270-20/10 = 25 = 32
Следовательно, скорость реакции увеличится в тридцать два раза.
Пример 3. В какую сторону сместится равновесие в гомогенных системах
1.2HBr Û H2 Br2 – 70,18 кДж;
2.2NO O2 Û 2NO2 117 кДж
вследствие повышения давления и температуры?
Решение. В первой системе реакция идет без изменения объема, поэтому изменение давления не вызывает смещения равновесия, а повышение температуры приведет к увеличению скорости прямой эндотермической реакции. (Принцип Ле — Шателье)

Во второй системе повышение давления вызовет смещение равновесия в сторону прямой реакции, идущей с уменьшением объема, а повышение температуры – в сторону обратной реакции (эндотермической).
Лабораторная работа № 2.
§

а) Влияние соли слабой кислоты на диссоциацию этой кислоты
Выполнение работы.В две пробирки внести по 5 капель 0,1 н раствора уксусной кислоты (СН3СООН), которая распадается незначительно на ионы:
CH3COOH ↔ CH3COO− H (Ка = 1,8 ·10−5).
Затем в каждую пробирку прибавить по 1 капле индикатора — метилового оранжевого. Под влиянием, каких ионов метиловый оранжевый приобретает красный цвет? Одну пробирку с уксусной кислотой оставить в качестве контрольной, а в другую внести 3 капли насыщенного раствора ацетата натрия (CH3COONa → CH3COO − Na ) и перемешать раствор. Сравнить окраску полученного раствора с окраской раствора в контрольной пробирке. На изменение концентрации, каких ионов указывает изменение цвета метилового оранжевого?
Запись данных опыта.Написать выражение константы диссоциации уксусной кислоты. Объяснить, как согласно принципу Ле Шателье смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия. Как меняются при этом степень диссоциации уксусной кислоты и концентрация ионов водорода [H ]?
б) Влияние соли слабого основания на диссоциацию этого основания
Выполнение работы.В две пробирки внести по 5 капель 0,1 н раствора аммиака NH3∙H2О (Кв=2,0∙10−5). В каждую пробирку прибавить по 1 капле индикатора — фенолфталеина. Под влиянием, каких ионов фенолфталеин приобретает малиновый цвет? Одну пробирку с раствором аммиака оставить в качестве контрольной, а в другую внести несколько кристалликов хлорида аммония (NH4С1→NH4 С1−) и раствор тщательно перемешать. Сравнить окраску полученного раствора с окраской раствора в контрольной пробирке. На изменение концентрации, каких ионов указывает изменение цвета фенолфталеина?
Запись данных опыта. Схема равновесия в водном растворе аммиака: NH3 H2О↔ ↔NH4 OH−.Объяснить, как смещается равновесие в этом растворе при добавлении к нему хлорида аммония. Почему при этом цвет фенолфталеина становится менее интенсивным (розовый)?
Опыт2 Характер диссоциации гидроксидов
Выполнение работы. Поставить в два ряда 10 пробирок. Затем в две пробирки №1 внести по 2 капли 0,5 н раствора хлорида магния (MgCl2), №2 – нитрата алюминия (Al(NO3)3), №3 – силиката натрия (Na2SiO3), №4 – сульфата никеля (NiSO4), №5 – сульфата цинка (ZnSO4). В две пробирки №№ 1,2,4,5 по каплям добавлять 2 н раствор гидроксида натрия (NaOH) до выпадения осадков гироксидов магния, алюминия, никеля и цинка. В две пробирки №3 добавлять до выпадения осадка гидроксида кремния (кремниевая кислота) 2 н раствор хлороводородной кислоты. Написать уравнения, протекающих реакций. Отметить цвет осадков.
Определить химический характер гидроксидов. Для этого в один ряд пробирок с осадками добавить по 4 капли раствора гидроксида натрия, а в другой – по 4 капли раствора хлороводородной кислоты. В каких случаях осадки растворились только в щелочи, только в кислоте, и какие осадки растворились и в щелочи и в кислоте? Написать уравнения соответствующих реакций. При этом следует учесть, что при растворении амфотерных гидроксидов в водных растворах щелочей образуются гидроксокомплексы. Например, при растворении гидроксида цинка в растворе гидроксида натрия образуется тетрагидроксоцинкат натрия:
Zn(OH)2 2NaOH → Na2[Zn(OH)4]
Запись данных опыта.
Указать кислотными, основными или амфотерными свойствами обладают гидроксиды магния, алюминия, кремния, никеля, цинка? Составить уравнения диссоциации (без ступеней), полученных гидроксидов, без учета процессов гидратации.
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Гетерогенное равновесие: осадок ↔ насыщенный раствор
подчиняется правилу произведения растворимости –в насыщенном растворе трудно растворимого сильного электролита произведение концентраций (активностей) ионов, возведенных в степени стехиометрических коэффициентов, есть величина постоянная при данной температуре.
Если малорастворимый электролит распадается на ионы по уравнению:
Ca3(PO4)2 = 3Ca2 2PO43−,
то выражение для произведения растворимости будет иметь вид:
ПР(Ca3(PO4)2) = a3(Ca2 ) · a2 (PO43−) = fa(Ca2 )·[Ca2 ]3· fa(PO43−)·[PO43−]2.
В разбавленных растворах, какими являются насыщенные растворы трудно растворимых электролитов, при fа =1, а =С, тогда: ПР(Ca3(PO4)2)= [Ca2 ]3·[PO43−]2.
Отсюда вытекают два следствия:
1. Условие растворения осадка: произведение концентраций ионов возведенных в степень стехиометрических коэффициентов, должно быть меньше величины произведения растворимости ПР(Ca3(PO4)2) > [Ca2 ]3·[PO43−]2.
2. Условие образования осадка: произведение концентраций ионов возведенных в степень стехиометрических коэффициентов, должно быть больше величины произведения растворимости ПР(Ca3(PO4)2)< [Ca2 ]3·[PO43−]2.
Пример 1.Растворимость (S) карбоната кальция в воде при температуре 250 С составляет 6,9 ·10 −5 моль/л. Найти ПР(CaCO3). S S S
Решение.В насыщенном растворе карбоната кальция: CaCO3 ↔ Ca2 CO32−,
[Ca2 ] = [CO32−] = S = 6,9 ·10 −5 моль/л. Отсюда, ПР(CaCO3) =[Ca2 ]·[CO32−]=S·S= S2.
Подставляем числовые значения: ПР(CaCO3) = (6,9 ·10 −5)2 = 4,8·10 −9.
Пример 2.Произведение растворимости йодида свинца ПР(PbI2) = 1,1·10−9. Чему равна S (растворимость) йодида свинца? S S 2S
Решение.Запишем уравнение диссоциации: PbI2 ↔ Pb2 2I−. Из каждой молекулы йодида свинца образуется один ион Pb2 и два иона I−. Следовательно, в насыщенном растворе PbI2, растворимость ионов свинца [Pb2 ] = S, а йодид –ионов [I−] = 2S. Отсюда получаем: ПР(PbI2) = [Pb2 ]·[I−]2 = S·(2S)2 = 4S3. Растворимость йодида свинца
___________ __________
[PbI2]= S = 3√ ПР(PbI2) / 4 ; S= 3√ 1,1·10−9 / 4 = 6,5·10−4 моль/л.
Лабораторная работа № 4
Произведение растворимости
Опыт 1. Дробное осаждение.
Выполнение работы.В две пробирки внести по 1 капле 0,5 н раствора нитрата серебра (AgNO3). В пробирку №1 добавить 2 капли 0,5 н раствора хлорида калия (AgNO3 КС1→AgCl↓ KNO3), №2 —2 капли 0,5 н раствора хромата калия (2AgNO3 K2CrO4→Ag2CrO4↓ 2KNO3).
Написать ионные уравнения реакций, отметить цвет осадков хлорида и хромата серебра.
Какое вещество будет выпадать в осадок первым из раствора, содержащего ионы Cl−, CrO42− и Ag в равных концентрациях?

ПР(AgCl)=1,8∙10−10; ПР(Ag2CrO4) = 4∙ 10−12
Проверить предположение опытом, для чего в пробирку №3 внести сначала
2 капли 0,5 н раствора хлорида калия (КС1), затем 2 капли 0,5 н раствора хромата калия (K2CrO4), добавить 3 капли дистиллированной воды. Раствор тщательно перемешать. Осторожно прибавить к нему 1 каплю 0,5 н раствора нитрата серебра (AgNO3), перемешать. Какое вещество при этом образуется? Добавить ещё несколько капель раствора нитрата серебра, тщательно перемешать. Наблюдается ли образование хромата серебра? Отметить его образование при дальнейшем увеличении концентрации катионов серебра.
Запись данных опыта.Описать наблюдаемые явления. Написать выражения, произведений растворимости хлорида и хромата серебра. Объяснить, применив следствие правила произведения растворимости, последовательность образования осадков в данном опыте (пробирка №3), учитывая величины произведений растворимости хлорида и хромата серебра. На все вопросы ответить письменно.
§

Выполнение работы.Подготовить семь пробирок. В каждую пробирку внести
1 каплю индикатора (нейтральный раствор лакмуса). Затем в 1-ю пробирку добавить
5 капель дистиллированной воды (контроль), а в остальные — по 5 капель 0,5 н растворов следующих солей: во 2-ю – ацетат натрия (CH3COONa), в 3-ю— нитрат алюминия (Al(NO3)3), в 4-ю – карбонат натрия (Na2CO3), в 5-ю – карбонат аммония ((NН4)2CO3), в 6-ю – хлорид калия (КСl), в 7-ю – ацетат аммония (CH3CООNН4).
Все растворы тщательно перемешать. По изменению цвета лакмуса в растворах солей по сравнению с контрольной пробиркой сделать вывод о реакции среды в растворе каждой соли.
Запись данных опыта.Полученные результаты свести в таблицу.
| № пробирки | Формула соли | Цвет Лакмуса | Реакция среды | рН раствора рН > 7 рН <7 рН =7 |
Какие из исследованных солей подвергаются гидролизу? Написать ионные и молекулярные уравнения реакций их гидролиза и указать вид гидролиза каждой соли (простой или сложный ступенчатый).
В случае ступенчатого гидролиза написать уравнение реакции только для первой ступени, так как практически в достаточно концентрированных растворах последующие ступени протекают очень слабо.
Опыт 2. Факторы, влияющие на степень гидролиза солей.
а) Влияние силы кислоты и основания, образующих соль, на степень её гидролиза.
Выполнение работы.Подготовить две пробирки, затем в одну пробирку внести несколько кристалликов сульфита натрия (Na2SO3), в другую – столько же кристалликов карбоната натрия (Na2CO3). В каждую пробирку добавить по 4 капли дистиллированной воды и по 1 капле фенолфталеина.
Написать ионные уравнения гидролиза сульфита натрия и карбоната натрия по 1-й ступени. В растворе, какой соли цвет фенолфталеина интенсивнее? В каком растворе концентрация гидроксид-ионов (ОН–) более высокая? Вычислить константу гидролиза каждой соли. Константа гидролиза, какой соли больше? Почему?
Сделать общий вывод о влиянии силы кислоты или основания, образующих соль, на степень её гидролиза.
б) Влияние разбавления раствора на степень гидролиза соли
Выполнение работы.В пробирку внести 2 капли раствора 0,5 н хлорида сурьмы (III) (SbCl3) и постепенно по каплям добавлять дистиллированную воду до выпадения осадка хлорида оксосурьмы (SbOCl). Этот осадок образуется на второй ступени гидролиза из хлорида дигидроксосурьмы (Sb(OH)2Cl) вследствие отщепления воды.
Запись данных опыта. Написать ионные уравнения первой и второй ступеней гидролиза хлорида сурьмы (III) и общее уравнение её гидролиза до образования Sb(OH)2Cl. Написать формулу для вычисления константы гидролиза хлорида сурьмы (III) для первой ступени. Показать при помощи этой константы, как влияет разбавление на степень гидролиза хлорида сурьмы (III)? Проверить свое заключение опытом. Сделать общий вывод о влиянии разведения на степень гидролиза солей.
Опыт 3. Случаи полного (необратимого) гидролиза солей.
Выполнение работы.В две пробирки внести по 2 капли 0,5 н раствора нитрата алюминия (Al(NO3)3). Затем в пробирку №1 добавлять по каплям 0,5 н раствор сульфида натрия ((NH4)2S), №2 – 0,5 н раствор карбоната натрия (Na2CO3) до выпадения осадка гидроксида алюминия (Al(OH)3). Отметить выделение сероводорода (H2S) в первой пробирке и диоксида углерода (CO2) во второй.
Запись данных опыта.Написать в ионном виде уравнения реакций гидролиза, которые привели к образованию гидроксида алюминия в обоих случаях. сероводорода в первом и диоксида углерода во втором случае. Составить общие уравнения, протекающих реакций. Объясните, почему не образуются сульфид и карбонат алюминия.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ.
БУФЕРНЫЕ РАСТВОРЫ.
Большинство реакций, применяемых в анализе, протекают в водных растворах. Вода относится к слабым электролитам и, хотя в незначительной степени, но подвергается ионизации:
H2O ↔ H OH−
Процесс ионизации воды характеризуется константой ионизации (диссоциации):
[H ]·[OH−] / [H2O] = K(H2O) (1)
Преобразуем это уравнение:
[H ]·[OH−] = K(H2O) · [H2O] (2)
В приведенном уравнении [H2O] (при постоянной температуре) можно считать практически постоянной. Следовательно, правая часть уравнения (2), а значит, и произведение [H ]·[OH−] – величина постоянная. Её называют ионным произведением воды и обозначают Kw:
Kw: = [H ]·[OH−] (3)
При температуре 250 С в чистой воде [H ] = [OH−] = 10-7моль/л, следовательно
Kw = 10-7·10-7 = 10-14. При повышении температуры Kw быстро увеличивается. Смысл уравнения (3) заключается в следующем: как бы, не изменялась, концентрация ионов H и OH−, их произведение [H ]·[OH−] в любом водном растворе сохраняет постоянное значение равное 10-14 при 25 0С.
Вместо концентрации [H ] удобнее пользоваться отрицательным десятичным логарифмом из этой величины – водородным показателем (рН).
pH = −ℓg[H ] (4)
Кроме водородного показателя (рН) при расчетах широко используют и гидроксильный показатель (рОН) и прологарифмированный показатель ионного произведения воды
рОН =−ℓg[ОH−],
рКw = −ℓgКw,
рКw = рН рОН.
В кислых растворах рН <7, в щелочных растворах рН >7, в нейтральных растворах рН = 7.
Пример 1. Вычислить рН и рОН 0,25 М раствора Са(ОН)2
Решение: Запишем уравнение электролитической диссоциации гидроксида кальция, являющегося сильным электролитом. Са(ОН)2 → Са2 2ОН−. Из уравнения диссоциации видно, что [ОН−] =2[Са(ОН)2]= 2∙0,25 = 5∙10−1 моль/л.
Вычислим рОН по уравнению рОН = − lg [ОН−];
рОН = − lg 5∙10−1 = 1 − lg 5 = 1 −0,7 = 0,3
Вычислим рН по уравнению рН = 14 − рОН ; рН = 14 − 0,3 = 13,7.
Пример 2. Какова концентрация гидроксид — ионов в растворе, рН которого 10,8?
Решение. Находим концентрацию ионов водорода в растворе
pH = − lg [H ] ; [H ] = 10−pH;
[H ] = 10−10,8 =10−11∙100,2 =1,6 · 10−11 моль/л.
[H ] = 1,6 · 10−11 моль/л.
Так как произведение [H ]·[OH−]= 10−14, то [OH−]= 10−14/ 1,6·10−11= 6,25·10−4 моль/л.
Пример 3. Вычислить рН и рОН 0,5 М раствора сернистой кислоты H2SO3.
Решение. Сернистая кислота (H2SO3) – электролит средней силы, диссоциирует по двум ступеням. Для расчета концентрации катионов водорода Н будем учитывать диссоциацию сернистой кислоты только по первой ступени — H2SO3 ↔ Н HSO3−.

Доля (степень диссоциации) молекул распавшихся на ионы определяется выражением: α = С(Н ) / С(H2SO3), откуда С(Н ) = α С(H2SO3) (1),
Из выражения закона разбавления Оствальда найдем К1= α2 С(H2SO3) (2), откуда
___________
α = √ К1 / С(H2SO3) (3), подставляем в уравнение (1),
___________ ____________
С(Н ) = С(H2SO3)· √ К1 / С(H2SО3) = √ К1 · С(H2SO3),
где К1 – константа диссоциации сернистой кислоты по 1-й ступени, числовое значение которой переписываем из справочной таблицы.
К1= 1,4 ∙10−2
__________
Подставляем числовые значения С(Н ) = √1,4 ∙10−2 0,5 =0,084моль/л.
Вычислим рН рН = −lg С(Н );
рН = −lg 8,4∙10−2 = 2 − lg 8,4= 2 – 0,92=1,08.
Вычислим рОН рОН = 14 – рН;
рОН = 14 – 1,08 = 12,92.
Пример 4.В каких соотношениях следует взять растворы 0,1 н СН3СООН и 0,1 н CH3COONa для приготовления буферной смеси с рН = 4,73.
Решение. pН буферной смеси можно вычислить по уравнению буферного действия. Для ацетатных смесей
рН = рКкисл — lg Cкисл / Ссоли
где рКкисл = — lg Ккисл. – силовой показатель кислоты.
Для аммонийных буферных смесей
рН = 14 – рКосн. lg Сосн / Ссоли
где рКосн = −lg Косн — силовой показатель основания. Следует помнить, что силовой показатель можно вычислить для слабых электролитов, для которых справедлив закон действия масс и существуют термодинамические константы диссоциации Кдисс..
Если концентрации растворов, составляющих буферную смесь, одинаковы, то величина рН будет зависеть от объемов растворов
рН = рКкисл – lg Vкисл / Vсоли
Для ацетатного буферного раствора
рКкисл = −lg 1,8 10 –5 = 4,73.
Отсюда 4,73 = 4,73 — lg Vкисл /Vсоли,
т.е. lg Vкисл / Vсоли = 0.
Следовательно, Vкисл / Vсоли = 1 или Vкисл = Vсоли.
Для приготовления ацетатного буферного раствора с рН = 4,73 надо смешать равные объемы 0,1 н растворов уксусной кислоты и ацетата натрия..
Лабораторная работа № 6
§

Опыт 1. Приближенное определение рН в водных растворах при помощи индикатора.
а) Окраска некоторых кислотно-основных индикаторов в различных средах
Выполнение работы.Определить окраску кислотной и щелочной форм наиболее часто применяемых кислотно-основных индикаторов: метилового оранжевого, метилового красного, лакмуса и фенолфталеина. Наблюдения провести в сильнокислой и сильнощелочной среде, чтобы в первом случае рН был заведомо ниже, а во втором – заведомо выше области перехода указанных индикаторов. Для чего в четыре пронумерованные пробирки внести по 4 капли 0,1 н раствора хлороводородной (соляной) кислоты, а в другие четыре пробирки с теми же номерами по 4 капли 0,1 н раствора гидроксида натрия. Пробирки в штативе поставить в два ряда таким образом, чтобы в одном ряду стояли только пробирки с кислотой, а в другом – пробирки со щелочью. После этого в обе пробирки №1 добавить по 1 капле индикатора метилового оранжевого, в пробирки №2 – метилового красного, в пробирки №3 – лакмуса, в пробирки №4 – фенолфталеина.
Запись данных опыта.Наблюдения по цвету кислотной и щелочной форм индикаторов записать по прилагаемой ниже схеме, где уже указаны интервалы рН областей перехода каждого индикатора и цвет его в этой области.
| Индикатор | рН области перехода | Цвет индикатора | ||||
| № проб. | Кислотной формы | В области перехода | № проб. | Щелочной формы | ||
| Метиловый оранжевый | 3,1 – 4,4 | HCl | Оранжевый | NaОН | ||
| Метиловый красный | 4,4 – 6,2 | HCl | Оранжевый | NaОН | ||
| Лакмус | 5,0 – 8,0 | HCl | Фиолетовый | NaОН | ||
| Фенол- фталеин | 8,2 – 10 | HCl | Розовый | NaОН |
Область перехода, какого из исследованных индикаторов находится ближе всего к нейтральной среде? Какие индикаторы имеют область перехода в кислой среде? В щелочной? Вычислить водородный показатель (рН) 0,002 н раствора хлороводородной кислоты (HCl) и 0,01 н раствора гидроксида натрия (NaOH).
Опыт 2. Определение водородного показателя (рН) в водном растворе соли с помощью универсального индикатора.
Для приближенного определения рН удобно пользоваться так называемыми универсальными индикаторами, представляющими собой смеси нескольких индикаторов, изменяющими свой цвет в водных растворах различных веществ в широком диапазоне рН. Бумага, пропитанная универсальным индикатором, и высушенная, называется универсальной индикаторной бумагой. К пачке такой бумаги прилагается цветная шкала, показывающая, какой цвет принимает индикаторная бумага (значение рН) при нанесении на неё 1 капли исследуемого раствора. Универсальные индикаторы применяют и в виде растворов. В этом случае готовится серия эталонов в герметически закрытых сосудах с указанием на каждом из них рН, соответствующего цвету эталона – раствора.
Выполнение работы.Получить у преподавателя раствор, водородный показатель (рН) которого требуется определить. При помощи пипетки нанести 1 каплю исследуемого раствора на универсальную индикаторную бумагу. Сравнить окраску пятна, образовавшегося на бумаге, с цветной шкалой и выбрать оттенок, наиболее близкий к цвету полученного пятна. На цветной шкале, приводятся цвета, соответствующие целым значениям рН, поэтому в случае необходимости можно по промежуточной окраске пятна ориентировочно оценить десятые доли рН. Сделать вывод о рН исследуемого раствора и указать реакцию среды. Проверить правильность своего вывода у преподавателя.
Опыт 3. Буферные растворы.
В лабораторной практике и в ряде технологических процессов возникает необходимость применения растворов, в которых водородный показатель (рН) практически не меняется, как при их разбавлении растворителем (водой), так и при добавлении к ним небольших количеств сильных кислот или оснований (щелочей). Такие растворы существуют, и они получили название буферных растворов или буферных смесей.
Наиболее часто применяемые буферные растворы представляют собой смесь слабой кислоты с солью, образованной этой кислотой и сильным основанием, например: (CH3COOH CH3COONa) – ацетатная буферная смесь или смесь слабого основания с солью, образованной этим основанием и сильной кислотой, например: (NH4OH NH4Cl) – аммонийная буферная смесь.
Буферные растворы слабых кислот имеют рН<7, в буферных растворах слабых оснований рН>7.
Выполнение работы.Приготовить ацетатный буферный раствор (CH3COOH CH3COONa), для чего поместить в небольшой стаканчик по 5 мл 0,1М растворов уксусной кислоты и ацетата натрия, полученный раствор перемешать стеклянной палочкой. В другом стаканчике приготовить таким же образом аммонийную буферную смесь (NH4OH NH4Cl) из 0,1 М растворов аммиака и хлорида аммония.
Определить рН приготовленных растворов с помощью универсального индикатора (см. опыт 2).
Запись данных опыта.Записать способ приготовления буферных смесей и экспериментально установленные в них значения рН.

