- Что собой представляет кремний
- — § 3. кремний
- Важные соединения кремния
- Все тесты
- Нахождение в природе
- Производственное применение стабильного оксида
- Соединения кислорода
- Способы получения кислорода
- Технология получения
- Физические признаки и получение sio2
- Физические свойства и нахождение в природе
- Физические свойства кремния. аллотропные модификации кремния
- Химические свойства
- Химические свойства si
- Электронное строение кислорода
Что собой представляет кремний
Кремний в химии имеет обозначение Si (силициум) от латинского слова silex «кремень». Это типичный неметалл, элемент 14 группы (по прежней классификации — главной подгруппы IV группы) и третьего периода периодической системы Д.И. Менделеева. Атомный номер 14. Атомная масса 28,09.
— § 3. кремний
Ближайший аналог углерода – кремний – является третьим (после кислорода и водорода) по распространенности
элементом: на его долю приходится 16,7% от общего числа атомов земной коры.
Если углерод можно считать основным элементом для органической жизни, то
кремний играет подобную же роль по отношению к твердой земной коре, так как
главная часть ее массы состоит из силикатных пород, представляющих собой
соединения кремния с кислородом и рядом других элементов.
Элементарный кремний может быть получен
восстановлением его двуокиси (SiC) магнием.
Реакция начинается при поджигании смеси тонко измельченных веществ и протекает
по уравнению
SiO2
2Mg
= 2MgO Si
Для освобождения от MgO и избытка SiO2 продукт реакции последовательно обрабатывают
соляной и плавиковой кислотами.
1) Практически кремний получают обычно в
виде сплава с железом (ферросилиция) сильным накаливанием смеси SiO2 , железной руды и угля. Важнейшее применение
ферросилиций находит в металлургии, где он употребляется для введения кремния в
различные сорта специальных сталей и чугунов.
Свойства кремния сильно зависят от
величины его частиц. Получаемый–при восстановлении SiO2магниемаморфный кремний представляет собой бурыйпорошок.
Перекристаллизовывая его из некоторых расплавленных металлов (например, Zn), можно получить кремний в виде серых, твердых, но
довольно хрупких кристаллов с плотностью 2,4. Кремний плавится при 1415 °С и
кипит при 2620°С.
Кристаллический кремний химически
довольно инертен, тогда как аморфный значительно более реакционноспособен. С
фтором он реагирует уже при обычных условиях, с кислородом, хлором и серой –
около –500°С. При очень высоких температурахкремний способен соединяться также с азотом и углеродом. Он растворим во многих
расплавленных металлах, причем с некоторыми из них образует соединения
(например, Mg2 Si), называемые
силицидами.
Кислоты на кремний при обычных условиях
не действуют (за исключением смеси HF HNO3 ).
Щелочи
с выделением водорода переводят его в соли кремневой кислоты:
Si 2NaOH H2 O =
Na2 SiO3 2Н2
Наиболее характерным и устойчивым
соединением кремния является его двуокись (SiO2 ), образование которой из элементов идет с очень
большим выделением тепла:
Si O2
= SiO2 203 ккал
Двуокись кремния представляет собой
бесцветное твердое вещество, плавящееся лишь при 1713 °С.
Свободная двуокись кремния (иначе,
кремнезем, кремневый ангидрид) встречается преимущественно в виде минералакварца, который составляет основу обычного песка. Последний является одним из
главных продуктов разрушения горных пород и одновременно одним из важнейших
строительных материалов, мировое потребление которого составляет около 500 млн.
т ежегодно. На долю свободной двуокиси кремния приходится приблизительно 12% от
веса земной коры. Гораздо большее количество SiO2 (около 43% от веса земной коры) химически связано в составе
различных горных пород. В общем, следовательно, земная кора более чем на
половину состоит из двуокиси кремния.
2) Большие прозрачные кристаллыкварца
(плотность 2,65) часто называют горным хрусталем, окрашенную в фиолетовый цвет
разновидность – аметистом и т. д. К мелкокристаллическим модификациям
кремнезема (с примесями других веществ) относятся агат, яшма и т. д.
3) На основе SiO2 готовится важный огнеупорный материал – динас. Последний
получают обжигом при 1500 °С измельченного кварца, к которому добавлено 2–2,5%
извести. Динасовый кирпич размягчается лишь около 1700 °С и служит, в
частности, для выкладки сводов мартеновских печей.
В воде SiO2 практически нерастворима. Не действуют на
нее и кислоты, за исключением HF, которая реагирует по схеме:
SiO2 4HF = SiF4 2Н2 О
Щелочи постепенно переводят SiO2 в раствор, образуя соответствующие соли кремневой кислоты
(называемые кремнекислыми или силикатами), например, по реакции:
SiO2 2NaOH = Na2 SiO3 Н2 О
Практически кремнекислые соли получают обычно путем сплавления SiO2 с соответствующими карбонатами, из
которых при высокой температуре выделяется СО2 , например, по схеме:
SiO2 Na2 CO3 = Na2 SiO3 СО2
В результате реакция сводится к выделению угольной кислоты
кремневой кислотой.
Кремнекислые соли, как правило, бесцветны, тугоплавки и
практически нерастворимы в воде. К числу очень немногих растворимых относится Na2 Si03 .
В практике эту соль часто
называют «растворимым стеклом», а ее водные растворы – «жидким стеклом».
4) Производство силиката натрия достигает
весьма значительных размеров (порядка сотен тысяч тонн ежегодно), так как
«жидкое стекло» используется для укрепления грунтов при строительных работах и
в ряде отраслей промышленности. Растворы его следует держать в сосудах с
резиновыми пробками (так как стеклянные и корковые сильно приклеиваются к
горлышку).
Так как кремневая кислота очень слаба,
«жидкое стекло» показывает в результате гидролиза резко щелочную реакцию, а
силикаты слабых оснований гидролизованы в растворе практически
нацело. По той же причине кремневая
кислота выделяется из растворов своих солей многими другими кислотами, в том
числе угольной.
Если в раствореугольная кислота выделяет
кремневую из ее солей, то при накаливании, как уже отмечалось выше, происходит
обратное выделение. Первое направление обусловлено меньшей силой (степенью
диссоциации) кремневой кислоты, второе– ее меньшей летучестью при нагревании.
Так как ряд кислот по их сравнительной летучести может резко отличаться от ряда
тех же кислот по их силе, направления реакций выделения в растворе, с одной
стороны, и при накаливании, с другой – Moгутбыть также весьма различными, что видно
хотя бы из приводимой ниже в качестве примера схемы:
выделение в растворе
–––––––––––––––––––––––––––––––––––––>>>
HCl – H
2
SO
4
– H
3
PO
4
– H
2
SiO
3
<<<–––––––––––––––––––––––––––––––––––––
выделение
при накаливании
Свободная кремневая кислота практически
нерастворима в воде (в форме истинного раствора). Однако она легко образует
коллоидные растворы и поэтому обычно осаждается лишь частично. Осадок имеет вид
бесцветного студня, причем состав его отвечает не простой формуле H2 SiO3 (метакремневой
кислоты) или H4 SiO4 (ортокремневой
кислоты), а более общей – xSiO2 ·yH2 O
со
значениями х и y, изменяющимися в зависимости от условий осаждения. При х>1 получаются различные поликремневые кислоты, производными которых с точки зрения химического
состава могут считаться многие минералы.
5) Растворенная часть кремневой кислоты
диссоциирована крайне мало (K1 = 3·10–10, K2 = 2·10–12). Природные гидратные формы кремнезема с
содержанием x
>> y встречаются в виде неорганических образований –кремня, опала,
трепела и т. д., а также остатков панцирей некогда живших мельчайших морских
организмов – диатомита («инфузорной земли»). Образование перекисных соединений
для кремния нехарактерно, и производные надкислот этого элемента не получены.
Соли кремневых кислот известны для
гидратных форм с самыми различными значениями х и у. Продуктами полного или
частичного замещения в них водорода на те или иные металлы являются так
называемые простые силикаты. Примером их может служить минерал асбест (Mg3 H4 Si2 09 или
3MgO·2H2 O·2SiO2 ).
Значительно более распространены в
природе сложные силикаты, с точки зрения химического состава производящиеся
главным образом от кислот общей формулы хЭ2 О3 ·ySiO2 ·zH2 O. Важнейшими
соединениями этого типа являются алюмосиликаты Э = Аl), особенно относящиеся к группе полевых шпатов, на долю которых
приходится более половины веса земной коры.
Минералы:
ортоклаз
– K2 Al2 Si6 O16 или K2 O·Al2 O3 ·6SiO2
альбит – Na2 Al2 Si6 O16 или Na2 O·Al2 O3 ·6SiO2
анортит – CaAl2 Si2 O8 или CaO·Al2O3 ·2SiO2
могут быть названы в качестве основных их
представителей.
6) Пространственное строение ряда
силикатов было изучено с помощью рентгеновских лучей. При этом выяснилось, что
исследованные структуры могут быть классифицированы с разбивкой на небольшое
число типов, отличающихся друг от друга характером сочетания тетраэдрических
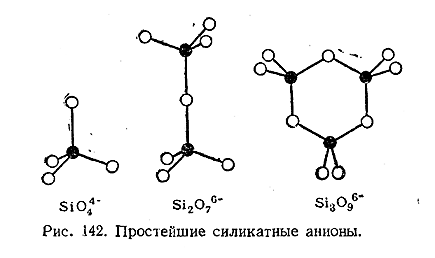
ионов SiO44–.
Некоторым из таких типов отвечают
простейшие силикатные анионы. Как видно из рис. 142, сюда относятся прежде
всего случаи заполнения узлов пространственной решетки индивидуальными ионами SiO44–. Второй тип
характеризуется наличием в узлах решетки ионов Si2 O76– (образованных двумя тетраэдрами SiO44–с одним общим
углом), третий – наличием в узлах решетки циклических ионов Si3 O96– (образованных тремя тетраэдрами SiO44–с двумя
общимиуглами у каждого из них).
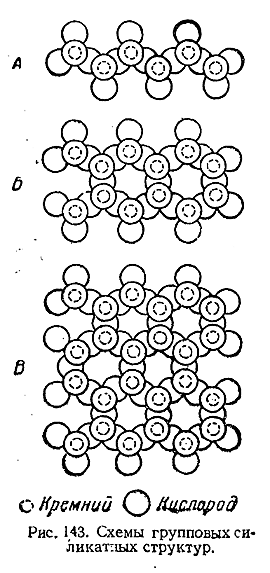
Другие типы силикатных структур могут быть
названы групповыми, так как они слагаются из теоретически бесконечного числа
тетраэдров Si44–. Такие сочетания (рис. 143) могут иметь характер
простой цепи (А), двойной цепи (Б) или плоскости (В). Наконец, существуют типы,
представляющие собой объемную структуру. Во всех подобных решетках часть ионов Si4 может быть заменена на ионы Аl3 и т. д., а часть ионов О2– –
на ионы ОН– и т. д. Вместе с тем
часть входящих в состав силикатаионов (К , Na и т. д.) может располагаться между цепями или плоскостями, а
также в промежутках трехмерной структуры.
Под совместным действием различных
природных факторов, главным образом углекислоты и воды, природные силикаты,
алюмосиликаты и т. п. постепенно разрушаются («выветриваются»), причем растворимые
продукты уносятся водой в океан, а нерастворимые частично отлагаются на месте,
частично оседают в руслах рек или выносятся в море. Основными нерастворимыми продуктами распада наиболее
распространенных з природе алюмосиликатов являются кремнезем (SiO2 ), оседающий в виде песка, и каолин (H4 Al2 Si2 O9 ,
или
Al2 O3 ·2SiO2 ·2H2 O),
представляющий
собой основу обычных глин (окрашенных в бурый цвет примесями окиси железа) и в
более чистом состоянии образующий иногда залежи белой глины. Процесс их
образования при разрушении алюмосиликата может быть изображен следующей
примерной схемой:
K2 Al2 Si6 O16
CO2 2H2 O = K2 CO3 H4 Al2 Si2 O9
4SiO2
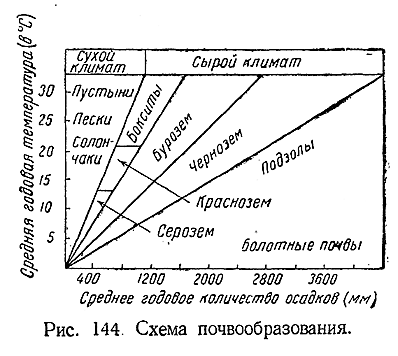
Песок и глина создают минеральную основу
всех видов почв. Характер последних зависит главным образом от условий
температуры и влажности данной местности (рис. 144).
Из получаемых искусственно нерастворимых
в водесиликатов наиболее важным является стекло, известное человечеству еще с
глубокой древности. Состав «нормального» стекла выражается формулой Na2 CaSi6 O14 или Na2 O·СаО·6SiO2 . Довольно близко к нему подходит обычное оконное
стекло. Путем соответствующих изменений этого основного состава удает ся
получать различные специальные сорта стекол, характеризующиеся теми или иными
требуемыми для отдельных применений качествами.
Основными исходными продуктами
стекольного производства являются сода, известняк и песок. Процесс образования
«нормального» стекла может быть выражен уравнением:
Na2 СО3 СаСО3
6SiO2 = 2CO2 Na2 O·CaO·6SiO2
Смесь исходных веществ нагревают
приблизительно до 1400 °С и выдерживают расплавленную массу до полного удаления
газов, после чего она пускается в дальнейшую переработку.
7) При выработке стекла соду нередко
заменяют более дешевой смесью сульфата натрия и угля. В этом случае реакция
идет по следующему уравнению:
Na2 SO4
C CaCO3 6SiO2 = Na2 O·CaO·6SiO2
CO SO2 CO2
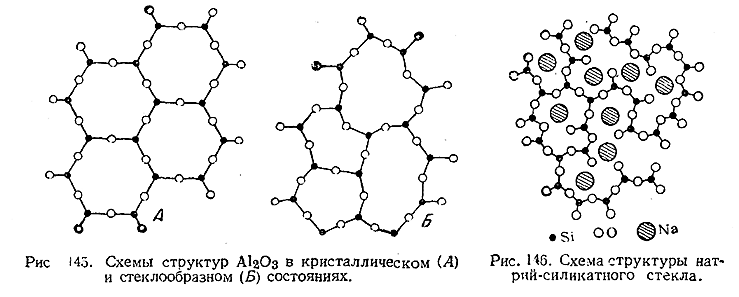
8) Исследования при помощи рентгеновских
лучей показали, что стеклообразное состояниевещества (подобно жидкому)
отличается от кристаллического неполной упорядоченностью взаимного расположения
отдельных элементов пространственной решетки. На рис. 145 приведены схемы
структур Al2 O3 в
кристаллическом (Л) и стеклообразном (Б) состояниях. Как видно из этих схем,
характерные для кристаллической решетки AI2 O3 шестиугольники в стеклообразном состоянии строго не выдержаны, но общий
характер расположения частиц все же подобен имеющему место в кристалле.
Приведенная на рис. 146 схеме структуры
натрий–силикатного стекла дает представление о размещении в решетке
металлических ионов: последние без какой–либо четкой последовательности
располагаются в пустотах силикатной сетки. Так как в этой сетке нет строго
закономерного повторения структурных элементов, отдельные ее связи
характеризуются неодинаковой прочностью. Поэтому стекло, в противоположность
кристаллу, не обладает определенной температуройплавления, а в процессе
нагревания размягчается постепенно.
9) Сравнительно недавно началось
проивзодство кварцевого стекла, представляющего собой по химическому составу
почти чистый кремнезем (SiO2 ). Наиболее ценным
его преимуществом перед обычным является примерно в 15 раз меньший коэффициент
термического расширения. Благодаря этому кварцевая посуда переносит без
растрескивания очень резкие изменения температуры: ее можно, например, нагреть
до красного каления и тотчас опустить в воду. С другой стороны, кварцевое
стекло почти не задерживает ультрафиолетовые лучи, сильно поглощаемые обычным
стеклом. Недостатком кварцевого стекла является его большая по сравнению с
обычным хрупкость.
Хотя стекло в целом практически
нерастворимо, однако вода частично разлагает его с поверхности, вымывая главным
образом натрий. Подобно воде действуют и кислоты (кроме плавиковой) – стекло,
находившееся некоторое время в соприкосновении с водой или кислотами, дальше
практически не разрушается ими. Напротив, вследствие сильного преобладания SiO2 в составе стекла действие на него щелочей
имеет длительный характер. Поэтому хранящиеся в стеклянных сосудах щелочные
жидкости обычно содержат примеси растворимых силикатов.
Галоидные производные кремния общей
формулы SiF4 могут быть
получены прямым синтезом по схеме: Si 2Г2
= SiГ4 . Галогениды SiГ4 бесцветны. При обычных условиях SiF4 газообразен, SiCl4 и SiBr4 представляют
собой жидкости, SiJ4 – твердое тело.
Из химических свойств галогенидов.
кремния наиболее характерно для них энергичное взаимодействие с водой по схеме:
SiГ4 2Н2 О
< = >SiO2 4НГ
В случаях Сl, Вr и J равновесие практически нацело смещено вправо,
тогда как в случае F реакция
обратима. Вследствие образования при гидролизе твердых частиц SiO2 (точнее, xSiC2 ·yН2 О) дары галогенидов кремния
дымят во влажном воздухе.
10) Некоторые константы галогенидов
кремния сопоставлены ниже:
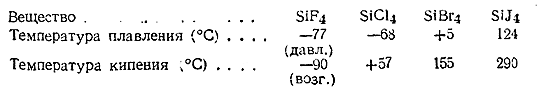
Значительные количества SiF4 получаются как побочный продукт
суперфосфатного производства. Фтористый кремний весьма ядовит.
При взаимодействии SiF4 с HF образуется комплексная
кремнефтористоводородная кислота:
2HF SiF4 = H2 [SiF6 ]
В парахреакция эта заметно обратима, но в водном раствореравновесие ее смещено вправо. Аналогичные комплексные кислоты H2 SiF6 с другими галоидами не
образуются.
Свободная H2 SiF6 является сильной двухосновной кислотой.
Большинство ее солей (кремнефтористых, или фторосиликатов) бесцветно и хорошо
растворимо в воде.
11) Вследствие образования H2 SiF6 схема гидролиза SiF4 более точно выражается уравнением:
3SiF4
2H2 O = 2H2 SiF6 SiO2
Таким пугем обычно и получают
кремнефгористоводородную кислоту.
Свободная H2 SiF6 используется
в пивоварении (как дезинфицирующее средство), а малорастворимые фторосиликаты Na и Ва – для борьбы с
вредителями сельского хозяйства. Легкорастворимые фторосиликаты Mg, Zn и Аl под техническим
названием «флюаты» находят применение в строительном деле (для придания
водонепроницаемости цементированным поверхностям).
12) Белый сульфидкремния (SiS2 ) образуется
при сплавлении «аморфного» кремния с серой. Водой он медленно разлагается на SiO2
и H2 S.
13) Соединение кремния
с азотом происходит лишь выше 1300 °С. Образующийся нитрид кремния (Si3 N4 ) представляет
собой белый порошок. При кипячении с водой он медленно гидролизуется до SiO2 и
NНз.
14) При накаливании
смеси SiO2 с
углем в электрической печи до 2000 °С образуется карбид кремния (SiC), называемый обычно
карборундом. Реакция идет по уравнению: SiO2 3C = 2CO SiC. Чистый
карборунд представляет собой бесцветные кристаллы, а технический продукт обычно
окрашен примесями в темный цвет. Из свойств карборунда наиболее практически
важна его твердость, уступающая лишь твердостиалмаза. Поэтому карборунд широко
применяется для обработки
твердых материалов. В частности, из него обычно изготовляют круги точильных
станков.
15) Карборунд обладает
довольно высокой электропроводностью и используется при изготовлении
электропечей. Еще чаще для этого применяют т. н. силит, получаемый обжигом при
1500 °С (в атмосфере СО или N2 ) массы, сформованной из
смеси карборунда, кремния и глицерина. Силит характеризуется механической
прочностью, химической стойкостью и хорошей электропроводностью (которая с
повышением температуры возрастает).
Водородные соединения
кремния (кремневодороды, или силаны) получаются в смеси друг с другом и с
водородом при действии разбавленной НСl на силицидмагния (Mg2 Si). По
составу и структурным формуламкремневодороды (SiH4 , Si2 H6 т. д. вплоть до последнего известного члена –
Si6 H14 )
аналогичны углеводородам ряда метана. Большое
сходство наблюдается и в отношении физических свойств. Напротив, общая
химическая характеристика обоих классов соединений резко различна: в
противоположность очень инертным углеводородамсиланы чрезвычайно реакционноспособны.
На воздухе они легко воспламеняются и с большим выделением тепла сгорают до SiO2 и воды по реакции, например:
SiH4 2О2
= SiO2 2Н2 О
308 ккал
16) По мере увеличения числа атомовкремния в молекуле устойчивость силанов быстро уменьшается. Константы первых
членов ряда приводятся ниже:
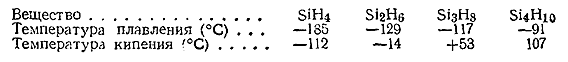
Все силаны бесцветны, обладают характерным
запахом и сильно ядовиты. Водой они медленно разлагаются с выделением водорода
по схеме, например: SiH4 4H2 O
= 4H2 Si(OH)4 .
17) Для кремния известно большое число
различных кремнийорганических соединений, во многом аналогичных соответствующим
производным углерода. Как правило, они устойчивы на воздухе и нерастворимы в
воде. Синтез высокомолекулярных производных этого типа открыл возможность их
широкого практического использования для выработки лаков и смол,
характеризующихся высокой термической устойчивостью и рядом других ценных
свойств.
Еще по теме:
Важные соединения кремния
Оксид кремния (IV) SiO2 имеет атомное строение, высокий показатель твердости, тугоплавкий (плавится при температуре 1730 °С). Кислотный оксид, соответствует кремниевой кислоте.
Получают:
- в промышленности — нагреванием кремния в атмосфере кислорода:
Si O2 →600°СSiO2.
Химические свойства SiO2:
- не растворяется в кислотах, реагирует только с плавиковой кислотой и газообразным фтороводородом:
На реакции с карбонатами основано получение оконного стекла — смесь из соды, известняка и белого песка прокаливают при температуре, равной 1500 °С:
Na2CO3 CaCO3 6SiO2 →t°Na2O·CaO·6SiO2 2CO2↑.
Кремниевая кислота и ее соли — силикаты.
Кремниевая кислота H2SiO3 — слабая, малорастворимая.
Na2SiO3 2HCl → 2NaCl H2SiO3↓.
Кремниевая кислота реагирует только с сильными основаниями и их оксидами, образуя силикаты:
H2SiO3 LiOH → Li2SiO3 2H2O.
Силикаты, кроме Na2SiO3 и K2SiO3 (их называют жидким стеклом), нерастворимы в воде. Получают следующими методами:
- взаимодействие кремния, оксида кремния или кремниевой кислоты с щелочами:
MgO SiO2 → MgSiO3 силикат магния;
- реакция растворимых силикатов с солями:
K2SiO3 CaCl2 → CaSiO3 силикат кальция 2KCl.
Силициды — это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Тип химической связи — ионная.
Получают при сплавлении простых веществ или восстановлением смеси оксидов коксом в электропечах:
Вступают в реакцию:
Силан — это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если к порошку силицида магния добавить разбавленную соляную кислоту, то на поверхности раствора образуются пузырьки силана. Они лопаются и загораются на воздухе.
Химические свойства силана:
5. Карборунд SiC имеет атомный тип кристаллической решетки, сходный с алмазной. Твердый, плавится при температуре 2730 °С.
Получают по схеме:
Si C →2000°СSiC.
Окисляется кислородом:
Применение кремния и его соединений — силикатная промышленность.
Кремний используют в металлургии — добавка к стали и другим сплавам; в электронике — изготовление полупроводниковых приборов, радиодеталей и солнечных батарей.
Кремний необходим для поддержания здоровья кожи, волос и ногтей. Кремний участвует в формировании костей, повышает эластичность и прочность кровеносных сосудов, что используется в профилактике сердечно-сосудистых заболеваний.
Диоксид кремния:
- производство стекла, керамики, бетона и кирпича. Из керамики, помимо посуды и декоративных изделий, производят изоляторы для высоковольтных ЛЭП и другие изделия, используемые в технике и строительстве;
- чистый кварц используется в приборостроении;
- производство косметики: как эмульгатор и компонент против слеживания.
Силициды входят в состав жаропрочных и кислотоустойчивых сплавов и высокотемпературных полупроводниковых материалов.
Карбид кремния используют как абразив при затачивании резцов металлорежущих станков и шлифовки драгоценных камней, а также в качестве имитации алмаза в ювелирном деле.
Все тесты
- Тест на темуАнализ стихотворения «Не с теми я, кто бросил землю» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Перемена» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Петербурге» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Стихи к Блоку» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Клеветникам России» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Завещание» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Стихи о Москве» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «Молитва» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «И. И. Пущину!» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «День и ночь» Ф. Тютчева5 вопросов
- Тест на темуАнализ стихотворения «Весна в лесу» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Журавли» Р. Гамзатова5 вопросов
- Тест на темуАнализ стихотворения «Люблю» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Когда на меня навалилась беда» К. Кулиева5 вопросов
- Тест на темуАнализ стихотворения «Гамлет» Б. Пастернака5 вопросов
- Тест на темуАнализ стихотворения «Русь» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Ночь» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения К. Симонова «Ты помнишь, Алёша, дороги Смоленщины…»5 вопросов
- Тест на темуАнализ стихотворения Жуковского «Приход весны»5 вопросов
- Тест на темуАнализ стихотворения Анны Ахматовой «Сероглазый король»5 вопросов
- Тест на темуАнализ стихотворения «Июль – макушка лета…»5 вопросов
- Тест на темуАнализ стихотворения «Мелколесье. Степь и дали…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Не позволяй душе лениться» Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «На дне моей жизни» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Нивы сжаты, рощи голы…» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Бабушкины сказки» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снежок» Н. Некрасова1 вопрос
- Тест на темуАнализ стихотворения «По вечерам» Н. Рубцова5 вопросов
- Тест на темуАнализ стихотворения «Вчерашний день, часу в шестом…» Н. Некрасова5 вопросов
- Тест на темуАнализ стихотворения «Цветы последние милей…» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Я знаю, никакой моей вины…» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Я не ищу гармонии в природе»Н. Заболоцкого5 вопросов
- Тест на темуАнализ стихотворения «Разбуди меня завтра рано» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Снега потемнеют синие» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Осень» Н. Карамзина5 вопросов
- Тест на темуАнализ стихотворения «Молитва» А. Ахматовой5 вопросов
- Тест на темуАнализ стихотворения «Вечер» А. Фета5 вопросов
- Тест на темуАнализ стихотворения «Не жалею, не зову, не плачу» С. Есенина5 вопросов
- Тест на темуАнализ стихотворения «Тучи» М. Лермонтова5 вопросов
- Тест на темуАнализ стихотворения «Книга» Г. Тукая5 вопросов
- Тест на темуАнализ стихотворения «Необычайное приключение, бывшее с Владимиром Маяковским летом на даче» В. Маяковского5 вопросов
- Тест на темуАнализ стихотворения «Деревня» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Летний вечер» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Я убит подо Ржевом» А. Твардовского5 вопросов
- Тест на темуАнализ стихотворения «Элегия» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Зимнее утро» А. Пушкина5 вопросов
- Тест на темуАнализ стихотворения «Троица» И. Бунина5 вопросов
- Тест на темуАнализ стихотворения «Бабушке» М. Цветаевой5 вопросов
- Тест на темуАнализ стихотворения «О весна без конца и краю» А. Блока5 вопросов
- Тест на темуАнализ стихотворения «Море» В. Жуковского5 вопросов
Нахождение в природе
Кремний в чистом виде (как самородный минерал) встречается крайне редко. Но, соединяясь с кислородом, он образует SiO2 — кремнезем, входящий в состав многих минералов: песок, кварц, полевой шпат, слюда, некоторые поделочные и полудрагоценные камни: яшма, гранат, турмалин и др., что обуславливает высокое (не менее 26%) содержание кремния в земной коре.
Производственное применение стабильного оксида
- Крупные кристаллы кварца популярны в ювелирном деле — в качестве полудрагоценных камней (например, горный хрусталь, опал).
- В промышленности — авиационная индустрия, оптика, электроника.
- При производстве зубной пасты — как «мягкий» абразив.
- В качестве огнеупорного вещества в сталелитейном производстве.
- В фармацевтической отрасли (как загуститель) — при производстве мазей, суспензий, гелей.
- При производстве ядохимикатов (средство для борьбы с клопами «Гектор») — порошок не отравляет насекомых, но он выводит воду из их организма, что приводит к последующему обезвоживанию и гибели вредителей.
- В пищевой промышленности — как стабилизатор суспензий, загуститель, порошок для фильтрации (в производстве пива, масел, натуральных соков), для предотвращения слеживания и комкования сыпучих продуктов (сахара, муки, соли). Кроме того, этот материал используется как энтеросорбент и даже самостоятельная пищевая добавка (E551 — в сырах, специях, сухих завтраках).
Добавка E551 считается полностью безопасной для организма человека — он разрешена к использованию не только в России и странах бывшего СНГ, но также в государствах ЕС и США.
Однако вдыхание пыли двуокиси кремния может привести к появлению проблем со стороны дыхательной системы — бронхиту, реже — силикозу легких (заболеванию, снижающему способность легких перерабатывать кислород) и даже спровоцировать развитие онкозаболеваний.
Соединения кислорода
Основные степени окисления кислород 2, 1, 0, -1 и -2.
Соединения кислорода:
| Степень окисления | Типичные соединения |
| 2 | Фторид кислорода OF2 |
| 1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Кислородсодержащие кислоты Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
2KMnO4 → K2MnO4 MnO2 O2
Разложение бертолетовой соли в присутствии катализатора MnO2:
2KClO3 → 2KCl 3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O O2
2HgO → 2Hg O2
2KNO3 → 2KNO2 O2
Технология получения
В лабораторных условиях кремний получают:
- прокаливанием белого песка (оксид кремния IV) с металлическим магнием:
2Mg SiO2 →t°Si↓ 2MgO;
- восстановлением из оксида кремния IV с помощью алюминия:
2Al SiO2 →t°Si↓ Al2O3.
Промышленные способы получения кремния:
SiO2 2Cкокс→t°2CO↑ Si↓.
Однако, такой кремний имеет примеси карбида кремния и не подходит для производства микросхем.
Продукт со степенью чистоты до 99,9% получают:
SiCl4 2H2 →1200°СSi↓ 4HCl;
SiH4 →t°Si↓ 2H2↑.
Физические признаки и получение sio2
Другое название соединения — кремнезем. Это твердое вещество с атомной кристаллической решеткой (в узлах расположены отдельные атомы, соединенные ковалентными связями). Температура плавления — 1713 °C, кипения — 2590 °C. Получение:
- Окисление кремния: Si O2 → SiO2.
- Разложение водой сульфида: SiS2 2H2O → SiO2 2H2S.
- Воздействие кислот на растворимые силикаты: Na2SiO3 2CH3COOH (уксусная кислота) → 2CH3COONa H2SiO3; H2SiO3 → SiO2 H2O.
В природе соединение встречается в виде обычного и кварцевого песка (из-за содержащихся в нем примесей может приобретать разную окраску), крупных прозрачных кристаллов горного хрусталя или фиолетового аметиста, агата, яшмы, в минералах тридимит и кристобалит (редкие камни).
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183оС.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Физические свойства кремния. аллотропные модификации кремния
Кремний имеет две аллотропные модификации:
- Кристаллический — свойства обусловлены наличием кубической кристаллической решетки. Атомы расположены на вершине и в центре каждой грани, прочно связаны друг с другом ковалентной связью.
- Аморфный — порошок бурого цвета на основе разупорядоченной кристаллической структуры. Гигроскопичный, активнее вступает в реакции.
| Физическая характеристика | Кристаллический кремний | Примечание |
| Цвет | Темно-серый, с металлическим блеском | |
| Плотность | 2,33 г/см³ при н.у. | |
| Температура плавления | 1415 °С | |
| Температура кипения | 2350 °C | |
| Прочность | Хрупкий | При нагревании свыше 800 °C пластичный |
| Удельное электрическое сопротивление | 0,1–60 Ом·м | полупроводник |
| Теплопроводность | 149 Вт/(м·К) | |
| Твердость | 7 по шкале Мооса | твердый |
Таблица 1. Основные физические параметры кристаллического кремния.
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
Химические свойства si
Определяются положением кремния в периодической системе Д.И. Менделеева и строением атома: электронная формула 1s2 2s2 2p6 3s2 3p2. Проявляет степени окисления: -4, 0, 2, 4. Валентность: II и IV.
Окислительные свойства кремний проявляет в реакциях с активными металлами:
Si 2Mg →t°Mg2Si-4 силицид магния;
С водородом не реагирует, но при растворении силицидов в кислотах образуется силан:
Mg2Si 4HCl → 2MgCl2 SiH4 силан.
Восстановительные свойства кремния.
- галогены (Cl, Br, J) при нагревании, со фтором при комнатной температуре:
Si 2F2 → SiF4 тетрафторид кремния;
3Si 4HNO3 18HF → 3H2[SiF6] 4NO 8H2O.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии:
😯 1s22s22p4 1s ![]() 2s
2s ![]() 2s
2s 2p
![]()
Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
