- Что такое парниковый эффект
- Что способствует уменьшению выбросов парниковых газов в атмосферу
- История открытия
- Нахождение в природе
- Откуда берутся парниковые газы
- Поддержка жизни и рекреационное использование
- Получение кислорода в лаборатории
- Разложение кислородсодержащих веществ
- Распространенность оксигена в природе
- Сварка и резка металлов
- Свойства и молекулярная структура
- Свойства и применение кислорода
- Физические свойства
- Фториды кислорода
- Химические свойства
Что такое парниковый эффект
Парниковый эффект – явление, при котором отраженное от парниковых газообразных компонентов тепло оказывает влияние на климат земной поверхности. Действие летучих веществ можно сравнить со стеклянной поверхностью или пластиковым брезентом, покрывающим теплицу. В результате повышается температура воздуха, почвы и воды, что приводит к необратимым изменениям в экосистеме:
- избыточное парообразование вод Мирового океана;
- таяние полярных льдов;
- изменение климатических условий;
- гибель некоторых видов животных из-за перемены климата;
- увеличение риска глобального потепления.
Разрушительное влияние парникового эффекта наблюдается на примере планеты Венера, атмосфера которой на 90% состоит из летучей углекислоты. Отраженное от Солнца тепло увеличивает температуру ее поверхности до 500°C. Если не остановить глобальную экологическую проблему, это может привести к природной катастрофе. Частичное очищение воздушных масс на планете происходит благодаря поглощению парниковых веществ водами океана и почвой.
Парниковый эффект характеризуется увеличением показателя среднегодовой температуры воздуха, повышением частоты природных катаклизмов. Неблагоприятная экологическая обстановка способна привести к гибели животных и растений, нанести вред здоровью людей.
Решить проблему на 100% нельзя, потому что скопление парниковых веществ к 21 веку достигло большой концентрации. Политика международных организаций по борьбе с парниковым эффектом состоит в том, чтобы регулировать процесс повышения температуры и как можно сильнее смягчать негативные последствия:
- Повышение уровня Мирового океана благодаря таянию полярных льдин. Острова и прибрежные зоны будут затоплены. Территория для жилого заселения сократится на 20%.
- Увеличение влажности вследствие необратимых климатических изменений. В регионах с умеренным климатом могут начать аномальные осадки: снегопады, бури, ураганы, дожди. В засушливых зонах резкое повышение температуры Земли способно привести к острому недостатку питьевой воды.
- Вымирание 42% видов животных и растений. Перемены в климате способны изменить оптимальные условия для жизни некоторых организмов, что может привести к их полному исчезновению.
- Сокращение площади ледников, таяние льда в высокогорье. Данные последствия могут спровоцировать сход лавин, начало масштабных оползней, сели.
- Сокращение объемов производства, снижение эффективности сельского хозяйства в странах с жарким и засушливым климатом. Важно помнить, что они ведут аграрную политику и поставляют большую часть пищевой продукции на мировой экономический рынок. Вследствие изменений погодных условий, снижении роста растений на пахотных землях, падеж скота начнется массовый голод. В то же время зоне умеренного выпадения осадков существует вероятность увеличения объемов урожая, но эти показатели не смогут компенсировать потерю аграрных территорий.
- Дефицит питьевой воды. В условиях сильного потепления Земли подземные источники пересохнут не только из-за повышения температуры, но и по причине таяния ледников.
- Ухудшение общего состояния здоровья человеческого населения. Ухудшение экологической обстановки, недостаток питьевой воды и продуктов питания, увеличение радиации, снижение качества воздуха могут привести к развитию заболеваний и летальному исходу.
Что способствует уменьшению выбросов парниковых газов в атмосферу
Сокращение выбросов парниковых газов относится к категории наиболее приоритетных задач экологического мирового сообщества. Работа организации ориентирована на создание единой программы для безопасной утилизации природных и синтетических соединений, не наносящей вред атмосфере и здоровью людей.
В борьбе с парниковым явлением должен участвовать и быть заинтересованным каждый человек. Чтобы предотвратить ухудшение экологического состояния планеты и сократить вероятность развития потепления планеты, потребуется принять следующие меры:
- увеличить эффективность и объемы промышленного производства за счет использования возобновляемой или зеленой энергии, остановить эксплуатацию горючих ископаемых;
- увеличить количество лесопосадок, остановить масштабную вырубку деревьев и рационализировать работу сельскохозяйственных угодий;
- поддерживать законопроекты по защите окружающей среды;
- поощрять предприятия, которые придерживаются экологической ответственности: снижать налоги, увеличить финансирование;
- повысить штраф за загрязнение природной среды;
- предупредить дальнейшие изменения концентрации парниковых соединений.
Для решения глобальной экологической проблемы потребуется сократить производство топлива, основанного на свойствах горючих полезных ископаемых. Наибольший вклад приносит переход автомобильной промышленности на изготовление электрокаров. Альтернативным вариантом решения проблемы является использование биотоплива, которое не уступает топливу из нефтепродуктов. В Бразилии его изготавливают из сахарного тростника, европейские страны переходят на производство биоэтанола.
Атомные электростанции, деятельность которых не требует использования нефти, угля и нефтепродуктов, помогают сократить эмиссию газообразной углекислоты в 25 раз. Компании по добыче и переработке горючих полезных ископаемых должны координировать свою работу с экологическим сообществом и правительством, чтобы сократить объем выделяемого в атмосферу метана. Данный законопроект был одобрен в России, США, Мексике, Норвегии и Нигерии.
Оздоровить воздушный слой Земли поможет сокращение масштабной вырубки лесов. Важно помнить, что деревья являются основным источником кислорода и природными утилизаторами углекислого газа. Растения малых размеров не способны переработать в короткий срок большой объем вредного соединения.
В Западной Европе вводят ограничения по использованию бойлеров и нагревателей холодной воды. Кроме того, технические характеристики оборудования должны соответствовать стандартам контроля по выбросу CO2 в процессе их эксплуатации. В такой ситуации в течение 6 лет можно сократить объем парниковых веществ на более чем 135 млн т в атмосфере.
В программу по борьбе с глобальным потеплением входит выведение на мировой уровень технологии возобновляемой энергии.
Принципы методики основаны на природных явлениях, повторяющихся циклами. Такие неограниченные ресурсы, как вода, свет солнца, приливы и ветер, можно использовать в промышленности. В 2022 году 20% мирового энергопотребления перешли на применение возобновляемых энергоисточников. Офисы в Германии получают электричество с помощью установки солнечных панелей.
История открытия
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли1 августа1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
- 2HgO→t2Hg O2↑{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория.
Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Нахождение в природе

Накопление O
2
в
атмосфере
Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1
. (3,85—2,45 млрд лет назад) — O
2
не производился
2
. (2,45—1,85 млрд лет назад) — O
2
производился, но поглощался океаном и породами морского дна
3
. (1,85—0,85 млрд лет назад) — O
2
выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4
. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O
2
в атмосфере
5
. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O
2
в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе).
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было.
Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита.
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2022 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Откуда берутся парниковые газы
Парниковые газообразные вещества присутствуют в составе атмосферы любой из планет Солнечной системы.
Из-за высокой концентрации неорганических соединений сильно повышается температура воздуха. В некоторой степени благодаря наличию летучих соединений, способных отражать тепло солнечных лучей, на Земле поддерживаются оптимальные условия для жизнедеятельности живых организмов.
В то же время большой объем парниковых компонентов способен привести к экологической катастрофе: высокая температура способна сжечь все неприспособленные к выживанию в таких условиях формы жизни. После зарождения планеты причиной возникновения парниковых соединений являлись естественные процессы:
- парообразование;
- химические реакции летучих веществ в атмосфере;
- формирование воздушного пространства;
- образование газообразных веществ в результате нагревания земной поверхности под действием солнечного света;
- вулканические извержения.
В начале образования атмосферы основными газами, создающими парниковое явление, были водяной пар и углекислый газ. Оба неорганических соединения концентрировались в тропосфере и нижних слоях стратосферы. Из-за их большого объема развивался мощный парниковый эффект, заставлявший воду кипеть и выбрасывать большое количество пара.
С процессом гниения растений и мелких живых организмов в атмосферу начали выделяться метан и оксиды азота. Озоновый слой начал смещаться, проникая в тропосферу.
Благодаря созданному воздушному барьеру из концентрированных газов, пропускающих тепло к Земле, поверхность планеты постепенно нагревалась до оптимальной температуры. На последующих этапах формирования атмосферы объем летучих веществ был низким, поэтому не представлял экологической угрозы.
С развитием жизни и эволюции человека химический баланс воздушного пространства начал перестраиваться. Развитие промышленности и расширение сельского хозяйства начали способствовать ухудшению экологии. Кроме того, люди относились безответственно к используемым полезным ископаемым. Никто не знал о выделяющихся газах в процессе горения топлива.
Наиболее разрушительное воздействие на атмосферу оказывает животноводство: продукты жизнедеятельности скота выделяют углекислоту. С возникновением химических удобрений в воздушном пространстве начала расти концентрация азотных соединений. Негативное воздействие на химическую структуру воздуха оказывает выращивание риса.
С развитием научного прогресса люди начали задумываться об изменениях климата и экологической обстановки на планете. В ходе исследований были обнаружены газообразные вещества, увеличивающие температуру поверхности земли. Это стало причиной общей тревоги, когда ученые доказали, что нагревание почвы не останавливается. Большую часть ответственности за это явление несут рост предприятий и активные выбросы ядовитых веществ в атмосферу.
Химические заводы, крупные промышленные компании, пищевая и сельскохозяйственная отрасли выбрасывают тонны углекислого газа, метана, азотных оксидов и водного пара.
В естественных условиях эти вещества образуются в результате разложения органических материалов:
- водорослей;
- животных;
- растений;
- отходов жизнедеятельности.
Поддержка жизни и рекреационное использование
O2 как дыхательный газ низкого давления применяется в современных космических костюмах, которые окружают тело пассажира дыхательным газом. В этих устройствах используется почти чистый кислород при примерно одной трети от нормального давления, что приводит к нормальному парциальному давлению в крови O2.
Этот компромисс более высокой концентрации кислорода для более низкого давления необходим для поддержания гибкости костюма. 32)
Дайверы и подводники также используют искусственно поставляемый О2. Подводные лодки и атмосферные подводные костюмы обычно работают при нормальном атмосферном давлении.
Дыхательный воздух очищается от углекислого газа путем химической экстракции, а кислород заменяется для поддержания постоянного парциального давления.
Дайверы, погружающиеся при давлении окружающей среды, дышат воздушными или газовыми смесями с кислородной фракцией, подходящей для рабочей глубины.
Чистый или почти чистый O2 при погружении при давлениях выше атмосферного, обычно ограничивается ребризерами или декомпрессией на относительно небольших глубинах (глубина ~ 6 метров или менее), 33) или медицинской помощи в камерах рекомпрессии при давлениях до 2,8 бар, где от острой кислородной токсичности можно избавиться без риска утопления.
Глубокое погружение требует значительного разведения O2 с другими газами, такими как азот или гелий, для предотвращения кислородной токсичности.
Люди, которые поднимаются на горы или летают в самолётах без давления, иногда имеют приборы для поставки дополнительного O2.
В коммерческих самолетах под давлением, аварийный O2 автоматически подается пассажирам в случае сброса давления в кабине. Внезапная потеря давления в кабине активирует химические генераторы кислорода над каждым сиденьем, в результате чего падают кислородные маски.
Экзотермическая реакция затем производит постоянный поток газообразного кислорода.
Кислород, предположительно вызывающий мягкую эйфорию, имеет историю рекреационного использования в кислородных барах и в спорте. Кислородные бары существуют в Японии, Калифорнии и Лас-Вегасе, штат Невада, с конца 1990-х годов, предлагая пользователю вдохнуть больше O2, чем обычно, за плату.
34) Профессиональные спортсмены, особенно в американском футболе, иногда выходят с поля между играми и надевают кислородные маски, чтобы повысить производительность. Фармакологический эффект таких действий сомнителен; эффект плацебо – более вероятное объяснение.
Доступные исследования подтверждают эффект повышения производительности от употребления обогащенных кислородом смесей, только если они используются во время аэробных упражнений.
Другие виды рекреационного использования, в которых не используется дыхание, включают в себя пиротехнические применения.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий
 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий оксида
оксида
Соответствующее химическое уравнение:
https://www.youtube.com/watch?v=qxuyD2Bj8rU
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган
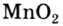
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 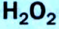 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган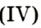
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 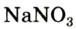

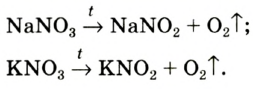
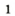
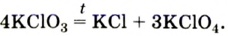
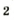 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: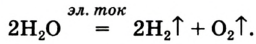
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
- 2KMnO4→tK2MnO4 MnO2 O2↑{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
- 2H2O2→MnO22H2O O2↑{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
- 2KClO3⟶2KCl 3O2↑{displaystyle {ce {2KClO3 -> 2KCl 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
- 2HgO→100°C2Hg O2↑{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 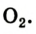
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 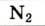 | 78,09 | 75,51 |
| Кислород | 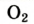 | 20,95 | 23,15 |
| Аргон | 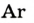 | 0,93 | 1,28 |
| углекислый газ | 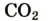 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 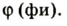
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 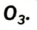 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 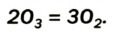
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
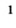
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Сварка и резка металлов
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни, для лечения патологии желудочно-кишечного тракта в виде кислородных коктейлей.
Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки.
Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха.
Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометруредуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавкиE948[26], как пропеллент и упаковочный газ.
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты.
В тепличном хозяйстве для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Свойства и молекулярная структура
При стандартной температуре и давлении, кислород представляет собой бесцветный, безвкусный газ, не имеющий запаха, с молекулярной формулой O2, называемый диоксидом. 9) Являясь диоксидом, кислород имеет два атома, химически связанных друг с другом.
Эта связь может быть описана по-разному, на основе уровня теории, но разумно и просто описывается как ковалентная двойная связь, которая возникает в результате заполнения молекулярных орбиталей, образованных из атомных орбиталей отдельных атомов кислорода, заполнение которых приводит к связи порядка двух.
Более конкретно, двойная связь является результатом последовательной, низкой и высокой энергии или Aufbau, заполняя орбитали и, как следствие, отменяя вклады двух электронов после последовательного заполнения низких σ и σ*-орбиталей; σ перекрытие двух атомных 2p-орбиталей, лежащих вдоль молекулярной оси OO и формируя π-перекрытие двух пар атомных 2p-орбиталей, перпендикулярных оси OO-молекул, а затем отменяя вклады от оставшихся двух из шести 2p-электронов после их частичного заполнения наименьших π- и π*-орбиталей [24].
Эта комбинация аннулирования σ и π перекрытий приводит к характеру и реакционной способности двойного связывания диоксида и триплетному электронному основному состоянию. Конфигурация электронов с двумя неспаренными электронами, найденная в двуосных орбиталях с равной энергией, представляют собой конфигурацию, называемую триплетным состоянием спина.
Следовательно, основное состояние молекулы O2 называется триплетным кислородом.
При наивысшей энергии, частично заполненные орбитали являются антисвязывающими, и поэтому их заполнение ослабляет порядок связей с трех до двух. Из-за его неспаренных электронов, триплетный кислород медленно реагирует с большинством органических молекул, которые имеют парные спины электронов; это предотвращает самовозгорание.
В триплетной форме, молекулы O2 парамагнитны. То есть, они придают магнитный характер кислороду, когда он находится в присутствии магнитного поля, из-за спиновых магнитных моментов неспаренных электронов в молекуле и отрицательной энергии обмена между соседними молекулами O2.
Жидкий кислород настолько магнитен, что в лабораторных демонстрациях мостик жидкого кислорода может поддерживаться против собственного веса между полюсами мощного магнита. 10) Синглетный кислород – это название, присвоенное нескольким более высокоэнергетическим видам молекулярного O2, в котором все спины электронов спарены.
Он намного более реактивен с общими органическими молекулами, чем молекулярный кислород как таковой. В природе, синглетный кислород обычно образуется из воды при фотосинтезе, используя энергию солнечного света. Он также образуется в тропосфере путем фотолиза озона светом короткой длины волны и иммунной системой в качестве источника активного кислорода.
Каротиноиды в фотосинтезирующих организмах (и, возможно, животных) играют важную роль в поглощении энергии из синглетного кислорода и превращении его в невозбужденное основное состояние до того, как оно может нанести вред тканям. 11)
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 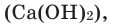
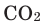
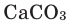
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (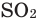
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (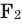
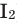
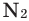
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (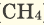
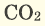
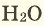
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г., то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C,2,09 мл/100 г при 50 °C) и спирте(2,78 мл/100 г при 25 °C).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 МПа[17].
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейкиa=5,403 Å,b=3,429 Å,c=5,086 Å;β=132,53°[18].β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å,α=46,25°[18].γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[18].
Ещё три фазы существуют при высоких давлениях:
Фториды кислорода
- 2F2 2NaOH⟶2NaF H2O OF2↑{displaystyle {ce {2F2 2NaOH -> 2NaF H2O OF2 ^}}}
- F2 O2⟶O2F2{displaystyle {ce {F2 O2 -> O2F2}}}
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 годуПьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[23][24].
Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород).
- 4Li O2⟶2Li2O{displaystyle {ce {4Li O2 -> 2Li2O}}}
- 2Sr O2⟶2SrO{displaystyle {ce {2Sr O2 -> 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO O2⟶2NO2↑{displaystyle {ce {2NO O2 -> 2NO2 ^}}}
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 15O2⟶12CO2 6H2O{displaystyle {ce {2C6H6 15O2 -> 12CO2 6H2O}}}
- CH3CH2OH 3O2⟶2CO2 3H2O{displaystyle {ce {CH3CH2OH 3O2 -> 2CO2 3H2O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH O2⟶CH3COOH H2O{displaystyle {ce {CH3CH2OH O2 -> CH3COOH H2O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета.
Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- 2Na O2⟶Na2O2{displaystyle {ce {2Na O2 -> Na2O2}}}
- 2BaO O2⟶2BaO2{displaystyle {ce {2BaO O2 -> 2BaO2}}}
- H2 O2⟶H2O2{displaystyle {ce {H2 O2 -> H2O2}}}
- Na2O2 O2⟶2NaO2{displaystyle {ce {Na2O2 O2 -> 2NaO2}}}
- K O2⟶KO2{displaystyle {ce {K O2 -> KO2}}}
- 3KOH 3O3⟶2KO3 KOH⋅H2O 2O2↑{displaystyle {ce {3KOH 3O3 -> 2KO3 KOH * H2O 2O2 ^}}}
- PtF6 O2⟶O2PtF6{displaystyle {ce {PtF6 O2 -> O2PtF6}}}
В этой реакции кислород проявляет восстановительные свойства.


![{displaystyle {ce {2HgO ->[t] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/804710fd51b4d0c4adca861caa5d341fb5921d84)
![{displaystyle {ce {2KMnO4 ->[t] K2MnO4 MnO2 O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fa985cedcb06a74333be1dbf055f4b95e5b416e4)
![{displaystyle {ce {2H2O2 ->[MnO2] 2H2O O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39356fdea2f393003bf49298522c43c2aa66e358)

![{displaystyle {ce {2HgO ->[100{°}C] 2Hg O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ed83305529bb4aea427f4cd72a0f92c5fe51aef)














