- Атом и молекула платины. формула платины. строение атома платины:
- Вопросы и задания для самоконтроля
- Газы в сплавах платины
- История открытия:
- Осмий
- Особенности литья сплавов платиновой группы
- Платина — госстандарт
- Платина — энциклопедия «гранат»
- Платина, свойства атома, химические и физические свойства.
- Получение:
- Применение платины:
- Применение:
- Родий
- Рутений
- Физические свойства платиновых металлов
- Физические свойства:
- Химические свойства платиновых металлов
Атом и молекула платины. формула платины. строение атома платины:
Платина (лат. Platinum, от исп. Plata – «маленькое серебро», «серебришко») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Pt и атомным номером 78. Расположен в 10-й группе (по старой классификации – побочной подгруппе восьмой группы), шестом периоде периодической системы.
Платина – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Платина обозначается символом Pt.
Как простое вещество платина при нормальных условиях представляет собой мягкий, тяжёлый, блестящий металл серебристо-белого цвета.
Молекула платины одноатомна.
Химическая формула платины Pt.
Электронная конфигурация атома платины 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d9 6s1. Потенциал ионизации (первый электрон) атома платины равен 864,4 кДж/моль (8,95883(10) эВ).
Строение атома платины. Атом платины состоит из положительно заряженного ядра ( 78), вокруг которого по шести оболочкам движутся 78 электронов. При этом 77 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку платина расположен в шестом периоде, оболочек всего шесть.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлены s-, р-, d- и f-орбиталями.
Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома платины на 5d-орбитали находятся восемь спаренных электронов и один неспаренный электрон. На внешнем энергетическом уровне атома платины на 6s-орбитали находится один неспаренный электрон. В свою очередь ядро атома платины состоит из 78 протонов и 117 нейтронов. Платина относится к элементам d-семейства.
Радиус атома платины (вычисленный) составляет 177 пм.
Атомная масса атома платины составляет 195,084(9) а. е. м.
Вопросы и задания для самоконтроля
- 1. Какие металлы входят в платиновую группу?
- 2. Чем характерен сплав системы платина — иридий?
- 3. Как влияют кремний, алюминий и углерод на свойства сплавов платины?
- 4. Назовите особенности литья сплавов платиновой группы.
- 5. В каких тиглях и в какой атмосфере ведут плавку сплавов платиновой группы?
Газы в сплавах платины
Газы не оказывают заметного действия на сплавы платины, однако, попадая в расплав, они удерживаются в нем, и образуют поры и раковины — очаги разрушения.
Платина и сплавы на ее основе адсорбируют на поверхности пары воды, кислород, водород, оксид углерода.
Кислород. Платина незначительно растворяет кислород и образует три оксида: PtO, Pt304 и Pt02. На поверхности платины всегда существует прочно связанный с ней слой кислорода.
Азот. Платина и иридий не растворяют азот и не образуют нитридов.
Водород. Платина принадлежит к числу металлов, быстро и необратимо адсорбирующих водород аналогично палладию и никелю. В нагретом состоянии платина обладает высокой проницаемостью по отношению к водороду, причем скорость диффузии и растворимость водорода значительно увеличиваются с повышением температуры. Однако растворимость водорода в платине даже при высоких температурах мала.
История открытия:
Платина известна с древнейших времен, в чистом виде впервые получена У. Волланстоном в 1803 г. В природе встречается как самородная платина так и образуя минералы: поликсен, ферроплатина, палладистая платина, куперит (PtS), бреггит (Pt, Pd,Ni)S. В переводе с испанского Platina означает “серебришко”.
Обнаружив этот металл в Новом Свете на рубеже XVI и XVII веков, испанцы не смогли по достоинству оценить его, поскольку он не поддавался плавке обычными для европейцев методами. На Урале первые находки самородной платины, обратившие на себя внимание минералогов, относятся к 1819 году. Вскоре платину стали называть «русским металлом», поскольку до 90% ее добывалось на Урале
Осмий
Порошок осмия легко окисляется кислородом до тетраоксида OsO4, который восстанавливается различными органическими восстановителями до диоксида OsO2.
Дисульфид осмия OsS2 может быть получен аналогично RuS2. Для осмия, как и для рутения, характерно образование OsSe2 и OsTe2.
Тетрахлорид осмия OsCl4 получается при хлорировании осмия. Одновременно может быть получен трихлорид OsCl3.
При сплавлении металлического осмия со смесью щелочи и пероксида натрия (или бария) получается осмиат натрия, который при растворении в соляной кислоте образует комплексный хлорид осмия:
Na2[OsO4] 8HCl ⇄ Na2[OsCl6] Cl2 4Н2O
Это соединение можно восстановить соляной кислотой до Na3[OsCl6]. Свойства водных растворов комплексных хлоридов осмия напоминают свойства рутениевых комплексов.
В аффинажных операциях большое значение имеет соль Фреми [OsO2(NH3)4]Cl2, которую получают по реакции:
K2[OsO4] 4NH4Cl ⇄ [OsO2(NH3)4]Cl2 2КСl 2Н2O
При прокаливании этой соли получается металлический осмий.
Статья на тему общие свойства платиновых металлов
Особенности литья сплавов платиновой группы
Плавку платины и ее сплавов ведут в тигельных индукционных высокочастотных печах с набивной футеровкой из оксида кальция, магнезита или оксида циркония. Тигли для плавки изготавливают из тех же огнеупоров. Шамотовые и графитовые тигли не пригодны для плавки платиновых сплавов из-за образования хрупкого силицида платины и насыщения расплава углеродом.
В качестве шихтовых материалов используют губчатую платину, спрессованную в брикеты, или скрап. Легирующие компоненты вводят в расплавленную платину при 1850—1900°С. Несмотря на слабое взаимодействие платины с печными газами плавку ведут форсированно. Раскисление расплава перед заливкой не производят из-за опасения загрязнения сплавов избытком раскислителя.
Заливку платиновых сплавов ведут с небольшим перегревом расплава в подогретые стальные или туфовые (известковые формы).
Плавку палладия ведут в окислительной атмосфере в магнезитовых тиглях. При плавке в кварцевых тиглях особенно вредна восстановительная атмосфера, так как она способствует загрязнению расплава кремнием. При содержании в расплаве 0,003% кремния в отливках появляются горячие трещины. Перед разливкой палладий раскисляют 0,1% алюминия. Флюс при плавке не применяют.
Для плавки чаще всего используют индукционные печи с магнезитовой футеровкой и окислительной атмосферой. В качестве раскислите- лей применяют алюминий и силикокальций.
При плавке благородных металлов и сплавов особое значение придается созданию условий, обеспечивающих их минимальные безвозвратные потери. В частности, не допускаются излишне высокий перегрев расплавов над температурой ликвидуса сплавов и длительная выдержка при температурах литья.
Платина — госстандарт
Платина — энциклопедия «гранат»
Платина, химический знак Pt, атомный вес 193,4, точка плавления 1746° (по Нернсту), удельный вес 21,48. В природе встречается в самородном виде, но никогда в чистом, а обыкновенно с примесью палладия, иридия, рутения, родия и осмия; последние металлы суть постоянные спутники платины и потому называются металлами платиновой группы; кроме того, часто с примесью меди и железа. Главное месторождение платины — Урал; в незначительных количествах попадается в Калифорнии, Бразилии, Борнео, Доминго и Австралии.
Металлическая платина имеет белый, несколько с синеватым оттенком цвет, вполне металлический блеск и, сваренная, отличается большей твердостью, чем сплавленная. В нагретом состоянии куется, сваривается и вытягивается в тонкую проволоку. Незначительные примеси других металлов сильно понижают ковкость; поэтому продажная, обычно содержащая иридий, платина гораздо хрупче, чем чистая. Платина принадлежит к тугоплавким металлам, почему и находит применение как материал для тиглей, употребляемых в химической лаборатории. Легко плавится платина в известковом тигле в пламени гремучего газа и светильного газа, сжигаемого в струе кислорода (на лампе Девиля). В белокалильном жару два платиновые куска свариваются; в красно-калильном — платиновые сосуды пропускают через стенки водород; другие же газы не диффундируют. На воздухе не изменяется, даже в сильном жару не окисляется; кислоты: соляная, азотная, серная и плавиковая на нее действуют крайне незначительно. Ввиду этого, платиновые сосуды употребляются на заводах для упаривания камерной серной кислоты до крепости в 66° Б. Только царская водка легко и вполне растворяет платину. Гидраты окисей калия, натрия, лития, а также хлористый литий сильно действуют на платину, равным образом и смесь селитры и окиси калия. Действует на платину смесь угля и кремнезема, образуя хрупкую кремнистую платину; ввиду этого не рекомендуется платиновые тигли нагревать между углями. Губчатая платина получается прокаливанием аммониевого хлороплатината (NH4)2 PtCL6, — представляет серую губчатую массу, которая при белом калении и при сильном давлении сваривается в компактную массу и принимает металлический блеск полированной стали. Платиновая чернь — черный, подобно углю, тяжелый порошок, принимающий при давлении белый цвет и металлический блеск, есть не что иное, как металлическая платина в состоянии весьма тонкого измельчения. Получается платиновая чернь восстановлением платиновых соединений (винным спиртом, сахаром, формалином) в щелочной среде. Платиновая чернь и губчатая платина имеют способность поглощать газы, особенно кислород; объем платиновой черни может сгустить в своих порах несколько сот объемов кислорода. Свойство мелко раздробленной платины сгущать в своих порах кислород и давать легко восстановимые низшие степени окисления на поверхности своих раздробленных мелких частиц — обусловливает окислительное действие платина в этих состояниях уже при обыкновенной температуре. Окислителем является кислород, воздуха. Благодаря способности платиновой черни ускорять окисление, в технике платина в виде черни употребляется для окисления сернистого газа в серный ангидрид, винного спирта в уксусную кислоту и т. д. Для окисления сернистого газа в серный ангидрид признается наилучшей температура в 400°, так как при этой температуре получаются наибольшие выходы SО3. Такое действие (ускорять и повышать окисление) платины называют контактным, или каталитическим (см. катализ). Платина находит применение для химических и электрохимических целей, а также как материал химических сосудов (тигли, чашки, проволока, жесть), для изготовления реторт для упаривания серной кислоты; платиновые соли употребляются не только в химическом анализе, но и в технике, например для фотографии; в виде платиновой черни — в химических реакциях окисления. Благодаря редкости металла и вследствие его технического применения, в последние годы цена на платину сильно возросла. О месторождениях и добывании платины см. приложение.
Е. Орлов.
Добывание платины и ее соединения.
Самородная платина, встречающаяся в природе в россыпях, никогда не бывает чиста, представляя сплав платины с иридием, палладием, родием, железом, медью и иногда о осмием. Платиновые россыпи произошли чрез разрушение большой массы горных пород, в которых платина представляет еще гораздо меньшее содержание, чем в россыпях. Спутниками зерен и листочков самородной платины в россыпях являются зерна кварца, серпентина, циркона, корунда, титанового и хромистого железняков, золота и т. п. Платиносодержащий песок ничем не отличается по внешнему виду от обыкновенного песка. Среднее содержание платины в этом песке Керль считает 6—8 г на 1000 кг, иногда оно поднимается до 40 г или падает до 2,6 г. Получение платины из россыпей распадается на 2 части: выделение самородной платины из носков и ее очищение. Извлекается самородная платина из песков, как золото, промывкой; причем иногда еще подвергается обработке ртутью для извлечения золота. Продукт промывки поступает в продажу под названием сырой платины, или платиновой руды. О мировой добыче платины и добыче ее в России см. XV, 496, приложение статистика горного дела.
Сырую платину подвергают очистке или на специальных платиновых заводах, или на химических заводах. По описанию Луи, теперь в России перерабатывают платиновую руду так. Нагревают с царской водкой на песчаной бане в чашках в 0,6 м в диаметре. Раствор выпаривают досуха, остаток извлекают соляной кислотой, раствор снова выпаривают и обрабатывают остаток соляной кислотой, повторяя это до полного разложения азотной кислоты. Последний раствор отцеживается от осадка, который продается на германские химические заводы, перерабатывающие его на металлы платиновой группы. Раствор же осаждают нашатырем (NH4Cl); нашатырный осадок промывают на особых фильтрах с насосом и получают его в виде плиток. Его высушивают медленно и прокаливают в муфеле на платиновых пластинках. Получается плитка губчатой платины. Ее измельчают и спрессовывают в стальной ступке Абиха, после чего сплавляют в печи Девиля. Сплавленная платина отливается в формы, сделанные из известкового туфа. Получаются болванки толщиной в 5 см. Нашатырный маточный раствор, отцеженный от хлороплатината, содержит еще платину. Ее осаждают железом и затем рафинируют как сырую платину.
Платина образует с другими элементами соединения или по типу закиси PtX2 (например РtO, РtCl2) или по типу окиси PtX4 (например, РtO2, PtCl4); здесь — Х обозначает одновалентный элемент, например СІ. В химической практике чаще всего находит применение т. н. хлорная платина, добываемая растворением платины в царской водке при слабом нагревании; получается бурый раствор, из которого испарением можно выделить буро-красные призмы состава: H2PtCl6.6Н2О. Это вещество и носит название хлорной платины. При нагревании из этого соединения удаляется вода, НСІ, часть хлора; остается PtCl2, хлористая платина. Соединение же PtCl4 можно получить из H2PtCl6.6H2O при нагревании в струе хлора при 360°. РtCl4 выкристаллизовывается из водных растворов с 4Н2O. Соединение H2PtCl6 принимают за особого рода кислоту, называемую хлороплатиноводородной. Потому что существуют многочисленные солеобразные производные ее, в которых водород ее замещается металлом или аммониевой группой, например K2PtCl6, (NH4)2РtCl6; соединения эти носят название хлороплатинатов, например калия, натрия. Хлористая платина, PtCl2, нерастворима в воде, но в горячей соляной кислоте быстро растворяется, образуя в водном растворе кислоту H2PtCl4; соли этой кислоты, например, K2PtCl4, (NH4)2 РtСl4 — носят название хлороплатинитов (например, калия, натрия). Хлороплатинаты и хлороплатиниты называются комплексными солями. Комплексные соли вообще характеризуются тем, что при реакциях обмена роль одного из ионов играет сложный комплекс атомов, группирующихся около атома металла, как бы около центрального ядра, например: 1) K2РtСl6 2AgNO3 = Ag2PtCl6 2KСІ; 2) K2РtCl4 2AgNO3 = Ag2PtCl4 2KCl. Здесь комплекс атомов, группирующихся около атома платины, как бы около центрального ядра, (РtСl6), (РtСl4), играет роль отрицательного иона простой соли, например СІ в хлористом калии, КСІ.
Кроме вышеупомянутых солей, платина образует многочисленные сложные соединения, в которых играют роль ионов платиново-аммиачные комплексы, например Pt(NH3)4Х2 или Pt(NH3)6Х4, где Х=СІ, Вr, J, (NO3), ½ (SO4). В этих солях роль металла играет дву- или четырехвалентный комплекс, состоящий из атома платины и 4-х или 6 частиц аммиака. Как видно, валентность самой платины по отношению Х остается и после присоединения аммиака такой же, как и в простых ее соединениях: соединения Pt(NH3)4Х2 называются платозаминовыми солями и получаются из солей закиси платины, соединения Pt(NH3)6Х4 носят название платини-аминовых солей. Но для обоих рядов существуют соли и с меньшим содержанием аммиака, вообще с (NH3)n, где n = 6, 4, 3, 2 и 1. Убыль аммиака отражается на изменении свойств Х-ов: когда исчезает один аммиак, одновременно исчезает и один Х, как ион с его подвижностью, причем Х вступает в самый комплекс около платинs вместо ушедшего NH3; например:
[Pt(NH3)6]Сl4; [Pt(NH3)8/Cl2]Cl; [Pt(NH3)2/Cl4] и [Pt(NH3)8/Cl5]K. Изучение электропроводности растворов этих платиновых соединений явилось простым и быстрым средством для Вернера, решить, сколько Х-ов в данной соли обладают указанной подвижностью ионов. Изучая комплексные соединения платины, кобальта, хрома и т. д., Вернер отметил две характерные особенности их: 1) число молекул воды, аммиака и пр., присоединяющихся к молекуле металлической соли в гидратах, аммиакатах, число отрицательных атомов или остатков, входящих в состав комплексных солей, имеет строго определенное значение, чаще других повторяется 6, затем 4; 2) кислотные остатки, входящие в состав комплексных молекул: Cl, J, NO2, NO3, SO4 и пр. могут обладать существенно различным характером. В одних случаях остатки эти имеют характер типичных ионов, отличаются подвижностью, склонностью к реакциям солевого обмена, например [Pt.4NH3).Cl2; [Pt.4NH3)(NO3)2 и пр. В других случаях, наоборот, кислотные остатки прочно удерживаются комплексной молекулой, в обменное разложение вступают не моментально, как анионы солей, но сравнительно медленно; вообще скорее напоминают атомы или остатки, связанные с углеродом в органических соединениях, например, в С2Н5Cl; СН3СІ. Существуют также смешанные типы, где в одной и той же комплексной молекуле, наряду с легко подвижными и, следовательно, ионизированными кислотными остатками находятся малоподвижные и прочно связанные, например, в [Pt(NH3)8/Cl3]Cl. Для объяснения различных случаев комплексных соединений, Вернер предложил координационную теорию, по которой в каждой комплексной молекуле один атом (чаще всего металл, например, Pt, Со, Сr, Сu) занимает центральное положение (ядро), а около него уже группируются все остальные атомы, атомные группы и целые молекулы. Это будет центральный атом молекулы. Число атомов или групп, непосредственно примыкающих к центральному атому и могущих поместиться в так называемой внутренней, или первой координационной сфере, по Вернеру, строго ограничено, и притом не зависит от способа, при помощи которого осуществляется их связь с другими частями молекул. В громадном большинстве случаев оно не превышает 6; в некоторых случаях бывает меньше 6, например, 4. Когда число 6, то атомы или атомные группы, непосредственно окружающие центральный атом, расположены по углам некоторого октаэдра, в простейшем случае правильного; когда же число равняется 4, атомы или атомные группы располагаются по четырем углам четырехугольника или квадрата (рис. 1 и 2).
Распределение составных частей комплексной молекулы Вернер связывает с той второй особенностью комплексных соединений, на которую выше обращено внимание. Компоненты первой, или внутренней, сферы связаны непосредственно с центральным атомом и притом прочно, наподобие того, как хлор связан с углеродом в органических соединениях. Наоборот, компоненты внешней сферы связаны с центральным атомом чрез посредство других атомов или групп, легко подвижны и склонны к ионизации. Для разъяснения разберем несколько случаев из группы платозаминовых соединений. Например, при действии NH3 на двухлористую платину, PtCl2, в зависимости от условий, образуется несколько различных соединений; из них мы остановимся здесь только на четырех. Одно из них содержит 4 молекулы NH3, например, PtCl2.4NH3 три остальных отвечают одной и той же эмпирической формуле PtCl2.2NH3. Соединение PtCl2.4NH3, т. н. хлорид 1-го основания Рейзе, легко реагирует с ляписом, причем оба атома хлора замещают остаток азотной кислоты: PtCl2.4NH3 2AgNO3 = Pt(NO3)3 4NH3 2AgCl; а также с влажной окисью серебра оно дает 2АgСІ и Pt(OH)2. 4NH3, представляющее сильную щелочь. Отсюда ясно, что в этой соли Рейзе оба атома хлора носят характер ионов (анионов) и что группа Pt.4NH3, представляет из себя двухвалентный катион Pt4NH3, и потому координационная формула хлорида первого основания Рейзе будет [Pt 4NH3] Cl2; гидрата: [Pt. 4NH3](OH)2, азотнокислой соли [Pt. 4NH3](NO3)2 и т. д. Из трех других упомянутых соединений с общей эмпирической формулой РtCl2.2NH3, два, довольно похожие друг на друга (малорастворимые тела желтого цвета), трудно и медленно реагируют с ляписом и вообще мало склонны к реакциям обменного разложения. Очевидно, атомы хлора в них не ионизированы (или с трудом переходят в состояние ионов), и потому, по Вернеру, им следует приписать координационное строение [Pt.2 NH3Сl2); другими словами: все составные части молекулы здесь помещаются во внутренней сфере, в непосредственной связи с атомом платины. Однако, вещества эти различаются во многих отношениях (по кристаллической форме, растворимости, реакциям) и получаются различным образом. Одно из них, носящее название хлорида 2-го основания Рейзе, образуется при отщеплении 2 молекул NH3 от хлорида [Pt 4NH3] Cl2 при нагревании последнего или при действии на него соляной кислотой. Другое, с названием соли Пейроне, получается при действии NH3 (в сравнительно небольшом количестве) на раствор Рt Cl2 в соляной кислоте, или же на двойную соль Pt Cl2. 2 KСІ. Оба эти основания при действии NH3 дают хлорид 1-го основания Рейзе [Pt. 4NH3] Cl2. Все это свидетельствует в пользу того, что они обладают одинаковым молекулярным весом и, следовательно, изомерны. Различие их обусловливается различным пространственным расположением атомов 2 NH3 и Cl2 в молекуле; но об этом будет упомянуто дальше. Третье (последнее) соединение эмпирической формулы PtCl2. 2NH3, отличающееся очень трудной растворимостью в воде и зеленым цветом, носит название соли Магнуса. Судя по эмпирической формуле, оно изомерно с двумя предыдущими, но, в отличие от них, обладает вдвое более сложной формулой. Известно, что KСІ, NaCl, NH4Cl легко соединяются с двухлористой платиной, PtCl2, давая соединения типа PtCl2. 2MeCl или PtCl2.MeCl2 и т. д. (Me=Nа, Kа, NH4, Мg). Образующиеся простые соединения суть соли некоторой двухосновной комплексной кислоты формулы Н2 [PtCl4]: в этой кислоте платина входит в состав аниона [Pt СІ4], а водород играет роль катиона. Вышеупомянутые двойные соединения должны быть рассматриваемы как соли такой комплексной кислоты K2 [Pt СІ4], Na2 [Pt Cl4], Мg [Pt СІ4]. При действии ляписа на эти двойные соли (хлороплатиниты) образуется серебряная соль той же комплексной кислоты в виде нерастворимого осадка сёможно-красного цвета: K2 (Pt Cl4) 2Ag NO3 = Ag2 (Pt Cl4) 2 KNO3. Все хлороплатиниты дают эту характерную реакцию, а потому она может служить для распознавания солей Н2 (PtCl4). Вот если на вышеупомянутую соль Магнуса подействуем ляписом, то моментально зеленый цвет переходит в сёможно-красный, а исследование продуктов превращения показывает, что последнее выражается так [РtCl2. 2 NH3]2 2 Аg NO3 = Ag2[PtCl4] [Pt. 4NH3].NО2. Ясно поэтому, что соль Магнуса есть продукт сочетания двух комплексных ионов: [PtCl4] (отрицательный) и [Pt 4NH3], (положительный) что она есть хлороплатинит 1-го основания Рейзе: [Pt. 4NH3]PtCl4. Верность этого заключения подтверждается ее синтезом: если слить бесцветный раствор соли 1-го основания Рейзе с красным раствором какого-нибудь хлороплатинита, то немедленно получится обильный осадок зеленой соли Магнуса:
[Pt 4NH3] Cl2 K2 [PtCl4] = [Рt4NH3][РtCl4] 2KСІ.
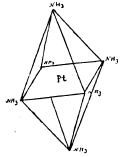
Рис. 1.
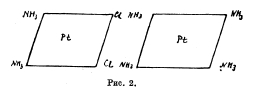
Рис. 2.
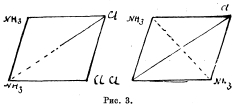
Рис. 3.
Чем же объясняется разница двух изомерных солей: соли Пейроне и хлорида 2-го основания Рейне. Соль Пейроне получается при действии NH3 на соли Н2РtCl4:
(NH4)2[Pt Cl4] 2NH3 = [Pt.2 NH3Cl2] 2NH4Cl.
Это кристаллический порошок оранжево-желтого цвета 1 весовая часть его растворяется в 26 весовых частях воды при 100° и в 387 частях при 0°. Хлорид 2-го основания Рейзе получается при отщеплении NH3 из соли 1-го основании Рейзе:
(Pt4NH3)Cl2 = (Pt2NH3Cl2) 2 NH3. Микроскопические октаэдры бледно-желтого цвета. 1 весовая часть растворяется в 160 весовых частях воды при 100° и 4472 весовых частях при 0°. При действии пиридина оба вещества дают различные, но притом изомерные между собой соединения, отвечающие общей координационной формуле (Pt2NH32Py).Сl2. (Здесь символом Ру обозначается пиридин). Изомерию солей Пейроне и Рейзе Вернер объясняет, исходя из плоскостной схемы, которая, по его представлению, должна отвечать координационному числу 4. Легко видеть, что здесь по теории возможны два и только два пространственных изомера, как это видно из следующих схем рис. 3. Переводя соли Пейроне и Рейзе в пиридиновые соединения, синтезируя те же пиридиновые соединения из пиридиновых солей, подобных вышеупомянутым солям Пейроне и Рейзе, и изучая отношение их к высокой температуре и к действию НСІ, Вернеру удалось доказать справедливость плоскостного представления обоих изомерных соединений.
Из платин-аминовых соединений получены соли разного состава, например:
[Pt(NH3)6]Cl4; (Рt(NH3)6] (NO3)4; [Рt(NH3)6] CO2; [Pt(NH3)6](SО4)2; [Pt(NH3)4/Cl2](NО3)2 и т. д. Интересно, что комплекс [Pt(NH3)6] имеет некоторое сходство с щелочноземельными металлами, так как углекислая и сернокислая соли его отличаются малой растворимостью в воде. При действии азотной кислоты на соль Магнуса, Гро получил белый порошок, так называемый хлороплатинидиамин-нитрат, состава: [Pt(NH3)4/Cl2](NО3)2. Это — азотнокислая соль Гро.
Получены соли: [Pt(NH3)4/ NО3](NО3)2 и [Pt(NH3)8/ (ОН)2](NО3)2 называются солями Жерара. Соль Клеве: [Pt(NH3)8/ Cl3]Cl – хлористый хлороплатинимонодиамин и т. д. и т. д.
См. Л. А. Чугаев, «О химическом строении комплексных соединений» (Спб. 1910).
Е. Орлов.
Платина, свойства атома, химические и физические свойства.
Pt 78 Платина
195,084(9) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p7 5d9 6s1
Платина — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 78. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), шестом периоде периодической системы.
Атом и молекула платины. Формула платины. Строение атома платины
Цена на платину
Изотопы и модификации платины
Свойства платины (таблица): температура, плотность, давление и пр.
Физические свойства платины
Химические свойства платины. Взаимодействие платины. Химические реакции с платиной
Получение платины
Применение платины
Таблица химических элементов Д.И. Менделеева
Получение:
Природные минералы или шламы электрорафинирования меди растворяют в царской водке, осаждают примеси в виде гидроксидов, действием NH4Cl, переводят в (NH4)2[PtCl6], который разлагают при 800°С и восстанавливают в токе водорода.
Применение платины:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Применение:
Катализатор многих химических процессов, платино-родиевый сплав — катализатор окисления аммиака в производстве азотной кислоты. Для изготовления лабораторной посуды, тиглей, электродов, термопар, фильер. В электротехнике — электрические контакты, сопротивления, постоянные магниты (сплав с Со), медицинское оборудование и ювелирные украшения.
Родий
Так же, как иридий, родий — малоактивный металл и в компактном виде не растворяется в царской водке. С кислородом он образует соединения Rh2О3 и RhО2. При пропускании сероводорода через раствор родиевых солей образуется сернистый родий Rh2S3, который при нагревании в токе кислорода или воздуха разлагается с образованием металлического родия.
Хлорид родия RhCl3 при растворении в соляной кислоте образует родиевохлористоводородную кислоту H3[RhCl6]. Однако ион [RhCl6]³⁻ подвергается акватации уже при концентрации хлор-иона, меньшей 6 М:
[RhCl6]³⁻ H2O ⇄ [Rh(H2O)Cl5]²⁻ Сl⁻
При pH>2,9 начинается процесс гидролиза родиевых комплексов:
[RhCl6]³⁻ nH2O ⇄ [Rh(H2O)n-1 (OH)Cl6-n]³⁻ nСl⁻ H⁺.
Поэтому в водных растворах трихлорид родия может существовать в виде катионных, анионных и нейтральных аквогидроксохлорокомплексов. Такое многообразие форм затрудняет выделение этого металла из раствора обычными гидрометаллургическими методами.
Аналогично ведут себя соли родиевой кислоты — хлорородиаты (Na3[RhCl6], K3[RhCl6] и т. д.). При обработке хлорородиата аммония нитритом натрия образуется Na3[Rh (NO2)6]. Добавка хлористого аммония к раствору этой соли вызывает выпадение практически нерастворимого аммоний натриевого гексанитрита родия:
Na3[Rh(NO2)6] 2NH4Cl ⇄(NH4)2Na[Rh(NO2)6] 2NaCl.
При взаимодействии Na3[Rh (NO2)6] с NH4OH образуется триаминнитрит родия:
Na3[Rh(NO2)6] 3NH4OH ⇄ 2[Rh(NH3)3](NO2)3 3NaNO2 3H2O,
который, взаимодействуя с соляной кислотой, дает малорастворимый триаминхлорид родия:
2[Rh(NH3)3](NO2)3 6HCl ⇄ 2[Rh(NH3)3Cl3] 3H2O 3NO2 3NO
Прокаливание триаминхлорида позволяет получить порошок металлического родия. Все приведенные выше реакции используют на аффинажных предприятиях.
Сульфаты родия в водных растворах, как и хлориды, акватируются и гидролизуются, поэтому в сульфатных растворах родий, так же как иридий, находится в виде катионов, анионов и нейтральных акво- и гидроксосульфатных комплексов.
Рутений
В отсутствие кислорода воздуха на рутений не действует даже царская водка. Однако содержащая кислopод соляная кислота медленно растворяет рутений. Порошкообразный рутений полностью переходит в RuО2 при прокаливании в струе кислорода. При температуре выше 600°С образуется летучий тетраоксид рутения RuО4— сильный окислитель.
Дисульфид рутения RuS2 может быть получен осаждением сероводородом из рутениевых солей или непосредственным взаимодействием элементов. Выше 1000 °С начинается распад этого соединения на металл и серу. Селенид и теллурид рутения RuSe2 и RuTe2 очень похожи на сульфид, но менее устойчивы.
Комплексные хлориды рутения — Me2[RuCl6], Me4[Ru2OCl10] и Me2[Ru(H2O)Cl5]—образуются при поглощении тетраоксида рутения соляной кислотой. Однако в зависимости от концентрации соляной кислоты и времени ее взаимодействия с RuO4 могут образоваться самые различные промежуточные соединения.
Комплексные анионы рутения легко гидролизуются и акватируются с образованием различных аквагидроксохлорокомплексов. Трехвалентный рутений в водных растворах образует также легко акватируемый и гидролизуемый комплекс [Ru(H2O)Cl5]2-. Поэтому в реальных хлоридных растворах рутений может находиться в виде нейтральных, положительно и отрицательно заряженных аквагидроксохлорокомплексов.
Те же самые процессы акватации и гидратации протекают в сульфатных растворах, содержащих рутений. Обычно в сульфатных растворах присутствуют многоядерные полимеризованные аквагидроксокомплексы рутения (III) и (IV). При этом в растворе находятся одновременно катион-ные, анионные и нейтральные комплексы этого металла. Поэтому выделение рутения из подобных растворов чрезвычайно затруднено.
Физические свойства платиновых металлов
Физические свойства металлов платиновой группы весьма сходны между собой . Это очень тугоплавкие и труднолетучие металлы светло-серого цвета разных оттенков. По плотности платиновые металлы разделяют на легкие (рутений, родий, палладий) и тяжелые (осмий, иридий, платина). Самые тяжелые металлы — осмий и иридий, самый легкий — палладий.
Платина, палладий, родий и иридий кристаллизуются в гранецентрированные кубические (г. ц. к.) решетки. Кристаллические решетки осмия и рутения — гексагональные с ротной упаковкой. При воздействии на растворы солей восстановителями платиновые металлы могут быть получены в виде «черни», обладающей высокой дисперсностью.
Температуры кипения и плавления металлов в обеих триадах убывают слева направо — от рутения к палладию и от осмия к платине, и снизу вверх по вертикали в периодической системе. Наиболее тугоплавкие осмий и рутений, самый легкоплавкий — палладий. Температуры кипения платиновых металлов очень высокие.
Однако при прокаливании на воздухе рутений постепенно, а осмий быстро улетучиваются вследствие образования летучих тетраоксидов. Наблюдается также улетучивание платины (начиная с 1000 °С), иридия (с 2000 °С) и родия, объясняемое образованием летучих оксидов.
Осмий, рутений, иридий и родий очень тверды и хрупки. Наибольшей твердостью обладает осмий, однако и он может быть растерт в порошок. Родий поддается обработке почти так же трудно, как осмий, иридий—лишь при температуре красного каления. Платина в горячем состоянии хорошо прокатывается и сваривается.
Характерным свойством платиновых металлов является способность абсорбировать на поверхности некоторые газы, особенно водород и кислород. Склонность к абсорбции значительно возрастает у металлов, находящихся в тонкодисперсном и коллоидном состояниях.
Наибольшая способность к абсорбции водорода присуща палладию: 1 объем палладия при комнатной температуре может поглотить до 900 объемов водорода. При поглощении определенного объема водорода кристаллическая решетка палладия расширяется, так как образуются твердые растворы водорода в металле.
Абсорбционная способность по отношению к водороду убывает в ряду: Pd>Ir>Rh>Pt>Ru>Os. Абсорбированный водород может быть удален при нагревании металлов до 100 °С в вакууме. Легче всего он удаляется из палладия, труднее-из платины и, особенно, иридия.
Платина (особенно платиновая чернь) довольно сильно» поглощает кислород: 100 объемов кислорода на один объем платиновой черни. Палладий и другие платиновые металлы поглощают кислород значительно меньше.
Вследствие способности к абсорбции газов платиновые металлы, главным образом, палладий, платина и рутений, применяют в качестве катализаторов при реакциях гидрогенизации и окисления. Каталитическая активность их увеличивается при использовании черни.
Физические свойства:
Серебристо-белый пластичный металл, плотность 21,46 г/см3, Тпл.= 1772°С. Легко протягивается (из 1 г платины можно получить до 500 км проволоки) и прокатывается в тончайшую фольгу.
Химические свойства платиновых металлов
Для платиновых металлов характерна высокая стойкость по отношению к химическим реагентам, которая для разных платиновых металлов проявляется по-разному. Более того, стойкость этих металлов в большой степени зависит от степени их дисперсности. Если компактные платиновые металлы весьма стойки к различным реагентам, даже при повышенной температуре то дисперсные формы металлов активно взаимодействуют с различными окислителями, особенно» при повышенной температуре.

