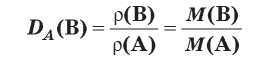Относительная плотность газа — что это за величина
При изучении свойств газообразных веществ используют множество параметров. Одной из наиболее важных характеристик газов является их плотность.
Плотность — скалярная физическая величина, которая вычисляется путем деления массы вещества на занимаемый им объем.
Рассматриваемую величину обозначают с помощью греческой буквы ρ или латинских D и d. Единицей измерения плотности в системе СИ принято считать кг/м3, а в ОпределениеВ распространенных случаях по отношению к газам применяют термин «относительная плотность». Данная характеристика является отношением массы рассматриваемого газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении. Параметр называют относительной плотностью первого газа по второму.К примеру, при нормальных условиях диоксид углерода СО2 в объеме 1 л обладает массой 1,98 г, а водород в том же объеме и при тех же условиях — массой 0,09 г. Таким образом, плотность диоксида углерода по водороду составит: 1,98 / 0,09 = 22.
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.O2 2H2 = 2H2O (550oС, сгорание H2в O2); O2 F2 = O2F2 (-183oС, электрический разряд); O2 N2↔2NO (электрический разряд); O2 S = SO2 (сгорание на воздухе); 5O2 4P = P4O10 (сгорание на воздухе); O2 C = CO2 (600-700oС, сжигание на воздухе); O2 2Na = Na2O2 (сжигание на воздухе); O2 2Mg = 2MgO (сгорание на воздухе); 3O2 4Al = 2Al2O3 (сгорание на воздухе). Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
§ 27. Относительная плотность газов » Народна Освіта
Вспомните:• плотность вещества равна отношению массы вещества к его объему;• единица измерения плотности — кг/м3 (или г/л, г/мл);Относительная плотность газовПлотность газов очень мала, поэтому измерять массы газообразных веществ очень неудобно. Намного удобнее сравнивать плотности газов, т. е. определять отношение их плотностей. Эту величину называют относительной плотностью газа В по газу А и обозначают Da(B). Методику экспериментального определения относительной плотности газов разработал французский химик Жан Дюма и с помощью этого метода определял молекулярные массы неизвестных газообразных веществ. Это возможно благодаря тому, что относительная плотность газов равна как отношению плотностей газообразных веществ, так и отношению их молярных масс:Поскольку относительная плотность является отношением двух величин с одинаковой размерностью, то сама относительная плотность является безразмерной величиной.Для вычисления относительной плотности газов по определенному газу необходимо вычислить отношение молярных масс газов.Относительная плотность кислорода по водороду будет равна:Известный французский химик-органик и государственный деятель, президент французского химического общества. В юности работал аптекарем. С 1823 г. работал в Париже сначала репетитором, а затем — профессором в Сорбонне. В 1832 г. основал собственную лабораторию. Своими работами Дюма оказал влияние на развитие органической химии, открыл новые органические вещества (хлороформ, хлоруксусную кислоту), разработал новые методы органического синтеза. Предложил метод определения относительной плотности паров, с помощью которого определил атомную массу многих химических элементов и молекулярную массу многих соединений.Относительную плотность кислорода по гелию, азоту или воздуху вычисляют таким же образом. При вычислении относительной плотности по воздуху используют среднюю молярную массу воздуха, равную 29 г/моль.Относительная плотность показывает, во сколько раз плотность одного газа больше плотности другого. Например, если относительная плотность углекислого газа по водороду равна 22 (DHa (CO2) = 22), это означает, что углекислый газ тяжелее водорода в 22 раза. А если относительная плотность метана по кислороду равна 0,5 (D02(CH4) = 0,5), это означает, что метан легче кислорода в два раза.Формулируя свой закон, Авогадро писал: «Плотность разных газов является мерой массы их молекул». Рассмотрим два газа — А и В — количеством 1 моль, которые находятся при одинаковых условиях. Плотность газа можно определить как отношение его массы к объему:Если масса и объем известны для одного моля газа, то в это уравнение можно подставить, соответственно, молярную массу и молярный объем:Молярные объемы разных газов при одинаковых условиях равны, поэтому плотность газа при заданных условиях прямо пропорциональна его молярной массе. То есть, чем больше масса одной молекулы (одного моля молекул), тем больше масса определенного объема газа — его плотность. А отношение плотностей двух газов будет равно отношению их молярных масс:Расчеты с использованием относительной плотности газовЗадача 1. Определите, во сколько раз азот тяжелее гелия.Задача 2. Относительная плотность газообразного простого вещества по воздуху равна 2,45. Вычислите молярную массу этого вещества. Какое это может быть вещество?Выводы1. Если взять два образца газообразных веществ одинакового объема при одинаковых условиях, то можно измерить отношение их плотностей и получить относительную плотность этих газов.2. Относительная плотность газов — безразмерная величина, она показывает, какой из газов тяжелее (имеет большую плотность) и во сколько раз. Она равна отношению молярных масс газов, поэтому позволяет определить молярную массу неизвестного газа.1. Какой физический смысл имеет относительная плотность газа?2. Запишите формулу для вычисления относительной плотности неизвестного газа по водороду, гелию и углекислому газу.3. Чему равна средняя молярная масса воздуха?4. Для определения относительной плотности любого газа по водороду необходимо молярную массу этого газа: а) умножить на молярную массу водорода; б) разделить на молярную массу водорода; в) сложить с молярной массой водорода.Задания для усвоения материала1. Почему для воздуха нельзя использовать понятие «молярная масса», а только «средняя молярная масса»?2. Во сколько раз кислород тяжелее: а) водорода; б) азота?3. У какого из газов наименьшая относительная плотность по водороду: азот; кислород; гелий?4. Определите относительную плотность гелия и неона: а) по водороду; б) по воздуху.5. Найдите относительную плотность по гелию газов: H2, CH4, N2, O2, SO2.6. Определите относительную плотность: а) хлора Cl2 по воздуху; б) азота по гелию; в) аммиака NH3 по кислороду; г) пропана C3H8 по хлору; д) углекислого газа CO2 по воздуху; е) аммиака по водороду; ж) сернистого газа SO2 по озону; з) кислорода по азоту; и) метана по хлору.7. Относительная плотность неизвестного газа по водороду равна 17. Определите молярную массу этого газа. Запишите его химическую формулу.8. Масса 1 л газа при нормальных условиях равна 1,251 г. Вычислите относительную плотность этого газа по водороду.9. Относительная плотность неизвестного газа по воздуху равна 1,656. Вычислите массу 1 л этого газа при нормальных условиях. Какой газ это мог бы быть?10. Почему относительные плотности всех газов по водороду больше 1?11. Относительная плотность некоторого газа по кислороду равна 2. Чему равна относительная плотность этого газа по водороду?12. Какой газ тяжелее по кислороду в 1,5 раза и образован одним элементом? тяжелее в 2 раза и образован двумя элементами?13. У соединений Карбона и Нитрогена с Оксигеном при одинаковых условиях одинаковая плотность. Определите формулы этих соединений.14*. Предложите способ экспериментального измерения относительной плотности двух газов.Проверьте свои знания по теме «Количество вещества. Расчеты по химическим формулам».Это материал учебника Химия 8 класс Григорович
Вычисление относительной плотности газа по другому газу
Решение1. Найдем относительные молекулярные массы газов, о которых говорится в условии задачи и запишем их в дано.2. Относительная плотность газа X по газу Y равна отношению относительной молекулярной массы X к относительной молекулярной массе Y.Вычислим это отношение:DH2(О2) = 32 / 2 = 16 Dвозд(О2) = 32 / 29 = 1,1033. Запишем ответ Ответ: DH2(О2) = 16;
Dвозд(О2) = 1,103
Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.
Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.
Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.
Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) Ar(C) (3 × Ar(O)) = 40 12 (3 × 16) = 100 г/моль
M (HCl) = Ar(H) Ar(Cl) = 1 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.
Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.
ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.
Объемные отношения газов при химических реакциях
Вещество из жидкого или твердого переходит в газообразное агрегатное состояние при нагреве, примерами таких процессов являются: кипение жидкостей;возгонка твердых веществ (переход из твердого состояния сразу в газообразное).В связи с тем, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, является объемом свободного пространства между молекулами газа, перемещающимися хаотично. Величина этого пространства зависит от условий, при которых находится газ:Данная характеристика практически равна для всех газов. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Вывод из вышесказанного сформулирован в законе Авогадро. ОпределениеСледствие 1Молярный объем газа определяют как отношение объема газа к его количеству:
Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) Ar(O) = (2 × 1) 16 = 18
Mr (KMnO4) = Ar(K) Ar(Mn) (4 × Ar(O)) = 39 55 (4 * 16) = 158
Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oC растворяют 4,9, а при 20oC – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже: Таблица 1. Физические свойства и плотность кислорода. Плотность, кг/м31,42987 – газ1141 – жидкостьТемпература плавления, oС-218,35Температура кипения, oС-182,96Энергия ионизации атома, эВ9,32Относительная электроотрицательность1,51Радиус атома, нм112Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500oC она становится заметной.Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул. Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
По какой формуле высчитывается
Формула 1Формула 2Плотность газообразного вещества в лабораторных условиях определяют следующим методом: Измеряют вес стеклянной колбы с краном с помощью аналитических весов.Принимают за исходную массу колбы, а за конечную — массу колбы, которую наполняют рассматриваемым газом до определенного давления.Путем вычитания из второй массы исходной определяют их разность, которую затем делят на объем колбы.Полученное в результате значение является плотностью газа в заданных условиях.Расчет плотности газообразного вещества при нормальных условиях выполняют с помощью уравнения состояния идеального газа: p2=pN V2=VN T2=TN p1/pN×V1/m×m/VN=T1/TN;m/V1=r1 m/VN=rN Таким образом: rN=r1×pN/p1×T1/TNЗначения плотностей некоторых газообразных веществ при нормальных условиях представлены в таблице:
Примеры решения задач
Задача 1Задача 2Задача 3Задача 4Задача 5
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы.В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Рассчитать плотность, относительную плотность по кислороду, по водороду, по воздуху хлора Cl2
D (по кислороду) = M (Сl2/М (O2) = 35,5/32=1,11D (по водороду) = M (Сl2/М (Н2) = 35,5/2=17,75D (по воздуху) = M (Сl2/М (воздуха) = 35,5/29=1,22