- Вопрос № 5 учитывая значения электроотрицательностей элементов (табл. 20 учебника), составьте химические формулы и укажите сдвиг общих связывающих электронных пар в следующих соединениях: а ) кальция с водородом; б) лития с азотом; в) кислород с фтором; г
- Составьте формулы и укажите сдвиг электронов: лития с азотом…
- Таблица электроотрицательности химических элементов (1 часть):
- Таблица электроотрицательности химических элементов (2 часть):
- Таблица электроотрицательности химических элементов (3 часть):
- Таблица электроотрицательности химических элементов.
- Химические свойства азота
- Химические свойства галогенов
- Химические свойства кислорода
- Химические свойства кремния
- Химические свойства серы
- Химические свойства углерода
- Химические свойства фосфора
Вопрос № 5 учитывая значения электроотрицательностей элементов (табл. 20 учебника), составьте химические формулы и укажите сдвиг общих связывающих электронных пар в следующих соединениях: а ) кальция с водородом; б) лития с азотом; в) кислород с фтором; г
Вопрос № 5 Учитывая значения электроотрицательностей элементов (табл. 20 учебника), составьте химические формулы и укажите сдвиг общих связывающих электронных пар в следующих соединениях: а ) кальция с водородом; б) лития с азотом; в) кислород с фтором; г) углерод с серой; д) углерод с алюминием.
Ответ:
а) кальция с водородом:
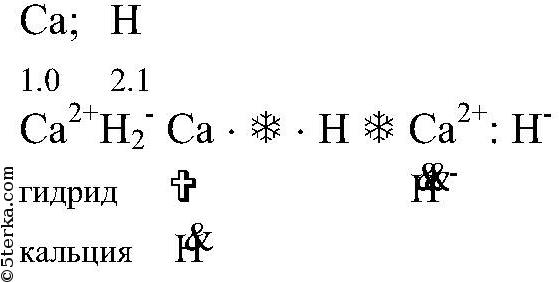
б) лития с азотом:

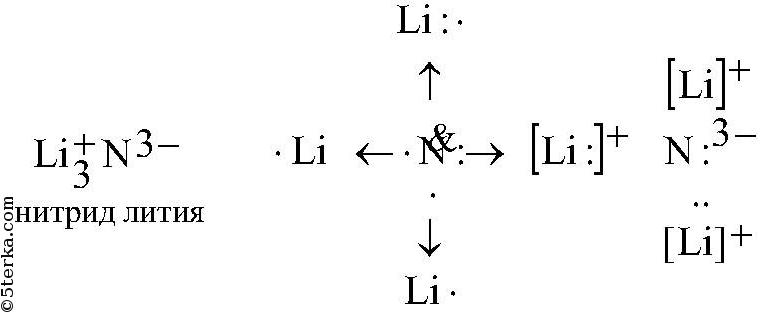
в) кислорода с фтором:
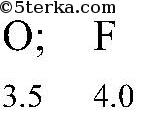
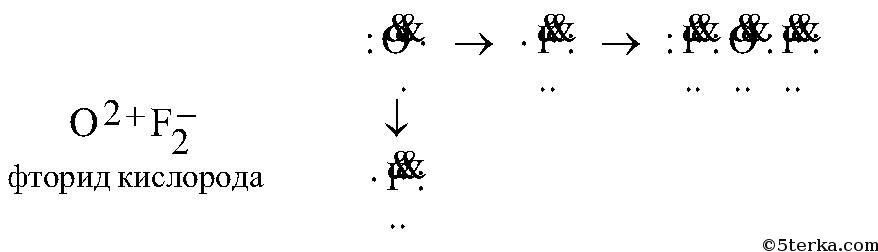
г) углерода с серой:
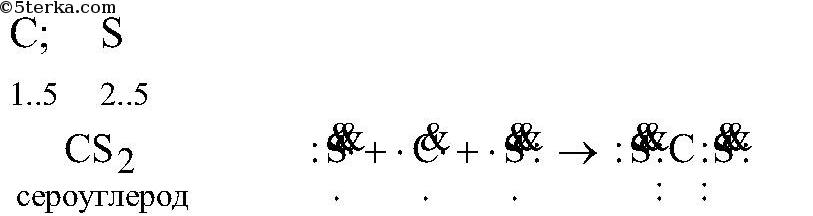
д) углерода с алюминием.
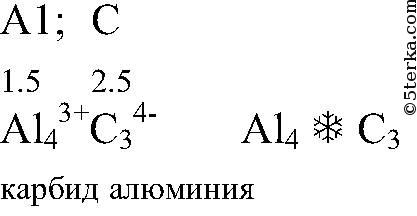

Решебник
по
химии
за 8 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 1999 год),
задача №5
к главе «Глава VII. Химическая связь. Строение веществ. Задачи к §§ 40-41 (стр. 126) ».
Все задачи
Составьте формулы и укажите сдвиг электронов: лития с азотом…
По таблице мы можем определить, какой элемент будет более электроотрицательным. А по таблице Менделеева узнать, сколько электронов есть у этого элемента и сколько электронов ему не хватает до устойчивой оболочки благородного газа.
а) Более электроотрицательный – азот. Находится в V группе, значит ему не хватает 3 электрона. У лития (I группа) есть 1 электрон. Таким образом мы можем написать формулу соединения и указать сдвиг:
Li3 –> N
б) Более электроотрицательный – фтор. Находится в VII группе, значит ему не хватает 1 электрона. У кислорода (VI группа) есть 2 электрона (почему 2, а не 6 вы узнаете в старших классах). Таким образом мы можем написать формулу соединения и указать сдвиг:
O –> F2
в) Углерод и сера имеют равные значения электроотрицательности. Поэтому такую связь можно считать ковалентной неполярной и не учитывать сдвиг. Однако, преимущество все же есть у серы, которой не хватает 2 электрона до устойчивой конфигурации. У углерода же есть сразу 4 электрона. Таким образом мы можем написать формулу соединения:
C – S2
г) Более электроотрицательный – углерод, которому не хватает 4 электрона. У алюминия есть 3. Таким образом мы можем написать формулу соединения и указать сдвиг:
Al4 –> C3
1. Объясните почему численные значения электроотрицательности атомов элементов позволяют судить о виде химической связи, возникающей между ними. Приведите примеры.
2. В тетрадях напишите по три формулы соединений: а) с ионной; б) с ковалентной полярной; в) с ковалентной неполярной связью. Изобразите их электронные формулы.
3. Изобразите структурные формулы молекул воды и хлороводорода.
Таблица электроотрицательности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Электроотрицательность по шкале Полинга |
| 1 | Водород | H | 2,20 |
| 2 | Гелий | He | 4,5 |
| 3 | Литий | Li | 0,98 |
| 4 | Бериллий | Be | 1,57 |
| 5 | Бор | B | 2,04 |
| 6 | Углерод | C | 2,55 |
| 7 | Азот | N | 3,04 |
| 8 | Кислород | O | 3,44 |
| 9 | Фтор | F | 3,98 |
| 10 | Неон | Ne | 4,4 |
| 11 | Натрий | Na | 0,93 |
| 12 | Магний | Mg | 1,31 |
| 13 | Алюминий | Al | 1,61 |
| 14 | Кремний | Si | 1,90 |
| 15 | Фосфор | P | 2,19 |
| 16 | Сера | S | 2,58 |
| 17 | Хлор | Cl | 3,16 |
| 18 | Аргон | Ar | 4,3 |
| 19 | Калий | K | 0,82 |
| 20 | Кальций | Ca | 1,0 |
| 21 | Скандий | Sc | 1,36 |
| 22 | Титан | Ti | 1,54 |
| 23 | Ванадий | V | 1,63 |
| 24 | Хром | Cr | 1,66 |
| 25 | Марганец | Mn | 1,55 |
| 26 | Железо | Fe | 1,83 |
| 27 | Кобальт | Co | 1,88 |
| 28 | Никель | Ni | 1,91 |
| 29 | Медь | Cu | 1,90 |
| 30 | Цинк | Zn | 1,65 |
| 31 | Галлий | Ga | 1,81 |
| 32 | Германий | Ge | 2,01 |
| 33 | Мышьяк | As | 2,18 |
| 34 | Селен | Se | 2,55 |
| 35 | Бром | Br | 2,96 |
Таблица электроотрицательности химических элементов (2 часть):
| 36 | Криптон | Kr | 3,0 |
| 37 | Рубидий | Rb | 0,82 |
| 38 | Стронций | Sr | 0,95 |
| 39 | Иттрий | Y | 1,22 |
| 40 | Цирконий | Zr | 1,33 |
| 41 | Ниобий | Nb | 1,6 |
| 42 | Молибден | Mo | 2,16 |
| 43 | Технеций | Tc | 1,9 |
| 44 | Рутений | Ru | 2,2 |
| 45 | Родий | Rh | 2,28 |
| 46 | Палладий | Pd | 2,20 |
| 47 | Серебро | Ag | 1,93 |
| 48 | Кадмий | Cd | 1,69 |
| 49 | Индий | In | 1,78 |
| 50 | Олово | Sn | 1,96 |
| 51 | Сурьма | Sb | 2,05 |
| 52 | Теллур | Te | 2,1 |
| 53 | Йод | I | 2,66 |
| 54 | Ксенон | Xe | 2,6 |
| 55 | Цезий | Cs | 0,79 |
| 56 | Барий | Ba | 0,89 |
| 57 | Лантан | La | 1,10 |
| 58 | Церий | Ce | 1,12 |
| 59 | Празеодим | Pr | 1,13 |
| 60 | Неодим | Nd | 1,14 |
| 61 | Прометий | Pm | 1,1 |
| 62 | Самарий | Sm | 1,17 |
| 63 | Европий | Eu | 1,2 |
| 64 | Гадолиний | Gd | 1,20 |
| 65 | Тербий | Tb | 1,20 |
| 66 | Диспрозий | Dy | 1,22 |
| 67 | Гольмий | Ho | 1,23 |
| 68 | Эрбий | Er | 1,24 |
| 69 | Тулий | Tm | 1,25 |
| 70 | Иттербий | Yb | 1,1 |
Таблица электроотрицательности химических элементов (3 часть):
| 71 | Лютеций | Lu | 1,27 |
| 72 | Гафний | Hf | 1,3 |
| 73 | Тантал | Ta | 1,5 |
| 74 | Вольфрам | W | 2,3 |
| 75 | Рений | Re | 1,9 |
| 76 | Осмий | Os | 2,2 |
| 77 | Иридий | Ir | 2,2 |
| 78 | Платина | Pt | 2,28 |
| 79 | Золото | Au | 2,64 |
| 80 | Ртуть | Hg | 2,0 |
| 81 | Таллий | Tl | 1,62 |
| 82 | Свинец | Pb | 2,33 |
| 83 | Висмут | Bi | 2,02 |
| 84 | Полоний | Po | 2,0 |
| 85 | Астат | At | 2,2 |
| 86 | Радон | Rn | 2,2 |
| 87 | Франций | Fr | 0,7 |
| 88 | Радий | Ra | 0,9 |
| 89 | Актиний | Ac | 1,1 |
| 90 | Торий | Th | 1,3 |
| 91 | Протактиний | Pa | 1,5 |
| 92 | Уран | U | 1,38 |
| 93 | Нептуний | Np | 1,36 |
| 94 | Плутоний | Pu | 1,28 |
| 95 | Америций | Am | 1,3 |
| 96 | Кюрий | Cm | 1,3 |
| 97 | Берклий | Bk | 1,3 |
| 98 | Калифорний | Cf | 1,3 |
| 99 | Эйнштейний | Es | 1,3 |
| 100 | Фермий | Fm | 1,3 |
| 101 | Менделевий | Md | 1,3 |
| 102 | Нобелий | No | 1,3 |
| 103 | Лоуренсий | Lr | 1,3 |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности 6 901
Таблица электроотрицательности химических элементов.
Электроотрицательность (χ) – фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, т.е. способность атомов притягивать к себе электроны других атомов.
На электроотрицательность атома химического элемента влияет как его атомный номер, так и расстояние, на котором находятся его валентные электроны от заряженного ядра. Чем выше связанная с этим электроотрицательность, тем больше атом притягивает электроны.
Обычно используют относительную электроотрицательность по шкале Полинга.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (2000оС или действие электрического разряда) азот реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С N2 → N≡C–C≡N
1.3.Азот взаимодействует с водородом при высоком давлении и высокой температуре ,в присутствии катализатора. При этом образуется аммиак:
N2 ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 6Li → 2Li3N
2.Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 3LiH → Li3N NH3
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей. Галогены реагируют с металлами и неметаллами.
1.1. Галогены не горятна воздухе. Фтор окисляет кислород с образованием фторида кислорода:
2F2 O2 → 2OF2
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
S Cl2 → SCl2 (S2Cl2)
S 3F2 → SF6
1.3. При взаимодействии фосфора иуглерода с галогенами образуются галогениды фосфора и углерода:
2P 5Cl2 → 2PCl5
2P 3Cl2 → 2PCl3
2F2 C → CF4
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например, железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 2Fe → 2FeCl3
I2 Fe → FeI2
Аналогичная ситуация с медью: фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
Cl2 Cu → 2CuCl2
I2 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример: алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 2Al → 2AlCl3
1.5.Водород горит в атмосфере фтора:
F2 H2 → 2HF
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Cl2 H2 → 2HCl
Бром также реагирует с водородом с образованием бромоводорода:
Br2 H2 → 2HBr
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
I2 H2 ↔ 2HI
1.6.Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например, фтор окисляет хлор, бром и йод:
Cl2 F2 → 2ClF
2.Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например, хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления ( 1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 H2O ↔ HCl HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и 5, образуя соляную кислоту и хлорную кислоту:
Cl2 6H2O ↔ 5HCl HClO3
Фтор реагирует с водой со взрывом:
2F2 2H2O → 4HF O2
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например, хлор реагирует с холодным раствором гидроксидом натрия:
Сl2 2NaOH (хол.) → NaCl NaClO H2O
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
3Cl2 6NaOH (гор.) → 5NaCl NaClO3 3H2O
Еще пример: хлор растворяется в холодном растворе гидроксида кальция:
2Сl2 2Са(OH)2(хол.) → СaCl2 Сa(ClO)2 2H2O
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например, хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 2NaI → 2NaCl I2
Cl2 2NaBr → 2NaCl Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например, фтор окисляет хлор с образованием фторида хлора (I):
Cl2 F2 → 2Cl F–
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
Cl2 I2 H2O → HCl HIO3
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например, хлор окисляет сероводород:
Cl2 H2S → S 2HCl
Хлор также окисляет сульфиты:
Cl2 H2O Na2SO3 → 2HCl Na2SO4
Также галогены окисляют пероксиды:
Cl2 3H2O2 → 2HCl 2H2O O2
Или, при нагревании или на свету, воду:
2Cl2 2H2O → 4HCl O2 (на свету или кип.)
Химические свойства кислорода
ри нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O
Химические свойства кремния
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойстваокислителя(при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойствавосстановителя(при взаимодействии с элементами, расположенными выше и правее).
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si 2F2 → SiF4
При нагревании кремний реагируетсхлором, бромом, йодом:
Si 2Cl2 → SiCl4
Si 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагируетс углеродом с образованием бинарного соединения карбида кремния (карборунда):
C Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si 2S → SiS2
1.3.Кремний не взаимодействует с водородом.
1.4.С азотом кремний реагирует в очень жестких условиях:
3Si 2N2 → Si3N4
1.5.В реакциях сактивными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca Si → Ca2Si
Si 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействуетс кислородом:
Si O2 → SiO2
2.Кремний взаимодействует сосложными веществами:
2.1. В водных растворахщелочейкремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si 2NaOH H2O → Na2SiO3 2H2
Видеоопыт взаимодействия кремния с раствором щелочи можно посмотреть здесь.
2.2.Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si 6HF → H2[SiF6] 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) 4HF(г.) = SiF4 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется всмеси концентрированных азотной и плавиковой кислот:
3Si 4HNO3 12HF → 3SiF4 4NO 8H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя(при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горениисеры на воздухе образуется оксид серы (IV):
S O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода)образуются галогениды серы:
S Cl2 → SCl2 (S2Cl2)
S 3F2 → SF6
1.3. При взаимодействии фосфора иуглерода с серой образуются сульфиды фосфора и сероуглерод:
2P 3S → P2S3
2P 5S → P2S5
2S C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S Fe → FeS
S Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S 2Al → Al2S3
1.5. С водородомсера взаимодействует при нагревании с образованием сероводорода:
S H2 → H2S
2.Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителямисера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S 6HNO3 → H2SO4 6NO2 2H2O
Серная кислотатакже окисляет серу. Но, поскольку S 6 не может окислить серу же до степени окисления 6, образуется оксид серы (IV):
S 2H2SO4 → 3SO2 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до 4:
S 2KClO3 → 3SO2 2KCl
Взаимодействие серы с сульфитами(при кипячении) приводит к образованию тиосульфатов:
S Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S NaOH → Na2SO3 Na2S H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S H2O (пар) → 2H2S SO2
Химические свойства углерода
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремниемс образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C 2S → CS2
C Si → SiC
1.3.Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С 2Н2 → СН4
1.4.С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C 3Al → Al4C3
2C Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 H2 O → C 2O H20
2.2.Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO C → Zn CO
Также углерод восстанавливает железо из железной окалины:
4С Fe3O4 → 3Fe 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С СаО → СаС2 СО
9С 2Al2O3 → Al4C3 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C 2H2SO4(конц) → CO2 2SO2 2H2O
2.4.Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C 4HNO3(конц) → CO2 4NO2 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C Na2SO4 → Na2S 4CO
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородомвоздуха образу
ются оксиды – ангидриды соответствующих кислот:
4P 3O2 → 2P2O3
4P 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенамиобразуются галогениды с общей формулой PHal3 и PHal5:
2P 3Cl2 → 2PCl3
2P 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора ссеройобразуются сульфиды:
2P 3S → P2S3
2P 5S → P2S5
1.4. При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P 3Ca → Ca3P2
2P 3Mg → Mg3P2
Ещепример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P 3Na → Na3P
1.5. С водородомфосфор непосредственно не взаимодействует.
2.Со сложными веществамифосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1.При взаимодействии сокислителямифосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислотаокисляет фосфор до фосфорной кислоты:
5HNO3 P → H3PO4 5NO2↑ H2O
5HNO3 3P 2H2O → 3H3PO4 5NO↑
Серная кислотатакже окисляет фосфор:
2P 5H2SO4 → 2H3PO4 5SO2 2H2O
Соединения хлора,например, бертолетова соль, также окисляют фосфор:
6P 5KClO3 → 3P2O5 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор.Например, оксид серебра (I):
2P 5Ag2O → P2O5 10Ag
2.2.При растворении вщелочахфосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P 3KOH 3H2O → 3KH2PO2 PH3↑ или
P4 3KOH 3H2O → 3KH2PO2 PH3↑
Или с гидроксидом кальция:
8P 3Ca(OH)2 6H2O → 3Ca(H2PO2)2 2PH3↑

