- Валентные возможности атома азота
- Давайте порассуждаем вместе
- Какая степень окисления у серебра?
- Онлайн урок: фосфор по предмету химия 8 класс |
- Применение серебра:
- Свойства атома серебра:
- Таблица степени окисления химических элементов
- Физические свойства серебра:
- Фосфор и его соединения
- Химические свойства сероводорода
- Элементы подгруппы кислорода
Валентные возможности атома азота
Запишем электронно-графическую формулу внешнего энергетического уровня атома азота:
Как видно из иллюстрации выше, атом азота в своем обычном состоянии имеет 3 неспаренных электрона, в связи с чем логично предположить о его способности проявлять валентность, равную III. Действительно, валентность, равная трём, наблюдается в молекулах аммиака (NH3), азотистой кислоты (HNO2), треххлористого азота (NCl3) и т.д.
Выше было сказано, что валентность атома химического элемента зависит не только от количества неспаренных электронов, но также и от наличия неподеленных электронных пар. Связано это с тем, что ковалентная химическая связь может образоваться не только, когда два атома предоставляют друг другу по одному электрону, но также и тогда, когда один атом, имеющий неподеленную пару электронов — донор(
Несмотря на то что одна из ковалентных связей образуется по донорно-акцепторному механизму, все связи N-H в катионе аммония абсолютно идентичны и ничем друг от друга не отличаются.
Валентность, равную V, атом азота проявлять не способен. Связано это с тем, что для атома азота невозможен переход в возбужденное состояние, при котором происходит распаривание двух электронов с переходом одного из них на свободную орбиталь, наиболее близкую по уровню энергии.
Атом азота не имеет d-подуровня, а переход на 3s-орбиталь энергетически настолько затратен, что затраты энергии не покрываются образованием новых связей. Многие могут задаться вопросом, а какая же тогда валентность у азота, например, в молекулах азотной кислоты HNO3 или оксида азота N2O5? Как ни странно, валентность там тоже IV, что видно из нижеследующих структурных формул:
Пунктирной линией на иллюстрации изображена так называемая делокализованнаяπ-связь. По этой причине концевые связи NO можно назвать «полуторными». Аналогичные полуторные связи имеются также в молекуле озона O3, бензола C6H6 и т.д.
em>Резюмируя информацию по валентным возможностям атома азота:
1) Для азота возможны валентности I, II, III и IV
2) Валентности V у азота не бывает!
3) В молекулах азотной кислоты и оксида азота N2O5 азот имеет валентность IV, а степень окисления 5 (!).
4) В соединениях, в которых атом азота четырехвалентен, одна из ковалентных связей образована по донорно-акцепторному механизму (соли аммония NH4 , азотная кислота и д.р).
Давайте порассуждаем вместе
1. Атом азота в азотной кислоте имеет степень окисления:
1) 0
2) 3
3) 5
4) -5
Ответ: Формула азотной кислоты HNO3, степень окисления водорода равна 1, кислорода -2, степень окисления азота обозначим за х и рассчитаем ее по уравнению: 1 х 3* (-2) = 0
х = 5
2. Степень окисления -2 атом серы проявляет в каждом из соединений
1) CuSO4 и H2S
2) SO2 и Na2S
3) H2SO3 и SO3
4) CaS и FeS
Ответ: степень окисления -2 атом серы проявляет в бинарных соединениях с металлами (сульфидах) и водородом (H2S), поэтому правильный ответ CaS и FeS
3. Максимально возможную степень окисления атом хлора проявляет в соединении
1) HCl
2) HClO3
3) KClO4
4) Ba(ClO2)2
Ответ: атом хлора расположен в 7 группе, поэтому может иметь максимальную степень окисления 7. Такую степень окисления атом хлора проявляет в веществе KClO4. Проверим это. У калия степень окисления 1, у кислорода -2, у хлора х. Из уравнения: 1 х 4* (-2) = 0 находим х = 7
4. В соединениях NO2 и NH3 степени окисления азота соответственно равны:
1) 4 и -3
2) 2 и 3
3) 2 и -2
4) 5 и 3
Ответ: В оксиде азота (IV) у кислорода степень окисления -2, значит у азота степень окисления 4. В аммиаке у водорода степень окисления 1, значит у азота степень окисления -3.
5. Установите соответствие между схемами превращения веществ и изменением степени окисления хлора
Ответ:
В молекуле хлора Cl2 степень окисления хлора равна 0
В молекуле ClF3 у фтора степень окисления -1, значит у хлора 3
В молекуле ICl3 у хлора степень окисления -1
В молекуле ClO2 у кислорода степень окисления -2, значит у хлора 4
В молекуле HCl у водорода 1, а у хлора -1
6. Установите соответствие между схемами превращения веществ и изменением степени окисления серы
Ответ:
В молекуле сероводорода у водорода степень окисления 1, а у серы -2
В молекуле SO2 у кислорода степень окисления -2, а у серы 4
В молекуле сернистой кислоты у водорода степень окисления 1, у кислорода -2, значит у серы 4
В молекуле серной кислоты у водорода степень окисления 1, у кислорода -2, значит у серы 6
7. Установите соответствие между схемами превращения веществ и изменением степени окисления азота
Ответ:
В молекуле NO степень окисления у кислорода равна -2, а у азота 2
В молекуле азота N2 степень окисления азота равна 0
В молекуле NO2 степень окисления азота равна 4
В молекуле N2H4 степень окисления азота равна -2
8. В каких реакциях железо выступает в роли восстановителя?
1) Fe S = FeS
2) 2FeCl3 H2 = 2FeCl2 2HCl
3) 2Fe(OH)3 = Fe2O3 3H2O
4) 3Fe 2O2 = Fe3O4
5) 2FeCl2 Cl2 = 2FeCl3
Ответ: 1, 4, 5 , т.к. в этих реакциях железо отдает электроны и повышает свою степень окисления.
9. В каких реакциях сера не изменяет степень окисления?
1) Cu S = CuS
2) 2HCl Na2SO3 = 2NaCl SO2 H2O
3) Cu 2H2SO4 = CuSO4 SO2 2H2O
4) SO2 H2O = H2SO3
5) SO2 2H2 = S 2H2O
Ответ: 2, 4, т.к. в этих реакциях сера не изменяет свою степень окисления.
10. В каком соединении фосфор проявляет степень окисления -3
1) P2O3
2) Na3PO4
3)Ca3P2
4) PCl3
Ответ: степень окисления -3 фосфор проявляет в бинарных соединениях с металлами, значит в фосфиде кальция Ca3P2 у кальцая степень окисления 2, а у фосфора -3.
Какая степень окисления у серебра?
Серебро может существовать в виде простого вещества – металла, а степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
Известно, что серебро может проявлять в своих соединениях степени окисления ( 1), ( 2) и ( 3), однако наиболее устойчивыми из них являются те, в которых степень окисления серебра равна ( 1), что обусловлено прочностью конфигурации ![]() :
: ![]() :
:  ,
, ![]() ,
, ![]() ,
,  ,
, ![]() ,
, ![]() ,
,  ,
, ![]() (ответ на вопрос «какая степень окисления у серебра»).
(ответ на вопрос «какая степень окисления у серебра»).
В первой реакции происходит изменение степеней окисления у элементов серебро, кислород и азот, причем первый и третий из них восстанавливаются, а второй – окисляется. Схемы электронного баланса имеют следующий вид:
![]()
![]()
![]()
Во второй реакции происходит изменение степеней окисления у элементов серебро и кислород, причем первый из них восстанавливается, а второй – окисляется. Схемы электронного баланса имеют следующий вид:
![]()
![]()
Онлайн урок: фосфор по предмету химия 8 класс |
Соединения фосфора – обязательная составляющая растительных и животных организмов.
В растениях фосфор сосредоточен главным образом в семенах и плодах.
В организме человека и животных – в скелете, мышечной и нервной тканях.
Наверняка вы ни один раз слышали, что фосфор очень полезен для мозга. Это действительно так, он очень важен для правильного функционирования нервной ткани.
Твёрдость скелету придаёт фосфат кальция.
Поступивший с пищей фосфор попадает в кости уже через 4-6 ч.
В среднем тело человека содержит около 1,5 кг фосфора, из которых большинство приходится на кости.
Работа мозга и сокращение мышц также связаны с химическими превращениями соединений фосфора.
Источником фосфора является растительная пища.
Растения извлекают фосфор из почвы, а животные получают его с растительной пищей.
После отмирания растений и животных органические соединения, содержащие фосфор, под действием фосфоробактерий превращаются в фосфаты кальция и магния.
Так осуществляется круговорот фосфора в природе.
Этот круговорот нарушается при удалении соединений фосфора с урожаем сельскохозяйственных культур.
Недостаток фосфора практически не восполняется естественным путём, поэтому необходимо вносить в почву фосфорные удобрения.
Красный фосфор применяют в производстве спичек.
Как же устроена современная спичка?
Масса спичечной головки на 60% состоит из бертолетовой соли, а также из горючих веществ: серы или каких-нибудь сульфидов металлов.
Чтобы воспламенение головки происходило медленно и равномерно, без взрыва, к массе добавляют так называемые наполнители, например, стеклянный порошок.
Связующим материалом служит клей. А намазка шкурки?
Здесь основной компонент – красный фосфор.
К нему также добавляют толченое стекло и клей.
При трении происходит воспламенение:
Также фосфор идёт на получение ядохимикатов (дихлофос, хлорофос), дымовых снарядов.
Фосфорная кислота входит в состав синтетических моющих и чистящих средств, средств для растворения накипи, огнеупорных красок.
Из фосфатов получают специальные цементы, например, цинкофосфатный цемент применяют для пломбирования зубов.
Фосфорную кислоту также очень широко используют в качестве пищевой добавки.
Применение серебра:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Свойства атома серебра:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 165 пм |
| 205 | Эмпирический радиус атома* | 160 пм |
| 206 | Ковалентный радиус* | 145пм |
| 207 | Радиус иона (кристаллический) | Ag 81 (2) пм, 114 (4) пм, 129 (6) пм, 142 (8) пм, Ag2 108 (6) пм, Ag3 89 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 172 пм |
| 209 | Электроны, Протоны, Нейтроны | 47 электронов, 47 протонов, 61 нейтрон |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na 1I-1, Mg 2Cl-12, Al 3F-13, Zr 4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно ( 1) и ( 2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, ( 2), ( 4), ( 6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
Порядковый номер | Русское / англ. название | Химический символ | Степень окисления |
1 | Водород / Hydrogen | H | ( 1), (-1) |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | ( 1) |
4 | Бериллий / Beryllium | Be | ( 2) |
5 | Бор / Boron | B | (-1), 0, ( 1), ( 2), ( 3) |
6 | Углерод / Carbon | C | (-4), (-3), (-2), (-1), 0, ( 2), ( 4) |
7 | Азот / Nitrogen | N | (-3), (-2), (-1), 0, ( 1), ( 2), ( 3), ( 4), ( 5) |
8 | Кислород / Oxygen | O | (-2), (-1), 0, ( 1), ( 2) |
9 | Фтор / Fluorine | F | (-1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | ( 1) |
12 | Магний / Magnesium | Mg | ( 2) |
13 | Алюминий / Aluminum | Al | ( 3) |
14 | Кремний / Silicon | Si | (-4), 0, ( 2), ( 4) |
15 | Фосфор / Phosphorus | P | (-3), 0, ( 3), ( 5) |
16 | Сера / Sulfur | S | (-2), 0, ( 4), ( 6) |
17 | Хлор / Chlorine | Cl | (-1), 0, ( 1), ( 3), ( 5), ( 7), редко ( 2) и ( 4) |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | ( 1) |
20 | Кальций / Calcium | Ca | ( 2) |
21 | Скандий / Scandium | Sc | ( 3) |
22 | Титан / Titanium | Ti | ( 2), ( 3), ( 4) |
23 | Ванадий / Vanadium | V | ( 2), ( 3), ( 4), ( 5) |
24 | Хром / Chromium | Cr | ( 2), ( 3), ( 6) |
25 | Марганец / Manganese | Mn | ( 2), ( 3), ( 4), ( 6), ( 7) |
26 | Железо / Iron | Fe | ( 2), ( 3), редко ( 4) и ( 6) |
27 | Кобальт / Cobalt | Co | ( 2), ( 3), редко ( 4) |
28 | Никель / Nickel | Ni | ( 2), редко ( 1), ( 3) и ( 4) |
29 | Медь / Copper | Cu | 1, 2, редко ( 3) |
30 | Цинк / Zinc | Zn | ( 2) |
31 | Галлий / Gallium | Ga | ( 3), редко ( 2) |
32 | Германий / Germanium | Ge | (-4), ( 2), ( 4) |
33 | Мышьяк / Arsenic | As | (-3), ( 3), ( 5), редко ( 2) |
34 | Селен / Selenium | Se | (-2), ( 4), ( 6), редко ( 2) |
35 | Бром / Bromine | Br | (-1), ( 1), ( 5), редко ( 3), ( 4) |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | ( 1) |
38 | Стронций / Strontium | Sr | ( 2) |
39 | Иттрий / Yttrium | Y | ( 3) |
40 | Цирконий / Zirconium | Zr | ( 4), редко ( 2) и ( 3) |
41 | Ниобий / Niobium | Nb | ( 3), ( 5), редко ( 2) и ( 4) |
42 | Молибден / Molybdenum | Mo | ( 3), ( 6), редко ( 2), ( 3) и ( 5) |
43 | Технеций / Technetium | Tc | ( 6) |
44 | Рутений / Ruthenium | Ru | ( 3), ( 4), ( 8), редко ( 2), ( 6) и ( 7) |
45 | Родий / Rhodium | Rh | ( 4), редко ( 2), ( 3) и ( 6) |
46 | Палладий / Palladium | Pd | ( 2), ( 4), редко ( 6) |
47 | Серебро / Silver | Ag | ( 1), редко ( 2) и ( 3) |
48 | Кадмий / Cadmium | Cd | ( 2), редко ( 1) |
49 | Индий / Indium | In | ( 3), редко ( 1) и ( 2) |
50 | Олово / Tin | Sn | ( 2), ( 4) |
51 | Сурьма / Antimony | Sb | (-3), ( 3), ( 5), редко ( 4) |
52 | Теллур / Tellurium | Te | (-2), ( 4), ( 6), редко ( 2) |
53 | Иод / Iodine | I | (-1), ( 1), ( 5), ( 7), редко ( 3), ( 4) |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | ( 1) |
56 | Барий / Barium | BA | ( 2) |
57 | Лантан / Lanthanum | La | ( 3) |
58 | Церий / Cerium | Ce | ( 3), ( 4) |
59 | Празеодим / Praseodymium | Pr | ( 3) |
60 | Неодим / Neodymium | Nd | ( 3), ( 4) |
61 | Прометий / Promethium | Pm | ( 3) |
62 | Самарий / Samarium | Sm | ( 3), редко ( 2) |
63 | Европий / Europium | Eu | ( 3), редко ( 2) |
64 | Гадолиний / Gadolinium | Gd | ( 3) |
65 | Тербий / Terbium | Tb | ( 3), ( 4) |
66 | Диспрозий / Dysprosium | Dy | ( 3) |
67 | Гольмий / Holmium | Ho | ( 3) |
68 | Эрбий / Erbium | Er | ( 3) |
69 | Тулий / Thulium | Tm | ( 3), редко ( 2) |
70 | Иттербий / Ytterbium | Ib | ( 3), редко ( 2) |
71 | Лютеций / Lutetium | Lu | ( 3) |
72 | Гафний / Hafnium | Hf | ( 4) |
73 | Тантал / Tantalum | Ta | ( 5), редко ( 3), ( 4) |
74 | Вольфрам / Tungsten | W | ( 6), редко ( 2), ( 3), ( 4) и ( 5) |
75 | Рений / Rhenium | Re | ( 2), ( 4), ( 6), ( 7), редко (-1), ( 1), ( 3), ( 5) |
76 | Осмий / Osmium | Os | ( 3), ( 4), ( 6), ( 8), редко ( 2) |
77 | Иридий / Iridium | Ir | ( 3), ( 4), ( 6), редко ( 1) и ( 2) |
78 | Платина / Platinum | Pt | ( 2), ( 4), ( 6), редко ( 1) и ( 3) |
79 | Золото / Gold | Au | ( 1), ( 3), редко ( 2) |
80 | Ртуть / Mercury | Hg | ( 1), ( 2) |
81 | Талий / Thallium | Tl | ( 1), ( 3), редко ( 2) |
82 | Свинец / Lead | Pb | ( 2), ( 4) |
83 | Висмут / Bismuth | Bi | ( 3), редко ( 3), ( 2), ( 4) и ( 5) |
84 | Полоний / Polonium | Po | ( 2), ( 4), редко (-2) и ( 6) |
85 | Астат / Astatine | At | — |
86 | Радон / Radon | Ra | 0 |
87 | Франций / Francium | Fr | — |
88 | Радий / Radium | Ra | ( 2) |
89 | Актиний / Actinium | Ac | ( 3) |
90 | Торий / Thorium | Th | ( 4) |
91 | Проактиний / Protactinium | Pa | ( 5) |
92 | Уран / Uranium | U | ( 3), ( 4), ( 6), редко ( 2) и ( 5) |
Физические свойства серебра:
| 400 | Физические свойства | |
| 401 | Плотность* | 10,49 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,320 г/см3 (при температуре плавления 961,78 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 961,78 °C (1234,93 K, 1763,2 °F) |
| 403 | Температура кипения* | 2162 °C (2435 K, 3924 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 11,28 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 254 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,235 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,36 Дж/(K·моль) |
| 411 | Молярный объём | 10,282955 см³/моль |
| 412 | Теплопроводность | 429 Вт/(м·К) (при стандартных условиях), 429 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 18,9 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | 174 мм2/С (при 300 K) |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Фосфор и его соединения
Видеоурок позволяет узнать о строении атома фосфора, его возможных степенях окисления в соединениях. В виде таблицы собран материал по аллотропным модификациям фосфора. Здесь рассматриваются физические и химические свойства не только фосфора, но и его соединений: фосфина, оксида фосфора (V), фосфорной кислоты. Кроме этого, приведены названия кислых солей фосфорной кислоты, качественная реакция на фосфат-ион в виде демонстрации, круговорот фосфора в природе, а также применение фосфора и его соединений.
Фосфор и его соединения
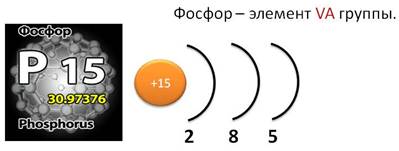
Фосфор,
как и азот – элемент V A
группы. Значит, на внешнем энергетическом уровне у него 5
электронов. Атом фосфора в соединениях может проявлять различные степени
окисления: от -3 до 5. Атомы фосфора по сравнению с атомами азота имеют
больший радиус, меньшее значение электроотрицательности. Фосфор чаще проявляет
в соединениях степень окисления 5.
В природе
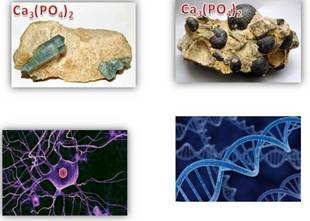
фосфор встречается только в виде соединений, важнейшими из которых являются
минералы фосфориты и апатиты, содержащие фосфат кальция – Ca3(PO4)2.
Часть
фосфора в организме человека распределена в мышечной, нервной и мозговой
тканях. В виде производной фосфорной кислоты фосфор входит в состав нуклеиновых
кислот – ДНК и РНК, осуществляющих передачу наследственных свойств
организма. Из фосфора, поступающего в организм человека с пищей, главным
образом с яйцами, мясом, молоком и хлебом, строится АТФ –
аденозинтрифосфорная кислота.
Фосфор
был открыт немецким алхимиком Брандом в 1669 году и
получил своё название за способность светиться в темноте (от
греческого фосфор – светоносный).


Химический
элемент фосфор образует несколько аллотропных модификаций, различающихся
между собой по строению, физическим свойствам и химической активности.
Белый
фосфор состоит из молекул P4,
имеющих форму тэтраэдра. Молекулярное строение этого вещества
обуславливает его легкоплавкость и летучесть. Этот фосфор не растворим в воде,
но хорошо растворим в сероуглероде. На воздухе легко окисляется, а в
порошкообразном состоянии даже воспламеняется.

Белый
фосфор очень ядовит. Он светится в темноте и его хранят под
водой.
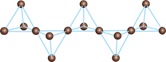
Красный
фосфор имеет атомную структуру, в которой каждый атом
фосфора связан с тремя другими атомами ковалентными связями. При
нагревании красного фосфора в пробирке, закрытой ватным тампоном, он превращается
в белый фосфор.


Красный
фосфор – порошок тёмно-красного цвета, он неядовит, не растворяется ни в
каких растворителях, нелетуч и в химическом отношении менее активен, чем белый.
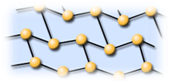
При
нагревании под давлением, белый фосфор переходит в чёрный, который имеет
атомную кристаллическую решетку. Чёрный фосфор по своим физическим свойствам похож
на металл: он проводит электрический ток и блестит. По внешнему виду он
похож на графит и жирен на ощупь.
При
взаимодействии с кислородом фосфор проявляет восстановительные
свойства, а в реакциях с металлами – окислительные. В
реакциях фосфора с металлами образуются соединения – фосфиды. Например,
в реакции с фосфором образуется фосфид кальция.
В
этой реакции кальций повышает свою степень окисления с 0 до 2, а фосфор
понижает с 0 до -3. Каждый атом кальция отдаёт по 6 электронов молекуле
фосфора. При этом кальция является восстановителем, а фосфор – окислителем.

Белый фосфор
самовоспламеняется на воздухе, а красный горит при поджигании. При этом
образуется оксид фосфора (V).

В
этой реакции фосфор повышает свою степень окисления с 0 до 5, а кислород
понижает с 0 до -2. Фосфор выступает в роли восстановителя, а кислород – в роли
окислителя.
С
водородом фосфор не реагирует, но его водородное соединение – фосфин
– PH3 можно получить из фосфидов действием на них кислот. Например,
при взаимодействии фосфида кальция с соляной кислотой образуется соль – хлорид
кальция и фосфин.

Фосфин
– это ядовитый газ с неприятным запахом. Он легко
воспламеняется на воздухе.
Появление
блуждающих огней на старых кладбищах и болотах вызвано воспламенением на
воздухе фосфина и других соединений фосфора с водородом. Эти газообразные
вещества образуются при разложении органических соединений, содержащих фосфор.
На воздухе продукты соединения фосфора с водородом самовоспламеняются с
образованием светящегося пламени и капелек фосфорной кислоты – продукта
взаимодействия оксида фосфора (V) с водой. Эти капельки создают размытый контур
«привидения».

Красный
фосфор используют для производства спичек, фосфорной
кислоты, которая идёт на производство фосфорных удобрений и кормовых добавок
для животных, его применяют для производства ядохимикатов.

Фосфор
образует оксид фосфора (V) и оксид фосфора (III), а также
кислородсодержащие кислоты, среди которых наиболее важное промышленное
применение находит фосфорная кислота.
Оксид
фосфора (V) образуется при
сгорании фосфора в кислороде.
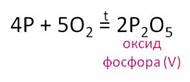
При недостатке
кислорода образуется оксид фосфора (III).
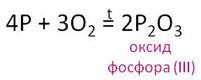
Оксид
фосфора (V)
представляет собой белый порошок, энергично поглощает пары воды из воздуха и
постепенно превращается в прозрачную расплывшуюся массу. Благодаря этому свойству
оксид фосфора (V) способен
отнимать воду и у других веществ. Поэтому он широко используется как осушитель.
Многие органические вещества обугливаются при действии на них этого оксида,
кроме того, при попадании на кожу он может вызвать сильные ожоги.
Оксид
фосфора (V) – типичный кислотный
оксид, он взаимодействует с основными оксидами и щелочами, образуя соли
фосфорной кислоты – фосфаты.
Так,
в реакции оксида фосфора (V)
с оксидом кальция образуется соль – фосфат кальция. В реакции оксида
фосфора (V) с гидроксидом
натрия образуется соль – фосфат натрия и вода.
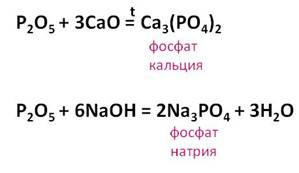
При
взаимодействии оксида фосфора (V)
с избытком воды образуется фосфорная кислота.

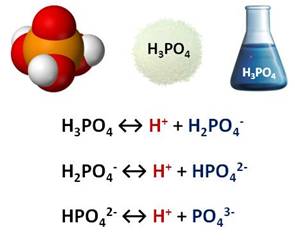
Фосфорная
кислота представляет собой твёрдое прозрачное
кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Это
слабая кислота, поэтому в водном растворе диссоциирует ступенчато: на
первой ступени образуется катион водорода и дигидрофосфат-ион, на второй
ступени опять образуется катион водорода и гидрофосфат-ион, а на третьей
ступени образуется катион водорода и фосфат-ион.
Фосфорная
кислота проявляет свойства, характерные для кислот. Она взаимодействует с
металлами, стоящими в ряду активности до водорода. Например, в реакции
фосфорной кислоты с цинком, образуется соль – дигидрофосфат цинка и выделяется
газ – водород.
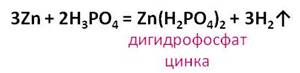
Фосфорная
кислота вступает во взаимодействие с основными оксидами. Так в реакции
оксида лития с фосфорной кислотой образуется соль – фосфат лития и вода.
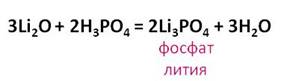
Фосфорная
кислота реагирует и с основаниями. В реакции гидроксида натрия с
фосфорной кислотой образуется соль – фосфат натрия и вода.
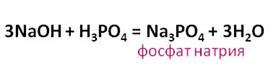
Фосфорная
кислота – трёхосновная кислота, поэтому она может образовывать кроме
средних солей кислые соли. Например, Ca3(PO4)2–
средняя соль, она называется фосфат кальция, CaHPO4
– кислая соль и называется гидрофосфат кальция, Ca(H2PO4)2
тоже кислая соль и называется дигидрофосфат кальция. Фосфаты всех металлов в воде
нерастворимы (исключение – фосфаты щелочных металлов), дигидрофосфаты всех
металлов хорошо растворимы, а гидрофосфаты занимают промежуточное положение.
Качественной
реакцией на фосфат-ион является реакция с нитратом
серебра, при этом образуется фосфат серебра (I) – осадок жёлтого цвета и соль –
нитрат натрия.
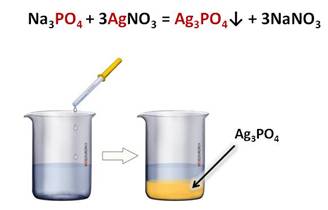
В
природе постоянно происходит круговорот фосфора. Фосфор из почвы
извлекается растениями, а животные получают фосфор с растительной пищей. После
отмирания растительных и животных организмов фосфор снова переходит в почву.
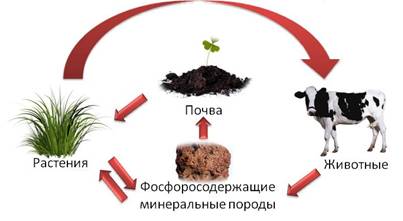
Фосфорная
кислота используется как катализатор в органическом синтезе,
для производства кормовых добавок, придании кисловатого вкуса безалкогольным
напиткам, осветления сахара. Но основная часть фосфорной кислоты расходуется на
производство фосфатов, использующихся в качестве минеральных удобрений. Фосфаты
применяются и в медицине, для пропитки тканей, древесины и пластмасс с целью
придания им огнестойкости, также при производстве стиральных порошков.

Таким
образом, фосфор является элементом V Aгруппы.
На внешнем энергетическом уровне у него 5 электронов, для него характерны
степени окисления от -3 до 5, но наиболее типична 5. В природе он встречается
в виде соединений – фосфоритов и апатитов. Фосфор образует несколько
аллотропных модификаций: белый, красный и чёрный фосфор. Наиболее
распространёнными соединениями фосфора являются – оксид фосфора (III), оксид
фосфора (V), фосфин и фосфорная кислота. В реакциях с металлами фосфор
проявляет окислительные свойства, а в реакции с кислородом – восстановительные.
Фосфорная кислота – трёхосновная кислота, которая образует три вида солей:
фосфаты, гидрофосфаты и дигидрофосфаты. Качественным реактивом на фосфат-ион
является нитрат серебра один, потому что в результате взаимодействия образуется
осадок жёлтого цвета. Фосфор и его соединения имею большое значение в
химической промышленности.
Химические свойства сероводорода
1.В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S 2NaOH → Na2S 2H2OH2S NaOH → NaНS H2O
2.Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S O2 → 2S 2H2O
В избытке кислорода:
2H2S 3O2 → 2SO2 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S Br2 → 2HBr S↓
H2S Cl2 → 2HCl S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S 4Cl2 4H2O → H2SO4 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S 2HNO3(конц.) → S 2NO2 2H2O
При кипячении сера окисляется до серной кислоты:
H2S 8HNO3(конц.) → H2SO4 8NO2 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S SO2 → 3S 2H2O
Соединения железа (III) также окисляют сероводород:
H2S 2FeCl3 → 2FeCl2 S 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S K2Cr2O7 4H2SO4 → 3S Cr2(SO4)3 K2SO4 7H2O
2H2S 4Ag O2 → 2Ag2S 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S H2SO4(конц.) → S SO2 2H2O
Либо до оксида серы (IV):
H2S 3H2SO4(конц.) → 4SO2 4H2O
4.Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S Pb(NO3)2 → PbS 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопытвзаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Элементы подгруппы кислорода
ОБЩАЯ ХАРАКТЕРИСТИКА
Общая характеристика
элементов главной подгруппы VI группы (подгруппы кислорода)
Таблица. Электронное строение и физические свойства.
Поряд- | Элемент | Относитель- | Электронная | Атомный | ПИ | Э.О | Степени | t°пл | t°кип | r |
8 | Кислород (O) | 15,9994 | [He] 2s22p4 | 0,066 | 14,5 | 3,5 | -2, -1, | -218,4 | -182,9 | 1,2 |
16 | Сера (S) | 32,06 | [Ne] 3s23p4 | 0,105 | 10,5 | 2,6 | -2, 2, 3, | 112,8 | 444,67 | 2,07 |
34 | Селен (Se) | 78,96 | [Ar] 3d104s24p4 | 0,116 | 9,8 | 2,01 | -2, 4, 6 | 217 | 1390 | 4,8 |
52 | Теллур (Te) | 127,60 | [Kr] 4d105s25p4 | 0,143 | 8,6 | 1,9 | -3, 3, 4, 5 | 450 | 1750 | 6,68 |
84 | Полоний (Po) | 208,98 | [Xe] 4f145d106s26p4 | 0,176 | 7,8 | 1,76 | 2, 4 | 282 | 962 | 9,32 |
cКИСЛОРОД
Кислород O2
(К.В. Шееле 1772 г., Дж. Пристли 1774 г.)
Самый распространенный элемент на Земле; в воздухе — 21% по объему; в земной коре — 49% по массе; в гидросфере — 89% по массе; в составе живых организмов— до 65% по массе.
Строение атома
P11 = 8; n01 = 8; e = 8
1s22s22p4
P11 = 8; n01 = 8; e = 8
1s22s22p4
Физические свойства
Газ — без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1.
Способы получения
1. Промышленный способ (перегонка жидкого воздуха).
2. Лабораторный способ (разложение некоторых кислородосодержащих веществ)
2KMnO4 –t°® K2MnO4 MnO2 O2
2KClO3 –t°;MnO2® 2KCl 3O2
2H2O2 –MnO2® 2H2O O2
Способы собирания
Вытеснением воды Вытеснением воздуха
Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
С неметаллами
C O2 ® CO2
S O2 ® SO2
2H2 O2 ® 2H2O
С металлами
2Mg O2 ® 2MgO
2Cu O2 –t°® 2CuO
Со сложными веществами
4FeS2 11O2 ® 2Fe2O3 8SO2
2H2S 3O2 ® 2SO2 2H2O
CH4 2O2 ® CO2 2H2O
Горение в кислороде
Вытеснением воды Вытеснением воздуха
Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
С неметаллами
C O2 ® CO2
S O2 ® SO2
2H2 O2 ® 2H2O
С металлами
2Mg O2 ® 2MgO
2Cu O2 –t°® 2CuO
Со сложными веществами
4FeS2 11O2 ® 2Fe2O3 8SO2
2H2S 3O2 ® 2SO2 2H2O
CH4 2O2 ® CO2 2H2O
Горение в кислороде
Озон O3
Озон -аллотропная модификация кислорода.
Физические свойства
Газ, запах свежей хвои, бесцветный, растворим в воде; t°кип= -112°С; t°пл= -193°C.
Получение
3O2 ® 2O3
1. Во время грозы (в природе), (в лаборатории) в озонаторе
2. Действием серной кислоты на пероксид бария
3BaO2 3H2SO4 ® 3BaSO4 3H2O O3
Химические свойства
1. Неустойчив:
O3 ® O2 O
2. Сильный окислитель:
2KI O3 H2O ® 2KOH I2 O2
Обесцвечивает красящие вещества, отражает УФ — лучи, уничтожает микроорганизмы.


