Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин.
На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера[13], [14].
Но каким же образом пальмитиновая кислота может способствовать нейродегенерации? Установлено, что из-за избытка этой кислоты накапливаются церамиды, которые участвуют в регуляции терминальной дифференцировки, пролиферации и апоптоза нейронов. Посредством нескольких химических реакций они воздействуют на регуляторы клеточного цикла, повышая концентрацию ингибиторов киназp21/SDI1 и p27/KIP1.
Таким образом церамиды останавливают клеточный цикл, что, в свою очередь, активирует главного «стража генома» — белок р53 — и «насылает» на клетку апоптоз [15]. Кроме этого, при деградации церамида образуется вещество сфингозин, обладающее цитотоксическим действием и способное вызывать как апоптоз, так и некроз клеток.
Но и это еще не всё. Обнаружено, что накопление насыщенных жирных кислот (пальмитиновой и стеариновой) стимулирует специальные клетки головного мозга (астроглию) на эндогенный (внутренний) синтез церамидов. Эти произведенные церамиды запускают цепную реакцию следующего вида: церамиды → повышение секреции провоспалительных цитокинов и оксида азота → увеличение производства АФК и окислительный стресс → активация стресс-регулируемых киназ (CDK5 и GSK-3) в нейронах → образование β-амилоидного белка и гиперфосфорилирование τ-белка[16].
Как улучшить свои митохондрии?
Итак, мы рассмотрели все, что известно о жизни митохондрий в наших клетках. Как они производят энергию, делятся, сливаются, умирают, поглощаются клетками. И рассмотрели несколько примеров стратегий разработки митохондриальных препаратов, воздействующих на эти аспекты жизни митохондрий.
На сегодняшний день зарегистрированных митохондриальных препаратов пока нет, но идет множество клинических и доклинических испытаний, и, я надеюсь, в самом ближайшем будущем митохондриальные препараты будут доступны для пациентов с митохондриальными заболеваниями.
Несмотря на достижения науки, позволяющие воздействовать точечно на какие-то конкретные процессы в митохондриях, все же многие метаболические нарушения имеют комплексное воздействие на митохондрии [18], [29], [64], [65].
Например, высокожировая диета, гиподинамия, депривация сна, вредные привычки приводят как к уменьшению количества митохондрий в клетках и нарушению их биогенеза, так и к появлению «плохих» митохондрий, которые хуже вырабатывают АТФ. Это, в свою очередь, приводит к накоплению липидов в клетке, которые сами по себе могут быть токсичными . Такой эффект лежит в основе сахарного диабета второго типа.
Но есть и обратный путь. Изменяя образ жизни, можно улучшить свои митохондрии без особых сложностей. Наиболее важными являются три аспекта образа жизни, за которыми стоит следить: 1 — питание, 2 — физическая активность, 3 — вредные привычки. Например, интервальное голодание в течение 8–10 часов оказывает положительный эффект на состояние митохондрий.
То есть, фактически, если не есть ночью, этого вполне достаточно, чтобы немного улучшить собственные митохондрии [68]. Источник жиров — еще один немаловажный аспект, который следует учитывать. Например, насыщенные жиры, характерные для фастфуда, и полиненасыщенные жиры из рыбы или нерафинированного оливкового масла совершенно по-разному влияют на работу митохондрий (выбор очевиден)
Мы обсуждали, что физические упражнения способствуют созданию локальной гипоксии, которая прекрасно тренирует органы нашего организма к стрессовым условиям [27–30]. Особо заметные результаты показали высокоинтенсивные интервальные тренировки, увеличивающие число митохондрий и улучшающие их качество [74] даже у людей старшего возраста [75] или с метаболическими заболеваниями [76]. Впрочем, умеренные физические нагрузки тоже дают значимый эффект [77].
Влияние вредных привычек, таких как курение и чрезмерное употребление алкоголя, на состояние митохондрий было изучено еще в прошлом веке [78], [79]. Сейчас фокус исследователей больше направлен на разработку препаратов, противостоящих этим нарушениям [80], [81], однако волшебной пилюли пока ждать не приходится.
В заключение хотелось бы сказать, что, хотя сейчас и разрабатывается множество перспективных препаратов, все же пока самый лучший способ держать митохондрии в тонусе — спорт, сбалансированное питание и отказ от вредных привычек!
Желаю, чтобы ваши митохондрии были здоровы и счастливы!
Митохондрия как биологический тепловой двигатель внутри клеточного конвейера — портал научно-практических публикаций
Библиографическая ссылка:
Косарев А.В. Митохондрия как биологический тепловой двигатель внутри клеточного конвейера // Портал научно-практических публикаций [Электронный ресурс]. URL: https://lifeo2.ru/2022/07/8911 (дата обращения: 09.05.2022)
АННОТАЦИЯ
Рассмотрены морфологические и физиологические особенности клеточной органеллы митохондрии. Митохондрии являются “энергетическими станциями клетки”, участвуют в процессах клеточного дыхания и преобразуют порядка 40% энергии окисления субстратов в АТФ, в форму энергии доступную при использовании в многочисленных клеточных процессах. Принято считать, что остальные 60% выделившейся при окислении энергии превращаются в тепло и выводятся из клетки и организма. В статье высказано предположение, что, митохондрия использует энергию окисления более рационально, чем принято считать. 40% используется в процессе фосфорилирования АТФ, а 60%, выделяясь в объёме матрикса митохондрии, вызывают местный подъём температуры и как следствие давления. Повышенное давление в области матрикса сдавливает кристы и митохондрия работает как сильфонный насос. Биологический раствор выдавливается в форме гидродинамического потока из межмембранного пространства и матрикса митохондрии, обеспечивая все внутриклеточные перемещения.
Все живые организмы вне зависимости от их сложности имеют в своей основе клеточное строение. Однако “даже в случае простейшей клетки в процесс метаболизма вовлечены несколько тысяч сопряжённых химических реакций, что, безусловно, требует тонких механизмов координации и регуляции. Иными словами, здесь требуется чрезвычайно сложная функциональная организация. Если рассмотреть, как клетка выполняет сложную последовательность операций, то можно заметить, что клетка работает по тем же принципам, что и современный сборочный конвейер”. [9].
Основным источником энергии, функциональную основу жизни представляют циклические ферментативные реакции окисления и синтеза. Именно в силу цикличности этих реакций поддерживается постоянство неравновесности живой системы, формируются градиенты температур и давлений. Согласно синергетике и теории диссипативных структур наличие градиентов – необходимое условие для формирования в системе кооперативных потоков. Как пишет автор [10]: “Весьма вероятно, что через созидание диссипативных структур возникла жизнь”. К тому же на стадии окисления до 40% выделившейся энергии связывается в универсальном энергоносителе АТФ в удобный для живого вид потенциальной энергии, используемый во многих активных процессах.
Транспорт веществ внутри клетки и во всём организме обеспечивается кооперативными потоками энергии, продуцируемыми в клетках, т.к. только такие потоки способны совершать работу против сил диссипации, совершать внешнюю работу. В животной клетке действует своеобразный двигатель внутреннего сгорания, преобразующий энергию химических связей в механическую энергию гидродинамических потоков биологического раствора. Особенностью биологического двигателя является то, что производство механической работы в биоцикле сопряжено с синтезом высокомолекулярных соединений из низкомолекулярных субстратов. Так, процессы окисления, идущие с выделением тепла, сопровождаются промежуточным синтезом АТФ, а процессы синтеза белков и других высоко молекулярных соединений, идут с поглощением тепла.
Вся кооперативная энергия в организме вырабатывается на клеточном уровне и расходуется на жизнеобеспечение самой клетки и на внешнюю по отношению к клетке работу (деятельность).
Первичная метаболическая энергия (в виде АТФ и кооперативных гидродинамических потоков гиалоплазмы) производится в митохондриях и частично в цитоплазме за счёт реакций окисления. Цикличность переноса вещества вовнутрь митохондрии и клетки и обратно обеспечивается цикличностью реакций синтеза и диссоциации.
МИТОХОНДРИЯ КАК БИОЛОГИЧЕСКИЙ ДВИГАТЕЛЬ ВНУТРЕННЕГО СГОРАНИЯ
Условный цикл производства кооперативной энергии в животной клетке представляется следующим. По причине того, что и межклеточная жидкость, окружающая клетку, и цитоплазма, окружающая эндоплазматическую систему, состоят на 70% из воды, т.е. несжимаемой жидкости, даёт нам основание условно принять процесс в месте протекания реакций окисления и синтеза изохорическим. В местах изохорического разогрева происходит местное повышение давления, возникает перепад давления между зонами протекания реакций и остальной цитоплазмой. Органоидами эндоплазма- тической системы клетки, главным образом в которых протекают циклические процессы окисления, являются митохондрии, где синтезируется энергоноситель организма АТФ.
Митохондрии – наиболее обособленные структурные элементы цитоплазмы клетки, обладающие в значительной степени самостоятельной жизнедеятельностью, обладающие собственной ДНК. Они являются “энергетическими станциями клетки”, участвуют в процессах клеточного дыхания и преобразуют порядка 40% энергии окисления субстратов в АТФ, в форму энергии доступную при использовании в многочисленных клеточных процессах. Принято считать, что остальные 60% выделившейся при окислении энергии превращаются в тепло и выводятся из клетки и организма. В световом микроскопе митохондрии выглядят в виде округлых (шарообразных) или удлинённых (палочкообразных) структур длиной 0,3 – 5 мкм и шириной 0,2 – 1 мкм. С помощью электронной микроскопии установлено, что митохондрии являются органеллами с двойными мембранами. Между наружной и внутренней митохондриальными мембранами расположено межмембранное пространство толщиной 10 – 20 нм. Внутренняя мембрана, имея большую площадь чем внешняя, образует многочисленные гребневидные складки – кристы. Кристы существенно увеличивают поверхность внутренней мембраны, обеспечивая значительное место для размещения дыхательной цепи. В митохондриях локализованы и ферменты, катализирующие окислительные реакции. Большая часть белков митохондрий синтезируется вне митохондрий и контролируется ядром, митохондриальная ДНК кодирует лишь немногочисленные митохондриальные белки. Наблюдались случаи перемещения митохондрий в протоплазме. Считается, что доставка АДФ, ферментов, кислорода, субстратов для реакций окисления в матрикс, и вывод из матрикса в цитоплазму углекислого газа и АТФ, последовательно через две мембраны митохондрии, осуществляется методом активного транспорта. В зависимости от функциональной активности клеток, количество митохондрий в них изменяется от сотен до десятков тысяч. [2,4,11,12].
В [5] высказано предположение, что, митохондрия использует энергию окисления, получаемую в соответствии с законом Гесса, более рационально, чем принято считать. 40% используется в процессе фосфорилирования АТФ, а 60%, выделяясь в объёме матрикса митохондрии, вызывают местный подъём температуры и как следствие давления. Повышенное давление в области матрикса сдавливает кристы, происходит сжатие митохондрии и она работает как сильфонный насос. Биологический раствор выдавливается в форме гидродинамического потока из межмембранного пространства и матрикса митохондрии.
Строение внутренней мембраны митохондрии – классический пример рациональности природы. С одной стороны это большая, развитая поверхность для течения реакций окисления и синтеза АТФ, с другой – возможность получения гидродинамического потока на принципах сильфона.
Прежде чем описать принцип производства гидродинамических потоков митохондрией отметим, что в клетке есть ещё одна структура с двойной мембраной. Это ядро. В ядре имеются многочисленные ядерные поры, соединяющие внутреннее пространство ядра с цитоплазмой и протоки, соединяющие межмембранное пространство ядра с полостью ретикулума. “Ядерная оболочка пронизана множеством расположенных упорядоченно ядерных пор округлой формы диаметром 50 – 70 нм, которые в общей сложности занимают до 25% поверхности ядра. Через ядерные поры осуществляется избирательный транспорт крупных частиц, а также обмен веществ между ядром и цитоплазмой”. [11, стр.31]. “Перинуклеарное пространство составляет единую полость с эндоплазматическим ретикулумом”. [11, стр.31 и Рис.1, стр. 18].
Схожесть морфологии митохондрии и ядра позволяет, во-первых, высказать предположение о единстве эволюционного происхождения митохондрии и клеточного ядра. Во-вторых, высказать предположение о наличии у митохондрии пор наподобие ядерных, соединяющих матрикс митохондрии с цитоплазмой и наличие проток, соединяющих межмембранное пространство митохондрии с эндоплазматическим ретикулумом.

Рис.1
Митохондрия исполняет свои функции в два этапа (два такта). На рисунке – 1 показана последовательность этапов функционирования митоходрии. Здесь цифрой -1 обозначены митохондриальные поры, соединяющие полость матрикса с цитоплазмой. Цифрой -2 обозначены протоки, соединяющие межмембранное пространство митохондрии с пространством ретикулума. На рисунке -1 слева изображён этап сжатия. В этот период в матриксе и на кристах протекают реакции окисления цикла Кребса и дыхательной цепи. Выделяющееся в результате экзотермических реакций окисления тепло вызывает местный рост давления. Давление, воздействуя на площадь крист, заставляет митохондрию сжиматься, и она из палочкообразной формы превращается в округлую, уменьшаясь в объёме. При этом гиалоплазма из межмембранного пространства через протоку поступает в эндоплазматическую сеть, вызывая все внутриклеточные перемещения. Из матрикса гиалоплазма вместе с наработанной АТФ и углекислым газом вытесняется через митохондриальные поры в цитоплазму. На втором этапе (на рисунке -1 справа) в межмембранное пространство сжатой митохондрии из ретикулума через протоку начинает подаваться гиалоплазма. Это приводит к распрямлению митохондрии и она принимает палочкообразную форму, увеличиваясь в объёме. В матриксе создаётся разрежение и в него через митохондриальные поры поступают АДФ, субстраты для реакций окисления и кислород. Митоходрия готовится к новому циклу. Когда часть митохондрий в клетке сжимается, другая часть распрямляется.
Гидродинамические потоки, вырабатываемые митохондриями, и являются движущей силой внутриклеточного сборочного конвейера, основой активного внутриклеточного транспорта. Потоки упорядоченно движутся по развитой циркуляционной системе клеточного ретикулума.
В предложенной модели отпадает необходимость в прохождении крупных молекул в матрикс через две мембраны с помощью активного трансмембранного транспорта. Замеченные активные перемещения митохондрий в цитоплазме можно объяснить следующим. Когда случается отрыв протоки митохондрии от ретикулума, то в процессе сжатия у митохондрии возникает реакция струи, которая и вызывает её перемещение. Интересно отметить и такой факт. В [12, Том1] на Рис. 5.31 изображена электронная микрофотография лизосомы, внутри которой перевариваются, захваченные ею, старые митохондрии. Все митохондрии на фото имеют округлую форму, нет ни одной палочкообразной. Это можно объяснить тем, что оторвавшаяся старая митохондрия, сработав остатки субстратов внутри матрикса, успевает принять округлую форму. А вот для принятия палочкообразной формы у неё уже нет возможности.
Окислительные реакции, протекающие в митохондриях, или реакции цикла Кребса, в которых высвобождается и запасается большая часть энергии, по праву получили название – энергетический котёл, так как основываются на тех же законах физической химии, что и технические устройства. На фотографиях, полученных с помощью электронных микроскопов, митохондрии имеют или округлую или вытянутую цилиндрическую форму. Это говорит не о различной морфологии, а о различных функциональных состояниях митохондрии.
Возникшим кооперативным гидродинамическим потоком, с одной стороны, выносятся в межклеточную жидкость продукты распада от реакций окисления и продукты синтеза в клетке, которые используются всем организмом, с другой стороны – происходят перемещения по эндоплазматической системе, обеспечивающие функционирование самой клетки. Скажем, перенос информационной РНК, сформировавшейся в ядрышке на матричном гене ДНК, к тому месту эндоплазматической сети, где в рибосоме на матричной базе информационной РНК происходит синтез соответствующего белка. Процесс кооперативного движения протекает до тех пор, пока давление в зонах повышения давления не сравняется с давлением в межклеточной жидкости. Поток из митохондрии и клетки вовне прекращается. Однако в течение кооперативного процесса в соответствующие зоны эндоплазматической системы доставлены исходные материалы для протекания реакций синтеза высокомолекулярных соединений, необходимых организму для функционирования и регенерации. Реакции синтеза – это эндотермические реакции и они протекают с затратой энергии. То есть в полостях эндоплазматической сети, где протекают реакции синтеза, снижается температура и соответственно давление, в результате чего вновь появляется перепад давлений между межклеточной жидкостью и средой эндоплазматической сети, но направленный во внутрь клетки. Вновь возникает кооперативный гидродинамический поток по эндоплазматической сети от меж- клеточной жидкости через внешнюю мембрану во внутрь клетки. При этом в клетку из межклеточной жидкости доставляется новая порция субстратов и других необходимых элементов для протекания следующего функционального цикла клетки и в частности “перезарядка” митохондрий. Как на Рис.1 справа. Поток вовнутрь продолжается до выравнивания давления и температуры внутри клетки и в межклеточной жидкости. Функциональный цикл окисления – синтеза животной клетки замкнулся.
Митохондриальный и клеточный цикл энергопревращения в целом соответствует циклу сильфонно поршневого двигателя. [7,8]. Отметим, что для возможности таких процессов мы предполагаем у митохондрии дополнительные морфологические особенности. А именно наличие двойных пор – 1 (Рис.1) как у клеточного ядра и наличие трубчатых каналов – 2 (Рис.1), соединяющих межмембранную полость с полостью ретикулума. Без таких морфологических особенностей митохондрия не сможет циклически работать. На эту мысль нас навела работа сильфонно поршневого двигателя. А конструкция сильфонно поршневого двигателя зародилась при изучении морфологии митохондрии. Отметим ещё раз, что при таких морфологических особенностях снимается проблема интенсивного пропуска субстратов через двойную мембрану митохондрии. В [7,8] показано, что митохондриальный цикл реализует принципиально иной способ преобразования тепла в работу, нежели тот, что реализуется в сегодняшних тепловых машинах. Этот, реализованный в живой природе принцип преобразования тепла в работу позволяет снять противоречие между теоретической термодинамикой и экспериментальной биофизикой. В экспериментальной биологии ещё более 50-ти лет назад установлены удивительные факты, противоречащие устоявшимся представлениям классической термодинамики. Так КПД мышечной деятельности черепахи достигает эффективности в 75-80%. [1]. При этом перепад температур в клетке не превышает долей градуса, что необъяснимо с позиций классической термодинамики.
В качестве примера опишем возможный механизм обмена между внутренней полостью ядра и цитоплазмой.

Рис. 2
Условная схема циклического обмена между полостью ядра и цитоплазмой изображена на Рис.2. Здесь: 1 и 2 – внутренняя и внешняя мембрана ядра; 3 – ядерная пора; 4 – ДНК.
Если предположить, что внутренняя мембрана ядра по площади больше внешней мембраны (как у митохондрии), то при поступлении потоков в межмембранное пространство ядра, (как на Рис.2, слева) межмембранное пространство раздувается, а внутренняя полость ядра сдавливается и содержимое ядра выдавливается через ядерные поры в цитоплазму. Этим потоком смывается сформировавшаяся в ядрышке информационная РНК и выносится к рибосомам цитоплазмы. На второй стадии (Рис.2, справа) содержимое межклеточной полости двойной ядерной оболочки, по причине циклической работы митохондрий, перетекает в митохондрии, что приводит к поступлению в полость ядра из цитоплазмы мономеров для формирования РНК или ДНК. Округлая форма и общий объём ядра за цикл не меняется по причине меньшей по площади поверхности внешней ядерной мембраны. Происходит только локальное перетекание гиалоплазмы. В случае с ядром разница в площадях внешней и внутренней мембран не приводит к изменению внешней формы как у митохондрии по причине того, что с одной стороны у ядра имеется большое количество пор, с другой – внутренняя мембрана ядра не имеет кристов. В [3] показана решающая роль митохондрий в сократительных процессах миоцитов. В [8] описана конструкция теплового двигателя, работающего на тех же физико-химических принципах, что и митохондрия.
ЗАКЛЮЧЕНИЕ
Необходимо проведение исследований митохондрий с помощью электронного микроскопа для выявления митохондриальных пор и проток, соединяющих межмембранное пространство митохондрии с полостью эндоплазматического ретикулума, как у клеточного ядра. В случае их обнаружения изменится, принятая на сегодня картина обмена между матриксом митохондрии и цитоплазмой. Будет подтверждён принципиально новый биологический принцип преобразования тепла в работу. Получит объяснение высокий КПД мышечной деятельности, вытекающий из опытов Хилла и противоречащий классической термодинамике.
ЛИТЕРАТУРА
1. Антонов В.Ф. и др. Биофизика. – М.: “Владос”, 2003г., 288с.
2. Бышевский А.Ш., Терсенёв О.А. Биохимия для врача. Екатеринбург. Изд-во “Уральский рабочий”, 1994г., 384с.
3. Долгов М.А., Косарев А.В. Взаимодействие эластического и гидродинамического компонентов в процессе сокращения и расслабления мышечного волокна. //Вестник Оренбургского гос. у-та №12(79), 2007г., с. 106-112. http://vestnik.osu.ru/2007_12/21.pdf.
4. Каменский А.А. и др. Биология. – М.: ЭКСМО, 2003г., 640с.
5. Косарев А.В. Биодинамика, механизм и условия производства кооперативных потоков энергии в биологических структурах. // Вестник Оренбургского гос. у-та. №6, 2004г., – с. 93-99. http://vestnik.osu.ru/2004_6/17.pdf.
6. Косарев А.В. О морфологических и функциональных особенностях митохондрии. //Материалы Всероссийской научно – технической конференции “Современные проблемы математики и естествознания”. Нижний Новгород: Нижегородский научный и информационно-методический центр “Диалог” , 2009г., с.6-7.
7. Косарев А.В. Монография “Динамика эволюции неравновесных диссипативных сред”. Издание второе, переработанное и дополненное. – Из-во: LAMBERT Academic Publishing, г. Саарбрюккен, Германия, 2022г., 354с.
8. Косарев А.В. Тепловой двигатель на новом термодинамическом принципе преобразования тепла в работу и его работа на естественных перепадах температур возобновляемых источников энергии.
http://new-idea.kulichki.net/pubfiles/140121164236.doc
9. Николис Г., Пригожин И. Самоорганизация в неравновесных системах. – М.: “Мир”, 1979г., 512с.
10. Самойлов В.О. Медицинская биофизика. – Санкт-Петербург: “СпецЛит”, 2004г., 496с.
11. Сапин и др. Анатомия человека. Т.1 –М.: “ОНИКС”, 2002г., 464с.
12. Тейлор Д. и др. Биология. / Тейлор Д., Грин Н., Стаут У. /Пер. с англ. Ю.Л. Амченкова, М.Г. Дуниной и др.). – М.: “Мир”. Том 1, 2001г., 454с. Том 2, 2002г., 436с. Том 3, 2002г., 451с.
Количество просмотров публикации: —
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17].
В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида.
Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4).
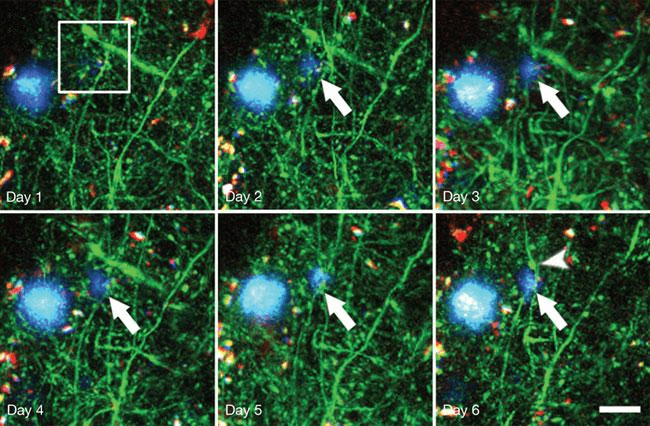
Рисунок 4. Образование амилоидной бляшки у генно-инженерных мышей (показано длинной стрелкой). На 6-й день уже видна дистрофия нейрона (короткая стрелка). Синим цветом обозначены отложения амилоида, зеленым — нейроны. Длина масштабной линейки — 20 мкм; снимки сделаны с помощью мультифотонного микроскопа.
[33]
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE).
Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА.
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви.
Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания.
Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути.
Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани.
Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина.
Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти.
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных).
Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов.
Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией.
Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ.
Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран.
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП.
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.

