Ацетилен
Ацетилен – газ, ненасыщенный углеродом, легче воздуха, бесцветен, имеет сладковатый вкус и слабо эфирный запах. Химическая формула C2H2. Температура плавления при сгорании в смеси с кислородом до 3200 o С.
Смесь ацетилена с воздухом и кислородом крайне взрывоопасна в различных пропорциях (2,2 – 81% – с воздухом, и 2,8 – 93% – с кислородом), кроме того чистый ацетилен взрывоопасен в сжатом состоянии, начиная с 15 МПа (150 кгс/см 2 ). К потребителю ацетилен поступает по трубопроводу от газоразрядных перепускных рамп, в баллонах или его получают из карбида кальция в ацетиленовом генераторе.
Использование растворенного ацетилена из баллонов предпочтительнее ацетилена, полученного в ацетиленовом генераторе: более устойчиво работает аппаратура, повышается безопасность работ и чистота рабочего места, обеспечивается лучшее использование дорогостоящего карбида кальция.
Безопасность
Сжатые кислород и ацетилен в баллонах — могут быть очень опасны при малейших нарушениях правил эксплуатации, потому их я конечно использовать не буду.
Газы – заменители ацетилена
Ввиду высокой стоимости ацетилена (С2Н2 стоит приблизительно в 4 раза дороже пропанобутановой смеси и в 43 раза дороже природного газа). Кроме того газы-заменители обладают рядом преимуществ перед кислородно-ацетиленовой резкой: более высокое качество поверхности реза; отсутствует оплавление кромок; процесс резки устойчивый, отсутствуют «хлопки» пламени; расстояние между мундштуком и разрезаемым металлом может изменяться в более широких пределах; износоустойчивость мундштуков при применении природного газа в 2-3 раза больше по сравнению с кислородно-ацетиленовой резкой. Газы-заменители подразделяются на две группы: сжиженные и сжимаемые.
Сжимаемые газы – метан и многокомпонентные газы, такие, как природный, городской, нефтяной и коксовый. К ним же относится и водород. Природные газы состоят в основном из метана и подаются, как правило, по трубопроводу или (реже) в баллонах под давлением 15 МПа (150 кгс/см 2 ).
Сжиженные газы – пропан, бутан и их смеси. Крупные потребители получают их в железнодорожных и автомобильных цистернах, из которых их переливают в заводские стационарные емкости (хранилища). Далее газ подается в газификатор или отбирается в паровой фазе.
Техника кислородной резки с использованием газов – заменителей ацетилена принципиально такая же, как при резке ацетилено-кислородным пламенем. К особенностям кислородной резки на газах – заменителях ацетилена можно отнести следующее: максимальная температура пламени находится на расстоянии от ядра в 2-3 раза большем, чем у ацетилено-кислородного пламени.
Это позволяет изменять расстояние между мундштуком резака и разрезаемым металлом в более широких пределах. Время начального подогрева металла при резке примерно вдвое больше, чем при нагреве ацетилено-кислородным пламенем, что несколько снижает производительность процесса резки.
В целом, кислородная резка с использованием газов-заменителей ацетилена (особенно природного газа) имеет ряд преимуществ перед ацетилено-кислородной: более низкая себестоимость процесса за счет низкой стоимости пропан-бутановой смеси и природного газа по сравнению со стоимостью ацетилена (в 3,5 и 43 раза соответственно!); более высокое качество поверхности реза (отсутствует оплавление кромок); процесс резки устойчивый, отсутствуют «хлопки» и обратные удары, что в свою очередь увеличивает безопасность и долговечность резака; износоустойчивость мундштуков в 2-3 раза больше у резаков с использованием газов-заменителей, чем у ацетиленовых; расстояние между мундштуком резака и разрезаемым металлом изменяется в более широких пределах.
Помимо газов также следует уделять внимание нефтепродуктам. Бензин, керосин, мазут и битум востребованные на нефтяном рынке. Оптом купить дизельное топливо летнее можно в компании Евро Групп Ойл по недорогим ценам.
Основные свойства горючих газов и жидкостей
| Наименование | Низшая удельная теплота, МДж/м 3 (ккал/м) | Температура пламени в смеси с кислородом, о C | Коэффициент замены | Количество кислорода, подаваемого на 1 м 3 горючего, м 3 | Предел взрываемости в смеси с кислородом, % |
|---|---|---|---|---|---|
| Ацетилен | 52,8 (12600) | 3100-3200 | 1,0 | 0,8-1,3 | 2,3-93,0 |
| Природный газ | 31-38 (7500-9000) | 2000-2200 | 1,8 | 1,6-1,8 | 5-61 (по метану) |
| Городской газ | 17-21 (4100-5000) | 2000-2200 | 3,0 | 1,3-1,5 | 5-61 (по метану) |
| Пропан-бутан | 9,1 (22000) | 2500-2700 | 0,6 | 3,4-4,2 | 2,3-57 (по пропану) |
| Керосин (пары) | 4,2-5 (1000-1200) | 2400-2450 | 1-1,3 | 1,7-2,4 (м 3 /кг) |
Жидкое горючее
Жидкое горючее– керосин, бензин – поступает к потребителю только из специальных бачков (передвижных и стационарных) под давлением до 0,3 МПа (3 кгс/см 2 ). Бензин и керосин перед применением следует очистить от механических примесей фильтрованием через войлок. Бензин следует использовать в смеси с керосином в соответствии 1/1.
Карбид кальция
Карбид кальция – твердое вещество темно-серого или коричневатого цвета и представляет собой продукт плавления извести с углеродом. Ацетилен получается в результате разложения карбида кальция водой по формуле: СаС2 2Н20 = С2Н2 Са(ОН)2.
Карбид кальция получается в больших кусках, которые дробятся. Количество мелочи и пыли, во избежание взрыва генератора, не должно превышать 5%. Транспортируется и хранится карбид кальция в специальных герметических закрытых барабанах. Масса в наполненном состоянии от 50 до 130 кг. Вскрываться барабаны должны специальными искробезопасными ключами.
АЦЕТИЛЕН, С2Н2. Молекулярный вес 26. Ацетилен по своим физическим свойствам представляет собой бесцветный газ, в чистом состоянии обладающий слабым своеобразным запахом; несколько легче воздуха (удельный вес 0,9056).
1 литр ацетилена весит около 1,17 г. Растворим в воде, в спирте и очень легко, под давлением, в ацетоне; 1 объем ацетона растворяет под давлением 12 atm около 300 объемов ацетилена; жидкость при этом сильно увеличивается в объеме. Ацетилен при 25° и 94 atm сгущается в бесцветную легко подвижную жидкость, кипящую под атмосферным давлением при —83°,8, удельный вес 0,451; критическая температура 37°, критическое давление 68 atm.
Химически ацетилен представляет собой непредельный углеводород, являющийся первым членом гомологического ряда аналогичных углеводородов. Все они характеризуются присутствием в частице так называемой тройной связи между углеродными атомами и имеют общую формулу СnН2n-2 (n= 2, 3, 4, . ).
Строение ацетилена изображается формулой СН : СН. Согласно представлениям, развиваемым в органической химии, такого рода соединения являются менее прочными, чем соединения предельные, не содержащие кратных связей (двойной или, как в ацетилене, тройной).
Эти соединения являются эндотермическими. Образование ацетилена может быть изображено следующим уравнением: 2С 2Н = С2Н2 — 61 cal. Ацетилен, подобно всем эндотермическим соединениям, может при подходящих условиях разлагаться со взрывом.
Однако при обыкновенном давлении он безопасен и получает свойства взрывчатого вещества лишь при повышении давления свыше 2 atm или в жидком виде. Смеси ацетилена с инертными газами или его растворы значительно более безопасны. Ацетилен горит светящимся и коптящим пламенем на воздухе.
При полном горении 1 объем ацетилена дает 2 объема двуокиси углерода и 1 объем водяных паров. Для полного сгорания 1 объема ацетилена теоретически требуется 2,5 объема кислорода или 12,5 объема воздуха. Молекулярная теплота горения ацетилена 312,9 cal. при постоянном давлении.
1 л ацетилена при 0° и 760 мм имеет теплотворную способность 14100 cal. Температура светящегося пламени около 1900°; температура горения смеси 0,6 объема ацетилена и 1 объема кислорода (обычное соотношение при автогенной сварке) около 2400°; температура вспышки смесей ацетилена с воздухом и кислородом лежит в пределах 400—500°.
Смеси ацетилена с кислородом и воздухом крайне взрывчатые. Смеси с воздухом, содержащие больше 5 и меньше 80% ацетилена, взрывают от пламени, электрической искры и т. п. Как непредельное соединение ацетилен характеризуется способностью к реакциям присоединения.
Галоиды (хлор, бром) энергично взаимодействуют с ацетиленом, в виду чего реакцию приходится вести в растворах, с образованием галоидопроизводных углеводородов: этана и этилена. Йодистый и бромистый водород также прямо присоединяются к ацетилену. Присоединение хлорноватистой кислоты (НСlO) даже в водных растворах может сопровождаться взрывом.
Разведенные водные растворы гипохлоритов (солей хлорноватистой кислоты, например, белильная известь) почти не действуют на ацетилен, концентрированные — реагируют бурно. Сухая белильная известь на холоде действует лишь на примеси технического ацетилена, чем и пользуются для его очистки, но всегда с добавкой избытка щелочей (чтобы избежать возможности образования взрывчатых соединений).
Ацетилен может в присутствии катализаторов (Ni) присоединять водород, образуя этилен, этан и ряд жидких углеводородов. Азотная кислота окисляет ацетилен; при этом частью идет присоединение воды и нитрация; некоторые из получающихся продуктов взрывчатые.
Щелочные растворы перманганата калия окисляют ацетилен до угольного ангидрида, частью до муравьиной и щавелевой кислоты. При действии на ацетилен хромовой кислоты образуются ацетальдегид и уксусная кислота. Водные растворы хромовой кислоты на ацетилен не действуют, чем можно пользоваться для очистки технического ацетилена.
При пропускании ацетилена в смеси с аммиаком над окисью алюминия получаются при температуре 300—400° пирролы и пиридиновые основания (Чичибабин). При пропускании ацетилена над пиритом (серный колчедан) образуются тиофен и его гомологи (Штейнкопф). Ацетилен присоединяет элементы воды с образованием ацетальдегида при пропускании его в серную кислоту, содержащую соли окиси ртути (Кучеров).
Характерна для ацетилена его способность образовывать нерастворимые в воде взрывчатые осадки производных меди, серебра и некоторых других металлов. Красный осадок ацетиленистой меди (состава ССu2, иногда ССu2∙Н2O) получается при пропускании ацетилена через растворы (нейтральные) медных солей или через аммиачный раствор окиси меди.
В сухом виде осадок взрывается от ничтожных причин. Аналогично образуются ацетилиды серебра и ртути. Влажный ацетилен в присутствии аммиака (технический ацетилен) действует и на металлическую медь. На соли железа, никеля, кобальта, свинца, кадмия, платины, цинка и олова ацетилен не действует.
Металлические производные меди, серебра и ртути разлагаются кислотами, выделяя обратно ацетилен. Производным ацетилена является и т. н. карбид кальция СаС2; этот ацетилид кальция легко разлагается уже водой с образованием ацетилена и гидрата окиси кальция. Карбид получается сплавлением в электрической печи (
3000°) извести и угля. Эта реакция воспроизводится теперь в большом масштабе технически, и этот карбид служит источником технического ацетилена.
Синтетически ацетилен был получен впервые Бертело; он помещал вольтову дугу, образованную между угольными электродами, в атмосферу водорода. Ацетилен часто образуется при пирогенных процессах из более сложных соединений. Технически ацетилен теперь получают, как выше сказано, разложением карбида кальция водой.
С момента появления карбида в 1895 г. как массового продукта ацетилену предсказывали блестящее будущее. Считали, что он сможет вытеснить светильный газ из обихода. Это не оправдалось. Причины лежали в неприятных свойствах ацетилена: его взрывчатости, способности давать взрывчатые соединения с медью как материалом арматуры, отвратительном запахе и ядовитости примесей технического ацетилена Кроме того, устройство горелок требовало особой их конструкции.
Ацетилен горит блестящим и не коптящим пламенем лишь в том случае, если он поступает в воздух под некоторым давлением и, если устройство насадок у горелок обеспечивает возможность достаточного смешения с воздухом, а также если в такой насадке не образуются продукты распада (графит) или полимеризации ацетилена под влиянием высокой температуры.
Эта проблема разрешена, но ацетиленовым освещением пользуются лишь для установок малого размера или переносного типа. Высокая температура и малый объем ацетиленокислородного пламени обусловили широкое применение ацетилена для т. н. автогенной сварки. Перед мировой войной в Германии не менее 30—40% карбида шло на эту отрасль применения ацетилена.
В собственно химической промышленности широко пропагандировались и получили распространение некоторые галоидопроизводные, получаемые из ацетилена и хлора. Это — жидкости, превосходно растворяющие жиры, смолы и т. п. вещества, негорючие, с малой теплотой парообразования; они с успехом заменяют огнеопасные бензины и эфир для целей экстракции упомянутых веществ.
Проще всего получить первоначально тетрахлорэтилен, обладающий, однако, некоторыми практически неудобными свойствами (реагирует со щелочами и действует в присутствии воды на железо); поэтому нагреванием с известковым молоком этот продукт превращают в трихлорэтилен С2НСl3 — жидкость с температурой кипения 85°, индифферентной даже в присутствии воды по отношению к железу, меди, свинцу, цинку и олову.
Довоенное перепроизводство хлора нашло в этих продуктах новый способ реализации на рынке избыточного хлора. Вздорожание продуктов сухой перегонки дерева, в частности уксусной кислоты, необходимой для синтеза индиго (через фенилглицин из анилина и хлоруксусной кислоты), вызвало применение трихлорэтилена для замены уксусной кислоты в этой отрасли синтеза красителей.
Нагреванием трихлорэтилена с алкоголятом натрия получался дихлорвиниловый эфир по схеме: C2HCl3 NaOC2H5 = NaCl C2HCl2OC2H5. Нагреванием с водой этого последнего получался хлоруксусный эфир:
В послевоенные годы начинает приобретать все большее значение следующий цикл реакций. Пропускание ацетилена в горячую 6 %-ную серную кислоту, содержащую соли окиси ртути (реакция Кучерова), дает уксусный альдегид по реакции: С2Н2 Н2О = СН3∙СНО.
Альдегид можно окислить кислородом воздуха, растворив его в готовой уксусной кислоте; окисление идет в присутствии небольших количеств марганцовых солей. Получается синтетическая уксусная кислота СН3∙СНО О = СН3СООН. Можно конденсировать две частицы альдегида в одну частицу уксусного эфира (реакция Тищенко) в присутствии алкоголята алюминия:
2 СН3∙СНО = СН3СООС2Н5. Как видно, все эти реакции, в сущности, нуждаются лишь в дешевом ацетилене, ибо остальные исходные материалы — вода и кислород воздуха — ничего не стоят, катализаторы же регенерируются в процессе работы.
Вопрос возможности конкуренции уксусной кислоты, полученной этим способом, с уксусной кислотой, получаемой при сухой перегонке дерева, — это вопрос дешевизны ацетилена или, в конечном счете, вопрос о дешевой электрической энергии для получения карбида.
Кислород
Кислород – газ без цвета и запаха, соединяется с большинством элементов, кроме инертных газов, благородных металлов, а также фтора. Активно поддерживает горения. Химическая формула О2.Температура сжижения кислорода при нормальном атмосферном давлении -182,96°С. Температура затвердевания – 218,4 o С.
Кислород получают из атмосферного воздуха. Принцип получения заключается в следующем: воздух охлаждается и сжижается, а затем кислород выделяется вследствие разницы температур кипения кислорода (-183 o С) и азота (-195,8 o С), благодаря чему азот испаряется из воздуха раньше и быстрее, чем кислород.
Кислород поступает потребителю по трубопроводу под давлением 0,5-3,0 МПа (кгс/см 2 ) от кислородной станции или газификатора, от перепускных разрядных рамп или индивидуальных баллонов под давлением 15 МПа (150 кгс/см 2 ).
Кислород газообразный технический выпускается по ГОСТ 5583-78 трех сортов: (I, II, III) I сорт – чистота 99,7%; II сорт – чистота 99,5%; III сорт – чистота 99,2%.
На предприятиях используется в основном кислород I сорта. Для чистовой резки допускается применение кислорода II сорта, но при этом значительно возрастает его расход.
При работе с кислородом следует всегда помнить, что кислород при контакте с маслом или жиром образует взрывоопасное соединение, поэтому вся кислородная аппаратура должна подвергаться тщательному обезжириванию. В процессе работы необходимо следить, чтобы грязь, масло и жир не могли попадать на детали аппаратуры.
Конструкция
Итак, нам понадобится генератор кислорода. В моем случае — медицинский кислородный концентратор Atmung (цена порядка 20к рублей — но он, к счастью, уже был в наличии). Может генерировать 1 литр в минуту 95% кислорода, и бОльшие объемы при снижении концентрации.



Результат
Пламя ацетилена в воздухе сильно коптит, и выглядит вполне заурядно:





Задача жизни выполнена, надеюсь и вам было интересно 🙂
PS. И не повторяйте это дома.
Теория
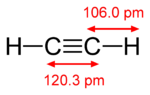
Температура пламени зависит от теплоты сгорания топлива и теплоемкости продуктов реакции. Когда мы сжигаем что-то в воздухе — нагревать приходится и азот (которого почти 80%), потому температура пламени в воздухе обычно не высокая (~1500-2000C и ниже).
Как топливо обычно рассматривают углеводороды. Углерод при сгорании дает углекислый газ, а водород — воду. Вода имеет очень большую теплоемкость (4.183 против 1.4 кДж/(кг*К) ), соответственно, чем больше в горючем будет углерода, и меньше водорода — тем выше в первом приближении потенциально достижимая температура.
Наилучшее сочетание — у ацетилена C2H2, а например у метана CH4 и пропана C3H8 — это соотношение намного хуже.
 6H6. Помимо токсичности бензола, при его сгорании выделяется меньше энергии, т.к. в ацетилене «лишняя» энергия запасена в нестабильной тройной углеродной связи, что и обеспечивает ему одну из наибольших температур горения в кислороде — 3150 °C.
6H6. Помимо токсичности бензола, при его сгорании выделяется меньше энергии, т.к. в ацетилене «лишняя» энергия запасена в нестабильной тройной углеродной связи, что и обеспечивает ему одну из наибольших температур горения в кислороде — 3150 °C.
Эта лишняя энергия (~16%) может выделится во время самопроизвольной детонации сжатого ацетилена даже без доступа воздуха (продуктом реакции будет как раз бензол и винилацетилен). Wikipedia утверждает, что для этого нужно давление всего в 2 атмосферы — но я в шприце сжимал ацетилен до 4-5 атмосфер и ничего не происходило (видимо нужны катализаторы, удар или повышенная температура).
В любом случае, из-за этого эффекта ацетилен в сжатом виде не хранят, а растворяют его в баллонах в ацетоне. Но есть и более простой и безопасный при маленьких объемах способ получения ацетилена — реакция карбида кальция с водой. Именно этот способ и будет использоваться.
Что примечательно, достигнуть еще бОльшей температуры можно — если использовать как топливо вещества, не содержащие водорода вообще: cyanogen (привет Android), (CN)2 — горит при 4525 °C и dicyanoacetylene C4N2, горит при 4990 °C (опять благодаря тройным углеродным связям, и меньшему относительному количеству лишнего азота). Но практически с этой целью их не используют из-за токсичности.

