- Валентность химических элементов
- Графическое изображение валентности и химической связи
- Дополнительные материалы
- Задание 1
- Задание 2
- Задание 3
- Запомни!
- Из истории возникновения понятия «валентность химических элементов»
- Исключения
- Какая валентность у водорода?
- Общие сведения о валентности водорода
- Определение степени окисления конкретного химического элемента
- Полезные ссылки
- Пример
- Развитие взглядов
- Различие понятий степень окисления и валентность
- Решение
- Современные представления о валентности
- Степень окисления
- Элементы с переменной степенью окисления
- Элементы с постоянной степенью окисления
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Графическое изображение валентности и химической связи
Возможность наглядного изображения молекул — одно из несомненных достоинств теории валентности. Первые модели появились в 1860-х, а с 1864 года используются структурные формулы, представляющие собой окружности с химическим знаком внутри.
Между символами атомов черточкой обозначается химическая связь, а количество этих линий равно значению валентности. В те же годы были изготовлены первые шаростержневые модели (см. фото слева). В 1866 году Кекуле предложил стереохимический рисунок атома углерода в форме тетраэдра, который он и включил в свой учебник «Органическая химия».
Валентность химических элементов и возникновение связей изучал Г. Льюис, опубликовавший свои труды в 1923 году после открытия электрона. Так называются отрицательно заряженные мельчайшие частицы, которые входят в состав оболочек атомов. В своей книге Льюис применил точки вокруг четырех сторон символа химического элемента для отображения валентных электронов.
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления 2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления 5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна 1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2H4 (гидразин) — валентность азота равна III, а степень окисления равна 2.
- H2 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Из истории возникновения понятия «валентность химических элементов»
Выдающийся английский химик XIX века Эдвард Франкленд ввел термин «связь» в научный обиход для описания процесса взаимодействия атомов друг с другом. Ученый заметил, что некоторые химические элементы образуют соединения с одним и тем же количеством других атомов. Например, азот присоединяет три атома водорода в молекуле аммиака.
В мае 1852 года Франкленд выдвинул гипотезу о том, что существует конкретное число химических связей, которые атом может образовывать с другими мельчайшими частицами вещества. Франкленд использовал фразу «соединительная сила» для описания того, что позже будет названо валентностью.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления 1, за исключением Si( 4)H4(-), B2( 3)H6(-), B( 3)H3(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na( )H(-), Ca( 2)H2(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2( )O2(-), Na(2 )O(2-), Ba( 2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2( )F2(-), O( 2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления 1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления 2 (хотя расположен во II группе побочной подгруппе).
Какая валентность у водорода?
Водород в своих соединениях проявляет постоянную валентность равную I.
Для того, чтобы определить валентность у водорода можно воспользоваться двумя способами. Высшая валентность водорода определяется номером группы в Периодической таблице Д.И. Менделеева. Так как водород находится в I группе, значит его валентность равна I.
Поскольку для данного химического элемента характерно всего одно значение валентности, совпадающее с номером группы (так называемая высшая валентность), то можно сделать вывод, что низшей валентности водород не имеет.
Кроме этого, можно записать электронную и электронно-графическую формулы водорода и по числу неспаренных валентных электронов на внешнем энергетическом уровне (один) найти значение валентности данного элемента:![]() .
.
Валентность водорода в конкретном соединении можно найти по следующей схеме (рассмотрим подробно на примере ![]() .
.
Валентность водорода в конкретном соединении можно найти по следующей схеме (рассмотрим подробно на примере 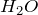 ):
):
— указываем валентность элементов, для которых это значение постоянно (известно, что валентность кислорода всегда равна II);
— вычисляем общее число единиц валентности кислорода, умножив число атомов этого элемента в молекуле на значение валентности:![]() ;
;
— делим общее число единиц валентности кислорода на число атомов водорода в соединении:![]() ;
;
— делим общее число единиц валентности кислорода на число атомов водорода в соединении: .
.
Это означает, что валентность водорода в ![]() равна I.
равна I.
Аналогичным образом определяем, что валентность водорода в ![]() равна I.
равна I.
Аналогичным образом определяем, что валентность водорода в  и других соединениях этого элемента равна I.
и других соединениях этого элемента равна I.
Общие сведения о валентности водорода
При температуре ниже -240oС (критическая температура водорода) он под давлением сжижается. Если испарять полученную жидкость, то образуется твердый водород в виде прозрачных кристаллов, плавящихся при -259,2oС.
Водород – самый легкий из всех газов, он в 14,5 раз легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, паладии, платине, растворяется в значительных количествах.
Водород имеет три изотопа: протий 1H, дейтерий 2H или D и тритий 3H или T. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий – радиоактивен. Ядро атома водорода 1H содержит один протон. Ядра дейтерия и трития включают кроме одного протона соответственно один и два нейтрона.
Молекула водорода состоит из двух атомов – H2.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Пример
Фосфор (P)
- Высшая степень окисления = 5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = 3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Развитие взглядов
Немецкий химик Ф.А. Кекуле доказал в 1857 году, что углерод является четырехосновным. В его простейшем соединении — метане — возникают связи с 4 атомами водорода. Термин «основность» ученый применял для обозначения свойства элементов присоединять строго определенное количество других частиц.
В России данные о строении вещества систематизировал А. М. Бутлеров (1861). Дальнейшее развитие теория химической связи получила благодаря учению о периодическом изменении свойств элементов. Его автор — другой выдающийся русский химик, Д. И. Менделеев.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Решение
Степень окисления натрия равна 1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*( 1) х 4(-2) = 0. Отсюда х = 6.
Современные представления о валентности
Все атомы состоят из положительного ядра, окруженного отрицательно заряженными электронами. Наружная оболочка, которую они образуют, бывает недостроенной. Завершенная структура наиболее устойчива, она содержит 8 электронов (октет). Возникновение химической связи благодаря общим электронным парам приводит к энергетически выгодному состоянию атомов.
Правилом для формирования соединений является завершение оболочки путем приема электронов либо отдачи неспаренных — в зависимости от того, какой процесс легче проходит. Если атом предоставляет для образования химической связи отрицательные частицы, не имеющие пары, то связей он образует столько, сколько у него неспаренных электронов.
По современным представлениям, валентность атомов химических элементов — это способность к образованию определенного числа ковалентных связей. Например, в молекуле сероводорода H2S сера приобретает валентность II (–), поскольку каждый атом принимает участие в образовании двух электронных пар.
При донорно-акцепторном механизме в процессе принимают участие электронные пары одного элемента и свободные валентные орбитали другого.
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд » «, а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак » » означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак » «.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание
степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = № группы.
- Низшая степень окисления = № группы – 8.
- Промежуточная степень окисления = № группы – 2.
Элементы с постоянной степенью окисления
Степень окисления = № группы
I группаглавная подгруппа степень окисления 1.
II группаглавная подгруппа степень окисления 2.
III группаглавная подгруппа (бор, алюминий) степень окисления равна 3.

