- §3.3 валентность. молекулярные формулы.
- Валентность кислорода в соединениях
- Общие сведения о валентности кислорода
- Составьте формулы бинарных соединений по известным валентностям: 2) составьте формулы веществ согласно валентности, между атомами: а) калия и кислорода б) алюминия и хлора (i) в) бора и кислорода г) азота (iii) и водорода 3) определите валентность элементов fecl3, mgs, al2s3 , zns, so2, fe2s3 , h2s, ph3, cao, ag2s —
- Степень окисления
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Таблица валентности химических элементов.
- Тренировочные задания
§3.3 валентность. молекулярные формулы.
§3.3 Валентность. Молекулярные формулы.
Введем еще один важный термин, нужный нам для дальнейшей работы: валентность. Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Например, число черточек, отходящих от символа элемента в структурных формулах, равно валентности этого элемента. Посмотрите на приведенные ниже структурные формулы некоторых веществ – из них видно, что водород и хлор одновалентны, кислород двухвалентен, углерод четырехвалентен, а азот трехвалентен.
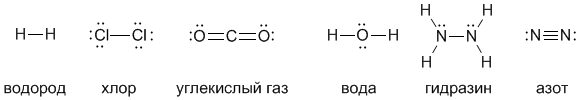
Точками здесь обозначены неподеленные пары электронов, но в структурных формулах их показывают не всегда (в связывании они непосредственно не участвуют, хотя важны с точки зрения правила октета). В структурных формулах каждая черточка – это именно поделенная пара электронов. Поэтому можно дать такое определение валентности:
Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами.
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными. Единичная (простая) связь возникает, когда атомы делят между собой одну пару валентных электронов.
Структурные формулы наглядно показывают состав вещества, последовательность связывания атомов друг с другом и валентность элементов. Но если такая подробная информация не нужна, состав вещества можно записывать в виде сокращенных химических формул:
H2 (водород) Cl2 (хлор) CO2 (углекислый газ) H2O (вода) N2H4 (гидразин) N2 (азот)
В данном случае все вещества состоят из молекул, поэтому такие формулы называют не просто сокращенными, а молекулярными. Цифра, стоящая внизу справа от символа элемента, называется индексом. Индекс показывает, сколько атомов данного элемента содержится в молекуле. Индекс 1 никогда не пишут.
Молекулярная формула показывает, сколько атомов каждого элемента входит в состав молекулы вещества.
Однако есть много веществ, в которых атомы не образуют отдельных молекул, а связаны друг с другом в «бесконечные» каркасы (подробнее вы познакомитесь с ними в §3.8). В этом случае можно выделить лишь отдельный повторяющийся фрагмент из атомов в таком веществе. Например, металлическая медь состоит из атомов (а не из молекул) меди, поэтому наименьший повторяющийся фрагмент этого вещества – атом Cu. Формула меди такая же: Cu. Соединения NaCl и CaF2 в твердом виде состоят из ионов, причем трудно различить, какие атомы «персонально» связаны друг с другом. Но отдельные повторяющиеся фрагменты (их называют «структурные единицы») состоят из атомов этих элементов именно в таких соотношениях, как мы только что записали. Кварц представляет собой «бесконечный» каркас из атомов кремния и кислорода, но наименьший повторяющийся фрагмент (структурная единица) этого каркаса содержит один атом Si и два атома O. Поэтому формула кварца – SiO2.
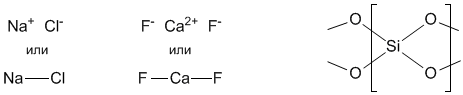
В этом случае сокращенные формулы вроде Cu, NaCl, CaF2, SiO2, строго говоря, нельзя называть молекулярными. Однако они тоже выражают элементный состав вещества и в этом смысле ничем принципиально от молекулярных формул не отличаются.
** Существует также ближайшая «родственница» сокращенной формулы — так называемая эмпирическая формула. Она показывает лишь соотношение между количеством атомов разного вида в соединении. Например, молекулярная формула гидразина N2H4 говорит о том, что молекула этого вещества действительно состоит из 2-х атомов азота и 4-х атомов водорода. А эмпирическая формула гидразина NH2 говорит лишь о том, что в этом веществе атомов водорода вдвое больше, чем атомов азота. Индексы в эмпирических формулах могут быть не только целыми, но и дробными числами. Как видно из уже приведенных здесь формул, молекулярная или сокращенная формула вещества часто либо совпадает с эмпирической формулой, либо кратна ей.
Формулы веществ в простых случаях можно составлять по валентностям входящих в них элементов. И наоборот, зная валентности элементов, можно правильно составить из них химическую формулу.
** Но как определяют валентности элементов? Для этого можно пользоваться нашими знаниями о строении внешних электронных оболочек атомов, как мы это уже делали при определении валентностей водорода, хлора, натрия, фтора, кислорода и азота в их конкретных химических соединениях.
Некоторые элементы проявляют в любых соединениях одну и ту же валентность. Таковы, например, водород, натрий, калий, серебро, фтор (валентность
I); или магний, кальций (валентность II). Другие элементы могут — в зависимости от партнеров по химической реакции — проявлять несколько разных валентностей. Причину этого мы легко объясним чуть позже, исходя из строения их атомов.
В то время, когда химики еще ничего не знали о строении атомов, они успешно определили валентности многих элементов по данным химического анализа.
Анализ позволяет выяснить состав соединения, то есть численное соотношение атомов разных элементов в молекуле — молекулярную формулу. Делается это путем точного определения массы каждого элемента в образце, тщательно очищенном от примесей других веществ. С методикой анализа вы познакомитесь позже, в курсе органической химии. Сейчас же мы воспользуемся результатами уже проведенного анализа для определения валентности, например, азота.
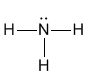
Допустим, анализ чистого образца газа аммиака дает для его молекулы формулу NH3. Можно воспользоваться тем обстоятельством, что валентность водорода всегда I (традиционно валентность обозначают римскими цифрами). Поскольку водород всегда одновалентен, его атомы в этом соединении не могут быть связаны между собой. Значит, они связаны с азотом. Вывод: валентность азота III. Для этого соединения можно придумать единственную структурную формулу:
Еще одно наблюдение: кислород во всех соединениях двухвалентен. Поэтому, например, в соединении SO2 валентность серы IV (валентность кислорода
II умножить на 2 атома кислорода = 4), а в соединении SO3 валентность серы — VI (валентность кислорода II умножить на 3 атома кислорода = 6).
В более сложных случаях можно дать лишь частичный ответ, но и он бывает полезен. Например, о соединении HClO4 мы можем лишь сказать, что остаток ClO4 — одновалентен (так как мы отняли от него одновалентный атом водорода). В соединении H2SO4 остаток SO4 — двухвалентен (отняли два одновалентных атома водорода). Поэтому для определения валентности какого-либо элемента годятся только его простые соединения с водородом и кислородом, содержащие только один атом изучаемого элемента. Требование простоты весьма существенно. Например, по составу соединения СН4 (метан) можно правильно заключить, что элемент углерод четырехвалентен. Но существует и более сложное соединение углерода С6Н6 (бензол), по которому судить о валентности углерода только из результатов анализа затруднительно.
Таблица 3-2. Валентности некоторых элементов (традиционно записываются римскими цифрами). Для элементов с переменной валентностью первая цифра – наиболее распространенная валентность. В скобках даны валентности, встречающиеся реже. Звездочками помечены элементы с постоянной валентностью.
Элемент | Валентность |
* Водород (H) | I |
* Натрий (Na) | I |
* Калий (K) | I |
* Серебро (Ag) | I |
* Фтор (F) | I |
Хлор (Cl) | I (III, V, VII) |
Бром (Br) | I (III, V, VII) |
Иод (I) | I (III, V, VII) |
Ртуть (Hg) | I, II |
Медь (Cu) | I, II |
*Бериллий (Be) | II |
* Магний (Mg) | II |
* Кальций (Ca) | II |
* Барий (Ba) | II |
* Кислород (O) | II |
Цинк (Zn) | II |
Олово (Sn) | II (IV) |
Свинец (Pb) | II (IV) |
Железо (Fe) | II, III |
Сера (S) | II, IV, VI |
Марганец (Mn) | II, IV, VII |
Хром (Cr) | III, VI |
* Алюминий (Al) | III |
Азот (N) | III (и другие) |
Фосфор (P) | III, V |
Углерод (C) | IV |
Кремний (Si) | IV (II) |
Мы уже знаем вполне достаточно, чтобы правильно определять валентности многих элементов по правилу октета и по электронному строению их атомов. Можно так и поступать в дальнейшем, не утруждая себя заучиванием валентностей важнейших элементов. Но на практике их проще выучить, чтобы не тратить каждый раз время на рисование электронных формул и структур Льюиса. В таблице 3-2 приводятся сведения о валентностях элементов, с которыми мы не раз столкнемся в нашем курсе.
Теперь разберемся в том, как составляют химические формулы по уже известным валентностям атомов. Нам нужно научиться делать это для сложных веществ, состоящих из двух элементов.
Например, надо записать формулу соединения железа (III) с кислородом (соединения элементов с кислородом называются оксидами). Запишем химические символы железа (Fe) и кислорода (O), а над символами поставим валентности этих элементов. Затем переместим вниз и крест-накрест значения валентностей, записав их справа (и внизу) около символов элементов в виде индексов:
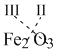
Теперь сделаем проверку. Два атома трехвалентного железа дадут в сумме (2 х III = 6) свободных валентностей и столько же свободных валентностей (3 х II = 6) обеспечивают три атома двухвалентного кислорода. Свободных, неиспользованных валентностей у атомов не осталось. Значит, формула оксида железа (III) составлена правильно: Fe2O3.
Задачи
3.7. В школьном курсе не изучают химию элемента скандия. Тем не менее, основываясь на электронном строении атома 21Sc, сделайте следующее:
а) напишите электронную формулу скандия и определите его наиболее вероятную валентность (пользуясь правилом октета);
б) напишите формулу Льюиса для соединения скандия с хлором;
в) напишите простейшую и структурную формулы соединения скандия с хлором;
г) определите: будет ли связь Sc–Cl ковалентной (один вариант), либо (второй вариант) – полярной ковалентной или ионной.
3.8. 1) Используя валентности элементов, напишите формулы соединений: а) калия с фтором; б) магния с кислородом; в) кальция с водородом; г) алюминия с фтором; д) алюминия с кислородом.
2) Нарисуйте структурные формулы соединений и определите валентность каждого атома: а) HCl; б) BeCl2; в) AlBr3; г) PH3; д) TiCl4.
3.9. Напишите формулы соединений хрома (III) и хрома (VI) с кислородом.
3.10. Напишите формулы Льюиса для соединений: H2S, CCl4 BF3, I2, ICl. Найдите здесь соединение с ковалентной связью.
** 3.11. Напишите электронную формулу валентной оболочки элемента 34Se. Сколько поделенных и сколько неподеленных электронных пар в соединении H2Se? Нарисуйте его структурную формулу.
** 3.12. Напишите формулу Льюиса и нарисуйте структурную формулу для соединения SF6. Сколько поделенных и сколько неподеленных электронных пар в этом соединении? Примечание: фтор – сильнейший акцептор электронов, поэтому электронные пары химических связей сдвинуты от атома серы к атомам фтора. Как вы думаете, какому инертному газу “подражает” сера в этом соединении – аргону или неону?
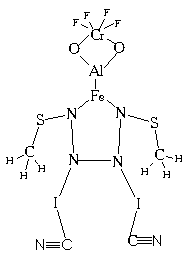
3.13. Наш старый знакомый Юх нарисовал свой химический автопортрет, повесил его в лаборатории и сказал, что со временем обязательно синтезирует такое соединение. Оно обязательно будет обладать какими-нибудь необычными свойствами. Доктор Пилюлькин сразу нашел ошибку в портрете и сказал Юху, что такое соединение вряд ли можно синтезировать. Какую ошибку смог найти доктор Пилюлькин?
_________________
Валентность кислорода в соединениях
Кислород — восьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VIA группе. В ядре атома кислорода содержится 8 протонов и 8 нейтронов (массовое число равно 16). В атоме кислорода есть два энергетических уровня, на которых находятся 8 электронов (рис. 1).
Электронная формула атома кислорода в основном состоянии имеет следующий вид:
1s22s22p4.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что кислород может проявлять валентность II в своих соединения (CaOII, Na2OII, Al2OII3, Cl2OII7, H2OII2 и т.д.).
Так как на 2 энергетическом слое нет подуровней кроме 2s и 2p, которые уже заняты электронами, возбужденного состояния у кислорода нет.
Общие сведения о валентности кислорода
Природный кислород состоит из трех стабильных изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9oС) и кипения (-183oС) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Составьте формулы бинарных соединений по известным валентностям: 2) составьте формулы веществ согласно валентности, между атомами: а) калия и кислорода б) алюминия и хлора (i) в) бора и кислорода г) азота (iii) и водорода 3) определите валентность элементов fecl3, mgs, al2s3 , zns, so2, fe2s3 , h2s, ph3, cao, ag2s —
Составьте формулы бинарных соединений по известным валентностям:
2) Составьте формулы веществ согласно валентности, между атомами:
а) калия и кислорода
б) алюминия и хлора (I)
в) бора и кислорода
г) азота (III) и водорода
3) Определите валентность элементов
FeCl3, MgS, Al2S3 , ZnS, SO2, Fe2S3 , H2S, PH3, CaO, Ag2S
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд » «, а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак » » означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.
Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак » «.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание
степеней окисления должно заменить даже самую развитую интуицию 😉
Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 615
Таблица валентности химических элементов.
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна 5?
1) HPO32) H3PO33) Li3P4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO32) H3PO33) Li3PO44) AlP
3. В каком соединении степень окисления азота равна 4?
1) HNO22) N2O43) N2O4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH32) N2H43) N2O54) HNO2
5. В каком соединении степень окисления серы равна 2?
1) Na2SO32) SO23) SCl24) H2SO4
6. В каком соединении степень окисления серы равна 6?
1) Na2SO32) SO33) SCl24) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) 2, 3, 62) 3, 6, 63) 2, 6, 54) 2, 6, 6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) числу электронов, недостающих до завершения внешнего электронного слоя4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода2) порядковому номеру химического элемента3) номеру группы4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO32) H3PO33) Na3P4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO32) H3PO33) Na3PO44) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, 32) –3, 53) 3, –34) 3, 5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –22) II, –13) I, 44) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, 52) II, –13) II, 64) III, 4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –32) III, 33) IV, –24) III, 4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом2) натрием3) фтором4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций2) железо3) сера4) хлор
18. Степень окисления 3 в своих соединениях могут проявлять
1) хлор и фтор2) фосфор и хлор3) углерод и сера4) кислород и водород
19. Степень окисления 4 в своих соединениях могут проявлять
1) углерод и водород2) углерод и фосфор3) углерод и кальций4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор2) железо3) кислород4) фтор

