- Видео
- Вычисление молярной массы
- Другие конвертеры
- Задание 29
- Задание 30
- Задание 31
- Задание 33
- Задание 34
- Задача:
- Использование конвертера «вычисление молярной массы»
- Массовая доля
- Массовая доля примесей
- Массовая доля элемента в сложном веществе
- Массовая концентрация
- Мольная доля
- Моляльная концентрация
- Молярность (молярная объёмная концентрация)
- Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
- Объёмная доля
- Объемная доля аммиака в смеси с кислородом равна 40 процентов. рассчитайте массовую долю аммиака в смеси
- Решение:
- Таблица перевода одной концентрации в другую.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Задание 29
H2S 8HNO3 = H2SO4 8NO2 4H2O
8∙ | N 5 ē → N 1
1∙ | S-2 – 8ē → S 6
Азот в степени окисления 5 (или азотная кислота) является окислителем.
Сера в степени окисления -2 (или сероводород) – восстановителем.
Задание 30
Вариант ответа
Cu(NO3)2 H2S = CuS 2HNO3
Cu2 2NO3- H2S = CuS 2H 2NO3-
Cu2 H2S = CuS 2H
Задание 31
1) 10NaHSO4 4Mg = 4MgSO4 5Na2SO4 H2S 4H2O
2) H2S 8HNO3 = H2SO4 8NO2 4H2O
3) Ba(NO3)2 H2SO4 = BaSO4 2HNO3
4) BaSO4 4C = BaS 4CO
Задание 33
К 245 г насыщенного раствора аммиака (при н.у. в 1 л воды растворяется 700 л аммиака) добавили 135 г раствора сульфата алюминия, в результате чего концентрация сульфата аммония в растворе составила 12%. Далее к образовавшемуся раствору, не отделяя осадок, прилили 700 г 35%-ного раствора серной кислоты.
Вычислите концентрацию сульфата аммония в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). (Молярный объем газов в условии задачи принять 22,4 л/моль.)
Решение:
6NH3 6H2O Al2(SO4)3 → 2Al(OH)3 3(NH4)2SO4 (I)
2NH3 H2SO4 → (NH4)2SO4 (II)
2Al(OH)3 3H2SO4 → Al2(SO4)3 6H2O (III)
Рассчитаем количество аммиака в эталонном насыщенном растворе из данных о его растворимости.nэт.(NH3) = 700 л/22,4 л/моль = 31,25 моль, тогда mэт.(NH3) = 31,25 моль · 17 г/моль = 531,25 г.
Тогда масса эталонного раствора будет составлять:mэт.р-ра(NH3) = 1000 г 531,25 г = 1531,25 г.
Для нахождения массы аммиака в 245 г насыщенного раствора составим пропорцию:1531,25 г раствора − 531,25 г аммиака245 г раствора − y г аммиака, откуда y = 85 г.
m(NH3) = 85 г, тогда количество вещества аммиака в 245 г насыщенного раствора будет равно n(NH3) = 5 моль.
Пусть количество вещества гидроксида алюминия составляет х моль, тогда количество вещества сульфата аммония будет составлять 1,5x моль.
В свою очередь, после добавления раствора сульфата алюминия имеем:1,5x · 132/(245 135 – 78x) = 0,12, откуда x = 0,22 моль гидроксида алюминия, тогда 0,33 моль сульфата аммония в образовавшемся растворе.
После добавления сульфата алюминия в первом растворе остается 5 – 0,66 = 4,34 моль аммиака.
Вычислим количество вещества серной кислоты:n(H2SO4) = 700 г · 0,35/98 = 2,5 моль.
При добавлении раствора серной кислоты в первую очередь с ней будет реагировать оставшийся в растворе аммиак, а реакция с гидроксидом алюминия, находящимся в осадке, не начнется пока не будет нейтрализован весь аммиак.
По уравнению II с 4,34 моль аммиака прореагирует в два раза меньшее количество серной кислоты, т.е. 2,17 моль.
Тогда на реакцию с гидроксидом алюминия останется 2,5 − 2,17 = 0,33 моль серной кислоты. Исходя из этого же уравнения следует, что и гидроксид алюминия и серная кислота прореагируют полностью, а количество образовавшегося дополнительного количества сульфата аммония будет равно 0,33 моль.
Таким образом, общее количество вещества сульфата аммония будет составлять:nобщее((NH4)2SO4) = 2,17 0,33 = 2,5 моль.
Общая масса сульфата аммония:mобщая((NH4)2SO4) = 132 г/моль = = 330 г.
Общая масса конечного раствора:mконечного(р-ра) = 245 135 700 = 1080 г
Массовая доля сульфата аммония в конечном растворе:w((NH4)2SO4) = 330 г/1080 г · 100% = 30,56%
Ответ: w((NH4)2SO4) = 330 г/1080 г · 100% = 30,56%
Задание 34
Известно, что массовые доли кислорода и водорода в некотором органическом соединении равны 54,55 и 4,54% соответственно. Известно, что при полном гидролизе данного соединения действием водного раствора серной кислоты образуется два соединения с мольным соотношением 3:
1, первое из которых способно вступать в реакцию серебряного зеркала.На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции гидролиза искомого соединения действием избытка водного раствора гидроксида натрия.
Решение:
Рассчитаем массовую долю углерода в искомом органическом соединении:w(C) = 100% − 54,55% − 4,54% = 40,91 %
Представим себе навеску искомого вещества массой 100 г. Тогда массы химических элементов в граммах будут численно равны массовым долям этих же элементов в процентах.
Тогда:n(C) = m/M = 40,91/12 = 3,41 моль,n(H) = m/M = 4,54/1 = 4,54 моль,n(O) = m/M = 54,55/16 = 3,41 моль.n(C) : n(H) : n(O) = 3,41 : 4,54 : 3,41 = 1 : 1,33 : 1 = 3 : 4 : 3
Таким образом, простейшая формула искомого соединения С3H4O3.
Исходя из условия следует, что искомое соединение может представлять собой сложный эфир с тремя сложноэфирными группами.
Три сложноэфирные группы содержат 6 атомов кислорода, что означает, что простейшую формулу нужно умножить минимум на 2.
Тогда молекулярная формула будет C6H8O6
Исходя из того, что один из продуктов гидролиза искомого соединения вступает в реакцию серебряного зеркала, логично предположить, что оно представляет собой сложный эфир глицерина и муравьиной кислоты, структурная формула которого:
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Использование конвертера «вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например:
1 103 000 = 1,103 · 106 = 1,103E 6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
Вначале находим w соединения:
100 — 15 = 85%
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Массовая доля элемента в сложном веществе
Видеоурок содержит информацию о массовой доле элемента. В уроке учащиеся рассмотрят примеры решения задач на расчёт массовой доли элемента и определение формулы сложного вещества по известным массовым долям элементов.
С
XIX
века химия перестала быть описательной наукой. Учёные широко стали использовать
методы измерения различных параметров веществ.
Массовая
доля элемента – это отношение массы этого элемента в
сложном веществе к массе всего вещества, выраженное в долях единицы (или в
процентах).
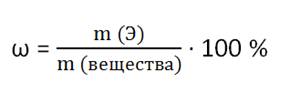
Массовая
доля элемента в веществе обозначается латинской буквой ω (дубль-вэ) и показывает
долю (часть массы), приходящуюся на данный элемент в общей массе вещества.
Массовая доля элемента в веществе выражается в долях единицы или в процентах.
Часть от целого всегда меньше целого, как долька апельсина меньше всего
апельсина.
Например,
в состав оксида ртути HgO входит два элемента –
ртуть и кислород. При нагревании этого вещества массой 50 г получается 46,3 г
ртути и 3,7 г кислорода. Рассчитаем массовую долю ртути в сложном веществе:
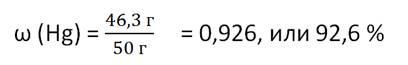
Рассчитаем
массовую долю кислорода в веществе. Для этого массу кислорода разделим на массу
смеси. Подставим значения масс веществ. Получаем:
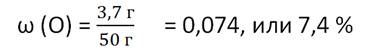
Учитывая,
что сумма массовых долей элемента в веществе равна единице, или 100 %, массовую
долю кислорода можно найти по разности:
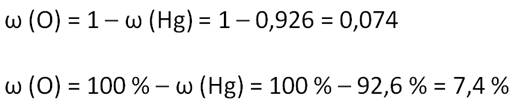
Для
того, чтобы найти массовую долю элемента в веществе, нужно относительную
атомную массу этого элемента умножить на число атомов данного химического
элемента в веществе и разделить на относительную молекулярную массу вещества.
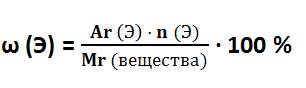
Определим
массовую долю кислорода в серной кислоте. Для этого найдём относительную
молекулярную массу серной кислоты. Необходимо значения все относительных
атомных масс элементов сложить.
Mr
(H2SO4)
= Ar
(H)
· 2 Ar
(S)
Ar
(O)
· 4 = 1 · 2 32 16 · 4 = 98
Найдём массовую долю кислорода. Для
этого нужно относительную атомную массу кислорода умножить на 4 и разделить на
относительную молекулярную массу всего вещества. Получается 0,653, или 65,3 %.
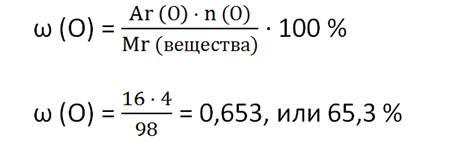
Рассчитаем
массовые доли элементов в метане, формула которого CH4.
Для этого определим относительную молекулярную массу метана. Подставим значения
относительных атомных масс и получим 16.
Mr (CH4) = Ar (C)
Ar (H) · 4 = 12 1 · 4 = 16
Затем
найдём массовую долю углерода в метане. Для этого 12 умножим на 1 и разделим на
16. В результате образуется 0,75, или 75 %.
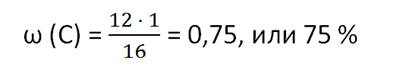
Для
того, чтобы найти массовую долю водорода в метане, следует от 1 вычесть
массовую долю углерода. Получается 0,25, или 25 %.
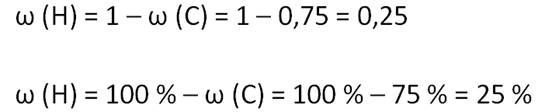
Пирит,
или золотая обманка, имеет ярко-жёлтый золотистый цвет, похож на золото,
поэтому и получил название «золото дураков». Испанские завоеватели грабили
индейцев ради изделий из пирита и увозили их домой в Европу. Пирит путали с
золотом и во время золотой лихорадки на Аляске. Это хорошо описано в книге
Джека Лондона. Минерал пирит, состоящий из 46,6 % железа и 53,4 % серы, внешним
видом очень напоминает золото. Вычислим химическую формулу пирита.

Обозначим
формулу пирита FexSy. Затем найдём
соотношение индексов x
и y.
Для этого значения массовых долей разделим на относительные атомные массы
элементов. Подставим значения и получим соотношение 0,0083 :
0,0167.
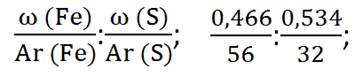
Приведём
соотношения индексов к целым числам. Для этого нужно каждое значение разделить
на меньшее число в соотношении. Получим 1 : 2. Значит,
формула пирита FeS2.
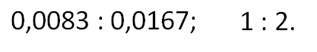
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Потому что в формуле расчёта молярной концентрации участвует объём раствора, а жидкости, как известно, в большинстве своём расширяются с ростом температуры.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na ] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Объемная доля аммиака в смеси с кислородом равна 40 процентов. рассчитайте массовую долю аммиака в смеси
2) Объём аммиака 1*0,4=0,4 л
3) Объём кислорода 1-0,4=0,6 л
4) Масса аммиака 0,4/22,4*17=0,303 кг
5) Масса кислорода 0,6/22,4*32=0,857 кг
6) ω=0,303/0,857=0,35
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} m_{2} = 200 г 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов.
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} m_{гл. 2} = 50 г 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} | large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B} frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} | = | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.