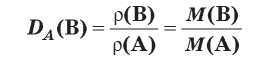- Определить формулу алкена зная что его плотность по водороду равна 14
- Рассчитайте относительную плотность фосфина (рн3) и пропана (с3н8) по водороду, кислороду, воздуху. 2. относительная плотность газа по водороду равна 32. вычислите относительная плотность этого газа по кислороду. — Знания.site
- Unnam<br /
- Вычеслите плотность аммиака nh3 по кислороду вычеслите плотность аммиака nh3 по воздуху
- Вычисление относительной плотности газа по другому газу
- Вычислите относительную плотность за воздухом бутана. — знания.site
- Закон авогадро и молярный объем газов
- Закон объемных отношений
- Массовая доля — ω
- Моль и число авогадро
- Молярная масса — m
- Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
- Нахождение относительной плотности
- Определение плотности газов
- Определите относительную плотность аммиака по кислороду и воздуху. объясните пожалуйста подробно как это делается. — спрашивалка
- Относительная атомная масса — ar
- Относительная молекулярная масса — mr
- Относительная плотность и водный раствор — ρ
- Расчет молярных масс газов по относительным плотностям газов
- Решение задач по уравнениям химических реакций
Определить формулу алкена зная что его плотность по водороду равна 14
M (CnH₂n) = DпоH₂ * M (H₂) = 14*2 = 28 г/моль
M (CnH₂n) = 12*n 1*2n = 14n
14n = 28
n = 2 ⇒ C₂H₄ — истин. ф-ла алкена
Рассчитайте относительную плотность фосфина (рн3) и пропана (с3н8) по водороду, кислороду, воздуху. 2. относительная плотность газа по водороду равна 32. вычислите относительная плотность этого газа по кислороду. — Знания.site
1)
дано
PH3
C3H8
——————
D(H2)-?
D(O2)-?
D(возд)-?
M(PH3) = 34 g/mol
D(PH3/H2) = 34 / 2 = 17
D(PH3 / O2) = 34 / 32 = 1.0625
D(PH3/возд) = 34 / 29 = 1.172
M(C3H8) = 44 g/mol
D(C3H8/H2) = 44 / 2 = 22
D(C3H8/O2) = 44 / 32 = 1.375
D(C3H8/ возд) = 44 / 29 = 1.517
2)
дано
D(H2) = 32
——————-
D(O2)-?
M(г) = D(H2) * 2 = 32 * 2 = 64 g/mol
D(O2) = M(г) / M(O2) = 64 / 32 = 2
ответ : 2
Unnam<br /
точно не сначала нужно найти относительно молекулярную массу
оксид ртути hgo= 200 16=216, чтобы вычислить массовую долю нужно 16: 216= 0.07(примерно), затем умножить на 100%, получим 7%
хлорат калия кclo3= m=39 35.5 16*3=122.5, чтобы вычислить массовую долю нужно 48: 122,5=0,4(примерно) *100%=40%
перманганат калия kmno4=m=39 54 16*4= 157, чтобы вычислить массовую долю o2, надо 64: 157=0,4(примерно)* 100%=40%
Вычеслите плотность аммиака nh3 по кислороду вычеслите плотность аммиака nh3 по воздуху
Вычисление относительной плотности газа по другому газу
Решение
1. Найдем относительные молекулярные массы газов, о которых говорится в условии задачи и запишем их в дано.
2. Относительная плотность газа X по газу Y равна отношению относительной молекулярной массы X к относительной молекулярной массе Y.
Вычислим это отношение:
DH2(О2) = 32 / 2 = 16
Dвозд(О2) = 32 / 29 = 1,103
3. Запишем ответ
Ответ: DH2(О2) = 16;
Dвозд(О2) = 1,103
Вычислите относительную плотность за воздухом бутана. — знания.site
Молекулярная масса воздуха равна 29 г/моль.
М(С4Н10) = 58 г/моль
D(по воздуху) = М(С4Н10)/М(воздуха) = 58/29 = 2.
Закон авогадро и молярный объем газов
Какие газы вы знаете? Что такое плотность?
Многие химические вещества существуют в газообразном состоянии, например 




Объем газов зависит от температуры и давления. При постоянном давлении и температуре расстояния между молекулами газообразных веществ примерно одинаковы.
Из курса физики вам известно понятие «плотность» 

В таблице 8 приведены некоторые величины, характеризующие известные вам газы.
Рассчитаем объем 1 моля каждого газа (при н.у.):
Как видно из этих расчетов, объемы одного моля различных газов при нормальных условиях (н. у.), т. е. при температуре 0°С и давлении 1 атм (101,3 кПа), примерно одинаковы и составляют 22,4 л. При стандартных условиях (t = 25°С, p = 101,3 кПа) молярный объем составляет 24 л. Эта величина называется молярным объемом и обозначается 
 V) при н. у. к
V) при н. у. к
количеству вещества 


В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. Этот закон был сформулирован итальянским ученым Авогадро в 1811 году.
Плотностью газа при н. у. называется отношение молярной массы газа на молярный объем.
Плотность газа при нормальных условиях:
Закон объемных отношений
Напишем уравнение реакции между газообразными веществами, когда в результате реакции также образуется газ:
Отношение количеств реагирующих и образовавшихся веществ выглядит следующим образом: 2 : 1 : 2. Теперь возьмем отношение объемов этих газов при нормальных условиях:
Как видим, отношения объемов газов соответствуют отношениям коэффициентов перед формулами веществ в уравнении.
При одинаковых условиях объемы реагирующих газов и газообразных продуктов реакции относятся между собой как небольшие целые числа. Это закон объемных отношений Гей-Люссака.
Из рассмотренных примеров можно сделать вывод, что при решении задач удобно пользоваться коэффициентами, т.к. они в уравнениях химических реакций указывают объемные отношения веществ.
Определите объем кислорода, необходимого для окисления 60 л оксида серы (IV) до оксида серы (VI) по уравнению:
Закон объемных отношений.
Делаев выводы:
- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.
Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.
Моль и число авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.
Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.
Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — m
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) Ar(C) (3 × Ar(O)) = 40 12 (3 × 16) = 100 г/моль
M (HCl) = Ar(H) Ar(Cl) = 1 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.
Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.
ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.
Нахождение объема, числа молекул, количества вещества по известной массе газа и обратные задачи
а) Определите объем, число молекул, количество вещества 8,8 г углекислого газа при н. у.
б) Рассчитайте массу, количество вещества и число молекул 67,2 л кислорода при н. у.
в) Рассчитать объем, массу, число молекул в 0,5 моль аммиака (н. у.).
г) Определите объем (н. у), массу и количество вещества сернистого газа числом молекул 
Нормальные и стандартные условия, молярный объем, число и закон Авогадро.
Нахождение относительной плотности
Рассчитайте относительные плотности кислорода и углекислого газа по водороду и воздуху
Определение плотности газов
Найдите плотности кислорода и углекислого газа при нормальных условиях.
Определите относительную плотность аммиака по кислороду и воздуху. объясните пожалуйста подробно как это делается. — спрашивалка
Для того чтобы справиться с задачей, необходимо использовать формулы на определение относительной плотности:
D (воздух) = Mr (газа) / Mr (воздуха) , где:
D (воздух) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (воздуха) — относительная молекулярная масса воздуха.
Все три параметра единиц измерения не имеют.
Mr (воздуха) = 29 (величина постоянная) , следовательно формула будет иметь вид:
D (воздух) = Mr (газа) / 29.
2
По аналогии выглядит формула на определение относительной плотности по водороду, с тем исключением, что вместо воздуха стоит водород. А значит, и в расчет берется относительная молекулярная масса водорода.
D (водород) = Mr (газа) / Mr (водорода) ;
D (водород) – относительная плотность;
Mr (газа) – относительная молекулярная масса газообразного вещества;
Mr (водорода) — относительная молекулярная масса водорода.
Mr (водорода) = 2, следовательно и формула будет иметь вид:
D (воздух) = Mr (газа) / 2.
Относительная плотность аммиака по воздуху.
Аммиак имеет формулу NH3.
Сначала найдите относительную молекулярную массу аммиака, которую можно рассчитать по таблице Д. И. Менделеева.
Ar (N) = 14, Ar (H) = 3 х 1 = 3, отсюда
Mr (NH3) = 14 3 = 17
Подставьте полученные данные в формулу на определение относительной плотности по воздуху:
D (воздух) = Mr (аммиака) / Mr (воздуха) ;
D (воздух) = Mr (аммиака) / 29;
D (воздух) = 17/ 29 = 0, 59.
Относительная атомная масса — ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — mr
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) Ar(O) = (2 × 1) 16 = 18
Mr (KMnO4) = Ar(K) Ar(Mn) (4 × Ar(O)) = 39 55 (4 * 16) = 158
Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.
Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.
Расчет молярных масс газов по относительным плотностям газов
Рассчитать молярные массы газов, если известны относительные плотности: 
Решение задач по уравнениям химических реакций
Вспомните!Уравнения химических реакций. Закон сохранения массы вещества. Составление и решение пропорции
По уравнениям химических реакций можно решать множество количественных задач. Мы остановимся на расчетных задачах по нахождению массы (m) и числа молей 
Решение задач осуществляется по следующему алгоритму:



 M), массу (m) веществ и записать эти данные под формулами этих веществ в уравнении.
M), массу (m) веществ и записать эти данные под формулами этих веществ в уравнении. х) записать над формулами этих веществ.
х) записать над формулами этих веществ. х).
х).
Задача 1. Сколько граммов хлорида натрия образуется при взаимодействии 92 г натрия с хлором?
 Ответ: 234 г NаCl.
Ответ: 234 г NаCl.
Задача 2. Сколько молей углекислого газа образуется при горении 36 г углерода?
 Ответ: 3 моля
Ответ: 3 моля 
Задача 3. Вычислите массу цинка (Zn), который должен взаимодействовать с соляной кислотой с выделением 10 г водорода.
 Ответ: 325 г Zn.Задача 4. Рассчитайте количество веществ оксида меди (CuO) и углекислого газа, полученных при разложении 5 г малахита
Ответ: 325 г Zn.Задача 4. Рассчитайте количество веществ оксида меди (CuO) и углекислого газа, полученных при разложении 5 г малахита 


а) 1 моль (м-т) : 2 моля (CuO) = 0,0225 моль (м-т) : х моль (CuO)
х = 0,045 моль (CuO) Ответ: 0,045 моль CuO, 3,6 г CuO.
Ответ: 0,045 моль CuO, 3,6 г CuO.
0,0225 моль