Взаимодействие неметаллов с кислородом
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Кислород и сера
Кислород О, сера S, селен Se, теллур Те являются элементами группы VIA периодической системы элементов и имеют общее название халькогены. К элементам группы VIA также относится радиоактивный металл полоний Ро.
Строение атомов и степени окисления:
Электронная конфигурация внешнего энергетического уровня атомов элементов группы VIA — 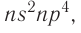
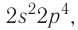
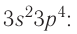
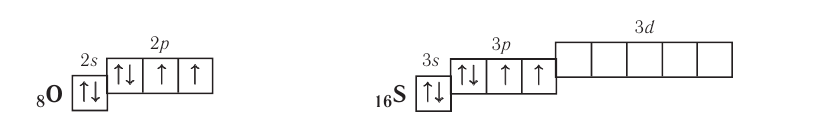
До завершения внешнего энергетического уровня атомам этих элементов не хватает по два электрона, поэтому они способны проявлять в своих соединениях степень окисления —2. Атомы серы, селена и теллура в своих соединениях с более электроотрицательными элементами проявляют положительные степени окисления 2, 4 и 6.
Распространённость в природе:
Кислород — самый распространённый элемент в земной коре. Простое вещество кислород является второй по количеству (примерно 21 % по объёму) и первой по значению для жизни составной частью атмосферы. Химический элемент кислород входит в состав воды, покрывающей 2/3 поверхности земного шара, многочисленных минералов и образуемых ими руд, многих органических соединений. Для жизни на Земле важную роль играет повторяющийся процесс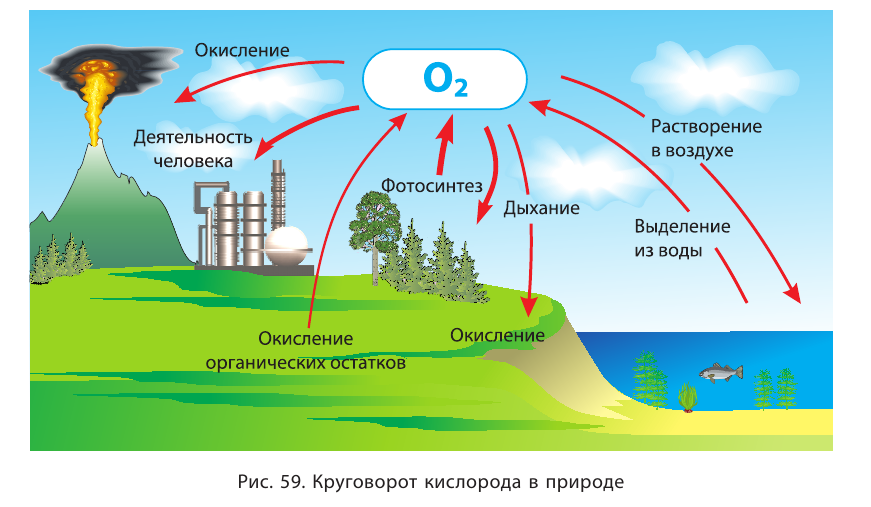
превращения и перемещения кислорода в природе, имеющий циклический характер — круговорот кислорода. Этот процесс связывает атмосферу с гидросферой и литосферой (рис. 59).
Сера в природе встречается в самородном состоянии, а также в виде соединений в составе различных минералов, например пирита 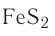
Сера относится к жизненно важным химическим элементам. Она входит в состав белков, витаминов и гормонов, присутствующих в биологических тканях всех растений и животных.
Простые вещества. Кислород:
Вы уже знаете, что кислород существует в виде двух аллотропных модификаций — кислорода 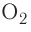
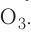
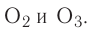
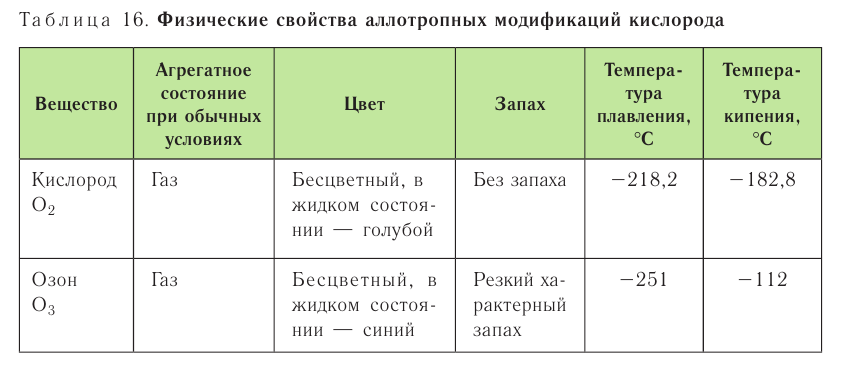
Простые вещества кислород и озон различаются и по своим химическим свойствам. Кислород непосредственно взаимодействует со многими простыми веществами. Например, он способен окислять металлы, кроме золота и платины, образуя оксиды:
Взаимодействие кислорода с неметаллами также приводит к образованию оксидов:
Важнейшим природным оксидом является вода 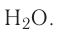
Вода обладает самой большой молярной теплоёмкостью (количество теплоты, которое надо сообщить 1 моль вещества для нагревания его на 1 °С) среди известных веществ — 75,2 Дж/моль К. Это обусловливает роль воды в природе, позволяя сглаживать перепады температур в Мировом океане.
Изменение теплоёмкости воды с повышением температуры аномально: от 0 до 37 °С она снижается, а от 37 до 100 °С повышается. Таким образом, теплоёмкость воды минимальна при 37 °С. Это температура тела человека, наиболее благоприятная для биохимических реакций в организме.
На основе физических свойств воды построена температурная шкала Цельсия: температура плавления (замерзания) воды принята за 0 °С, а температура кипения воды — за 100 °С.
Озон: является более сильным окислителем, чем кислород. Многие малоактивные металлы, например серебро, ртуть, он окисляет уже при обычных условиях:
Под влиянием катализаторов (ими могут быть различные вещества) озон легко разлагается с выделением атомарного кислорода — более сильного окислителя, чем молекулярный кислород:
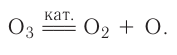
Кислород и озон способны окислять и сложные вещества. Органические вещества, окисляясь, превращаются в углекислый газ, воду, другие органические соединения.
В большинстве реакций окисления с участием кислорода выделяется теплота и излучается свет. Как вы помните, такие реакции называются горением. Например, при горении метана на воздухе образуются оксид углерода(IV) и вода:
Сера: При обычных условиях сера — хрупкое кристаллическое вещество жёлтого цвета (см. рис. 52). Твёрдая сера не смачивается водой, в результате чего мелко размолотая сера не тонет, а плавает на поверхности воды.
Простое вещество сера существует в виде нескольких аллотропных модификаций. Они различаются между собой составом, строением молекул и способом их расположения в кристаллах. В кристаллах и в неводных растворах сера чаще всего состоит из циклических молекул с одинаковой формулой 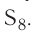
Наиболее устойчивы три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул 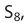 пластическая, молекулы которой состоят из полимерных цепей, содержащих от тысячи до миллиона атомов. В настоящее время получены циклические молекулы серы, содержащие в цепочке до 20 атомов.
пластическая, молекулы которой состоят из полимерных цепей, содержащих от тысячи до миллиона атомов. В настоящее время получены циклические молекулы серы, содержащие в цепочке до 20 атомов.
Аллотропные модификации серы в уравнениях химических реакций для упрощения обозначают символом S.
Химические свойства серы: Окислительные свойства серы проявляются при её взаимодействии с металлами, кроме золота и платины, например:
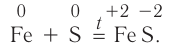
Некоторые вещества, например сульфид цинка ZnS, под действием различных видов излучений способны испускать видимый свет. Это явление называется люминесценцией. Люминесцентные покрытия наносят на дорожные знаки, на бумажные банкноты и др. При освещении таких покрытий ультрафиолетовым или видимым светом они начинают светиться.
Сера взаимодействует и с неметаллами, например горит в кислороде:При взаимодействии серы с водородом при высокой температуре образуется сероводород: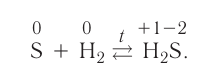
Сероводород — бесцветный газ с резким запахом тухлых яиц. Правильнее сказать, что тухлые яйца пахнут сероводородом, так как он всегда образуется при гниении белков, содержащих атомы серы. Сероводород очень ядовит. Он опасен тем, что способен накапливаться в организме, притупляя обоняние.
Сероводород растворим в воде, его водный раствор называется сероводородной кислотой. Эта кислота слабая, её диссоциация протекает ступенчато: 
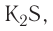
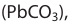
Таким способом реставрируют почерневшие старые картины, написанные масляными красками.Применение кислорода и серы
Области применения кислорода представлены на рисунке 61.
Способность озона разлагаться с образование атомарного кислорода позволяет использовать его для обеззараживания питьевой воды и обезвреживания промышленных сточных вод; как дезинфицирующее средство в медицине. Используется озон и в качестве отбеливающего средства.
Серу используют для производства серной кислоты, изготовления спичек, бенгальских огней, для борьбы с вредителями сельского хозяйства, а также для лечения некоторых болезней. Сера находит применение при производстве резины, красителей и пигментов, искусственных волокон, люминофоров и др.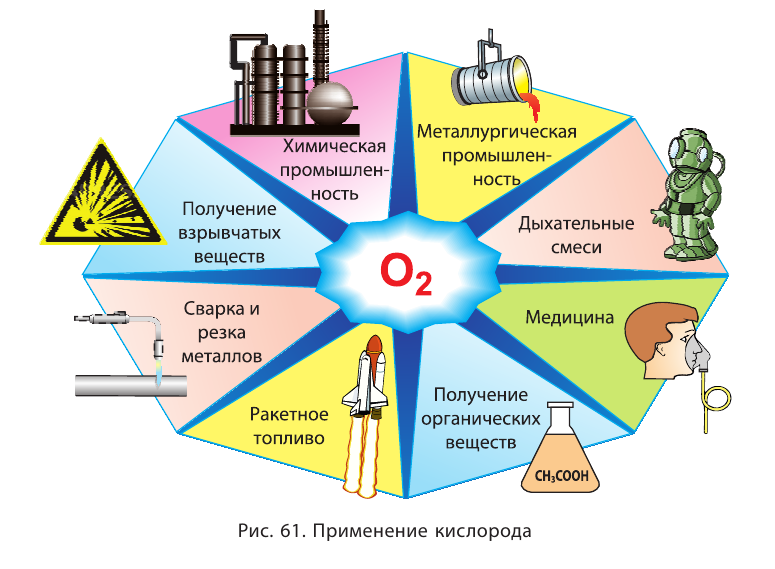
Для кислорода в соединениях с другими элементами наиболее характерна степень окисления -2, атомы серы, селена и теллура проявляют степени окисления -2, 2, 4 u 6.
Окислительные свойства кислорода и серы проявляются в их реакциях с металлами, водородом и некоторыми другими неметаллами.
Примечания
- ↑Гомоцепь представляет собой последовательность соединённых друг с другом атомов одного и тоже химического элемента. Так, молекулы S8 ромбической и моноклинной серы представляют собой замкнутые в цикл гомоцепи серы. Все органические соединения со связями углерод—углерод представляют собой гомоцепи.
- ↑Неницеску К., Общая химия, 1968, с. 51.
- ↑Мычко Д. И., Понятие «валентность», 2009, с. 6.
- ↑Реми Г., Курс неорганической химии, т. 1, 1963, с. 29.
- ↑Мычко Д. И., Понятие «валентность», 2009, с. 9.
- ↑Некрасов Б.В., Основы общей химии, т. 1, 1973, с. 26.
- ↑ 12Савельев Г. Г., Смолова Л. М., Общая химия, 2006, с. 19.
- ↑Неницеску К., Общая химия, 1968.
- ↑Некрасов Б. В., Основы общей химии, т. 1, 1973, с. 29.
- ↑Примером может служить цементит Fe3C.
- ↑Гомоцепи отсутствуют, например, в таких органических соединениях, как диметиловый эфир CH3—O—CH3 и метиловый эфир муравьиной кислоты HCO—O—CH3.
- ↑Савельев Г.Г., Смолова Л.М., Общая химия, 2006, с. 22.
- ↑Химическая энциклопедия, т. 1, 1988, с. 345.
Сравнительная характеристика галогенов
Открытие: Фтор впервые был получен электролизом жидкого фтороводорода (1886 г., А.Муассан, Франция), хлор — окислением соляной кислоты диоксидом марганца (1774 г., К.Шееле, Швеция), бром (1826 г., А.Балар, Франция), йод — из золы морских водорослей (1811, Б.Куртуа, Франция).
По-гречески «фторос » означает разрушающий, «хлорос» — желто-зеленый, «бромос » — зловонный, «иодэс » — фиолетовый.
Нахождение в природе: Галогены в природе встречаются только в виде соединений.
Важнейшие природные соединения фтора — флюорит (плавиковый шпат) 

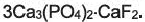
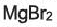
В течение года из морской воды в атмосферу переходит около 4 млн тонн брома. По этой причине в воздухе, у побережья морей, содержание брома многократно больше, по сравнению с другими районами.
Йод, в основном, встречается в виде йодида калия и йодида натрия, а также, как и бром, в составе морской водоросли — ламинарии.(а) Галогены в природе:
Соединения галогенов в Азербайджане встречаются в Нахчыване (в основном в виде NaCl) в буровых и морских водах близ городов Баку и Нефтчала (в виде йодидов и бромидов).
Получение:
1. Фтор можно получить электролизом расплавов фторида калия или фторида кальция:
2. Получение хлора (см. стр. 63)
3. Бром в лаборатории получают действием окислителей 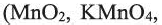
В промышленности его получают действием хлора на бромиды:
4. Йод в лаборатории получают действием слабых окислителей 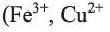
а в промышленности —действием хлора на йодиды:
Физические свойства:Фтор и хлор — ядовитые газы, соответственно, светло-желтого и желто-зеленого цвета.
Бром — жидкость красновато-бурого цвета, пары которого ядовиты. Йод — легко сублимирующее при нагревании, кристаллическое вещество темно-фиолетового цвета с резким запахом.
В ряду 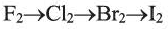
Галогены в воде малорастворимы, в спирте, бензине и керосине хорошо растворимы. Из-за того, что фтор при обычных условиях необратимо реагирует с водой, его водный раствор получить невозможно.
Химические свойства: Химическая активность галогенов убывает от фтора к йоду. Поэтому фтор по сравнению с другими галогенами более энергично вступает в реакции; например, фтор при обычных условиях энергично реагирует с углеродом, фосфором, серой и со многими металлами:
Другие галогены в реакции вступают в основном при нагревании.
С водородом фтор реагирует в темноте со взрывом, хлор — под действием света или при нагревании, бром и йод же — при нагревании:
Соединения НВr и HI — непрочные вещества. Поэтому их получают косвенным путем.
В промышленности фтороводород также получают не из простых веществ: действием концентрированной серной кислоты на минерал флюорит: 
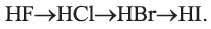
Это ее свойство используют на практике для нанесения узоров и надписей на стекле.
Соли галогенов однородных кислот называются фторидами, хлоридами, бромидами и йодидами. Для распознавания этих солей в растворе используют их реакцию с раствором нитрата серебра(I) (стр. 71).
Окислительные свойства галогенов ослабляются в ряду 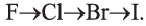
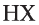
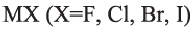
Для фтора эти реакции в водном растворе не характерны, так как фтор реагирует с водой.
Фтор, реагируя с водой, вытесняет из нее кислород (наблюдается явление горения): 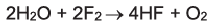
В отличие от фтора, хлор и бром очень слабо реагируют с водой. При этом, наряду с галогеноводородом, образуются хлорноватистая (НСlO) и бромноватистая (НВrО) кислоты:
Йод с водой не реагирует. Следует отметить, что восстановительные свойства галогенид ионов возрастают в ряду 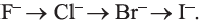
Применение галогенов: Среди галогенов наиболее широко применяется хлор (стр. 64).
Фтор и его соединения используются в синтезе фторорганических соединений (фреон, 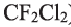
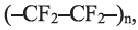
Соединения брома применяются в фотографии (AgBr), в медицине для успокоения нервной системы (NaBr, КВr) и в производстве ряда красителей.
Соединения йода применяются в йодировании (NaI ) поваренной соли, при лечении некоторых заболеваний, например, заболевания щитовидной железы, а также для дезинфекции ран 5%-ным раствором йода в этиловом спирте.
В организм человека йод поступает из воды, воздуха и пищи (молока, хлеба, яиц, соли, морской капусты и др.).
Определение ионов 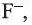
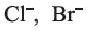 и
и 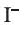 , а также молекулярного йодаИз опытов, проведенных в разделе «Деятельность», следует, что ионы
, а также молекулярного йодаИз опытов, проведенных в разделе «Деятельность», следует, что ионы 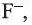
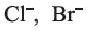 и
и 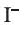 , в растворе можно определять с помощью раствора нитрата серебра(I): при этом ионы серебра
, в растворе можно определять с помощью раствора нитрата серебра(I): при этом ионы серебра 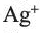
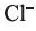
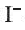
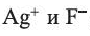
Однако ионы 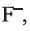
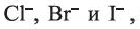
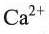
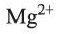
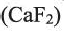
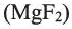
Определение молекулярного йода основывается на появлении темно-синего окрашивания при действии на крахмал разбавленного раствора йода в этиловом спирте (стр.183).
Химия и окружающая среда: Среди галогенопроизводных наибольшую экологическую опасность представляют хлорсодержащие пестициды, фреоны (фторхлор-производные углерода — 
Фотолиз — разложение вещества под действием света.
Таблица валентности химических элементов.
Порядковый номер химического элемента, он же: атомный номер, он же: зарядовое число атомного ядра, он же: атомное число | Русское / Английское наименование | Химический символ | Валентность |
1 | Водород / Hydrogen | H | (-1), 1 |
2 | Гелий / Helium | He | 0 |
3 | Литий / Lithium | Li | 1 |
4 | Бериллий / Beryllium | Be | 2 |
5 | Бор / Boron | B | -3, 3 |
6 | Углерод / Carbon | C | ( 2), 4 |
7 | Азот / Nitrogen | N | -3, -2, -1, ( 1), 2, 3, 4, 5 |
8 | Кислород / Oxygen | O | -2 |
9 | Фтор / Fluorine | F | -1, ( 1) |
10 | Неон / Neon | Ne | 0 |
11 | Натрий / Sodium | Na | 1 |
12 | Магний / Magnesium | Mg | 2 |
13 | Алюминий / Aluminum | Al | 3 |
14 | Кремний / Silicon | Si | -4, ( 2), 4 |
15 | Фосфор / Phosphorus | P | -3, 1, 3, 5 |
16 | Сера / Sulfur | S | -2, 2, 4, 6 |
17 | Хлор / Chlorine | Cl | -1, 1, ( 2), 3, ( 4), 5, 7 |
18 | Аргон / Argon | Ar | 0 |
19 | Калий / Potassium | K | 1 |
20 | Кальций / Calcium | Ca | 2 |
21 | Скандий / Scandium | Sc | 3 |
22 | Титан / Titanium | Ti | 2, 3, 4 |
23 | Ванадий / Vanadium | V | 2, 3, 4, 5 |
24 | Хром / Chromium | Cr | 2, 3, 6 |
25 | Марганец / Manganese | Mn | 2, ( 3), 4, ( 6), 7 |
26 | Железо / Iron | Fe | 2, 3, ( 4), ( 6) |
27 | Кобальт / Cobalt | Co | 2, 3, ( 4) |
28 | Никель / Nickel | Ni | ( 1), 2, ( 3), ( 4) |
29 | Медь / Copper | Сu | 1, 2, ( 3) |
30 | Цинк / Zinc | Zn | 2 |
31 | Галлий / Gallium | Ga | ( 2). 3 |
32 | Германий / Germanium | Ge | -4, 2, 4 |
33 | Мышьяк / Arsenic | As | -3, ( 2), 3, 5 |
34 | Селен / Selenium | Se | -2, ( 2), 4, 6 |
35 | Бром / Bromine | Br | -1, 1, ( 3), ( 4), 5 |
36 | Криптон / Krypton | Kr | 0 |
37 | Рубидий / Rubidium | Rb | 1 |
38 | Стронций / Strontium | Sr | 2 |
39 | Иттрий / Yttrium | Y | 3 |
40 | Цирконий / Zirconium | Zr | ( 2), ( 3), 4 |
41 | Ниобий / Niobium | Nb | ( 2), 3, ( 4), 5 |
42 | Молибден / Molybdenum | Mo | ( 2), 3, ( 4), ( 5), 6 |
43 | Технеций / Technetium | Tc | 6 |
44 | Рутений / Ruthenium | Ru | ( 2), 3, 4, ( 6), ( 7), 8 |
45 | Родий / Rhodium | Rh | ( 2), ( 3), 4, ( 6) |
46 | Палладий / Palladium | Pd | 2, 4, ( 6) |
47 | Серебро / Silver | Ag | 1, ( 2), ( 3) |
48 | Кадмий / Cadmium | Cd | ( 1), 2 |
49 | Индий / Indium | In | ( 1), ( 2), 3 |
50 | Олово / Tin | Sn | 2, 4 |
51 | Сурьма / Antimony | Sb | -3, 3, ( 4), 5 |
52 | Теллур / Tellurium | Te | -2, ( 2), 4, 6 |
53 | Иод / Iodine | I | -1, 1, ( 3), ( 4), 5, 7 |
54 | Ксенон / Xenon | Xe | 0 |
55 | Цезий / Cesium | Cs | 1 |
56 | Барий / Barium | Ba | 2 |
57 | Лантан / Lanthanum | La | 3 |
58 | Церий / Cerium | Ce | 3, 4 |
59 | Празеодим / Praseodymium | Pr | 3 |
60 | Неодим / Neodymium | Nd | 3, 4 |
61 | Прометий / Promethium | Pm | 3 |
62 | Самарий / Samarium | Sm | ( 2), 3 |
63 | Европий / Europium | Eu | ( 2), 3 |
64 | Гадолиний / Gadolinium | Gd | 3 |
65 | Тербий / Terbium | Tb | 3, 4 |
66 | Диспрозий / Dysprosium | Dy | 3 |
67 | Гольмий / Holmium | Ho | 3 |
68 | Эрбий / Erbium | Er | 3 |
69 | Тулий / Thulium | Tm | ( 2), 3 |
70 | Иттербий / Ytterbium | Yb | ( 2), 3 |
71 | Лютеций / Lutetium | Lu | 3 |
72 | Гафний / Hafnium | Hf | 4 |
73 | Тантал / Tantalum | Ta | ( 3), ( 4), 5 |
74 | Вольфрам / Tungsten | W | ( 2), ( 3), ( 4), ( 5), 6 |
75 | Рений / Rhenium | Re | (-1), ( 1), 2, ( 3), 4, ( 5), 6, 7 |
76 | Осмий / Osmium | Os | ( 2), 3, 4, 6, 8 |
77 | Иридий / Iridium | Ir | ( 1), ( 2), 3, 4, 6 |
78 | Платина / Platinum | Pt | ( 1), 2, ( 3), 4, 6 |
79 | Золото / Gold | Au | 1, ( 2), 3 |
80 | Ртуть / Mercury | Hg | 1, 2 |
81 | Талий / Thallium | Tl | 1, ( 2), 3 |
82 | Свинец / Lead | Pb | 2, 4 |
83 | Висмут / Bismuth | Bi | (-3), ( 2), 3, ( 4), ( 5) |
84 | Полоний / Polonium | Po | (-2), 2, 4, ( 6) |
85 | Астат / Astatine | At | нет данных |
86 | Радон / Radon | Rn | 0 |
87 | Франций / Francium | Fr | нет данных |
88 | Радий / Radium | Ra | 2 |
89 | Актиний / Actinium | Ac | 3 |
90 | Торий / Thorium | Th | 4 |
91 | Проактиний / Protactinium | Pa | 5 |
92 | Уран / Uranium | U | ( 2), 3, 4, ( 5), 6 |
Чего не указано в таблице валентности, это то, что валентность элемента может быть постоянной и переменной.
Виды валентности | ||
Постоянная (у металлов главных подгрупп) | Переменная (у неметаллов и металлов побочных подгрупп) | |
Высшая (равна номеру группы) | Низшая (равна разности между числом 8 и номером группы) | |
Знание валентности элементов необходимы для правильного составления химических формул соединений.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH | |
| 4 | Бериллий | Be | I, II | BeH, BeCO3 | |
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | CO, CH4 | |
| 7 | Азот | N | I, II, III, IV | N2O, NO, N2O3, NO2 | В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | CaO | |
| 9 | Фтор | F | I | HF | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | AlCl3 | |
| 14 | Кремний | Si | II, IV | SiO, SiO2 | |
| 15 | Фосфор | P | III, V | P2O3, P2O5 | |
| 16 | Сера | S | II, IV, VI | H2S, SO2, SO3 | |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII | NaCl, NaClO2, NaClO2, KClO3, Cl2O6, Cl2O7 | |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | TiO, Ti2O3, TiO2 | |
| 23 | Ванадий | V | II, III, IV, V | VO, V2O3, VO2, V2O5 | |
| 24 | Хром | Cr | II, III, VI | CrO, Cr2O3, CrO3 | |
| 25 | Марганец | Mn | II, III, IV, VI, VII | Mn(OH)2, Mn2O3, MnO2, MnO3, Mn2O7 | |
| 26 | Железо | Fe | II, III | Fe(OH)2, Fe(OH)3 | |
| 27 | Кобальт | Co | II, III | CoCl2, CoCl3 | |
| 28 | Никель | Ni | II, III | NiO, Ni2O3 | |
| 29 | Медь | Cu | I, II | Cu2O, CuO | |
| 30 | Цинк | Zn | II | ZnSO4 | |
| 31 | Галлий | Ga | I, II, III | Ga2Se, GaSe, Ga2Se3 | |
| 32 | Германий | Ge | II, IV | GeO, GeO2 | |
| 33 | Мышьяк | As | III, V | As2O3, As2O5 | |
| 34 | Селен | Se | II, IV, VI | H2Se, SeCl4, H2SeO4 | |
| 35 | Бром | Br | I, III, V, VII | HBr, HBrO2, HBrO3, HBrO4 | |
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ZrF2, ZrBr3, ZrCl4 | |
| 41 | Ниобий | Nb | I, II, III, IV, V | NbH, NbO, NbI3, NbO2, Nb2O5 | |
| 42 | Молибден | Mo | II, III, IV, V, VI | MoCl2, Mo(OH)3, MoO2, MoCl5, MoF6 | |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII | TcCl2, TcBr3, TcBr4, TcF5, TcCl6, Tc2O7 | |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII | Ru(OH)2, RuCl3, Ru(OH)4, Ru2O5, RuB2, NaRuO4, RuO4 | |
| 45 | Родий | Rh | II, III, IV, V, VI | RhO, Rh2(SO4)3, Rh(OH)4, RhF5, RhF6 | |
| 46 | Палладий | Pd | II, IV | PdO, PdO2 | |
| 47 | Серебро | Ag | I, II, III | Ag2O, AgO, Ag3P | |
| 48 | Кадмий | Cd | I, II | Cd2O, CdO | |
| 49 | Индий | In | I, II, III | In2O, InO, In2O3 | |
| 50 | Олово | Sn | II, IV | SnSO4, Sn(SO4)2 | |
| 51 | Сурьма | Sb | III, V | Sb2S3, Sb2S5 | |
| 52 | Теллур | Te | II, IV, VI | H2Te, TeO2, K2TeO4 | |
| 53 | Йод | I | I, III, V, VII | HI, HIO2, HIO3, HIO4 | |
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | Ce(NO3)3, CeO2 | |
| 59 | Празеодим | Pr | II, III, IV | PrO, Pr2O3, PrO2 | |
| 60 | Неодим | Nd | II, III | NdO, Nd2O3 | |
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | SmO, Sm(NO3)3 | |
| 63 | Европий | Eu | II, III | EuO, Eu(OH)3 | |
| 64 | Гадолиний | Gd | II, III | GdS, Gd2O3 | |
| 65 | Тербий | Tb | II, III, IV | TbH2, TbBr3, TbO2 | |
| 66 | Диспрозий | Dy | II, III | DyBr2, Dy2O3 | |
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | TmS, Tm2O3 | |
| 70 | Иттербий | Yb | II, III | YbBr2, Yb2O3 | |
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | HfCl, HfS, HfBr3, Hf(SO4)2 | |
| 73 | Тантал | Ta | I, II, III, IV, V | Ta2O, TaO, TaCl3, TaO2, Ta2O5 | |
| 74 | Вольфрам | W | II, III, IV, V, VI | W6Cl12, WO3, WO2, W2Cl10, WF6 | |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII | Re2O, ReO, Re2O3, ReO2, ReF5, ReCl6, ReF7 | |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII | OsI, OsI2, OsBr3, OsO2, OsCl4, OsF5, OsF6, OsOF5, OsO4 | |
| 77 | Иридий | Ir | I, II, III, IV, V, VI | IrCl, IrCl2, IrCl3, IrO2, Ir4F20, IrF6 | |
| 78 | Платина | Pt | II, III, IV, V, VI | PtO, Pt2O3, PtO2, PtF5, PtF6, | |
| 79 | Золото | Au | I, II, III, V | AuBr, AuS, Au2O3, Au2F10 | |
| 80 | Ртуть | Hg | I, II | GdHg3, HgH2 | |
| 81 | Таллий | Tl | I, II, III | Tl2S, TlS, TlBr3, | |
| 82 | Свинец | Pb | II, IV | PbO, PbO2 | |
| 83 | Висмут | Bi | III, V | Bi2O3, Bi2O5, | |
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ThI2, ThI3, Th(OH)4 | |
| 91 | Протактиний | Pa | II, III, IV, V | PaO, PaH3, Pa(OH)4, Pa2O5 | |
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Таблица химических элементов Д.И. Менделеева

